2. 中国科学院大学, 北京 100049;
3. 华南国家植物园, 广州 510650;
4. 海南医学院, 热带医学院, 海口 571199
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. South China National Botanical Garden, Guangzhou 510650, China;
4. School of Tropical Medicine, Hainan Medical University, Haikou 571199, China
热带珊瑚岛是分布于热带海域的特殊陆地类型,主要由死亡后的珊瑚虫残体堆筑而成。因此, 珊瑚岛的土壤主要由珊瑚残屑经长期生物作用下形成的磷质石灰土和珊瑚砂冲积至海边形成的滨海沙积土组成,粗沙粒多,缺乏粘粒,具有高盐、强碱性及含水量低等特点[1–2]。中国的珊瑚岛广泛分布于南海地区,在高温和强光辐射等极端条件下,植物生长困难,难以形成稳定、多样化的热带珊瑚岛植被,且极易发生退化。然而,植被是热带珊瑚岛生态系统形成的基础,可供给、调节和支持各项生态系统服务功能[3]。构建和恢复热带珊瑚岛植被能够为热带珊瑚岛提供宜居环境,对促进热带珊瑚岛生态系统的可持续发展具有重要价值。研究珊瑚岛适生植物的功能特征及其对环境的适应机理,是热带珊瑚岛植被构建和生态恢复的前提和理论基础。
植物水力性状是指与植物水分吸收、转运和丧失过程有关的功能特征,反映植物对环境水分条件的适应能力[4]。植物可在一定程度上调整水力性状,减小环境水分波动带来的不利影响,维持自身的正常生长发育,从而逐步形成有效适应当地环境水分条件的水分适应策略[5],因此植物水力性状可以作为评价植物对热带珊瑚岛水分条件适应性的重要依据。植物水力性状可以分为2个方面:与木质部抗栓塞能力有关,代表水力安全的性状;与木质部水分运输效率有关,代表水力效率的性状[4]。水分在植物蒸腾拉力和水分子内聚力的作用下,于木质部中形成连续体保持水分的向上运输。在面临植物干旱胁迫时,木质部张力会导致空气由导管上的纹孔进入木质部管道,导致栓塞发生。栓塞将在木质部管腔扩散,阻碍水分运输,持续发展的栓塞阻碍植物的正常生理活动,最终导致植物死亡[6]。木质部抵抗栓塞形成和扩张的能力通常使用木质部导水率损失50%时的水势(P50)衡量,反映木质部水分运输的安全性[7]。叶片膨压丧失点(ψtlp)反映植物叶片在干旱胁迫下维持细胞膨压的能力[8]。ψtlp越低的植物抵抗叶片脱水的能力越强,从而可在水分有效性较低的条件下维持气孔开放,保证光合作用的正常进行[9]。在水力效率方面,枝条边材比导水率(Ks)可以代表枝条尺度的木质部水分运输效率,叶片导水率(Kleaf)反映叶片尺度的水分传输效率[4, 10]。一般认为,水分运输效率越高的植物,其光合速率越高,径向生长也越快,可以归为“资源获取型策略”,但采取这种策略可能会降低植物的水力安全性[11]。
植物的水力脆弱性分区假说认为,叶片在面对木质部空化引发的栓塞时,比枝条和主干表现得更为脆弱(即叶片P50值更高)[12],因此植物可利用叶片作为安全阀,将栓塞限制在碳投资较低的器官即叶片,从而避免枝条和茎干等碳投资较高的器官出现严重的水力功能障碍[13–14],这可能是植物为应对干旱胁迫,维护木质部水分运输安全所采取的重要策略。同时,前人还报道了亚热带湿润地区的一些物种缺乏水力脆弱性分区,即枝条比附于其上的叶片更容易发生栓塞。这些物种的叶片在干旱胁迫下可能失去作为“安全阀”的功能,但可能用其他补偿性的水力策略来维持水分平衡[14]。然而,热带地区代表性木本植物采取何种水力脆弱性分区的策略,尚缺乏研究。
植物的形态结构性状也与光合、水力等功能联系紧密,可以很好的表征植物的生态适应策略。如边材密度(WD)具有广泛的生理意义,植物的高边材密度与更高的耐旱性和生存率有关,因为这类植物往往具有更强的抗栓塞能力和机械抗性[15]。叶面积边材面积比(Al/As)代表单位边材横截面积可供给的茎末端叶片面积,反映了茎干边材木质部水分运输能力与叶片光合潜能之间的权衡,与个体生物量密切相关,是植被水分利用模型中的重要参数[16]。在干旱胁迫下,Al/As降低可以减少整株蒸腾耗水,从而提高剩余叶片的水分供给,维持植物的水分平衡[16]。
抗风桐(Pisonia grandis)和草海桐(Scaevola sericea)分别为紫茉莉科(Nyctaginaceae)常绿乔木和草海桐科(Goodeniaceae)常绿亚灌木,是中国热带珊瑚岛植被中最常见的优势乔木树种和灌木树种[17]。二者均具有较高的生长速率和无性繁殖能力(离体组织再生能力)[18–19],且耐盐碱和干旱,在海岸固沙、调节热带珊瑚岛气候及热带珊瑚岛植被恢复中发挥了重要作用[20–21]。同时2种植物因花型独特, 造型优美,可作园林观赏树种,其叶片可作药用和饲料,也具有重要的生态和经济价值[22–23]。目前,对这2种植物的研究主要集中在形态生物学特性及药用、经济学特性等方面[21],而对其水力功能特性的研究较少[22–23]。因此,本研究以海南省文昌市热带珊瑚岛植被恢复实验基地培育的抗风桐和草海桐为研究对象,通过测量其枝条和叶片的水力性状, 结合形态解剖结构,分析其水力功能特性及水分适应策略,为热带珊瑚岛植被构建与恢复的物种选择提供参考。
1 材料和方法 1.1 研究地概况本研究地点位于海南省文昌市热带珊瑚岛植被恢复实验基地(110°45′ E,19°31′ N),为典型的热带海洋性季风气候,气温变化小,年均气温24 ℃,年均降水量1 800 mm,水热条件丰富,但降水时间分布不均,每年6月至11月为湿季,12月至翌年5月为干季,具有明显的季节性干旱现象。土壤基质为滨海沉积物沙积土,与热带珊瑚岛上的常绿乔木和常绿灌木的土壤基质基本一致,湿季土壤含水量约为10.5%,干季土壤含水量约为8.2%,但因为热带珊瑚岛降雨较多,湿季水分有效性依然较高[17]。实验基地的气候条件也和热带珊瑚岛基本一致,但植物生长和养护条件良好,环境均一,因此避免了热带珊瑚岛生境异质性导致植物个体间和物种间差异性来源难以确定的问题,保证了2种植物在同一环境条件下测量结果的可比性,能更准确的反映植物自身的水力性状差异。
1.2 试验材料和方法基于前期对中国热带珊瑚岛植物的调查及研究,本研究选取热带珊瑚岛特殊生境(高温、强光和强碱等)的2种优势适生木本植物:抗风桐(Pisonia grandis)和草海桐(Scaevola sericea)作为研究对象。其中抗风桐为多年生常绿乔木,树皮灰白且皮孔明显,卵形对生纸质叶片;草海桐为多年生常绿亚灌木,匙形至倒卵形肉质叶片,螺旋状排列于分枝顶端[17]。二者均具有生长速度快、断枝可再殖,耐强光、干旱和贫瘠等特性[16, 21]。2022年7月,每种植物选取株高接近(抗风桐为2.5 m,草海桐为1.5 m)且长势健康的植株,采集冠层周围无遮荫、长度为1.0~1.4 m的带叶枝条,并立即在水下修剪切口并套上黑色塑料袋(防止水分散失和外界空气等进入被切开的导管),立即带回实验室。本实验中所有用水均为超纯水,并用真空泵抽气6 h以上以排除水中的气体。
1.3 枝条边材比导水率枝条边材比导水率采用低压液流法测定[24]。将采回的样品在实验室内暗适应30~60 min,使用注气法测量最大导管长度[25]。将收集样段的形态学顶端枝条用锋利的刀片修剪平滑,并连接一条塑料软管,在0.1 MPa的压力下注入空气。塑料软管的末端浸入水中, 自样段末端起以2 cm长度在水中连续切割,直到样段末端出现第1个气泡,此时剩余的样段长度为最大导管长度(Lmax, cm)。在水下将待测样段切割成约30~ 50 cm (超过其最大导管长度, 抗风桐约为24.5 cm,草海桐约为21.5 cm)并记录(L, m)。将样段两端剥去1~ 2 cm韧皮部后用生料带缠绕,连入蠕动泵(KCP Pro, Kamoer, Shanghai, China)橡皮管并检查气密性。首先在0.15 MPa的压力下冲洗茎段20 min,去除导管中的气泡。测定使用的溶液为除气后的10 mmol/L KCl溶液。利用50 cm高度的水柱产生的静水压力(P, 约0.005 MPa)驱动液流通过样段, 样段下端连接到移液管,并记录移液管中凹液面通过一定数量连续刻度标记所需要的时间,计算流速Jv (kg/s), 同时通过温湿计测定样段附近空气的温度(T, ℃)和湿度(RH, %), 保持空气温度为22 ℃~28 ℃。计算样段最大导水率[Kmax, (kg·m)/(s·MPa)]=Jv/(∆P/∆L)。
测定完成后,使用体视显微镜拍摄茎段基部的横截面,使用ImageJ (National Institutes of Health, Bethesda, USA)测定木质部面积(As, m2),计算枝条木质部边材比导水率[Ks, kg/(m·s·MPa)]=Kmax/As。
1.4 枝条脆弱性曲线枝条脆弱性曲线采用自然干燥法测定[24]。用锡箔纸和自封袋将采回的枝条欲测茎段的上游和下游4~6片成熟叶片包裹后,将切口端插入水桶中, 同时在水下剪去约10 cm的一段后,用黑色塑料袋包裹复水2 h,以平衡枝条水势。复水结束后,用压力室(plant moisture stress, Corvallis, USA)分别测定被包裹的上游和下游端叶片水势,当两者的水势之差小于0.2 MPa时,认为此时的叶片水势等同于枝条的木质部水势(ψx, MPa)。将平衡后的枝条剪去叶片,并在切口端和末端在水槽中各切去一截,让枝条在水中释放木质部张力30 min。将释放张力后的枝条两端切口修平后连入上述导水率测量装置测量此时的实际导水率Ki,随后在0.15 MPa的压力下冲洗茎段20 min后测量其最大导水率Kmax。其余枝条在室内(26 ℃)自然晾干,达到不同的水势梯度,然后重复上述过程,测得不同水势下的枝条Ki与Kmax并计算导水损失率(PLC, %):PLC=100(1–Ki/Kmax)。
将水势与PLC的关系构建曲线即为枝条脆弱性曲线,拟合方程为PLC=100/{1+exp[a(ψ-b)]},其中a和b为常数。根据拟合曲线得到枝条导水率损失50%时的水势P50 branch作为枝条栓塞脆弱性的指示指标[24]。
1.5 叶片压力-容积曲线叶片压力-容积曲线参照Tyree等[26]的方法。从复水后的枝条上剪下成熟健康叶片进行测定,记录叶片水势(ψsat, MPa),确保其初始值均高于–0.05 MPa, 称量此时的叶片质量即为饱和鲜重(Wsat, mg)。此后将叶片置于天平上进行自然干燥,在失去2~5 mg水分后重新记录叶片质量(Wi, mg)和测定此时的叶片水势(ψi, MPa),重复以上过程,直至叶片萎蔫。然后于70 ℃烘箱干燥叶片48 h,测量其干质量(Wd, mg)。相对含水量(RWC, %)=100(Wi-Wd)/(Wsat-Wd), 基于叶面积的叶片水容[Cleaf, mmol/(m2·MPa)]=∆RWC/∆ψi(Wd/Aleaf)(Wsat/Wd)/M, 式中,Aleaf为叶面积(m2),M为水的摩尔质量(g/mol)。
以1/ψi为纵坐标,(1-RWC)为横坐标构建的曲线即为叶片压力-容积曲线,利用Schulte等[27]编制的程序确定叶片膨压丧失点时的水势(ψtlp, MPa)。
1.6 叶片脆弱性曲线叶片脆弱性曲线采用复水法测定[28]。将采回的带叶枝条在自然状态下失水不同时间,以形成不同的叶片水势梯度,达到不同水势梯度的枝条需进行暗处理至少30 min使枝条整体水势达到平衡。每个枝条选取至少1片叶片用压力室测定初始水势(ψ0, MPa),然后在水下切下相邻叶片,在暗处复水一定时间(t, 30~300 s),复水完成后取出叶片,迅速擦干,然后测定复水后水势(ψf, MPa)。结合叶片压力-容积曲线得到的叶片水容Cleaf计算叶片导水率[Kleaf, mmol/(m2·s MPa)]=Cleaf ln(ψ0/ψf)/t。
将所有测得的初始叶片水势大于-0.3 MPa的叶片导水率取平均值作为叶片最大导水率(Kmax leaf), 根据不同叶片水势下测定的叶片导水率与Kmax leaf计算导水损失率(PLC, %):PLC=100(1-Kleaf/Kmax leaf)。
将叶片水势与PLC的关系构建曲线即为叶片脆弱性曲线,拟合方程为PLC=100/{1+exp[a(ψ-b)]}, 以叶片导水率损失50%时的水势P50 leaf作为叶片栓塞脆弱性的指示指标[27]。
1.7 边材密度从测定导水率后的枝条(直径5~10 mm)截取一段长度约5 cm的无分支茎段,去除髓心和树皮, 浸泡在水中过夜,充分饱和后利用排水法测定边材体积(V, cm3),然后置于70 ℃烘箱中烘72 h后测定干重(DW, g),边材密度(WD, g/cm3)即为DW与V的比值。
1.8 叶面积边材面积比将取回的枝条形态学末端上所有的叶片取下,使用叶面积仪(Li-3000A, Li-Cor, Lincoln, USA)测定其总叶面积(Al, m2)。使用体视显微镜拍摄茎段基部的横截面,使用ImageJ测定木质部面积(As, cm2)。叶面积边材面积比(Al/As, m2/cm2)即为Al与As比值。
1.9 数据分析所有分析均在R 4.1.3 (R Development Core Team, 2022)中进行,所有图片使用SigmaPlot 14.0 (Systat Software, San Jose, USA)绘制。使用R软件中的“fitplc”包拟合脆弱性曲线。采用t检验(t-test)比较抗风桐和草海桐水力性状的差异。
2 结果和分析 2.1 枝条与叶片脆弱性曲线抗风桐和草海桐的枝条和叶片脆弱性曲线均为“S型”曲线(图 1)。抗风桐的叶片比枝条具有更低的木质部导水率损失50%的水势(即P50 leaf < P50 branch), 而草海桐的趋势则相反,即具有显著的枝条和叶片间的水力脆弱性分区(P50 leaf -P50 branch > 0)。与抗风桐相比,草海桐的枝条具有更低的P50,分别为–0.79和–1.25 MPa,草海桐的P50 branch比抗风桐低36.8%。然而,草海桐的P50 leaf比抗风桐更高,分别为–0.80和–1.07 MPa,P50 leaf值比抗风桐高25.2%。
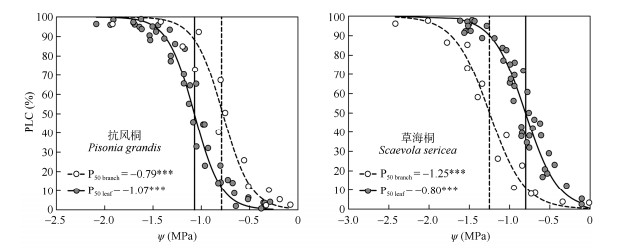
|
图 1 两种植物的枝条和叶片脆弱性曲线。PLC: 导水损失率; P50 branch: 枝条木质部导水率损失50%的水势; P50 leaf: 叶片导水率损失50%的水势; ***: P < 0.001。 Fig. 1 Branch and leaf hydraulic vulnerability curves of two species. PLC: Loss rate of hydraulic conductivity; P50 branch: Water potential at a 50% loss of hydraulic conductivity in branch; P50 leaf: Water potential at a 50% loss of hydraulic conductivity in leaf; ***: P < 0.001. |
抗风桐和草海桐的叶片膨压丧失点(ψtlp)、枝条边材比导水率(Ks)和叶片导水率(Kleaf)均存在显著差异(P < 0.001)(图 2)。抗风桐和草海桐的ψtlp分别为–0.73和–1.44 MPa,草海桐比抗风桐低49.3%;Ks分别为1.59和0.51 kg/(m·s·MPa),草海桐比抗风桐低31.8%;草海桐具有比抗风桐更高的Kleaf,分别为6.42和3.71 mmol/(m2·s·MPa),草海桐比抗风桐高57.8%。
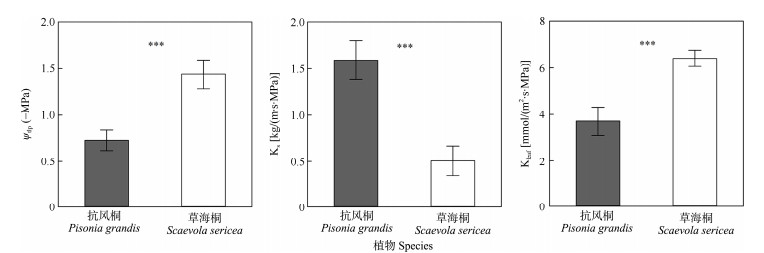
|
图 2 两种植物的水力功能性状对比。ψtlp: 叶片膨压丧失点; Ks: 枝条边材比导水率; Kleaf: 叶片导水率; ***: P < 0.001。 Fig. 2 Comparison of hydraulic functional traits between two species. Ψtlp: Leaf turgor loss point; Ks: Specific water conductivity of sapwood and xylem of branch; Kleaf: Leaf hydraulic conductivity; ***: P < 0.001. |
对于边材密度(WD)和叶面积边材面积比(Al/As),抗风桐与草海桐之间均存在显著差异(P < 0.05) (图 3)。与抗风桐相比,草海桐具有更高的边材密度,分别为0.28和0.38 g/cm3。另外,草海桐同样拥有更高的叶面积边材面积比,抗风桐和草海桐的Al/As分别为0.33和0.51 m2/cm2。
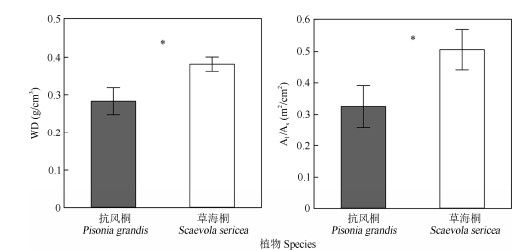
|
图 3 2种植物的水力结构性状对比。*: P < 0.05; WD: 木材密度; Al/As: 叶面积边材面积比。 Fig. 3 Comparison of hydraulic structural traits between two species. *: P < 0.05; WD: Wood density; Al/As: Ratio of leaf area to sapwood area. |
木质部P50能够作为判断植物栓塞脆弱性的指标[6]。本研究表明,抗风桐叶片相较于枝条具有更低的P50,而草海桐枝条的P50较叶片更低,说明抗风桐的叶片比草海桐更能抵抗栓塞,而枝条抗栓塞能力则稍弱。这两物种的枝条P50比陆地生态系统木本植物的平均P50都高(热带季节性森林树种枝条的P50均值约为–2.18 MPa[29]),表明在热带降雨较多的地区,植物普遍不具有很强的耐旱能力,主要应对季节性干旱或其他的胁迫环境条件。然而即使如此,2种植物也采取了截然不同的水分适应策略,草海桐的枝条与叶片之间存在显著的水力脆弱性分区,表明其叶片能够充当“安全阀”来保护水力通路免受水力障碍的影响。因为草海桐叶片的提前栓塞能够触发气孔关闭,降低蒸腾作用,从而降低其枝条和茎中木质部的张力,有利于其适应环境中高的饱和水汽压差,这是其在恶劣的珊瑚岛生存的重要策略[30]。抗风桐则可能选择以高效的木质部运水和储水能力的策略应对高蒸散环境可能造成的水分胁迫,并缺乏叶片的安全阀功能,这和前人[14]报道气候湿润地区的物种缺乏水力脆弱性分区的现象一致。作为补偿,抗风桐可能利用其他水力策略,如在土壤水分条件充足时,利用较高的枝条导水效率使土壤到末端叶片的水势梯度降低,从而避免枝条和叶片发生较大程度的栓塞[31]。此外,抗风桐还可以利用多孔隙、低边材密度的茎木质部存储水分,在面对环境干旱条件时能释放足够的水量来缓冲并维持植物水分平衡[32–33]。
3.2 水分运输策略水分运输效率高的物种,可以保持叶片良好的水分状况,从而保持气孔开放,增加碳同化的时间,有助于植物的生长[33]。本研究表明,抗风桐的叶片膨压丧失点(ψtlp)和枝条木质部导水效率(Ks)显著高于草海桐,而草海桐的叶片效率(Kleaf)则显著高于抗风桐,这表明草海桐作为灌木,选择以较低的Ks减小枝叶的水分散失,使在根运输上的有限水分能够在植株内均匀分配,使植物体内有充足的水分维持正常生长,同时以高的Kleaf来增强叶片水分运输能力以满足热带珊瑚岛高光高温生境引起的高蒸腾要求,在此条件下保护叶片免受过热造成的危害[34]。另一方面,草海桐ψtlp较低,Kleaf较高,表明其叶片可在更低的水势下维持叶细胞膨压,叶片关闭气孔较晚,因此能维持更长时间的气体交换[9, 35]。虽然叶片中储存的水分散失较快,但可以优先栓塞部分叶片,降低蒸腾,以保护枝条等碳投资较高器官的水力安全,这也支持了水力脆弱性分区的观点。
抗风桐则选择更高的枝条木质部导水效率,这可能是由于抗风桐作为乔木,根系可以在表层土壤干燥时,从深层土壤获得水分,从而可以将足量的水分通过枝条快速运输到叶片,以保持枝叶良好的水分状况[35],但这需要进一步的根系性状对比研究证实。抗风桐的ψtlp较高且叶片导水能力较低,这表明其叶片对干旱胁迫更加敏感,受到干旱胁迫后快速关闭气孔,及时降低蒸腾速率来防止水分散失,同时叶片具有更高的抗栓塞能力,以此来应对干旱[36]。
3.3 不同水分适应策略的结构基础边材密度(WD)反映木质部管道及其周边包围组织的性质,而叶面积边材面积比(Al/As)则反映了单位枝干组织量可供水的叶面积大小[15–16]。本研究表明抗风桐的WD和Al/As均显著低于草海桐,但两者的边材密度均属于热带地区木本植物中的较低水平(热带季节性森林树种WD均值约为0.54 g/cm3[37])。前人[38]研究认为,边材密度与边材水容通常有负的相关关系,这是因为具有高水容的植物枝干拥有更多的薄壁组织,能够在遭遇水分胁迫时释放薄壁细胞中的储存水来暂时缓解木质部张力,从而在一定程度上避免水力失败。这两种植物可能选择以此方式来应对一定程度的干旱胁迫,而不需要增加木质部导管的抗栓塞能力,同时也可以获得相对较高的生长速率以获取竞争优势[39]。此外,抗风桐更低的Al/As表明其边材向单位叶片面积的水分供应能力更强,因此其叶片可以获得更大的蒸腾速率以提升单位面积的光合能力,但尚需更多光合作用相关数据证明这一推测。根据实地观察,作为高大的乔木,抗风桐更低的Al/As也是其在暴风雨频发的热带珊瑚岛生存的一大优势,由于冠层叶片非常稀疏,主要以交错的枝干形成屏障,有效避免了被强风摧折。草海桐的单位枝干供水可以支撑更大的叶片面积, 这表明草海桐选择增加碳分配给叶片以增加总光合面积获取更强的竞争力,而在面临干旱胁迫时,则允许损失部分叶片以保证枝干的水力安全性[14]。同时生活型为灌木的草海桐从地表到冠层均生长了紧密的叶片,选择投资更多的碳到支撑组织,以换取更高的抵抗机械损伤的能力以及抗生物侵害能力, 从而应对更多的叶面积可能带来的潜在风险[40–41]。
综上,中国热带珊瑚岛植被典型适生木本植物抗风桐和草海桐表现出不同的水分适应策略。抗风桐在热带地区高温、高降雨、高光照的环境条件下,选择以高效的枝干水分运输来满足叶片高蒸腾需求的充足供水,同时叶片具有比枝条更强的抗栓塞能力,对水分胁迫更加敏感,能够快速关闭气孔, 降低蒸腾速率维持整体水分平衡。而草海桐在相同环境条件下,则选择高效的叶片水分运输维持蒸腾, 降低叶温以免受过热伤害,叶片膨压丧失点较低, 可在低水势下维持叶片气孔开放,同时叶片和枝条之间存在水力脆弱性分区,叶片可充当“安全阀”, 在面临水分胁迫时叶片首先栓塞,从而降低蒸腾, 以保证枝干的水力安全。这两种植物均具有相对较低的木材密度,选择以较高的生长速率获得竞争优势,同时木质部可在面临干旱时释放储存水分缓解水分胁迫造成的影响。总之,通过采取不同的水分适应策略,这两种植物均能较好地适应热带珊瑚岛独有的气候条件,成为热带珊瑚岛植被的优势树种。本研究揭示了热带珊瑚岛优势植物的两种水分适应策略,为热带珊瑚岛植被修复工具种的筛选提供了一定的科学依据和理论参考。
| [1] |
LI J, LIU N, REN H, et al. Ecological adaptability of seven plant species to tropical coral island habitat[J]. Ecol Environ Sci, 2016, 25(5): 790-794. 李婕, 刘楠, 任海, 等. 7种植物对热带珊瑚岛环境的生态适应性[J]. 生态环境学报, 2016, 25(5): 790-794. DOI:10.16258/j.cnki.1674-5906.2016.05.009 |
| [2] |
LIN Y X, LIU H, HE P C, et al. Physiological and biochemical responses of three species to environment stresses of tropical coral islands[J]. J Trop Subtrop Bot, 2017, 25(6): 562-568. 林忆雪, 刘慧, 贺鹏程, 等. 三种适生植物对热带珊瑚岛胁迫生境的生理生化响应[J]. 热带亚热带植物学报, 2017, 25(6): 562-568. DOI:10.11926/jtsb.3755 |
| [3] |
YOU C J, HOU P X, DENG C F, et al. Investigation of tourism resources in Xisha Islands[J]. Resour Sci, 2015, 37(8): 1609-1620. 游长江, 侯佩旭, 邓灿芳, 等. 西沙群岛旅游资源调查与评价[J]. 资源科学, 2015, 37(8): 1609-1620. |
| [4] |
XU T Y, NIU X, WANG B. Recent advances in plant leaf hydraulic traits[J]. Terr Ecosyst Conserv, 2022, 2(2): 83-91. 许庭毓, 牛香, 王兵. 植物叶片水力性状研究综述[J]. 陆地生态系统与保护学报, 2022, 2(2): 83-91. DOI:10.12356/j.2096-8884.2022-0005 |
| [5] |
ZHU S D, CHEN Y J, CAO K F, et al. Interspecific variation in branch and leaf traits among three Syzygium tree species from different successional tropical forests[J]. Funct Plant Biol, 2015, 42(4): 423-432. DOI:10.1071/FP14201 |
| [6] |
CHOAT B, BRODRIBB T J, BRODERSEN C R, et al. Triggers of tree mortality under drought[J]. Nature, 2018, 558(7711): 531-539. DOI:10.1038/s41586-018-0240-x |
| [7] |
ZHOU H H, LI W H, AYUP MUBAREK, et al. Xylem hydraulic conductivity and embolism properties of desert riparian forest plants and its response to drought stress[J]. Chin J Plant Ecol, 2012, 36(1): 19-29. 周洪华, 李卫红, 木巴热克·阿尤普, 等. 荒漠河岸林植物木质部导水与栓塞特征及其对干旱胁迫的响应[J]. 植物生态学报, 2012, 36(1): 19-29. DOI:10.3724/SP.J.1258.2012.00019 |
| [8] |
BARTLETT M K, SCOFFONI C, SACK L. The determinants of leaf turgor loss point and prediction of drought tolerance of species and biomes: A global meta-analysis[J]. Ecol Lett, 2012, 15(5): 393-405. DOI:10.1111/j.1461-0248.2012.01751.x |
| [9] |
BLACKMAN C J, BRODRIBB T J, JORDAN G J. Leaf hydraulic vulnerability is related to conduit dimensions and drought resistance across a diverse range of woody angiosperms[J]. New Phytol, 2010, 188(4): 1113-1123. DOI:10.1111/j.1469-8137.2010.03439.x |
| [10] |
GLEASON S M, WESTOBY M, JANSEN S, et al. Weak tradeoff between xylem safety and xylem-specific hydraulic efficiency across the world's woody plant species[J]. New Phytol, 2016, 209(1): 123-136. DOI:10.1111/nph.13646 |
| [11] |
TYREE M T, EWERS F W. The hydraulic architecture of trees and other woody plants[J]. New Phytol, 1991, 119(3): 345-360. DOI:10.1111/j.1469-8137.1991.tb00035.x |
| [12] |
BUCCI S J, SCHOLZ F G, CAMPANELLO P I, et al. Hydraulic differences along the water transport system of South American Nothofagus species: Do leaves protect the stem functionality?[J]. Tree Physiol, 2012, 32(7): 880-893. DOI:10.1093/treephys/tps054 |
| [13] |
WHITEHEAD D, JARVIS P G. Coniferous forests and plantations[M]// KOZLOWSKI T T. Water Deficits and Plant Growth, VI. New York: Academic Press, 1981: 49–152.
|
| [14] |
ZHU S D, LIU H, XU Q Y, et al. Are leaves more vulnerable to cavitation than branches?[J]. Funct Ecol, 2016, 30(11): 1740-1744. DOI:10.1111/1365-2435.12656 |
| [15] |
CHAVE J, COOMES D, JANSEN S, et al. Towards a worldwide wood economics spectrum[J]. Ecol Lett, 2009, 12(4): 351-366. DOI:10.1111/j.1461-0248.2009.01285.x |
| [16] |
MENCUCCINI M, MANZONI S, CHRISTOFFERSEN B. Modelling water fluxes in plants: From tissues to biosphere[J]. New Phytol, 2019, 222(3): 1207-1222. DOI:10.1111/nph.15681 |
| [17] |
REN H, JIAN S G, ZHANG Q M, et al. Plants and vegetation on South China Sea Islands[J]. Ecol Environ Sci, 2017, 26(10): 1639-1648. 任海, 简曙光, 张倩媚, 等. 中国南海诸岛的植物和植被现状[J]. 生态环境学报, 2017, 26(10): 1639-1648. DOI:10.16258/j.cnki.1674-5906.2017.10.001 |
| [18] |
YU X C, LIANG H Z, CHEN S Y, et al. Multiple shoot proliferation and plant regeneration in Pisonia grandis[J]. Guihaia, 2021, 41(6): 890-896. 于昕塍, 梁韩枝, 陈双艳, 等. 抗风桐的丛生芽诱导与再生[J]. 广西植物, 2021, 41(6): 890-896. DOI:10.11931/guihaia.gxzw202004015 |
| [19] |
WANG J. Breeding and mixed planting of local tree species Calophyllum inophyllum and Scaevola sericea in coastal shelterbelt on Hainan Island[D]. Haikou: Hainan Normal University, 2015. 王瑾. 海南岛海岸乡土树种红厚壳、草海桐的育苗和在海防林下混交种植的研究[D]. 海口: 海南师范大学, 2015. |
| [20] |
XU B B. Study on drought and saline-alkaline resistance of Scaevola sericea [D]. Guangzhou: Zhongkai University of Agriculture and Engineering, 2019. 徐贝贝. 草海桐的抗干旱和盐碱性研究[D]. 广州: 仲恺农业工程学院, 2019. |
| [21] |
XU B B, LIU N, REN H, et al. Stress resistance biological characterristics of Scaevola sericea in Paracel Islands[J]. Guihaia, 2018, 38(10): 1277-1285. 徐贝贝, 刘楠, 任海, 等. 西沙群岛草海桐的抗逆生物学特性[J]. 广西植物, 2018, 38(10): 1277-1285. DOI:10.11931/guihaia.gxzw201711012 |
| [22] |
HAN S S, LIU S X, MO X G, et al. Soil water dynamics and water balance on a tropical coral island[J]. Hydrol Process, 2021, 35(12): e14415. DOI:10.1002/hyp.14415 |
| [23] |
WANG C, ZHANG H, LIU H, et al. Application of a trait-based species screening framework for vegetation restoration in a tropical coral island of China[J]. Funct Ecol, 2020, 34(6): 1193-1204. DOI:10.1111/1365-2435.13553 |
| [24] |
PAMMENTER N W, VAN DER WILLIGEN C. A mathematical and statistical analysis of the curves illustrating vulnerability of xylem to cavitation[J]. Tree Physiol, 1998, 18(8-9): 589-593. DOI:10.1093/treephys/18.8-9.589 |
| [25] |
EWERS F W, FISHER J B. Techniques for measuring vessel lengths and diameters in stems of woody plants[J]. Am J Bot, 1989, 76(5): 645-656. DOI:10.1002/j.1537-2197.1989.tb11360.x |
| [26] |
TYREE M T, HAMMEL H T. The measurement of the turgor pressure and the water relations of plants by the pressure-bomb technique[J]. J Exp Bot, 1972, 23(1): 267-282. DOI:10.1093/jxb/23.1.267 |
| [27] |
SCHULTE P J, HINCKLEY T M. A comparison of pressure-volume curve data analysis techniques[J]. J Exp Bot, 1985, 36(10): 1590-1602. DOI:10.1093/jxb/36.10.1590 |
| [28] |
BRODRIBB T J, HOLBROOK N M. Changes in leaf hydraulic conductance during leaf shedding in seasonally dry tropical forest[J]. New Phytol, 2003, 158(2): 295-303. DOI:10.1046/j.1469-8137.2003.00736.x |
| [29] |
LIU H, GLEASON S M, HAO G Y, et al. Hydraulic traits are coordinated with maximum plant height at the global scale[J]. Sci Adv, 2019, 5(2): eaav1332. DOI:10.1126/sciadv.aav1332 |
| [30] |
TYREE M T, COCHARD H, CRUIZIAT P, et al. Drought-induced leaf shedding in walnut: Evidence for vulnerability segmentation[J]. Plant Cell Environ, 1993, 16(7): 879-882. DOI:10.1111/j.1365-3040.1993.tb00511.x |
| [31] |
BUCCI S J, SCHOLZ F G, GOLDSTEIN G, et al. Soil water availability and rooting depth as determinants of hydraulic architecture of Patagonian woody species[J]. Oecologia, 2009, 160(4): 631-641. DOI:10.1007/s00442-009-1331-z |
| [32] |
MCCULLOH K A, JOHNSON D M, MEINZER F C, et al. The dynamic pipeline: Hydraulic capacitance and xylem hydraulic safety in four tall conifer species[J]. Plant Cell Environ, 2014, 37(5): 1171-1183. DOI:10.1111/pce.12225 |
| [33] |
GUYOT G, SCOFFONI C, SACK L. Combined impacts of irradiance and dehydration on leaf hydraulic conductance: Insights into vulnerability and stomatal control[J]. Plant Cell Environ, 2012, 35(5): 857-871. DOI:10.1111/j.1365-3040.2011.02458.x |
| [34] |
PINEDA-GARCIA F, PAZ H, MEINZER F C. Drought resistance in early and late secondary successional species from a tropical dry forest: The interplay between xylem resistance to embolism, sapwood water storage and leaf shedding[J]. Plant Cell Environ, 2013, 36(2): 405-418. DOI:10.1111/j.1365-3040.2012.02582.x |
| [35] |
SCOFFONI C, MCKOWN A D, RAWLS M, et al. Dynamics of leaf hydraulic conductance with water status: Quantification and analysis of species differences under steady state[J]. J Exp Bot, 2012, 63(2): 643-658. DOI:10.1093/jxb/err270 |
| [36] |
ARITSARA A N A, WANG S, LI B N, et al. Divergent leaf and fine root "pressure-volume relationships" across habitats with varying water availability[J]. Plant Physiol, 2022, 190(4): 2246-2259. DOI:10.1093/plphys/kiac403 |
| [37] |
LI R H, ZHU S D, CHEN H Y H, et al. Are functional traits a good predictor of global change impacts on tree species abundance dynamics in a subtropical forest?[J]. Ecol Lett, 2015, 18(11): 1181-1189. DOI:10.1111/ele.12497 |
| [38] |
MEINZER F C, JOHNSON D M, LACHENBRUCH B, et al. Xylem hydraulic safety margins in woody plants: Coordination of stomatal control of xylem tension with hydraulic capacitance[J]. Funct Ecol, 2009, 23(5): 922-930. DOI:10.1111/j.1365-2435.2009.01577.x |
| [39] |
ZANNE A E, WESTOBY M, FALSTER D S, et al. Angiosperm wood structure: Global patterns in vessel anatomy and their relation to wood density and potential conductivity[J]. Am J Bot, 2010, 97(2): 207-215. DOI:10.3732/ajb.0900178 |
| [40] |
CLARK D A, CLARK D B. Getting to the canopy: Tree height growth in a neotropical rain forest[J]. Ecology, 2001, 82(5): 1460-1472. DOI:10.1890/0012-9658(2001)082[1460:GTTCTH]2.0.CO;2 |
| [41] |
FALSTER D S, BRÄNNSTRÖM Å, DIECKMANN U, et al. Influence of four major plant traits on average height, leaf‐area cover, net primary productivity, and biomass density in single‐species forests: A theoretical investigation[J]. J Ecol, 2011, 99(1): 148-164. DOI:10.1111/j.1365-2745.2010.01735.x |
 2024, Vol. 32
2024, Vol. 32


