2. 福建省农业科学院科技服务处, 福州 350003
2. Institute of Technology Services, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China
番石榴(Psidium guajava),又名芭乐、拔子、喇叭果、鸡屎果等,为桃金娘科(Myrtaces)番石榴属热带果树,原产于热带美洲[1],在我国广泛种植于海南、云南、广西、广东、福建、台湾等地区。番石榴果实清甜脆爽,香气独特,含有较丰富的蛋白质、维生素A、维生素C等营养物质和磷、钙、镁等微量元素[2],以及果胶、生物碱、类黄酮、三萜类、皂苷等生物活性物质[3–4]。番石榴叶则含有三萜、黄酮、鞣质、倍半萜、挥发油等多种结构类型的化学成分[5–10]。其果、叶具有抗氧化、抗菌、抗腹泻、保肝、降血糖、降血脂、降血压、抗心血管疾病和抗肿瘤等功效[11–14]。
目前,对番石榴功效的研究主要集中于番石榴叶的活性成分和生物活性。Deguchi等[15]的临床试验表明,番石榴叶茶能显著降低糖尿病患者餐后血糖水平、血清中胆固醇和甘油三酯的含量。Pongsak等[16]的研究表明番石榴叶提取物中的黄酮类物质, 如桑色素-3-O-来苏糖苷、桑色素-3-O-阿拉伯糖苷、槲皮素-3-O-阿拉伯糖苷等,对体内肠道细菌的抗菌效果良好。Rizzo等[17]报道,番石榴叶中杂萜类成分guajadial、psidial A、psiguadial A和psiguadial B对抑制小鼠乳腺癌细胞的生长非常有效,且比临床化疗药物对机体的毒性更低。Ojewole[18]的研究表明盐敏感的高血压大鼠在静脉注射番石榴叶提取物后,其血压和心率均显著降低。
番石榴种植过程中因修剪、疏果等措施会产生叶和幼果等副产物,大量的叶和幼果多被种植户丢弃。已有研究表明这2种副产物均具有很高的药用价值,可作为药材。相对于番石榴叶,对幼果的研究还较少,对不同品种及其叶和幼果的活性成分的比较研究更少。本文以4个番石榴品种叶和幼果为研究对象,测定其提取物的酚类和黄酮含量、清除自由基能力和α-葡萄糖苷酶抑制活性,并对提取物的酚类成分进行分析,旨在筛选活性较强的番石榴品种及其副产物(叶和幼果),为番石榴充分开发利用提供参考依据。
1 材料和方法 1.1 材料和仪器材料 番石榴(Psidium guajava)叶和幼果于2018年10月采自福建省农业科学院亚热带农业研究所闽台种质资源圃。供试品种有‘珍珠’、‘水蜜’、‘红宝石’和‘西瓜’。每个品种随机选取9株健康植株采集健壮叶和谢花后30 d的幼果,每3株叶或幼果混合成1个样品,即每个品种的叶与果实均设3个重复。表儿茶素、槲皮素、根皮苷、杨梅苷、咖啡酸、异阿魏酸、阿魏酸、鞣花酸、金丝桃苷、槲皮素-3-O-葡萄糖苷标准品购于北京索莱宝科技有限公司,纯度均≥98%。
仪器 Waters Acqutiy UPLC H-Class超高效液相色谱、Xevo TQ-S三重四级杆质谱(美国Waters公司);CR22N高速冷冻离心机(日本HITACHI公司); UPW-20N超纯水机(北京历元电子仪器有限公司); BS110S分析天平(德国Sartorius集团);PC650超声波细胞破碎仪(上海皓庄仪器有限公司); RE-52AA旋转蒸发仪(上海亚荣生化仪器厂); GZX-9246 MBE电热鼓风干燥箱(上海博迅实业有限公司); L5S紫外分光光度计(上海仪电分析仪器有限公司)。
1.2 方法叶和幼果提取物的制备 将采集的叶和果实(切块)置于60℃烘干,用粉碎机粉碎,过80目筛, 将粉末与体积分数60%乙醇按1∶20 (m/v)混合, 用超声波破碎仪超声提取30 min,功率为200 W, 连续超声时间3 s,超声间隔时间4 s。提取液用高速冷冻离心机5 170×g离心15 min,取上清液待测。
酚类、黄酮含量测定 参照Xu等[19]的方法测定。酚类含量测定以没食子酸为标准品,建立线性回归方程y=0.0018x-0.0032 (0~300 μg/mL, R²=0.999 5), 式中,y为吸光值,x为没食子酸质量浓度(μg/mL)。酚类含量以1 g干叶或幼果中所含的相当于没食子酸的质量表示,单位为mg/g。黄酮含量测定以芦丁为标准品,建立线性回归方程y=0.0026x–0.0047 (0~ 300 μg/mL, R²=0.998 8), 式中, y为吸光度值,x为芦丁质量浓度(μg/mL)。黄酮含量以1 g干叶或幼果中所含的相当于芦丁的质量表示,单位为mg/g。
清除自由基能力测定 参照前人[19–21]的方法测定提取物对DPPH·、ABTS+、HO·的清除能力。
α-葡萄糖苷酶抑制活性测定 参照邱珊莲等[22]的方法测定。
1.3 UPLC-MS/MS分析酚类成分色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);柱温: 40℃;流速:0.2 mL/min;进样体积:4 μL;流动相A:5 mmol/L乙酸铵+0.1%甲酸水溶液,流动相B:乙腈,梯度洗脱(洗脱程序:0~5 min, 90%~10% A;5~6 min, 10% A;6~8 min, 10%~50% A;8~9 min, 50%~90%;9~10 min, 90% A)。
质谱条件 离子源:电喷雾离子化源(ESI)正负模式;离子源温度:120℃;扫描方式:多级反应监测(MRM);毛细管电压:3.0 kV (正模式)、1.5 kV (负模式);脱溶剂气温度:500℃ (正模式)、450℃ (负模式)。质谱参数见表 1。
| 表 1 对照品的质谱参数和线性关系 Table 1 Mass spectrometry parameters and linear regression equation of standards |
对照品溶液制备和测定 精确称取表儿茶素、槲皮素、根皮苷、杨梅苷、咖啡酸、异阿魏酸、阿魏酸、鞣花酸、金丝桃苷、槲皮素-3-O-葡萄糖苷标准品,用色谱纯甲醇配制成1.0 mg/mL的对照品储备液。精确量取对照品储备液,用甲醇配制成系列质量浓度梯度为0.5、1.0、2.0、5.0和10.0 μg/mL的混合对照品溶液。以峰面积(y)对其质量浓度(x, μg/mL)进行线性回归,得到回归方程。
供试样品制备 称取8 g叶或幼果粉末,超声提取液在50℃下减压旋蒸除去乙醇,将浓缩液真空冷冻干燥,称量并记录冻干粉质量。准确称取50 mg冻干粉,用甲醇定容到50 mL,配制成1 mg/mL的溶液,过0.22 μm有机相滤膜,取滤液待测。
1.4 数据处理试验数据采用Excel 2007进行线性回归分析; 采用SPSS 22.0统计软件进行相关性和单因素方差分析,P < 0.05表示差异显著,P < 0.01表示差异极显著;采用OriginPro 8.6软件作图。
2 结果和分析 2.1 提取物中酚类与黄酮含量4个番石榴品种叶的酚类、黄酮含量均高于幼果(表 2),叶的酚类含量为148.08~165.98 mg/g,幼果为15.98~34.85 mg/g;叶黄酮含量为90.33~99.30 mg/g,幼果为9.27~25.03 mg/g。叶酚类含量依次为‘珍珠’ > ‘红宝石’ > ‘水蜜’ > ‘西瓜’,‘珍珠’和‘红宝石’间无显著差异,但显著高于‘水蜜’和‘西瓜’;幼果酚类含量依次为‘红宝石’ > ‘珍珠’ > ‘水蜜’ > ‘西瓜’,‘红宝石’显著高于其余3个品种。叶黄酮含量依次为‘红宝石’ > ‘水蜜’ > ‘珍珠’ > ‘西瓜’,‘红宝石’和‘水蜜’间无显著差异,但显著高于‘珍珠’和‘西瓜’;幼果黄酮含量依次为‘红宝石’ > ‘珍珠’ > ‘水蜜’ > ‘西瓜’,‘红宝石’显著高于其余3个品种。‘珍珠’和‘红宝石’叶的酚类和黄酮含量优势明显,‘红宝石’幼果的酚类和黄酮含量优势明显。
| 表 2 番石榴叶和幼果的酚类和黄酮含量 Table 2 Contents of phenols and flavonoids from leaves and young fruits of guava |
在0.05~0.40 mg/mL范围内,4个番石榴品种叶和幼果提取物对DPPH·的清除率与提取物质量浓度成线性量效关系(表 3)。叶提取物对DPPH·的清除能力均显著高于幼果,清除能力表现为‘珍珠’ > ‘红宝石’ > ‘西瓜’ > ‘水蜜’,‘珍珠’与‘红宝石’间无显著差异,‘珍珠’显著高于‘水蜜’和‘西瓜’;幼果提取物对DPPH·的清除能力表现为‘红宝石’ > ‘珍珠’ > ‘水蜜’ > ‘西瓜’,与幼果的酚类和黄酮含量的变化规律一致,幼果对DPPH·的清除能力在品种间均存在显著差异,‘红宝石’幼果有显著优势。‘珍珠’叶提取物对DPPH·的清除能力最强。
| 表 3 番石榴叶和幼果提取物的清除自由基能力 Table 3 Free radicals scavenging activities of leaves and young fruits extracts from guava |
在0.10~0.50 mg/mL范围内,4个番石榴品种叶和幼果提取物对ABTS+的清除率与提取物质量浓度成线性量效关系(表 3)。叶提取物对ABTS+的清除能力均显著高于幼果,清除能力表现为‘珍珠’ > ‘红宝石’ > ‘西瓜’ > ‘水蜜’,‘珍珠’与‘红宝石’间无显著差异;幼果提取物对ABTS+的清除能力表现为‘红宝石’ > ‘珍珠’ > ‘水蜜’ > ‘西瓜’,品种间均存在显著差异。‘珍珠’叶提取物对ABTS+的清除能力最强。
2.4 对HO·的清除能力在0.10~0.50 mg/mL范围内,4个品种番石榴叶和幼果对HO·的清除率与提取物质量浓度成线性量效关系(表 3)。叶提取物对HO·的清除能力均显著高于幼果,清除能力为‘珍珠’ > ‘红宝石’ > ‘水蜜’ > ‘西瓜’;幼果提取物对HO·的清除能力为‘红宝石’ > ‘珍珠’ > ‘水蜜’ > ‘西瓜’。8个样品中,‘珍珠’叶提取物对HO·的清除能力最强。
2.5 对α-葡萄糖苷酶的抑制作用4个番石榴品种叶和幼果提取物质量浓度与抑制率均呈对数函数关系,呈抛物线形曲线(表 4)。根据IC50可知,4个品种叶和幼果提取物对α-葡萄糖苷酶的抑制活性均高于阳性对照组阿卡波糖(IC50为3 133.47 µg/mL),叶提取物显著高于幼果,叶提取物的抑制活性表现为‘珍珠’ > ‘水蜜’ > ‘西瓜’ > ‘红宝石’,白肉番石榴高于红肉;幼果提取物表现为‘红宝石’ > ‘西瓜’ > ‘珍珠’ > ‘水蜜’,红肉番石榴显著高于白肉。‘珍珠’叶提取物的抑制活性最强。
| 表 4 番石榴叶和幼果提取物对α-葡萄糖苷酶的抑制活性 Table 4 Inhibitory activity on α-glucosidase of extracts from leaves and young fruits of guava |
从表 5可见,番石榴叶和幼果的酚类、黄酮含量与清除DPPH·、ABTS+、HO·能力均呈极显著的正相关性(P < 0.01, 0.909 5≤r≤0.920 0; P < 0.01, 0.921 9≤r≤0.931 8),与α-葡萄糖苷酶抑制活性具有显著的正相关性(P < 0.05, r=0.787 0; P < 0.05, r=0.804 1)。
| 表 5 番石榴叶和幼果中酚类、黄酮含量与生物活性的相关性 Table 5 Correlation between the biological activities and contents of phenols and flavonoids in guava leaves and young fruits |
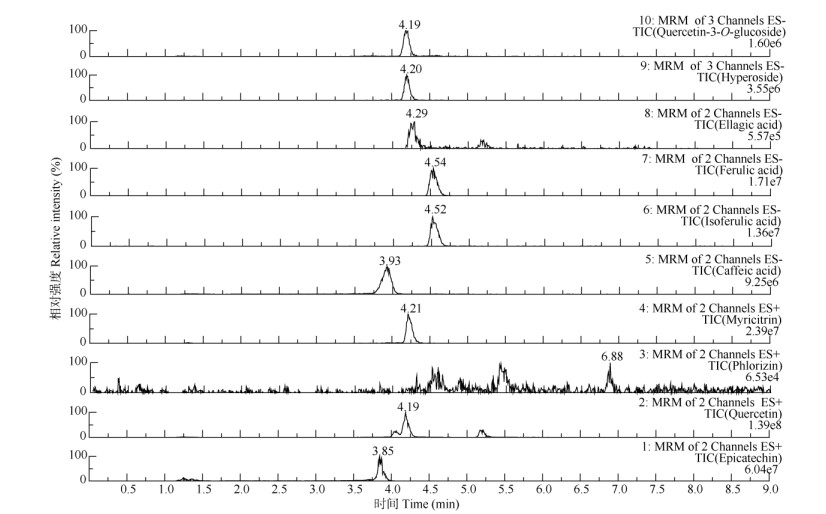
10种对照品的UPLC-MS/MS总离子流图见图 1。对4个番石榴品种叶和幼果提取物的酚类成分进行测定,所含的酚类成分相似,但含量存在差异(表 6)。‘珍珠’和‘水蜜’叶中主要酚类成分含量为槲皮素- 3-O-葡萄糖苷 > 金丝桃苷 > 鞣花酸 > 杨梅苷; ‘红宝石’叶为槲皮素-3-O-葡萄糖苷 > 杨梅苷 > 金丝桃苷 > 鞣花酸;‘西瓜’叶为槲皮素-3-O-葡萄糖苷 > 金丝桃苷 > 杨梅苷 > 鞣花酸。‘珍珠’幼果中主要酚类成分含量为杨梅苷 > 根皮苷 > 槲皮素-3-O-葡萄糖苷 > 金丝桃苷;‘水蜜’幼果为根皮苷 > 表儿茶素 > 槲皮素-3-O-葡萄糖苷 > 金丝桃苷;‘红宝石’幼果为根皮苷 > 表儿茶素 > 杨梅苷 > 金丝桃苷;‘西瓜’幼果为槲皮素-3-O-葡萄糖苷 > 金丝桃苷 > 杨梅苷 > 表儿茶素。可见,除根皮苷外,叶的各酚类成分含量均显著高于幼果。
|
图 1 10种对照品(2 μg/mL)的UPLC-MS/MS总离子流图 Fig. 1 Total ion chromatogram of standards (2 μg/mL) by UPLC-MS/MS |
| 表 6 番石榴叶和幼果提取物中的酚类组分含量(mg/kg) Table 6 Contents (mg/kg) of phenolic constituents extracted from guava leaves and young fruits |
酚类和黄酮是抗氧化和降血糖的重要活性物质。从广泛性来说,黄酮类物质属于酚类中的一员, 但其具有C6-C3-C6的特殊分子结构[23]。已有研究表明番石榴叶和果中均含有酚类和黄酮类物质,但不同品种及不同部位间的含量差异较大。郑必胜等[24]报道广东主栽的‘红心番石榴’的酚类、黄酮含量和抗氧化活性显著高于‘珍珠’、‘白玉珍珠’和‘胭脂红’品种,且果皮中的含量远高于果肉。侯峰[25]报道广州地区番石榴叶中黄酮含量为73.5~133.4 mg/g, 平均100.5 mg/g;幼果8.6~12.3 mg/g,平均9.9 mg/g,叶中黄酮含量约是幼果的10倍。本文测定了4个番石榴品种叶和幼果的酚类和黄酮含量,结果表明不同品种间、叶与幼果间的酚类和黄酮含量均具有显著差异。UPLC-MS/MS分析结果表明4个番石榴品种的叶提取物中主要酚类成分均为槲皮素-3- O-葡萄糖苷、金丝桃苷、杨梅苷、鞣花酸。‘珍珠’、‘水蜜’、‘红宝石’幼果提取物中主要酚类成分为根皮苷、表儿茶素、槲皮素-3-O-葡萄糖苷、金丝桃苷、杨梅苷,而‘西瓜’幼果提取物不含根皮苷。槲皮素- 3-O-葡萄糖苷、金丝桃苷、杨梅苷是叶和幼果共有的主要酚类成分,而鞣花酸则为叶片特有的酚类成分,在幼果中未检出。根皮苷是‘珍珠’、‘水蜜’和‘红宝石’幼果的主要酚类成分,也是10种酚类成分中唯一1种在幼果中的含量高于叶片的成分。番石榴叶中大部分酚类成分的含量均显著高于幼果。
3.2 酚类、黄酮含量与清除自由基能力、α-葡萄糖苷酶抑制活性的关系本研究测定了4个番石榴品种叶与幼果提取物对3种自由基(DPPH·、ABTS+、HO·)的清除能力和对α-葡萄糖苷酶的抑制活性,结果均表明‘珍珠’叶提取物的活性最强,各品种叶提取物的活性均显著高于幼果。Chen等[26]也报道番石榴叶提取物的抗氧化作用强于果。相关性分析结果表明,番石榴叶和幼果提取物的清除自由基能力与酚类、黄酮含量呈极显著正相关(P < 0.01),α-葡萄糖苷酶抑制活性与其呈显著正相关(P < 0.05)。曹双[27]报道番石榴抗氧化能力指数与其酚类、黄酮含量具有显著相关性。我们前期研究表明,同为桃金娘科的树葡萄(Myrciaria cauliflora)不同成熟度果实中总酚和总黄酮含量与抗氧化能力呈显著正相关[28];罗广华等[29]报道从植物中分离的鞣酸对
4个番石榴品种叶提取物的酚类和黄酮含量、清除自由基能力、α-葡萄糖苷酶抑制活性均显著高于幼果。叶提取物酚类成分均包含表儿茶素、槲皮素、根皮苷、杨梅苷、咖啡酸、异阿魏酸、阿魏酸、鞣花酸、金丝桃苷、槲皮素-3-O-葡萄糖苷。除鞣花酸外,大部分存在于叶中的酚类在幼果中也有检出,叶酚类成分的含量均明显高于幼果(根皮苷除外)。4个品种中,‘珍珠’叶酚类含量最高,提取物对DPPH·、HO·、ABTS+等3种自由基的清除能力和对α-葡萄糖苷酶抑制活性最强,因此,‘珍珠’番石榴叶用于开发抗氧化剂及α-葡萄糖苷酶抑制剂最具优势。
| [1] |
HONG J M, LIN B M, ZHANG C K, et al. Antioxidant capacity and αglucosidase inhibitory activity of ethanol extracts from guava fruits[J]. J NW Agric For Univ (Nat Sci), 2019, 47(1): 139-146. 洪佳敏, 林宝妹, 张朝坤, 等. 番石榴醇提物抗氧化能力及α-葡萄糖苷酶抑制活性研究[J]. 西北农林科技大学学报(自然科学版), 2019, 47(1): 139-146. DOI:10.13207/j.cnki.jnwafu.2019.01.017 |
| [2] |
DAKAPPA S S, ADHIKARI R, TIMILSINA S S, et al. A review on the medicinal plant Psidium guajava Linn. (Myrtaceae)[J]. J Drug Deliv Ther, 2013, 3(2): 162-168. |
| [3] |
CHAUHAN A K, SINGH S, SINGH R P, et al. Guava-enriched dairy products: A review[J]. Ind J Dairy Sci, 2015, 68(1): 1-5. |
| [4] |
JOSEPH B, PRIYA M. Review on nutritional, medicinal and pharmacological properties of guava (Psidium guajava Linn.)[J]. Int J Pharma Bio Sci, 2011, 2(1): 53-69. |
| [5] |
SESHADRI T R, VASISHTA K. Polyphenols of the leaves of Psidium guava: Quercetin, guaijaverin, leucocyanidin and amritoside[J]. Phytochemistry, 1965, 4(6): 989-992. DOI:10.1016/S0031-9422(00)86281-0 |
| [6] |
ARIMA H, DANNO G I. Isolation of antimicrobial compounds from guava (Psidium guajava L.) and their structural elucidation[J]. Biosci Biotechnol Biochem, 2002, 66(8): 1727-1730. DOI:10.1271/bbb.66.1727 |
| [7] |
BEGUM S, HASSAN S I, SIDDIQUI B S, et al. Triterpenoids from the leaves of Psidium guajava[J]. Phytochemistry, 2002, 61(4): 399-403. DOI:10.1016/S0031-9422(02)00190-5 |
| [8] |
BEGUM S, HASSAN S I, SIDDIQUI B S. Two new triterpenoids from the fresh leaves of Psidium guajava[J]. Planta Med, 2002, 68(12): 1149-1152. DOI:10.1055/s-2002-36353 |
| [9] |
BEGUM S, HASSAN S I, ALI S N, et al. Chemical constituents from the leaves of Psidium guajava[J]. Nat Prod Res, 2004, 18(2): 135-140. DOI:10.1080/14786410310001608019 |
| [10] |
PARK B J, MATSUTA T, KANAZAWA T, et al. Phenolic compounds from the leaves of Psidium guajava: I. hydrolysable tannins and benzophenone glycosides[J]. Chem Nat Compd, 2011, 47(4): 632-635. DOI:10.1007/s10600-011-0015-1 |
| [11] |
FU L, LU W Q, ZHOU X M. Phenolic compounds and in vitro antibacterial and antioxidant activities of three tropic fruits: Persimmon, guava, and sweetsop[J/OL]. BioMed Res Int, 2016, 2016: 4287461. doi: 10.1155/2016/4287461.
|
| [12] |
DIVYA N, ILAVENIL S. Hypoglycemic and hypolipidemic potentials of Psidium guajava in alloxan induced diabetic rats[J]. Res J Pharm Technol, 2012, 5(1): 125-128. |
| [13] |
QIN X J, YU Q, YAN H, et al. Meroterpenoids with antitumor activities from guava (Psidium guajava)[J]. J Agric Food Chem, 2017, 65(24): 4993-4999. DOI:10.1021/ACS.JAFC.7B01762 |
| [14] |
GUTIÉRREZ R M P, MITCHELL S, SOLIS R V. Psidium guajava: A review of its traditional uses, phytochemistry and pharmacology[J]. J Ethnopharmacol, 2008, 117(1): 1-27. DOI:10.1016/j.jep.2008.01.025 |
| [15] |
DEGUCHI Y, OSADA K, CHONAN O, et al. Effectiveness of consecutive ingestion and excess intake of guava leaves tea in human volunteers[J]. J Jpn Counc Adv Food Ingred Res, 2000, 3(1): 19-28. |
| [16] |
RATTANACHAIKUNSOPON P, PHUMKHACHORN P. Contents and antibacterial activity of flavonoids extracted from leaves of Psidium guajava[J]. J Med Plants Res, 2010, 4(5): 393-396. DOI:10.5897/JMPR09.485 |
| [17] |
RIZZO L Y, LONGATO G B, RUIZ A L T G, et al. In vitro, in vivo and in silico analysis of the anticancer and estrogen-like activity of guava leaf extracts[J]. Curr Med Chem, 2014, 21(20): 2322-2330. DOI:10.2174/0929867321666140120120031 |
| [18] |
OJEWOLE J A O. Hypoglycemic and hypotensive effects of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract[J]. Methods Find Exp Clin Pharmacol, 2005, 27(10): 689-696. DOI:10.1358/mf.2005.27.10.948917 |
| [19] |
XU J G, TIAN C R, HU Q P, et al. Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination[J]. J Agric Food Chem, 2009, 57(21): 1039210398. DOI:10.1021/jf902778j |
| [20] |
HU Q P, XU J G. Profiles of carotenoids, anthocyanins, phenolics, and antioxidant activity of selected color waxy corn grains during maturation[J]. J Agric Food Chem, 2011, 59(5): 2026-2033. DOI:10.1021/jf104149q |
| [21] |
CAO Y, PANG S B, XU L, et al. Antioxidant activities of Coreopsis tinctoria extracts in vitro[J]. Chin J Exp Tradit Med Formulae, 2011, 17(12): 144-147. 曹燕, 庞市宾, 徐磊, 等. 金鸡菊提取物体外抗氧化活性[J]. 中国实验方剂学杂志, 2011, 17(12): 144-147. DOI:10.3969/j.issn.10059903.2011.12.041 |
| [22] |
QIU S L, LIN B M, ZHENG K B, et al. Antioxidative activity and α-glucosidase inhibitory activity of ethanol extracts of leaves of different cultivars of jaboticaba[J]. J Fruit Sci, 2017, 34(11): 14501457. 邱珊莲, 林宝妹, 郑开斌, 等. 不同品种树葡萄叶片醇提物抗氧化及抑制α-葡萄糖苷酶活性研究[J]. 果树学报, 2017, 34(11): 14501457. DOI:10.13925/j.cnki.gsxb.20170141 |
| [23] |
VALLS J, MILLÁN S, MARTÍ M P, et al. Advanced separation methods of food anthocyanins, isoflavones and flavanols[J]. J Chromatogr A, 2009, 1216(43): 7143-7172. DOI:10.1016/j.chroma.2009.07.030 |
| [24] |
ZHENG B S, CAO S, ZHONG W. Analysis of phenolic compounds and antioxidation in different cultivar guavas[J]. Food Sci Technol, 2014, 39(12): 225-230. 郑必胜, 曹双, 钟伟. 不同品种番石榴的酚类物质及抗氧化活性[J]. 食品科技, 2014, 39(12): 225-230. DOI:10.13684/j.cnki.spkj.2014.12.048 |
| [25] |
HOU F. Development research on hypoglycemic components in leaves and unripe fruits of Psidium guajava[D]. Guangzhou: South China University of Technology, 2011: 22. 侯峰. 番石榴叶和幼果降糖成分开发研究[D]. 广州: 华南理工大学, 2011: 22. |
| [26] |
CHEN H Y, YEN G C. Antioxidant activity and free radical-scavenging capacity of extracts from guava (Psidium guajava L.) leaves[J]. Food Chem, 2007, 101(2): 686-694. DOI:10.1016/J.FOODCHEM.2006.02.047 |
| [27] |
CAO S. Antioxidant and antitumor activities of phenolics from guava (Psidium guajava L. )[D]. Guangzhou: South China University of Technology, 2015: 46-47. 曹双. 番石榴酚类物质抗氧化和抗肿瘤活性研究[D]. 广州: 华南理工大学, 2015: 46-47. |
| [28] |
LIN B M, ZHENG K B, ZHANG S, et al. Studies on antioxidant and α-glucosidase inhibitory activities of ethanol extracts from peels and seeds of jaboticaba at different maturities[J]. J Trop Subtrop Bot, 2018, 26(3): 233-240. 林宝妹, 郑开斌, 张帅, 等. 不同成熟度树葡萄果实醇提取物抗氧化和抑制α-葡萄糖苷酶活性研究[J]. 热带亚热带植物学报, 2018, 26(3): 233-240. DOI:10.11926/jtsb.3831 |
| [29] |
LUO G H, WANG A G. The scavenging effect of plant polyphenolics on superoxide radicals[J]. J Trop Subtrop Bot, 1994, 2(4): 95-99. 罗广华, 王爱国. 植物中的多酚物质对超氧物自由基的清除作用[J]. 热带亚热带植物学报, 1994, 2(4): 95-99. |
| [30] |
MA X W, WU H X, LIU L Q, et al. Polyphenolic compounds and antioxidant properties in mango fruits[J]. Sci Hort, 2011, 129(1): 102107. DOI:10.1016/j.scienta.2011.03.015 |
| [31] |
MEYER A S, YI O S, PEARSON D A, et al. Inhibition of human lowdensity lipoprotein oxidation in relation to composition of phenolic antioxidants in grapes (Vitis vinifera)[J]. J Agric Food Chem, 1997, 45(5): 1638-1643. DOI:10.1021/jf960721a |
| [32] |
VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J]. J Agric Food Chem, 1998, 46(10): 4113-4117. DOI:10.1021/jf9801973 |
| [33] |
ZHANG H J, JIA D Y, SUN H, et al. Inhibitory effect of polyphenol extract from pomegranate peel and its purified fractions on α-glucosidase activity[J]. Nat Prod Res Dev, 2012, 24(9): 1253-1256. 张海均, 贾冬英, 孙慧, 等. 石榴皮多酚提取物及纯化物对α-葡萄糖苷酶的抑制作用研究[J]. 天然产物研究与开发, 2012, 24(9): 12531256. DOI:10.3969/j.issn.1001-6880.2012.09.023 |
| [34] |
LIU Y L, YANG W K, LIU H S, et al. Inhibitory effects of the polyphenol extracts from Chinese bayberry on α-glucosidase in vitro[J]. J Fruit Sci, 2016, 33(1): 59-65. 柳余莉, 杨文康, 刘合生, 等. 杨梅多酚粗提物对α-葡萄糖苷酶体外抑制作用的研究[J]. 果树学报, 2016, 33(1): 59-65. DOI:10.13925/j.cnki.gsxb.20150211 |
| [35] |
LIU J C, JIAO Z G, WANG S X. Inhibitory effects of apple polyphenol extracts on α-amylase and α-glucosidase[J]. J Fruit Sci, 2011, 28(4): 553-557. 刘杰超, 焦中高, 王思新. 苹果多酚提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J]. 果树学报, 2011, 28(4): 553-557. DOI:10.13925/j.cnki.gsxb.2011.04.003 |
 2021, Vol. 29
2021, Vol. 29


