2. 福建省农业科学院, 福州 350003
2. Fujian Academy of Agricultural Sciences, Fuzhou 350003, China
福建有丰富的茶树资源、悠久的产茶历史、多茶类的共同发展,茶树育种工作一直是茶产业发展的基础与重点工程。良种是提高茶叶质量、实现产品多样化的最有效措施,尤其是无性系良种茶园具有发芽整齐,品质稳定,便于管理和加工等优点, 适宜于进行规模化生产,其经济效益平均可比有性系茶园提高一倍以上。综合分析我国和世界其他产茶国的茶叶发展史,茶叶生产的每一次飞跃总是与茶树新品种的育成和利用分不开[1]。茶(Camellia sinensis)是多年生木本植物,属于山茶科(Theaceae)山茶属茶组,复杂的遗传背景、基因型高度杂合及环境因素的影响,使得传统育种方法耗时长和效率低[2–4],有的长达20 a以上。随着分子标记技术的飞速发展,与以往的RAPD和ISSR标记相比,SSR标记由于具有共显性、位点丰富、多态性好、稳定性高等诸多优点而备受青睐,已广泛应用于DNA指纹图谱绘制[5–6]、亲缘关系分析[7–8]、连锁图谱构建[9–11]和品种鉴定[12–14]等研究。
茶树育种是为选育出符合社会发展需求的高效、优质品种。然而随着生产的发展与市场需求的变化,茶树育种目标也随之改变。20世纪80年代前,高产是主要的育种目标;后来随着名优茶的崛起,早生品种、高产成为育种目标;进入21世纪, 高香(品质)育种成为首要目标;目前育种开始向多样化方向发展,高香、高功能性成份育种或者特异叶色育种将成为主流。
本研究以‘福云6号’、‘金牡丹’等19个F1代杂交创新种质为材料,对其主要农艺性状进行分析(芽期、叶类、树型、生化等)和评价鉴定,利用SSR标记技术对其遗传多样性进行分析,旨在为今后茶树种质资源的开发和新品种选育提供参考。
1 材料和方法 1.1 材料以茶树(Camellia sinensis) ‘福云6号’、‘金牡丹’等品种为母本,通过天然杂交获得杂交创新种质100个。经单株制样,有19个新品系的香气独特、长势良好(表 1)。采用短穗扦插进行扩繁后,建立品系比较试验,以‘福鼎大白’(绿茶)及‘黄旦’(乌龙茶)为对照种。
| 表 1 新品系杂交亲本 Table 1 hybrid parent of new variety |
在同一块地,相同的施肥条件,每小区选定10株5 a生茶树,按陈亮等[15]的标准观测春梢生育期、树型、树姿、叶色。在春茶采摘前,茶树随机采摘一芽三叶初展新梢(留鱼叶采)和成熟叶,测量新梢长度、新梢质量等。
于2019年采集春茶第一批新梢顶端一芽二叶约100 g,当蒸锅水沸腾(100℃)时,将鲜叶平铺在蒸板上蒸1 min,然后快速吹风晾干表面水分,最后置于80℃烘箱中烘干(含水量低于5%),制成蒸青样,装入密封袋或容器,在低温(约4℃)干燥条件下保存备用,水浸出物总量测定参照GB 8305- 2013方法;茶多酚总量参照GB 8313-2008酒石酸铁比色法测定;可溶性糖参照蒽酮比色法[16]测定;游离氨基酸含量测定参照GB/T 8314-2013方法[17]。
1.3 DNA的提取和PCR扩增取新稍嫩叶,迅速用冰块冷冻,置于-80℃冰箱保存。DNA提取参照天根生化科技有限公司生产的植物基因组试剂盒(型号:DP320)说明书操作。参考林郑和等[18]的方法,利用琼脂糖凝胶电泳及紫外光/可见光分光光度计(Biochrom Libra S22)测定DNA浓度和纯度。
SSR引物从已公开发表的茶树SSR特异性引物网站(NCBI)上选取[19–20],共60对引物,由上海生工有限公司合成。以亲本‘福云6号’、‘金牡丹’基因组DNA为模板,进行PCR扩增,筛选扩增条带清晰、多态性丰富、重复性好的SSR特异性引物48对(表 2)。PCR反应体系共20 μL:ddH2O 12.4 μL、dNTP (10 nmol/L) 0.4 μL、DNA 2 μL、Taq酶(2 U/μL) 0.4 μL、10×PCR Buffer (Mg2+) 2 μL,以及正反向引物(10 μmol/L)各0.4 μL。PCR扩增程序为94℃预变性4 min;然后94℃变性30 s,52℃~60℃退火30 s,72℃延伸30 s,共35个循环,最后72℃延伸7 min,4℃保存。扩增产物用8%的聚丙烯酰胺凝胶电泳检测,140 V电压下电泳70 min,银染法显色[21], 用凝胶成像仪拍照并记录。
| 表 2 SSR引物序列及特征 Table 2 Primer sequences and characteristics of SSR markers |
试验数据采用DPS软件(V 15.50)进行差异显著性(LSD法)分析,所有试验均重复3~4次(每个植株为1个重复)。采用Excel 2007和SPSS 22.0软件对数据进行统计分析,采用UPMGA方法进行聚类分析。
2 结果和分析 2.1 农艺性状的观察春梢萌发期 气候条件、土壤肥力等是影响茶树萌发重要的外界因素。本研究所有新品种(系)都种植在同一块地,土壤经过深翻,肥力基本一致, 且施肥、喷药等管控措施均一致。从表 3可见,新品系1001 (‘春绿2号’)、1017和46-6为特早生品种, 与对照‘福鼎大白’相比,1001一芽一叶初展期早15 d, 一芽二叶初长期早16~17 d;新品系1017一芽一叶初长期早16~18 d,一芽二叶初长期早11~16 d;新品系46-6一芽一叶初长期早13~14 d,一芽二叶初长期早8~10 d。且属于早生种的还有1015、1013、1016和‘黄2’,比‘福鼎大白’早2~7 d;属于晚生种的有1007、1011和‘黄1’等,其余为中生种。
| 表 3 新品种(系)的春梢萌发期(2019和2020年) Table 3 Germination period of spring shoot of new varieties (lines) in 2019 and 2020 |
树形 除1001是小乔木外,其余新品系均为灌木;除1001的树姿直立外,其余新品系均为半开张或者开张。从叶片大小来看,有11个新品系为中叶,分别为1001、1003、1006、46-6、1013、‘黄1’、‘黄2’、1017、1012、1014和1016,其余8个新品系均为小叶,没有大叶的。
成熟叶片性状 从表 4可见,叶长与叶宽均超过‘福鼎大白’和‘黄旦’的新品系有1001、‘黄1’、‘黄2’和1016。大部分新品系叶形为长椭圆形,1017为近圆形,1011和1012为近椭圆形。叶脉对数最多的是1013、1017和‘黄2’,均达12对以上。叶色除1003、‘黄1’、‘黄2’为黄绿色外,其余均为绿色。叶表面除1003、1012、1014为光滑外,其余均为微隆; 1007、1011、1012叶尖为钝尖,其余均为渐尖; 1007、1011、1012叶基为近圆形,其余均为楔形。
| 表 4 新品系成熟叶片性状 Table 4 Characteristics of mature leaves |
春季新稍性状 从表 5可见,发芽密度大的新品系有1001和1006等9个,除‘黄1’发芽密度较稀疏外,其余发芽密度均为中等。新稍叶色为黄绿色的有1003、‘黄1’和‘黄2’,紫色的有1005、46-6、1013、1017、1009、1010、1011和1008,其余为绿色。一芽三叶最长的为1006,质量最高的为1001。
| 表 5 春季新稍的芽叶性状 Table 5 Bud and leaf characteristics of spring shoots |
从表 6可见,春稍一芽二叶的可溶性糖含量变化较大,最高的为1007 (7.1%),其次为1001 > 1013 > 1015 > 1010 > 1011 > 1016,最低的为‘黄1’ (3.7%), 超过对照‘黄旦’与‘福鼎大白’的有9个;水浸出物总量最高的是1009 (44.3%),超过对照的有8个;茶多酚含量最高的是1017和1006,均为16.6%。新品系一芽二叶的游离氨基酸含量为2.0%~3.1%,其中最高的是1019 (3.1%),咖啡碱含量为0.1~0.3 g/kg。
| 表 6 春季新稍的生化性质 Table 6 Biochemical characters of spring shoots |
利用48对引物对19个茶树新品系进行SSR标记扩增,总共扩增出231个等位基因(Na),平均每对引物扩增出4.8个,其中引物TM345和TM341分别扩增出12和9个等位基因(表 7)。扩增的有效等位基因为1.17~7.36个,平均2.94个,其中引物TM345扩增的有效等位基因达7.36个。引物的观测杂合度为0.12~0.96,其中TM382的最高(0.96), TM579的最低(0.12)。期望杂合度为0.15~0.88,平均为0.61, 最大为0.88 (TM345), 最小为0.15 (TM579)。Shannon信息指数为0.31~2.2,平均为1.15。多态性信息含量(PIC)为0.14~0.85,平均为0.55,其中TM345的最高(0.85),TM579的最低(0.14),超过平均值(0.55)的有28对引物,占总数的58.33%;基因多样性指数为0.14~0.86,以TM345的最大(0.864 2), TM579的最小(0.144 2),平均为0.596。说明所选引物具有鲜明的代表性,扩增出的多态性情况良好。
| 表 7 19个茶树新品系的SSR标记扩增 Table 7 Amplification of SSR markers of 19 tea lines |
基于叶片性状与SSR标记数据对29个新品种(系)进行聚类分析。从图 1可见,在遗传距离为0.32处,29个新品种(系)可分为4类,第Ⅰ类有1009、‘黄玫瑰’、‘黄旦’和‘黄观音’等4个,第Ⅲ类有‘福鼎大白茶’、‘福云6号’、1017、1019和1015等5个; 第Ⅳ类仅有1001和‘早春毫’,其余的均归为第Ⅱ类。可见,1001与‘早春毫’的遗传关系较近,1009与‘黄观音’的遗传关系较近,1017、1019、1015与‘福鼎大白’的遗传关系较近。
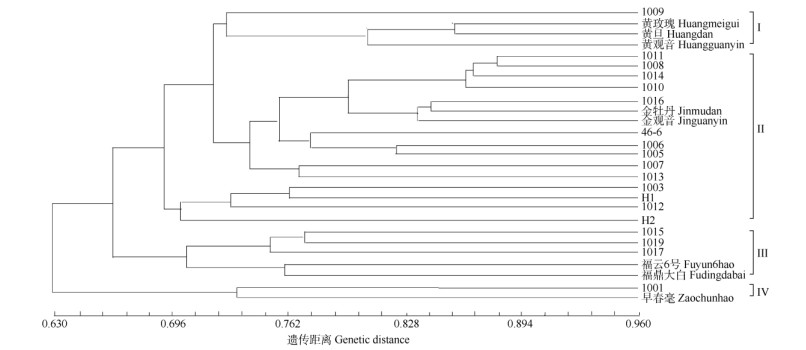
|
图 1 茶树种质聚类图 Fig. 1 UPGMA cluster diagram of tea germplasms |
茶树新品种的培育在茶产业发展中具有重要地位[1],而茶树种质资源是品种创新的基础,我国作为茶树的原产地,茶树种质资源非常丰富[22]。农艺性状的观测对茶树新品种鉴定、选育及其分类都具有重要作用,是茶树种质资源最基础的评价指标[23],也是茶树进行分类的重要依据之一。本研究结果,19个新品系中特早生种有1001、1017和46-6;除1001为小乔木外,其余品系均为灌木;叶长与叶宽均较大的有1001、‘黄1’、‘黄2’和1016;大部分新品系叶片为长椭圆形,1017为近圆形,1011和1012为近椭圆形,遗传变异较大。李瑞等[24]调查了西北50份茶树种质资源的20个农艺性状,均存在不同程度的变异,筛选出4份表现优良的种质; 王飞权等[25]调查了41份武夷名丛茶树种质的21个农艺性状,认为地方种质‘金锁匙’、‘半天妖’、‘水金龟’和‘金罗汉’可在乌龙茶产品的开发与创新利用、优良品种的选育等方面加以利用。
EST-SSR来自于基因的编码区域,具有重现性好,对模板DNA要求不高,可提供基因组表达序列的差异,是分析遗传多样性、直接与性状相关的有效标记,并且可从EST数据库中直接获得,不需耗费大量经费,通用性好[26],已被广泛应用于多种作物的遗传多样性研究,如黍稷(Panicum milia- ceum)[27]、梨(Pyrus sp.)[28]、玉米(Zea mays)[29]、茶树[10, 30–31]等。本研究筛选出48对引物,每对引物可扩增出等位基因4.8个,平均PIC为0.55,与福建茶树种质的平均PIC (0.56)相当[32],高于云南茶树种质的平均PIC (0.50)[33]。从分子水平上看,PIC越高,茶树品种之间的遗传差异越大,遗传多样性越高,同时也证明茶树的遗传背景相当复杂[30]。PIC大于0.5时表明该基因为高度多态性;0.25 < PIC < 0.5时,为中度多态性;PIC < 0.25时,为低度多态[10]。多态性信息含量是选取核心引物的重要参考条件, 本文选用的48对SSR引物整体表现良好,符合进行品种鉴定的要求。
聚类分析结果表明多数新品系可以与亲缘关系较近的母本聚在一起,说明种质间具有较近的亲缘关系,但也揭示了该新品系遗传相似性很高,遗传基础较为狭窄,应广泛收集地域相对较远、遗传距离相对较远的茶树种质进行创新种质。也可以通过积极引进国外的优异资源,挖掘国内的野生资源,扩大茶树育种的种质资源库,加快我国茶树育种步伐。1001未与母本‘福云6号’聚在一起,可能是受到其他茶树品种的花粉影响。
目前,对茶树种质资源创新、研究、评价通常以分子标记为主,并结合传统的形态学。然而,分子标记与形态学性状间不具备足够的相关性是当前分子标记单独应用于植物新品种特异性鉴定的瓶颈[34]。由于农艺学(形态学)性状大部分为数量性状,受微效多基因控制, 而SSR标记通常位于基因组中的非转录区,被认为是“中性”标记,不具备明显的生物学功能。刘洪等[34]认为SSR标记无法取代形态学性状单独用于花生品种特异性鉴定,理论上寻找与形态学性状高度相关的SSR标记存在很大难度。吴丽艳等[35]认为虽然农艺性状和SSR标记都将37份茄子(Solanum melongena)种质资源划分为4个类群,但大部分种质的分子标记与农艺性状的聚类结果一致性不高,这可能是由于农艺(表型)性状易受环境等外界因素的影响而存在差异。胡文舜等[36]报道19个枇杷杂交新品种(系)的遗传相似系数为0.728~0.969,并未将红肉与白肉的枇杷品种(系)间明显划分开。
与以往研究不同,本研究在明确茶树母本种质资源遗传背景的基础上,经多年田间区域试验,筛选出在福建试种表现良好、品质优异、香气独特的茶树种质资源,符合福建当地消费需求,这为福建的茶树发展提供了种质基础资料。
| [1] |
LIANG Y R, SHI M. Advances in tea plant genetics and breeding[J]. J Tea Sci, 2015, 35(2): 103-109. 梁月荣, 石萌. 茶树遗传育种研究进展[J]. 茶叶科学, 2015, 35(2): 103-109. DOI:10.13305/j.cnki.jts.2015.02.001 |
| [2] |
JIANG C J. Tea Tree Breeding[M]. Beijing: China Agricultural Press, 2011: 66. 江昌俊. 茶树育种学[M]. 北京: 中国农业出版社, 2011: 66. |
| [3] |
LUO Y P. Tea Cultivation[M]. 4th ed. Beijing: China Agricultural Press, 2008: 77-97. 骆耀平. 茶树栽培学[M]. 第4版. 北京: 中国农业出版社, 2008: 77-97. |
| [4] |
WAN X C. Tea Biochemistry[M]. 3rd ed. Beijing: China Agricultural Press, 2003: 68-162. 宛晓春. 茶叶生物化学[M]. 第3版. 北京: 中国农业出版, 2003: 68-162. |
| [5] |
JIANG X B, TANG D, GONG B C, et al. Genetic diversity and association analysis of local cultivars of Chinese chestnut based on SSR markers[J]. Acta Hort Sin, 2015, 42(12): 2478-2488. 江锡兵, 汤丹, 龚榜初, 等. 基于SSR标记的板栗地方品种遗传多样性与关联分析[J]. 园艺学报, 2015, 42(12): 2478-2488. DOI:10.16420/j.issn.0513-353x.2015-0484 |
| [6] |
YAO M Z, MA C L, QIAO T T, et al. Diversity distribution and population structure of tea germplasms in China revealed by EST-SSR markers[J]. Tree Genet Genom, 2012, 8(1): 205-220. DOI:10.1007/s11295-011-0433-z |
| [7] |
LI S J, LEI Y, DUAN J H, et al. Analysis of genetic diversity and relationship of Qimen population of tea plants based on EST-SSR markers[J]. J Tea Sci, 2015, 35(4): 329-335. 李赛君, 雷雨, 段继华, 等. 基于EST-SSR的祁门种群体遗传多样性和亲缘关系分析[J]. 茶叶科学, 2015, 35(4): 329-335. DOI:10.13305/j.cnki.jts.2015.04.004 |
| [8] |
HUANG X X, TANG T, JIANG Y L, et al. Genetic diversity of wild tea plant in different altitude in Qianjiazhai[J]. J Tea Sci, 2015, 35(4): 347-353. 黄晓霞, 唐探, 姜永雷, 等. 千家寨不同海拔野生茶树的EST-SSR遗传多样性研究[J]. 茶叶科学, 2015, 35(4): 347-353. DOI:10.13305/j.cnki.jts.2015.04.006 |
| [9] |
TAN L Q, PENG M, XU L Y, et al. Fingerprinting 128 Chinese clonal tea cultivars using SSR markers provides new insights into their pedigree relationships[J]. Tree Genet Gen, 2015, 11: 90. DOI:10.1007/s11295-015-0914-6 |
| [10] |
CHEN X, GONG Z M. Analysis of genetic diversity with EST-SSR markers for tea germplasm in Hubei Province[J]. Mol Plant Breed, 2017, 15(5): 1831-1838. 陈勋, 龚自明. 基于EST-SSR标记的湖北茶树种质资源遗传多样性分析[J]. 分子植物育种, 2017, 15(5): 1831-1838. DOI:10.13271/j.mpb.015.001831 |
| [11] |
VARSHNEY R K, GRANER A, SORRELLS M E. Genic microsatellite markers in plants: features and applications[J]. Trends Biotechnol, 2005, 23(1): 48-55. DOI:10.1016/j.tibtech.2004.11.005 |
| [12] |
ZHANG C C, LIU Y, JIANG Y H, et al. Application of SSR markers in cultivar identification of clonal tea plant in Zhejiang Province, China[J]. J Plant Genet Resour, 2014, 15(5): 926-931. 张成才, 刘园, 姜燕华, 等. SSR标记鉴定浙江省主要无性系茶树品种的研究[J]. 植物遗传资源学报, 2014, 15(5): 926-931. DOI:10.13430/j.cnki.jpgr.2014.05.002 |
| [13] |
HUANG D J, MA J Q, CHEN L. SSR identification and pedigree analysis of PVP application cultivars in tea plant[J]. J Tea Sci, 2016, 36(1): 68-76. 黄丹娟, 马建强, 陈亮. 茶树PVP申请品种的SSR分子标记鉴定和系谱关系分析[J]. 茶叶科学, 2016, 36(1): 68-76. DOI:10.13305/j.cnki.jts.2016.01.009 |
| [14] |
HEUBL G. New aspects of DNA-based authentication of Chinese medicinal plants by molecular biological techniques[J]. Planta Med, 2010, 76(17): 1963-1974. DOI:10.1055/s-0030-1250519 |
| [15] |
CHEN L, YANG Y J, YU F L, et al. Descriptors and Data Standard for Tea (Camellia spp.)[M]. Beijing: China Agricultural Press, 2005: 1-50. 陈亮, 杨亚军, 虞富莲, 等. 茶树种质资源描述规范和数据标准[M]. 北京: 中国农业出版社, 2005: 1-50. |
| [16] |
LIN Z H, QI Y P, CHEN R B, et al. Effects of phosphorus supply on the quality of green tea[J]. Food Chem, 2012, 130(4): 908-914. DOI:10.1016/j.foodchem.2011.08.008 |
| [17] |
LIN Z H, ZHONG Q S, CHEN C S, et al. Effects of nitrogen supply on the biochemical attributes of green tea[J]. Int J Agric Biol, 2020, 23(3): 573-581. |
| [18] |
LIN Z H, ZHONG Q S, SHAN R Y, et al. Leaf characteristics and genetic diversity of half-sib lines bred from Baijiguan (Camellia sinensis)[J]. Acta Tea Sin, 2017, 58(3): 102-107. 林郑和, 钟秋生, 单睿阳, 等. '白鸡冠'半同胞系F1代新品系性状比较及遗传多样性分析[J]. 茶叶学报, 2017, 58(3): 102-107. DOI:10.3969/j.issn.1007-4872.2017.03.004 |
| [19] |
CHEN Z H, SHAN R Y, YOU X M, et al. Constructing fingerprints and analyzing genetic diversity of 43 tea cultivars in Fujian Province[J]. J Trop Subtrop Bot, 2017, 25(6): 579-586. 陈志辉, 单睿阳, 游小妹, 等. 43个福建省茶树品种指纹图谱构建及遗传多样性分析[J]. 热带亚热带植物学报, 2017, 25(6): 579586. DOI:10.11926/jtsb.3743 |
| [20] |
DUAN Y S, JIANG Y H, WANG L Y, et al. Analysis of genetic diversity and relationship of tea cultivars and lines suitable for making green and black tea using SSR markers[J]. Sci Agric Sin, 2011, 44(1): 99-109. 段云裳, 姜燕华, 王丽鸳, 等. 中国红、绿茶适制品种(系)遗传多样性与亲缘关系的SSR分析[J]. 中国农业科学, 2011, 44(1): 99-109. DOI:10.3864/j.issn.0578-1752.2011.01.012 |
| [21] |
BAO S Y. Improvement of DNA denaturing polyacrylamide Gel electrophoresis in experiment teaching[J]. Exp Sci Technol, 2015, 13(2): 122-124. 鲍思元. DNA变性聚丙烯酰胺凝胶电泳的实验教学改进[J]. 实验科学与技术, 2015, 13(2): 122-124. DOI:10.3969/j.issn.1672-4550.2015.02.040 |
| [22] |
QIAO X Y, WANG Q S, CHEN D. The progress of tea germplasm and black tea breeding in the major tea-producing countries[J]. J Plant Gen Resour, 2015, 16(6): 1135-1140. 乔小燕, 王秋霜, 陈栋. 主要产茶国茶树资源与红茶育种研究进展[J]. 植物遗传资源学报, 2015, 16(6): 1135-1140. DOI:10.13430/j.cnki.jpgr.2015.06.001 |
| [23] |
ZHANG J, ZHANG L G. Diversity and cluster analysis of Chinese Kale germplasm resources[J]. Acta Agric Boreali-Occid Sin, 2008, 17(4): 285-289. 张静, 张鲁刚. 芥蓝种质资源的多样性和聚类分析[J]. 西北农业学报, 2008, 17(4): 285-289. DOI:10.3969/j.issn.1004-1389.2008.04.062 |
| [24] |
LI R, XIAO B, SONG H X, et al. Agronomic traits and cluster analysis of 50 tea germplasm resources[J]. Acta Agric Boreali-Occid Sin, 2011, 20(10): 107-111. 李瑞, 肖斌, 宋红霞, 等. 50份茶树种质资源农艺性状及其聚类分析[J]. 西北农业学报, 2011, 20(10): 107-111. DOI:10.3969/j.issn.10041389.2011.10.022 |
| [25] |
WANG F Q, FENG H, LUO S C, et al. Diversity analysis of agronomic traits of Wuyi Mingcong tea plant germplasm resources[J]. J Agric Sci Technol, 2019, 21(6): 43-54. 王飞权, 冯花, 罗盛财, 等. 武夷名丛茶树种质资源农艺性状多样性分析[J]. 中国农业科技导报, 2019, 21(6): 43-54. DOI:10.13304/j.nykjdb.2018.0665 |
| [26] |
SU H, LIU J J, HE W, et al. Association analysis of traits related to tea (Camellia sinensis) quality with EST-SSRs in southern Henan area[J]. J Agric Biotechnol, 2016, 24(9): 1328-1336. 苏会, 刘建军, 贺巍, 等. 豫南茶区茶品质相关性状与EST-SSR标记的关联分析[J]. 农业生物技术学报, 2016, 24(9): 1328-1336. DOI:10.3969/j.issn.1674-7968.2016.09.006 |
| [27] |
XUE Y T, LU P, QIAO Z J, et al. Genetic diversity and genetic relationship of broomcorn millet (Panicum miliaceum L.) germplasm based on SSR markers[J]. Sci Agric Sin, 2018, 51(15): 2846-2859. 薛延桃, 陆平, 乔治军, 等. 基于SSR标记的黍稷种质资源遗传多样性及亲缘关系研究[J]. 中国农业科学, 2018, 51(15): 2846-2859. DOI:10.3864/j.issn.0578-1752.2018.15.002 |
| [28] |
JIANG S, LUO J, WANG X Q, et al. A study on efficient screening of the primers for selecting polymorphic SSR markers based on the resequencing data in Pyrus[J]. J Fruit Sci, 2019, 36(2): 129-136. 蒋爽, 骆军, 王晓庆, 等. 基于基因组重测序数据高效筛选梨SSR标记多态性引物[J]. 果树学报, 2019, 36(2): 129-136. DOI:10.13925/j.cnki.gsxb.20180335 |
| [29] |
LI L J, YANG K C, PAN G T, et al. Genetic diversity of maize populations developed by two kinds of recurrent selection methods investigated with SSR markers[J]. Agric Sci China, 2008, 7(9): 10371045. DOI:10.1016/S1671-2927(08)60144-3 |
| [30] |
WANG S L, MA C L, HUANG D J, et al. Analysis of genetic diversity and construction of DNA fingerprints of chlorophyll-deficient tea cultivars by SSR markers[J]. J Tea Sci, 2018, 38(1): 58-68. 王松琳, 马春雷, 黄丹娟, 等. 基于SSR标记的白化和黄化茶树品种遗传多样性分析及指纹图谱构建[J]. 茶叶科学, 2018, 38(1): 5868. DOI:10.3969/j.issn.1000-369X.2018.01.006 |
| [31] |
WANG R J, YANG J, KONG X R, et al. Genetic analysis of fulland half-sib families of tea cultivar Jinguanyin based on SSR molecular markers[J]. J Tea Sci, 2017, 37(2): 139-148. 王让剑, 杨军, 孔祥瑞, 等. 利用SSR标记分析金观音(半)同胞茶树品种遗传差异[J]. 茶叶科学, 2017, 37(2): 139-148. DOI:10.3969/j.issn.1000-369X.2017.02.003 |
| [32] |
LIU Z, YAO M Z, WANG X C, et al. Analysis of genetic diversity and relationship of tea germplasms originated from Fujian Province based on EST-SSR markers[J]. Sci Agric Sin, 2009, 42(5): 1720-1727. 刘振, 姚明哲, 王新超, 等. 基于EST-SSR的福建地区茶树资源遗传多样性和亲缘关系分析[J]. 中国农业科学, 2009, 42(5): 17201727. DOI:10.3864/j.issn.0578-1752.2009.05.027 |
| [33] |
LIU B Y. Application studies of EST-SSR and ISSR markers in tea germplasms (Camellia spp. ) from Yunnan[D]. Beijing: Chinese Academy of Agricultural Sciences, 2009: 1-111. 刘本英. EST-SSR和ISSR分子标记在云南茶树资源中的应用研究[D]. 北京: 中国农业科学院, 2009: 1-111. |
| [34] |
LIU H, XU Z J, RAO D H, et al. Genetic diversity analysis and distinctness identification of peanut cultivars based on morphological traits and SSR markers[J]. Acta Agron Sin, 2019, 45(1): 26-36. 刘洪, 徐振江, 饶得花, 等. 基于形态学性状和SSR标记的花生品种遗传多样性分析和特异性鉴定[J]. 作物学报, 2019, 45(1): 26-36. DOI:10.3724/SP.J.1006.2019.84060 |
| [35] |
WU L Y, DU G H, BAO R, et al. Analysis of genetic diversity of eggplant germplasms by agronomic characters and SSR markers[J]. J Yunnan Univ (Nat Sci), 2018, 40(4): 820-828. 吴丽艳, 杜光辉, 鲍锐, 等. 茄子种质资源的农艺性状与SSR标记的遗传多样性研究[J]. 云南大学学报(自然科学版), 2018, 40(4): 820-828. DOI:10.7540/j.ynu.20170585 |
| [36] |
HU W S, DENG C J, XU Q Z, et al. Identification and Fingerprint construction of 19 new hybrid varieties (lines) of loquat by SSR[J]. J Trop Subtrop Bot, 2020, 28(2): 153-162. 胡文舜, 邓朝军, 许奇志, 等. 19个枇杷杂交新品种(系)的SSR鉴定和指纹图谱构建[J]. 热带亚热带植物学报, 2020, 28(2): 153-162. DOI:10.11926/jtsb.4131 |
 2021, Vol. 29
2021, Vol. 29


