2. 中国科学院华南植物园, 广东省应用植物学重点实验室, 中国科学院华南农业植物分子分析与遗传改良重点实验室, 广州 510650
2. Guangzhou Provincial key laboratory of Applied Botany, Key Laboratory of South China Agricultural Plant Molecular Analysis and Gene Improvement, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China
龙珠果(Passiflora foetida),别名香花果、天仙果、野仙桃等,为西番莲科(Passifloraceae)西番莲属草质藤本植物。原产于西印度群岛,在我国主要分布于广东、海南、福建和台湾等地,生长于荒山草坡、灌丛或近海边沙滩[1]。龙珠果花朵秀丽,颜色多变;果实外形美观,香甜可食[2]。
龙珠果茎杆和叶片中含有黄酮类化合物,主要成分为牡荆素、异牡荆素、荭草素,异荭草素等[3]。龙珠果具有清热解毒、清肺止咳的作用,可用于治疗肺热咳嗽、小便混浊、痈疮肿毒、外伤性眼角膜炎、淋巴结炎等症[4–5]。果实可用作催吐剂,煎煮后可用于治疗哮喘;叶片外敷可治疗创伤,干燥叶片泡茶有助于提高睡眠质量;根可用于调经,对治疗过度兴奋和暴躁有作用[6]。
龙珠果的自然繁殖方式是种子繁殖,但种子萌发率低、繁殖周期长。关于龙珠果组织培养技术, 国内尚未见文献报道。本文以龙珠果带节茎段为外植体,通过调整植物生长调节剂的种类和浓度,探讨适合丛生芽诱导、壮苗生根、炼苗移栽等阶段的培养基,为龙珠果直接器官发生体系的建立提供试验依据。龙珠果作为一种海滨植物,多生长于高盐环境,组培苗的耐盐程度是其能否在海滨环境成活的重要指标,通过对2月龄组培苗进行盐胁迫处理, 探讨其对盐胁迫的适应程度。
1 材料和方法 1.1 材料龙珠果(Passiflora foetida)种子发芽后种植在中国科学院华南植物园生物技术育种实验室。3个月后苗高约12 cm,选取生长健壮、长势基本一致的植株,截取带节的茎段用于组织培养。取移栽至基质中生长2个月长势基本一致的组培苗用于盐胁迫试验。
1.2 组织培养以MS为基本培养基[7],pH 5.7。培养条件: (25± 2)℃、光照强度32.57 μmol/(m2·s)、12 h光照/12 h黑暗。将清洗过的龙珠果茎段置于超净工作台上, 用75%酒精浸泡约30 s,无菌水清洗2~3次,然后用0.1% HgCl2浸泡5 min,最后无菌水冲洗4~5次。将消毒过的茎段切成约2 cm带节点小段,插入在已灭菌的培养基中。
植物生长调节剂组合的影响 将带节茎段接种于添加不同质量浓度的6-BA (0.5、1.0、2.0、3.0 mg/L)与IBA (0.05、0.1、0.2、0.3 mg/L)或NAA (0.05、0.1、0.2、0.3 mg/L)组合的MS培养基中, 以不添加任何植物生长调节剂的MS培养基为对照。每处理接种5瓶,每瓶15个茎段。40 d后统计丛生芽诱导率、芽分化率、愈伤组织诱导率等。丛生芽诱导率(%)=诱导出芽或芽点的茎段数/接种的茎段总数×100%,芽分化率(%)=分化出芽的数量/芽点的总数×100%,愈伤组织诱导率(%)=诱导出愈伤组织的茎段数/接种的茎段总数×100%。
壮苗生根 将诱导出的丛生芽分离,接种于含不同质量浓度的NAA (0.05、0.1、0.2 mg/L)和IBA (0.05、0.1、0.2 mg/L)的1/2MS培养基中进行壮苗生根培养,以1/2MS培养基为对照。每处理接种8瓶,每瓶3个小芽。40 d后统计生根率、根长、根粗等。生根率(%)=诱导出根的芽数量/接种芽的总数×100%。
炼苗移栽 组培苗长至8~12 cm高时,选择长势旺盛、叶片较多且根系发育良好的组培苗,打开瓶盖,转移到自然条件下炼苗1周。小心从组培瓶中取出幼苗,用自来水将根部冲洗干净,移栽至泥炭土∶蛭石∶珍珠岩为2∶1∶1的基质中,共移栽121株。基质浇透水,同时提高空气湿度,保持适当通风,30 d后统计移栽成活率。移栽成活率(%)=成活苗数/移栽总苗数×100%。
1.3 盐胁迫试验组培苗移栽2个月后,隔天用不同浓度的NaCl溶液浇灌,共设6个处理:0、100、200、400、600、800 mmol/L,以0 mmol/L NaCl为对照,每处理5株。5 d后每处理分别称取0.5 g功能叶片(从上向下第二片),冻存于-80℃冰箱中,3次重复。
SOD、POD、CAT和APX活性测定 取出叶片置于预冷的研钵中,加入少量的石英砂和5 mL 0.05 mol/L的磷酸缓冲液(pH 7.8,1% PVP, 0.1 mmol/L EDTA),在冰上迅速研磨成均一浑浊的悬浮液,转入15 mL离心管中。在4℃,7 104×g离心10 min,取上清液,4℃放置。SOD活性采用核黄素-NBT法[8]测定;POD活性采用愈创木酚法[9–10]测定;CAT活性采用紫外分光光度计法[11]测定; APX酶活性采用抗坏血酸氧化法[12]测定。
1.4 数据统计采用Excel 2010对数据进行整理和统计,显著性分析采用SPSS 22.0中的邓肯氏多重检测法(Dun- can’s multiple range test, DMRT), 以P < 0.05表示差异显著。
2 结果和分析 2.1 植物生长调节剂的影响茎段接种到诱导培养基后定期观察,约15 d在节点处开始长出芽点或小芽,随后茎段两端慢慢变黄,培养40 d后统计丛生芽诱导率、芽分化率、愈伤组织诱导率等指标(表 1和图 1: A)。
| 表 1 植物生长调节剂对丛生芽诱导的影响 Table 1 Effect of plant growth regulator on induction of cluster buds |

|
图 1 龙珠果茎段的离体培养和植株再生。A: 丛生芽诱导; B: 愈伤组织诱导; C: 小芽; D: 生根; E: 移栽30 d; F: 移栽90 d。 Fig. 1 Culture in vitro and regeneration from stems of Passiflora foetida. A: Cluster bud induction; B: Callus induction; C: Buds without root; D: Rooting; E: Transplant after 30 days; F: Transplant after 90 days. |
培养基中添加0.5 mg/L 6-BA+0.05 mg/L IBA, 诱导的丛生芽中有14.6%芽长可达4 cm;随6-BA、IBA浓度的升高,丛生芽诱导率没有显著变化,芽分化率下降,小芽(1 cm长)比例增加。当6-BA浓度为3.0 mg/L、IBA浓度为0.3 mg/L时,芽分化率为2.3%,诱导出的都是小芽。这表明6-BA与IBA组合能诱导出丛生芽或芽点,且随浓度升高芽分化率降低,小芽比例升高。
培养基中添加0.5 mg/L 6-BA+0.05 mg/L NAA,丛生芽诱导率为98.7%,4 cm大芽达9.9%;随着6-BA、NAA浓度的升高,丛生芽诱导率和芽分化率显著下降,小芽比例明显增加,从茎段诱导出有白色愈伤层的浅绿色愈伤组织(图 1: B),且愈伤组织的数量随6-BA、NAA浓度的升高而增多。当6- BA浓度为3.0 mg/L、NAA浓度为0.3 mg/L时, 丛生芽诱导率下降为40%,诱导出的全是1 cm小芽,愈伤组织诱导率为59.5%。这表明较低浓度的6-BA与NAA组合有利于茎段诱导丛生芽和芽的分化, 较高浓度的6-BA与NAA组合有利于茎段诱导产生愈伤组织。
因此,MS+6-BA 0.5 mg/L+NAA 0.05 mg/L培养基有利于龙珠果茎段诱导丛生芽并促进芽的生长, 而MS+6-BA 3.0 mg/L+NAA 0.3 mg/L培养基有利于茎段诱导愈伤组织。
2.2 植物生长调节剂对壮苗生根的影响将大小均匀一致的丛生芽(图 1: C)转接到壮苗生根培养基后定期观察,约15 d根开始形成,培养40 d后对根的生长情况进行统计、分析(表 2)。
| 表 2 植物生长调节剂对壮苗生根的影响 Table 2 Effect of plant growth regulator on rooting |
培养基中添加0.05 mg/L NAA, 生根率为100%, 29.2%的根长达5 cm,根细,植株生长正常;当NAA为0.2 mg/L时,生根率为83.3%,10.0%的根长达5 cm,根略粗,植株叶片较黄。这表明低浓度NAA有利于诱导分化芽长根,但根细长;高浓度NAA对根的诱导有抑制作用,但根较粗,叶片较黄。
培养基中添加0.05 mg/L IBA,生根率为54.2%,38.5%的根长达5 cm,根略粗,植株正常生长;当IBA为0.2 mg/L时,生根率为95.8%,73.9%的根长达5 cm,根略粗,叶片较绿(图 1: D)。这表明, 低浓度IBA诱导生根的效果较差,根短粗;而高浓度IBA有利于诱导生根,根长且粗,植株叶片较绿。
当NAA与IBA配合使用时,随浓度升高,生根率反而下降,但根较粗,植株叶片较黄。因此, 培养基1/2MS+IBA 0.2 mg/L适合龙珠果小芽的壮苗生根培养。
2.3 炼苗移栽待组培瓶苗长到8~12 cm高时,打开瓶盖置于自然条件下炼苗,7 d后将组培苗取出,洗净根部培养基,移栽至泥炭土∶蛭石∶珍珠岩为2∶1∶1的基质中。移栽后定期补充水分,30 d后(图 1: E)龙珠果成活率达92.6%,90 d后植株长势良好(图 1: F)。
2.4 盐胁迫的影响盐胁迫对龙珠果组培苗的生长总体表现为抑制作用,随NaCl浓度的升高,植株出现矮化现象, 叶片逐渐萎蔫卷曲,颜色变黄(图 2: A)。随NaCl浓度的升高,株高逐渐降低(图 2: B)。当NaCl浓度 < 200 mmol/L时,株高与对照的差异不显著(P > 0.05);NaCl浓度 > 400 mmol/L时,株高显著低于对照(P < 0.05)。表明龙珠果组培苗能适应200 mmol/L以下的NaCl胁迫。
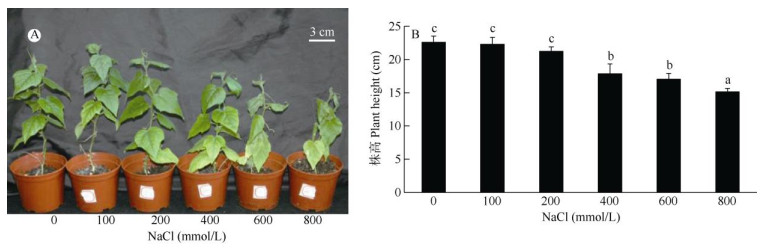
|
图 2 盐胁迫下龙珠果组培苗的表型(A)和株高(B)变化。n=3; 柱上不同字母表示差异显著(P < 0.05)(DMRT)。 Fig. 2 Phenotype (A) and height (B) of Passiflora foetida plantlets under NaCl stress. n=3. Different letters upon column indicate significant differences at 0.05 level by using DMRT. The same is following Figure. |
从图 3可见,龙珠果组培苗叶片的SOD活性随NaCl浓度升高呈逐渐升高的变化趋势,当NaCl浓度大于400 mmol/L时,SOD活性显著升高(P < 0.05)。NaCl浓度为0~400 mmol/L时,POD活性较低,当NaCl浓度大于400 mmol/L时,POD活性显著升高(P < 0.05)。CAT活性随NaCl浓度升高呈先升后降的变化趋势,0~200 mmol/L NaCl处理时,CAT活性逐渐升高,以200 mmol/L NaCl处理的最高,随后(200~800 mmol/L NaCl) CAT活性逐渐降低。APX活性随NaCl浓度升高呈先升后降的变化趋势,低浓度NaCl (0~400 mmol/L)处理的APX活性总体升高,以400 mmol/L NaCl处理的最高,随后(400-800 mmol/L NaCl) APX活性逐渐降低。
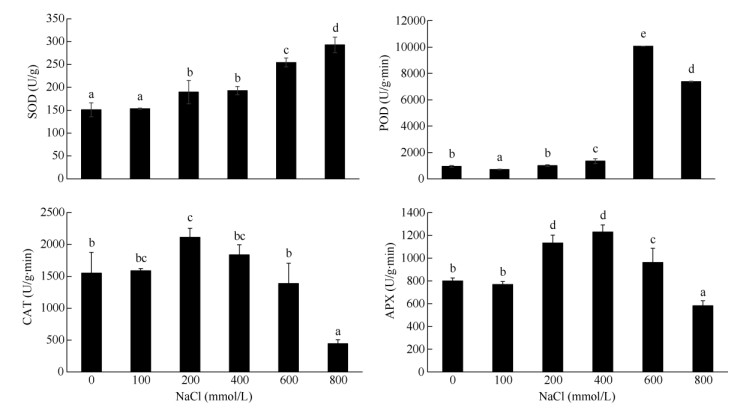
|
图 3 盐胁迫下龙珠果叶片的SOD、POD、CAT和APX活性 Fig. 3 Activities of SOD, POD, CAT and APX in Passiflora foetida leaves under NaCl stress |
6-BA与NAA或IBA组合诱导茎段产生丛生芽在很多植物中都有报道[13–15],本试验结果表明, 6-BA与NAA组合诱导龙珠果茎段产生丛生芽的效果较好,且较低浓度的6-BA与NAA组合有利于茎段诱导丛生芽和芽的生长;较高浓度的6-BA与IBA组合不能使龙珠果茎段产生愈伤组织,而较高浓度的6-BA与NAA组合诱导茎段产生愈伤组织的效果较好,推测NAA在龙珠果茎段诱导产生愈伤组织过程中占据主导地位,且NAA浓度的升高有利于龙珠果茎段形成愈伤组织。辜夕容等[16]的研究表明,NAA浓度增高有利于香樟(Cinnamomum cahora)茎段诱导出愈伤组织,这与本试验结果一致。由于愈伤组织数量有限,本试验没有进行愈伤组织增殖、分化的研究,还有待今后深入研究。
植株受到盐胁迫时,细胞内会产生大量的活性氧,抗氧化酶系统只能清除已经产生的活性氧,无法减少活性氧的生成,属于被动应答机制,一旦活性氧产生大于抗氧化酶系统的清除能力,植物会出现一系列不良症状,最明显的表现是生长受到抑制,甚至死亡[17–18]。本研究结果表明,0~200 mmol/L NaCl对龙珠果组培苗生长没有影响;200~800 mmol/L NaCl使植株变矮,叶片变黄萎蔫,这可能是较高浓度盐使细胞液泡积累较多的无机离子,水势降低, 同时根系吸收不到充分的水分和矿质元素,进而影响植株生长。
SOD能促进超氧阴离子转化为H2O2,并传递H2O2给下游酶;POD能与SOD联合作用,将SOD催化反应产生的H2O2分解清除;CAT是SOD的下游保护酶,能够进一步催化H2O2转化为H2O;APX也是SOD的下游保护酶,是叶绿体内解毒过氧化氢的关键酶,能够以抗坏血酸为底物,催化H2O2生成H2O[19–20]。张乃群等[21]对野生大豆(Glycine soja)幼苗的研究表明,随NaCl浓度的升高,POD和CAT活性呈先升高后下降的变化趋势,与本研究结果相似。
本文首次以海滨植物龙珠果为研究对象,以不同NaCl浓度模拟海滨附近生长环境,并通过4种抗氧化酶活性的变化探讨龙珠果组培苗对盐胁迫的适应程度。结果表明,SOD活性随NaCl浓度升高逐渐升高,POD、CAT和APX活性整体呈先升高后下降的变化趋势。0~200 mmol/L NaCl使叶片的SOD、POD、CAT和APX活性均呈现不同程度的升高,说明这4种酶协同发挥保护作用;当NaCl浓度大于400 mmol/L时,CAT和APX活性下降明显,说明盐浓度已超过龙珠果植株的耐盐阈值,生长受到严重抑制。综合来看,作为一种海滨植物,龙珠果对盐胁迫具有一定的耐受能力,200 mmol/L以下的NaCl对其生长影响不大,耐盐阈值为400 mmol/L,SOD、POD、CAT和APX等抗氧化酶共同构筑了龙珠果抵御盐胁迫的保护系统。
本研究成功建立了龙珠果茎段丛生芽诱导和植株再生体系,探究了组培苗对盐胁迫的适应程度,为龙珠果种苗繁育和移栽提供了理论依据和技术支持,对海滨生态环境绿化和修复具有重要意义。
| [1] |
WANG D, LU H J, SONG H D, et al. Determination of vitexin from different medicinal parts of Passiflora foetida Linn.[J]. Food Drug, 2014, 16(6): 425-427. 王东, 卢慧娟, 宋洪东, 等. 龙珠果不同入药部位中牡荆素的含量测定[J]. 食品与药品, 2014, 16(6): 425-427. DOI:10.3969/j.issn.1672-979X.2014.06.014 |
| [2] |
HUANG D. Ornamental plants and their application in Hainan seashore[J]. Flowers, 2016(3): 43-47. 黄丹. 海南海滨观赏植物及应用[J]. 花卉, 2016(3): 43-47. |
| [3] |
Editorial. Editorial Board of Chinese Materia Medica of State Administration of Traditional Chinese Medicine[M]. Shanghai: Shanghai Science and Technology Press, 1999: 478-479. 国家中医药管理局《中华本草》编委会. 中华本草, 第7卷[M]. 上海: 上海科学技术出版社, 1999: 478-479. |
| [4] |
JI S G, YANG K W, HE C Y, et al. Microscopic identification of Passi-flora foetida[J]. Chin Med Mat, 2012, 35(3): 391-393. 姬生国, 杨克伟, 何纯瑶, 等. 龙珠果的显微鉴定[J]. 中药材, 2012, 35(3): 391-393. DOI:10.13863/j.issn1001-4454.2012.03.020 |
| [5] |
Delectis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Edita. Florae Reipublicae Popularis Sinicae, Tomus 52(1)[M]. Beijing: Science Press, 1999: 111. 中国科学院中国植物志编辑委员会. 中国植物志, 第52卷第1分册[M]. 北京: 科学出版社, 1999: 111. |
| [6] |
KRISHNAVENI A, THAAKUR S R. Pharmacognostical and preli-minary phytochemical studies of Passiflora foetida[J]. Anc Sci Life, 2008, 27(3): 19-23. |
| [7] |
MURASHIGE T, SKOOG F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiol Plant, 1962, 15(3): 473-497. DOI:10.1111/j.1399-3054.1962.tb08052.x |
| [8] |
BEAUCHAMP C, FRIDOVICH I. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels[J]. Anal Biochem, 1971, 44(1): 276-287. DOI:10.1016/0003-2697(71)90370-8 |
| [9] |
MUÑOZ-MUÑOZ J L, GARCÍA-MOLINA F, GARCÍA-RUIZ P A, et al. Enzymatic and chemical oxidation of trihydroxylated phenols[J]. Food Chem, 2009, 113(2): 435-444. DOI:10.1016/j.foodchem.2008.07.076 |
| [10] |
QUINTANILLA-GUERRERO F, DUARTE-VÁZQUEZ M A, GARCÍA-ALMENDAREZ B E, et al. Polyethylene glycol improves phenol removal by immobilized turnip peroxidase[J]. Bioresour Technol, 2008, 99(18): 8605-8611. DOI:10.1016/j.biortech.2008.04.031 |
| [11] |
CHANCE B, MAEHLY A C. Assay of catalases and peroxidases[J]. Method Enzymol, 1955, 2: 764-775. DOI:10.1016/S0076-6879(55)02300-8 |
| [12] |
NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1981, 22(5): 867-880. DOI:10.1093/oxfordjournals.pcp.a076232 |
| [13] |
WANG Q, CHEN D Y, YANG G, et al. Tissue culture and rapid propa-gation in vitro of Clinacanthus nutans[J]. Plant Physiol J, 2018, 54(2): 232-236. 王强, 陈冬怡, 杨国, 等. 鳄嘴花的组织培养和快速繁殖[J]. 植物生理学报, 2018, 54(2): 232-236. DOI:10.13592/j.cnki.ppj.2018.0006 |
| [14] |
HOU S X, ZHAO Y X, LI J W, et al. Effects of different growth regulators on the rapid propagation in vitro of Dianthus caryophyllus[J]. Mol Plant Breed, 2018, 16(3): 938-942. 侯少霞, 赵永秀, 李佳雯, 等. 生长调节剂对香石竹离体快繁的影响[J]. 分子植物育种, 2018, 16(3): 938-942. DOI:10.13271/j.mpb.016.000938 |
| [15] |
WANG G P, XIAO R, LI C Y, et al. Study on the establishment of stem regenerating system from Ziziphus jujuba[J]. Chin Agric Sci Bull, 2011, 27(31): 184-188. 王国平, 肖蓉, 李春燕, 等. 枣茎段再生体系建立的研究[J]. 中国农学通报, 2011, 27(31): 184-188. |
| [16] |
GU X R, HUANG J G, YANG Q. Initial culture of Cinnamomum caphora (L.) Presl in vitro[J]. Chin Agric Sci Bull, 2005, 21(2): 97-100. 辜夕容, 黄建国, 杨庆. 香樟离体培养体系的构建初探[J]. 中国农学通报, 2005, 21(2): 97-100. DOI:10.3969/j.issn.1000-6850.2005.02.030 |
| [17] |
QI Q, MA S R, XU W D. Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance[J]. Mol Plant Breed, 2020, 18(8): 2741-2746. 齐琪, 马书荣, 徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展[J]. 分子植物育种, 2020, 18(8): 2741-2746. DOI:10.13271/j.mpb.018.002741 |
| [18] |
LIAO Q L. Influence of soil salinity on growth and physiological indexes of Phoenix canariensis seedlings[J]. J Trop Subtrop Bot, 2012, 20(2): 163-168. 廖启炓. 土壤盐度对加拿利海枣幼苗生长与生理指标的影响[J]. 热带亚热带植物学报, 2012, 20(2): 163-168. DOI:10.3969/j.issn.1005-3395.2012.02.010 |
| [19] |
ISHIKAWA T, SAKAI K, YOSHIMURA K, et al. cDNAs encoding spinach stromal and thylakoid-bound ascorbate peroxidase, differing in the presence or absence of their 3'-coding regions[J]. Febs Lett, 1996, 384(3): 289-293. DOI:10.1016/0014-5793(96)00332-8 |
| [20] |
SI C, ZHANG J Y, XU H C. Advances in studies on growth meta-bolism and response mechanisms of medicinal plants under drought stress[J]. China J Chin Mat Med, 2014, 39(13): 2432-2437. 司灿, 张君毅, 徐护朝. 药用植物在干旱胁迫下生长代谢变化规律及应答机制的研究进展[J]. 中国中药杂志, 2014, 39(13): 2432-2437. DOI:10.4268/cjcmm20141316 |
| [21] |
ZHANG N Q, LIU Y N, XIE Y H. Effects of salt stress on growth of wild soybean (Glycine soja) seedlings[J]. Soybean Sci, 2012, 31(6): 920-923. 张乃群, 刘彦娜, 解艳华. 盐胁迫对野生大豆幼苗生长的影响[J]. 大豆科学, 2012, 31(6): 920-923. DOI:10.3969/j.issn.1000-9841.2012.06.013 |
 2021, Vol. 29
2021, Vol. 29


