2. 安徽中医药大学药学院, 合肥 230012
2. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China
木槿(Hibiscus syriacus)是锦葵科(Malvaceae)木槿属的一种庭园常见的落叶灌木,别名朝开暮落花、篱障花、鸡肉花、白饭花等,广泛分布于我国热带和亚热带地区,具有较高的观赏、食用和药用价值,其花、果、根、叶和皮均可入药[1–2]。本品始载于《日华子本草》,已有近2000年的栽培历史。木槿子入药始载于《本草纲目》,木槿皮、木槿花入药始载于《日华子本草》。有收载木槿喜光,耐半阴,喜温暖湿润气候,也耐干旱和瘠薄,适应性强[3–7]。研究表明,木槿中有三萜、黄酮、木脂素等化学成分[8–11],且木槿提取物及其部分化学成分具有抗癌、抗炎、抗衰老、抗氧化和神经保护活性[9–14]。随着天然产物研究的发展,越来越多的研究证明药用植物次生代谢产物具有生理功能多样性的特点,黄酮以及木脂素等多种类型的化学成分具有抗炎、抑菌、抗肿瘤、抗病毒等多种药理活性。然而,目前对木槿所含天然活性成分及相关生物活性的研究仍然较少,这极大地限制了木槿资源的研究开发。为了丰富木槿属植物的化学成分,为木槿资源的开发利用提供科学依据,本文对木槿茎85%乙醇提取物的化学成分进行分离鉴定。
1 材料和方法 1.1 仪器和材料Avance Ⅲ 500 MHz、AM-400 MHz核磁共振仪(TMS为内标,德国Bruker公司);API Qstar Pulsar1质谱仪(美国Applied Biosystems/MDS SCIEX); Auto- Spec Premier P776三扇型双聚焦磁质谱仪(美国Waters公司);柱色谱硅胶(100~200、200~300目)及GF254薄层色谱硅胶板(青岛海洋化工厂);反相硅胶RP-C18 (40~75 μm,日本Fuji Silysia化学公司); Sephadex LH-20 (Pharmacia公司)。石油醚、氯仿、乙酸乙酯、丙酮、甲醇等均为分析纯;显色剂为10% 硫酸-乙醇溶液。二甲基亚砜(DMSO,北京索莱宝科技有限公司);DMEM培养基(美国Thermo公司); 胎牛血清(FBS, 美国CLARK Bioscience公司);脂多糖(LPS,上海源叶生物科技有限公司);Griess试剂(中国Beyotime公司);小鼠巨噬细胞RAW264.7细胞株(中国科学院细胞库,上海)。
植物材料于2019年9月采自安徽肥西县,经鉴定为锦葵科木槿属植物木槿(Hibiscus syriacus)的茎,凭证标本(HSL-201909002A)保存于安徽中医药大学。
1.2 提取和分离将新鲜木槿茎晾干, 取10 kg干燥茎粉碎,用85%乙醇室温冷浸提取3次,每次48 h,合并提取液减压浓缩得到总浸膏约1.1 kg。将总浸膏分散于温水中,依次用石油醚、乙酸乙酯、正丁醇萃取3次(5 L×3),减压浓缩后分别得到石油醚浸膏(150 g)、乙酸乙酯浸膏(360 g)和正丁醇浸膏(230 g)。乙酸乙酯萃取部分用硅胶柱(200~300目)分离,用氯仿∶甲醇(1∶0~0∶1)为流动相进行梯度洗脱,经薄层色谱检测合并后得到7个组分Frs. 1~Frs. 7。Fr. 2组分(16 g)经硅胶柱色谱(石油醚-丙酮1∶0~0∶1)和Sephadex LH-20凝胶(氯仿-甲醇1∶1)分离得到化合物2 (8.6 mg)、5 (10.2 mg)、6 (7.3 mg)和10 (11.2 mg); Fr. 3组分(23 g)经硅胶柱色谱层析(石油醚-丙酮1∶0~0∶1)梯度洗脱得到Frs. 3.1~Frs. 3.4共4个组分,Fr. 3.2组分(320 mg)和Fr. 3.3组分(280 mg)经制备型HPLC (液相条件:0~35 min,乙腈-水35∶70,流速: 3 mL/min)梯度洗脱分别得到化合物8 (10.6 mg, tR=19.3 min)、11 (12.2 mg, tR=29.8 min)和12 (5.8 mg, tR=22.6 min)。Fr. 4组分(13 g)由反相MCI柱色谱(MCI GEL CHP 20P,粒径: 75~150 µm)用甲醇-水(20∶80~100∶0)为流动相进行梯度洗脱,经薄层色谱检测合并相同组分后得到Frs. 4.1~Frs. 4.6共6个组分,组分Fr. 4.2 (420 mg)、Fr. 4.3 (390 mg)、Fr. 4.4 (410 mg)和Fr. 4.5 (360 mg)分别经Sephadex LH-20凝胶(氯仿-甲醇1∶1)和制备型HPLC (液相条件: 0~ 35 min, 乙腈-水35∶70, 流速: 3 mL/min)制备, 分别得到化合物1 (4.2 mg, tR=28.3 min)、4 (3.6 mg, tR=17.2 min)、7 (5.1 mg, tR=24.6 min)和9 (2.9 mg, tR=22.1 min)。Fr. 5组分(23 g)经反相硅胶柱色谱(甲醇-水10∶90~100∶0)梯度洗脱分离得到4个组分,Fr. 5.2 (220 mg)、Fr. 5.3 (290 mg)、Fr. 5.4 (330 mg)制备型HPLC (液相条件: 0~30 min, 乙腈-水35∶65, 流速: 3 mL/min)制备分别得到化合物3 (3.2 mg, tR=14.7 min)、9 (2.6 mg, tR=16.9 min)和13 (4.9 mg, tR=22.5 min)。化学物结构式见图 1。
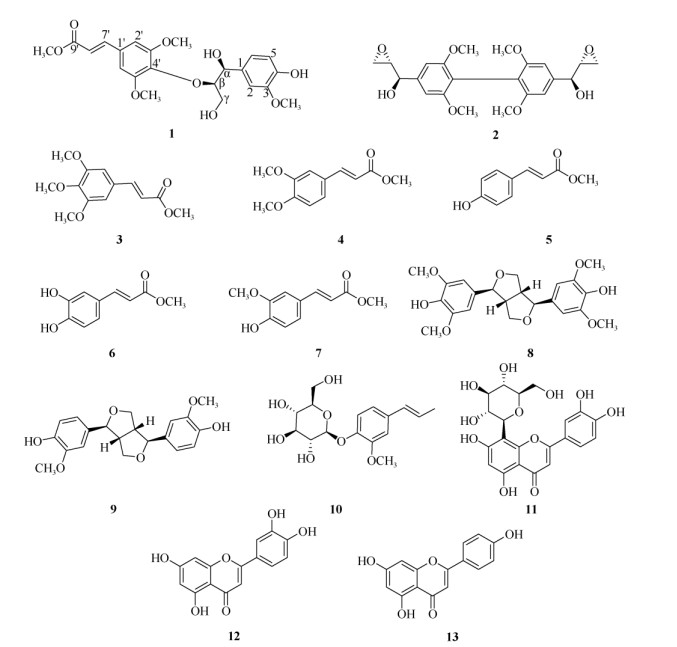
|
图 1 化合物1~13的结构 Fig. 1 Structures of compounds 1-13 |
MTS为一种全新的MTT类似物,全称为3-(4, 5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)- 2-(4-sulfopheny)-2H-tetrazolium,是一种黄色的染料。细胞线粒体能够代谢还原MTS,生成可溶性的物质,该物质的含量可以用酶标仪在490 nm处进行测定。通常情况下甲臜生成量与活细胞数成正比,可根据光密度OD值推测出活细胞的数目[15]。
取化合物1~10,用含0.3%DMSO的培养基溶解,以40 μmol/L浓度初筛,每孔终体积200 μL, 每处理均设3个复孔。37℃培养48 h后,贴壁细胞弃孔内培养液,每孔加MTS溶液20 μL和培养液100 μL; 悬浮细胞,取100 μL培养上清液,每孔加20 μL的MTS溶液;设3个空白复孔(MTS溶液20 μL和培养液100 μL的混合液)继续孵育2~4 h, 使反应充分进行后测定光吸收值。选择492 nm波长,多功能酶标仪(MULTISKAN FC)读取各孔光吸收值,记录结果。每次实验均设顺铂(DDP)和紫杉醇(Taxol) 2个阳性化合物,以浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线,应用两点法(Reed and Muench法)计算化合物的IC50值[16]。
1.4 结构鉴定化合物1 淡黄色无定形粉末;根据HR-ESI- MS m/z: 457.1466 [M + Na]+确定其分子式为C22H26O9, 不饱和度为10。在1H NMR谱(表 1)中,化学位移6.84 (1H, dd, J = 8.2, 1.9 Hz, H-6)、6.77 (1H, d, J = 1.9 Hz, H-5)和7.04 (1H, d, J = 8.2 Hz, H-2)表明1个典型的芳香ABX系统的存在,进而表明该化合物中有1个1, 3, 4-三取代苯环片段。化学位移7.61 (1H, d, J = 16.0 Hz, H-7′)和6.53 (1H, d, J = 16.0 Hz, H-8′)表明了1个典型的反式1, 2-二取代双键片段的存在。13C NMR谱(表 1)和DEPT谱表明化合物1有22个碳原子,其中4个甲基(CH3),1个亚甲基(CH2),9个次甲基(CH),8个季碳(C)。在HMBC谱(图 2)中7.09 (1H, s, H-6′)和145.3 (C-7′)的远程相关,7.61 (1H, d, J = 16.0 Hz, H-7′)和106.6 (C-2′)、118.1 (C- 8′)、131.1 (C-1′)、167.5 (C-9′)的远程相关,6.53 (1H, d, J = 16.0 Hz, H-8′)和131.1 (C-1′)、167.5 (C-9′)的远程相关以及3.73 (3H, s, H3-9′-OCH3)和167.5 (C-9′)的远程相关,进一步证明α, β-不饱和甲酯片段的存在,以及C-7′和C-1′的连接。4.99 (1H, d, J = 4.5 Hz, H-α)和61.0 (C-γ)、88.1 (C-β)、110.9 (C-2)、120.0 (C- 6)、133.7 (C-1)的远程相关,3.47/3.86 (2H, m, H-γ)和88.1 (C-β)、88.1 (C-β)的远程相关以及4.25 (1H, m, H-β)和138.6 (C-4′)相关,结合化学位移值,可以推断C-α和C-1的连接以及C-β和C-4′的连接。3.82 (3H, s, 3-OCH3)和147.9 (C-3)的远程相关,3.92 (3H, s, 3′-OCH3)和3.92 (3H, s, 5′-OCH3)、154.5 (C-3′)和154.5 (C-5′)的相关能够推断2个甲氧基的连接位置。化合物α、β、γ位的立体结构通过对比文献[17]相应位置氢的化学位移和偶合常数可得。结合文献[17]及波谱数据推断化合物1为methyl 4-[2-hydroxy-2-(4-hydroxy-3-methoxyphenyl)-1-(hydroxymethyl)ethyl] sinapate。
| 表 1 化合物1的核磁数据 Table 1 1H (500 MHz) and 13C NMR (125 MHz) data of compound 1 |
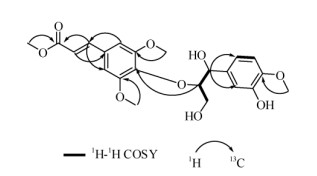
|
图 2 化合物1的1H-1H COSY相关和HMBC相关 Fig. 2 Key 1H-1H COSY and HMBC correlations of compound 1 |
化合物2 棕色粉末;ESI-MS m/z: 418 [M]+, 分子式C22H26O8;1H NMR (400 MHz,CDCl3): δ 6.59 (4H, s, H-3, 3ʹ, 5, 5ʹ), 5.77 (2H, s, OH-7, 7ʹ), 4.74 (2H, d, J = 4.2 Hz, H-7, 7ʹ),4.29 (2H, m, H-9b, 9ʹb),3.92 (2H, m, H-9a, 9ʹa), 3.91 (12H, s, 2, 2ʹ, 6, 6ʹ-OCH3), 3.11 (2H, m, H-8, 8ʹ);13C NMR (100 MHz, CDCl3): δ 131.8 (C-1, 1ʹ), 147.0 (C-2, 2ʹ, 6, 6ʹ), 102.5 (C-3, 3ʹ, 5, 5ʹ), 134.1 (C-4, 4ʹ), 85.8 (C-7, 7ʹ), 71.6 (C-9, 9ʹ), 56.1 (2, 2ʹ, 6, 6ʹ-OCH3), 54.0 (C-8, 8ʹ)。以上数据与文献[18]基本一致,故鉴定为2, 6, 2ʹ, 6ʹ-tetramethoxy-4, 4ʹ- bis(2, 3-epoxy-1-hydroxypropyl)biphenyl。
化合物3 白色粉末;ESI-MS m/z: 275 [M + Na]+,分子式C13H16O5;1H NMR (500 MHz, acetone- d6): δ 7.60 (1H, d, J = 16.0 Hz, H-7), 7.04 (2H, s, H-2, 6), 6.51 (1H, d, J = 16.0 Hz, H-8), 3.89 (6H, s, 3, 5-OCH3),3.77 (3H, s, 4-OCH3),3.74 (3H, s, 9-OCH3); 13C NMR (125 MHz, acetone-d6): δ 167.6 (C-9), 154.6 (C-3, 5), 145.5 (C-7), 141.2 (C-4), 130.8 (C-1), 117.8 (C-8), 106.6 (C-2, 6), 60.6 (4-OCH3), 56.5 (3, 5-OCH3), 51.6 (9-OCH3)。以上数据与文献[19]基本一致, 因此鉴定为3, 4, 5-三甲氧基肉桂酸甲酯。
化合物4 黄色油状物;ESI-MS m/z: 245 [M + Na]+,分子式C12H14O4;1H NMR (500 MHz, acetone-d6): δ 7.61 (1H, d, J = 16.0 Hz, H-7),7.33 (1H, d, J = 1.7 Hz, H-2),7.21 (1H, dd, J = 8.2, 1.7 Hz, H-6), 6.99 (1H, d, J = 8.2 Hz, H-5),6.44 (1H, d, J = 16.0 Hz, H-8),3.89 (3H, s, 4-OCH3),3.86 (3H, s, 3-OCH3), 3.73 (3H, s, 9-OCH3);13C NMR (125 MHz, acetone- d6): δ 167.8 (C-9), 152.5 (C-4), 150.6 (C-3), 145.5 (C-7), 128.2 (C-1), 123.5 (C-6), 116.1 (C-8), 112.3 (C-5), 111.1 (C-2), 56.1 (3-OCH3), 51.5 (4-OCH3), 49.7 (9-OCH3)。以上数据与文献[20]基本一致,故鉴定为3, 4-二甲氧基肉桂酸甲酯。
化合物5 白色晶体(甲醇);ESI-MS m/z: 201 [M + Na]+,分子式C10H10O3;1H NMR (500 MHz, CD3OD): δ 7.61 (1H, d, J = 16.0 Hz, H-7), 7.44 (2H, dd, J = 6.8, 1.9 Hz, H-2, 6), 6.79 (2H, dd, J = 6.8, 1.9 Hz, H-3, 5), 6.31 (1H, d, J = 16.0 Hz, H-8), 3.74 (3H, s, 10-OCH3);13C NMR (125 MHz, CD3OD): δ 169.8 (C-9), 161.9 (C-4), 146.7 (C-7), 131.1 (C-2, 6), 126.9 (C-1), 117.0 (C-3, 5), 114.6 (C-8),52.0 (9-OCH3)。以上数据与文献[21]基本一致,故鉴定为对羟基肉桂酸甲酯。
化合物6 白色粉末;ESI-MS m/z: 195 [M + H]+,分子式C10H10O4;1H NMR (500 MHz, CD3OD): δ 7.12 (1H, d, J = 1.8 Hz, H-2),6.82 (1H, d, J = 8.0 Hz, H-5), 6.98 (1H, dd, J = 8.0, 1.8 Hz, H-6), 7.52 (1H, d, J = 16.0 Hz, H-7), 6.24 (1H, d, J = 16.0 Hz, H-8), 3.70 (3H, s, 9-OCH3); 13C NMR (125 MHz, CD3OD): δ 127.6 (C-1), 115.3 (C-2), 146.4 (C-3), 148.8 (C-4), 115.4 (C-5), 122.5 (C-6), 145.9 (C-7), 116.1 (C-8), 167.9 (C-9), 51.6 (9-OCH3)。以上数据与文献[22]基本一致,故鉴定为咖啡酸甲酯。
化合物7 白色粉末;ESI-MS m/z: 209 [M + H]+,分子式C11H12O4;1H NMR (500 MHz, CD3OD): δ 7.56 (1H, d, J = 16.0 Hz, H-7), 7.15 (1H, s, H-2), 7.10 (1H, d, J = 8.0 Hz, H-6),6.92 (1H,d,J = 8.0 Hz, H-5), 6.30 (1H, d, J = 16.0 Hz, H-8), 3.90 (3H, s, 9- OCH3), 3.92 (3H, s, 3-OCH3);13C NMR (125 MHz, CD3OD): δ 56.2 (9-OCH3), 56.4 (3-OCH3), 111.4 (C-4),112.4 (C-7),116.7 (C-2),123.8 (C-8),129.0 (C-1),146.4 (C-3),150.6 (C-6),152.7 (C-5),170.6 (C-9)。以上数据与文献[23]一致,故鉴定为阿魏酸甲酯。
化合物8 白色无定形粉末;ESI-MS m/z: 417 [M – H]–,分子式C22H26O8;1H NMR (500 MHz, CD3OD): δ 6.83 (4H, s, H-2, 2ʹ, 6, 6ʹ), 4.88 (2H, d, J = 3.5 Hz, H-7, 7ʹ), 4.43 (2H, dd, J = 7.7, 5.7 Hz, H-9a, 9ʹa), 4.05 (2H, dd, J = 8.8, 2.3 Hz, H-9b, 9ʹb), 4.01 (12H, s, 3, 3ʹ, 5, 5ʹ-OCH3), 3.49 (2H, m, H-8, 8ʹ);13C NMR (125 MHz, CD3OD): δ 148.3 (C-3, 5, 3ʹ, 5ʹ), 135.2 (C-4, 4ʹ), 132.1 (C-1, 1ʹ), 103.5 (C-2, 2ʹ, 6, 6ʹ), 86.6 (C-7, 7ʹ), 71.7 (C-9, 9ʹ), 55.8 (C-8, 8ʹ), 54.5 (3, 5, 3ʹ, 5ʹ-OCH3)。以上数据与文献[24]报道对照基本一致,故鉴定为丁香脂素。
化合物9 无色油状物;ESI-MS m/z: 357 [M – H]–,分子式C20H22O6;1H NMR (500 MHz, CD3OD): δ 3.13 (2H, m, H-1, 5), 4.76 (2H, d, J = 3.9 Hz, H-2, 6), 3.89 (2H, dd, J = 8.9, 3.6 Hz, H-4, 8), 4.25 (2H, dd, J = 9.0, 6.8 Hz, H-4, 8), 4.43 (2H, dd, J = 7.7, 5.7 Hz, H- 9a, 9ʹa), 4.05 (2H, dd, J = 8.8, 2.3 Hz, H-9b, 9ʹb), 3.92 (6H, s, 4', 4ʹʹ-OCH3), 5.69 (2H, s, 3, 3ʹ-OH), 6.92 (2H, s, H-2ʹ, 2″), 6.91 (2H, d, J = 8.0 Hz, H-5ʹ, 5″), 6.85 (2H, dd, J = 8.0, 1.6 Hz, H-6ʹ, 6″);13C NMR (125 MHz, CD3OD): δ 146.6 (C-4ʹ, 4ʹʹ), 145.2 (C-3ʹ, 3ʹʹ), 132.8 (C-1ʹ, 1ʹʹ), 118.9 (C-6ʹ, 6ʹʹ), 114.2 (C-5ʹ, 5ʹʹ), 108.5 (C-2ʹ, 2ʹʹ), 85.8 (C-2, 6), 71.6 (C-4, 8ʹ), 55.9 (OCH3), 54.1 (C-1, 5)。以上数据与文献[25]基本一致,故鉴定为clemaphenol A。
化合物10 白色无定形粉末;ESI-MS m/z: 349 [M + Na]+,分子式C16H23O7;1H NMR (500 MHz, acetone-d6): δ 7.78 (1H, d, J = 1.5 Hz, H-2), 6.92 (1H, d, J = 8.5 Hz, H-5), 7.03 (1H, dd, J = 8.5, 1.5 Hz, H-6), 6.36 (1H, d, J = 16.0 Hz, H-1'), 6.24 (1H, dq, J = 16.0, 6.5 Hz, H-2ʹ), 1.69 (3H, d, J = 6.5 Hz, H-3ʹ), 3.71 (3H, s, 1-OCH3), 5.70 (1H, d, J = 7.5 Hz, H-1ʹʹ);13C NMR (125 MHz, acetone-d6): δ 134.0 (C-1), 118.1 (C-2), 147.1 (C-3), 150.9 (C-4), 110.8 (C-5), 120.0 (C-6), 131.7 (C-1ʹ), 124.8 (C-2ʹ), 18.6 (C-3ʹ), 56.4 (1-OCH3), 102.7 (C-1ʹʹ), 74.8 (C-2ʹʹ), 78.0 (C-3ʹʹ), 71.4 (C-4ʹʹ), 77.9 (C- 5ʹʹ), 62.7 (C-6ʹʹ)。以上数据与文献[26]基本一致, 故鉴定为(E)-3-hydroxyanethole β-d-glucopyranoside。
化合物11 黄色粉末;ESI-MS m/z: 447 [M – H]–,分子式C21H20O11;1H NMR(500 MHz, DMSO- d6): δ 13.17 (1H, s, 5-OH), 7.51 (2H, overlapped, H-2′, 6′), 6.86 (1H, d, J = 8.2 Hz, H-5′), 6.64 (1H, s, H-6), 6.26 (1H, s, H-3), 4.67 (1H, d, J = 9.84 Hz, H-1′′), 3.15~3.85 (5H, m, 糖上质子);13C NMR (125 MHz, DMSO-d6): δ 164.1 (C-2), 102.5 (C-3), 182.0 (C-4), 160.4 (C-5), 98.2 (C-6), 162.7 (C-7), 104.6 (C-8), 156.0 (C-9), 104.1 (C-10), 122.0 (C-1′), 114.1 (C-2′), 145.8 (C-3′), 149.6 (C-4′), 115.6 (C-5′), 119.4 (C-6′), 73.4 (C-1′′), 70.8 (C-2′′), 78.8 (C-3′′), 70.7 (C-4′′), 82.0 (C-5′′),61.6 (C-6′′)。以上数据与文献[27]报道的荭草苷数据基本一致,故鉴定为荭草苷。
化合物12 黄色粉末;ESI-MS m/z: 309 [M + Na]+, 分子式为C15H10O6;1H NMR (500 MHz, CD3OD): δ 11.85 (1H, s, 5-OH), 7.42 (2H, m, H-2′, 6′), 7.06 (1H, d, J = 7.8 Hz, H-5′), 6.64 (1H, s, H-3), 6.53 (1H, d, J = 7.8 Hz, H-8), 6.16 (1H, d, J = 1.8 Hz, H-6);13C NMR (125 MHz, CD3OD): δ 165.9 (C-2), 104.4 (C-3), 181.7 (C-4), 159.8 (C-5), 98.8 (C-6), 161.5 (C-7), 93.8 (C-8), 161.9 (C-9), 103.3 (C-10), 115.6 (C-1′), 108.4 (C-2′), 145.4 (C-3′), 149.8 (C-4′), 117.2 (C-5′), 124.7 (C-6′)。以上数据与文献[28]基本一致,故鉴定为木犀草素。
化合物13 黄色粉末;ESI-MS m/z: 271 [M + H]+, 分子式为C15H10O5; 1H NMR (500 MHz, DMSO- d6): δ 12.94 (5-OH),7.90 (2H, d, J = 8.8 Hz, H-2′, 6′),6.90 (2H, d, J = 8.8 Hz, H-3′, 5′),6.45 (1H, d, J = 1.8 Hz, H-8),6.17 (1H, d, J = 1.9 Hz, H-6),6.74 (1H, s, H-3);13C NMR (125 MHz,DMSO-d6): δ 164.0 (C-2),102.2 (C-3),181.4 (C-4),161.0 (C-5),98.7 (C-6),163.5 (C-7),93.7 (C-8),157.3 (C-9),103.7 (C-10),121.0 (C-1′),128.4 (C-2′, 6′),115.7 (C-3′, 5′),161.5 (C-4′)。以上数据与文献[29]基本一致,故鉴定为芹菜素。
1.5 细胞毒活性测定对木槿85%乙醇提取物中木脂素类化合物1~ 10进行了白血病HL-60细胞和肺癌A-549细胞的体外肿瘤生长抑制活性检测。结果表明化合物在40 μmol/L时均未显示出较好的抑制活性(表 2)。
| 表 2 化合物1~10的肿瘤细胞毒活性 Table 2 Cytotoxic activity of compound 1-10 |
本研究通过MCI-gel中压柱层析、硅胶柱层析、Sephadex LH-20凝胶柱层析和高效液相色谱等多种色谱方法,对木槿茎85%乙醇提取物的化学成分进行分离鉴定,共鉴定出13个化合物,分别为methyl 4- [2-hydroxy-2-(4-hydroxy-3-methoxyphenyl)-1-(hydro-xymethyl) ethyl] sinapate (1)、2, 6, 2′, 6′-四甲氧基-4, 4′-二(2, 3-环氧-1-羟基丙基)二苯(2)、3, 4, 5-三甲氧基肉桂酸甲酯(3)、3, 4-二甲氧基肉桂酸甲酯(4)、对羟基肉桂酸甲酯(5)、咖啡酸甲酯(6)、阿魏酸甲酯(7)、丁香脂素(8)、clemaphenol A (9)、(E)-3-hydro- xyanethole β-d-glucopyranoside (10)、荭草苷(11)、木犀草素(12)和芹菜素(13)。其中化合物1~10为木脂素类,化合物11~13为黄酮类,化合物1为新天然产物,化合物1~12为首次从该植物中分离得到。采用MTS法检测木脂素类化合物对人白血病HL- 60细胞和人肺癌A-549细胞株体外生长的抑制活性, 结果表明化合物1~10在40 μmol/L时均未显示出较好的抑制活性。
研究表明,肉桂酸及其衍生物具有较好的抗氧化活性[30],丁香脂素及其糖苷具有抗氧化、抗抑郁、抗胃溃疡、抗炎和选择性细胞毒作用,并对多种酶有抑制作用[31],这与木槿已报道的药理活性[9–14]相符合,表明木槿有进一步开发化妆品的潜力。文献报道从木槿中分离得到的荭草苷和木犀草素具有一定的抗氧化能力和抗炎活性[32–33],而芹菜素则对肝癌细胞具有一定的抑制作用[34]。木槿的药用价值仍需要进一步的开发,未来的研究方向可以从抗氧化活性入手,寻找延缓衰老的药物和化妆品。
| [1] |
Editorial Board of Chinese Materia Medica, State Administration of traditional Chinese medicine. Chinese Materia Medica[M]. Shanghai: Shanghai Science and Technology Press, 1999: 354-358. 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版, 1999: 354-358. |
| [2] |
WEI Q, JI X Y, XU F, et al. Chemical constituents from leaves of Hibiscus syriacus and their α-glucosidase inhibitory activities[J]. J Chin Med Mat, 2015, 38(5): 975-979. 卫强, 纪小影, 徐飞, 等. 木槿叶化学成分及抑制α-葡萄糖苷酶活性研究[J]. 中药材, 2015, 38(5): 975-979. DOI:10.13863/j.issn1001-4454.2015.05.022 |
| [3] |
YANG T, WANG B C, DENG B S, et al. Research on Hibiscus extraction technology and antioxidant[J]. Shandong Chem Ind, 2017, 46(12): 24-26. 杨涛, 王博诚, 邓碧珊, 等. 木槿提取工艺及抗氧化作用研究[J]. 山东化工, 2017, 46(12): 24-26. DOI:10.3969/j.issn.1008-021X.2017.12.008 |
| [4] |
SHEN W X, CUI C, LIU X H, et al. Overview of pharmacological research on Hibiscus syriacus L[J]. Anim Husband Feed Sci, 2011, 32(11): 54-55, 60. 申万祥, 崔超, 刘向辉, 等. 木槿药学研究概况[J]. 畜牧与饲料科学, 2011, 32(11): 54-55, 60. DOI:10.3969/j.issn.1672-5190.2011.11.027 |
| [5] |
JING L X, ZHENG C L, LIN B Q, et al. Nutritional components in Hibiscus syriacus[J]. Food Res Dev, 2009, 30(6): 146-148. 景立新, 郑丛龙, 林柏全, 等. 木槿花中营养成分研究[J]. 食品研究与开发, 2009, 30(6): 146-148. DOI:10.3969/j.issn.1005-6521.2009.06.044 |
| [6] |
ZHAO B Q, ZHANG W, TAN J T, et al. Pharmacognostic study on leaves of Hibiscus syriacus L[J]. Lishizhen Med Mat Med Res, 2007, 18(11): 2675-2676. 赵冰清, 张为, 谭金桃, 等. 木槿叶的生药学研究[J]. 时珍国医国药, 2007, 18(11): 2675-2676. DOI:10.3969/j.issn.1008-0805.2007.11.038 |
| [7] |
PENG Y, TAN J T. Study on the pharmacognosy of Hibiscus syriacus L[J]. Guid J TCM, 2006, 12(8): 98-101. 彭毅, 谭金桃. 木槿的生药学研究[J]. 中医药导报, 2006, 12(8): 98-101. DOI:10.13862/j.cnki.cn43-1446/r.2006.08.048 |
| [8] |
ZHANG E J, KANG Q S, ZHANG Z. Studies on chemical constituents from the bark of Hibiscus syriacus L[J]. Chin J Chin Mat Med, 1993, 18(1): 37-38. 张恩娟, 康钦树, 张昭. 川槿皮化学成分的研究[J]. 中国中药杂志, 1993, 18(1): 37-38. |
| [9] |
YUN B S, RYOO I J, LEE I K, et al. Two bioactive pentacyclic triterpene esters from the root bark of Hibiscus syriacus[J]. J Nat Prod, 1999, 62(5): 764-766. DOI:10.1021/np9804637 |
| [10] |
LEE S J, YUN Y S, LEE I K, et al. An antioxidant lignan and other constituents from the root bark of Hibiscus syriacus[J]. Planta Med, 1999, 65(7): 658-660. DOI:10.1055/s-2006-960841 |
| [11] |
YUN B S, LEE I K, RYOO I J, et al. Coumarins with monoamine oxidase inhibitory activity and antioxidative coumarino-lignans from Hibiscus syriacus[J]. J Nat Prod, 2001, 64(9): 1238-1240. DOI:10.1021/np0100946 |
| [12] |
YOO I D, YUN B S, LEE I K, et al. Three naphthalenes from root bark of Hibiscus syriacus[J]. Phytochemistry, 1998, 47(5): 799-802. DOI:10.1016/S0031-9422(97)00674-2 |
| [13] |
CHENG Y L, LEE S C, HARN H J, et al. The extract of Hibiscus syriacus inducing apoptosis by activating p53 and AIF in human lung cancer cells[J]. Amer J Chin Med, 2008, 36(1): 171-184. DOI:10.1142/S0192415X08005680 |
| [14] |
ZHANG R R, HU R D, LU X Y, et al. Polyphenols from the flower of Hibiscus syriacus Linn ameliorate neuroinflammation in LPS-treated SH-SY5Y cell[J]. Biomed Pharmacother, 2010, 130: 110517. DOI:10.1016/j.biopha.2020.110517 |
| [15] |
CORY A H, OWEN T C, BARLTROP J A, et al. Use of an aqueous soluble tetrazolium/formazan assay for cell growth assays in culture[J]. Cancer Commun, 1991, 3(7): 207-212. DOI:10.3727/095535491820873191 |
| [16] |
REED L J, MUENCH H. A simple method of estimating fifty per cent endpoints[J]. Amer J Epidemiol, 1938, 27(3): 493-497. DOI:10.1093/OXFORDJOURNALS.AJE.A118408 |
| [17] |
HELM R F, RALPH J. Lignin-hydroxycinnamyl model compounds related to forage cell wall structure: 1. Ether-linked structures[J]. J Agric Food Chem, 1992, 40(11): 2167-2175. doi: 10.1021/jf00023a025.
|
| [18] |
DAY S H, WANG J P, WON S J, et al. Bioactive constituents of the roots of Cynanchum atratum[J]. J Nat Prod, 2001, 64(5): 608-611. DOI:10.1021/np000428b |
| [19] |
MAHAJAN R P, PATIL S L, MALI R S. Convenient microwave assisted synthesis of naturally occurring methyl (E)-cinnamates[J]. Org Prep Proced Int, 2005, 37(3): 286-290. DOI:10.1080/00304940509354962 |
| [20] |
SHARMA A, SHARMA N, SHARD A, et al. Tandem allylic oxidation-condensation/esterification catalyzed by silica gel: An expeditious approach towards antimalarial diaryldienones and enones from natural methoxylated phenylpropenes[J]. Org Biomol Chem, 2011, 9(14): 5211-5219. DOI:10.1039/C1OB05293D |
| [21] |
LIU N Z, ZHAO B Q, QIAN Q G, et al. Chemical constituents from Scropularia ningpoensis[J]. Chin Trad Pat Med, 2019, 41(3): 576-579. 刘年珍, 赵碧清, 钱群刚, 等. 玄参化学成分的研究[J]. 中成药, 2019, 41(3): 576-579. DOI:10.3969/j.issn.1001-1528.2019.03.019 |
| [22] |
WANG Z M, YANG L, FANG Y D, et al. Chemical constituents from stems of Uncaria scandens[J]. Chin Trad Herb Drug, 2019, 50(12): 2802-2808. 王子明, 杨龄, 房银东, 等. 攀茎钩藤茎枝的化学成分研究[J]. 中草药, 2019, 50(12): 2802-2808. DOI:10.7501/j.issn.0253-2670.2019.12.009 |
| [23] |
ZHANG C H, LI M, ZENG J X, et al. Chemical constituents from Lagotis brevituba[J]. Chin Trad Pat Med, 2015, 46(10): 1437-1440. 张晨辉, 李敏, 曾金祥, 等. 短管兔耳草化学成分研究[J]. 中成药, 2015, 46(10): 1437-1440. DOI:10.7501/j.issn.0253-2670.2015.10.006 |
| [24] |
张荣荣, 梅文莉, 黄圣卓, 等. 海南栽培肾茶的化学成分研究[J]. 热带亚热带植物学报, 2017, 25(2): 182-188. DOI:10.11926/jtsb.3676 |
| [25] |
HE M, ZHANG J H, HU C Q. Studies on the chemical components of Clematis chinensis[J]. Acta Pharm Sin, 2001, 36(4): 278-280. 何明, 张静华, 胡昌奇. 威灵仙化学成分的研究[J]. 药学学报, 2001, 36(4): 278-280. DOI:10.3321/j.issn:0513-4870.2001.04.009 |
| [26] |
FUJIMATU E, ISHIKAWA T, KITAJIMA J. Aromatic compound glucosides, alkyl glucoside and glucide from the fruit of anise[J]. Phytochemistry, 2003, 63(5): 609-616. DOI:10.1016/S0031-9422(03)00179-1 |
| [27] |
YAO Y Z, LI S H. Chemical constituents from Angelica keiskei[J]. J Chin Med Mat, 2015, 38(8): 1656-1660. 姚元枝, 李胜华. 明日叶化学成分研究[J]. 中药材, 2015, 38(8): 1656-1660. DOI:10.13863/j.issn1001-4454.2015.08.023 |
| [28] |
WANG Z Y, TANG S Q. Chemical constituents form Solanum lyratum[J]. Chin Trad Pat Med, 2019, 41(12): 2928-2932. 王治阳, 唐素勤. 白毛藤化学成分的研究[J]. 中成药, 2019, 41(12): 2928-2932. DOI:10.3969/j.issn.1001-1528.2019.12.020 |
| [29] |
SONG W J, ZHANG W, LUO G F. Study on the ethyl acetate-soluble chemical constituents from the seed of Tibetan medicine Thlaspi arvense[J]. NW Pharm J, 2019, 34(4): 432-435. 宋文静, 张炜, 骆桂法. 藏药菥蓂子乙酸乙酯部位主要化学成分的研究[J]. 西北药学杂志, 2019, 34(4): 432-435. DOI:10.3969/j.issn.1004-2407.2019.04.002 |
| [30] |
HOU X T, HAO E W, QIN J F, et al. Chemical components and pharmacological action for Cinnamomum cassia and predictive analysis on Q-marker[J]. Chin Trad Herb Drugs, 2018, 49(1): 20-34. 侯小涛, 郝二伟, 秦健峰, 等. 肉桂的化学成分、药理作用及质量标志物(Q-marker)的预测分析[J]. 中草药, 2018, 49(1): 20-34. DOI:10.7501/j.issn.0253-2670.2018.01.003 |
| [31] |
FEI J. Study on the total synthesis and bioactivities of syringaresinol and glycosides[D]. Shanghai: Academy of Military Medical Sciences, 2005: 33-34. 费嘉. 丁香脂素及其糖苷的全合成以及活性初探[D]. 上海: 中国人民解放军军事医学科学院, 2005: 33-34. |
| [32] |
POTOČNJAK I, ŠIMIĆ L, GOBIN I, et al. Antitumor activity of luteolin in human colon cancer SW620 cells is mediated by the ERK/FOXO3a signaling pathway[J]. Toxicol in vitro, 2020, 66: 104852. DOI:10.1016/j.tiv.2020.104852 |
| [33] |
CHE D N, SHIN J Y, KANG H J, et al. Luteolin suppresses IL-31 production in IL-33-stimulated mast cells through MAPK and NF-κB signaling pathways[J]. Int Immunopharmacol, 2020, 83: 106403. DOI:10.1016/j.intimp.2020.106403 |
| [34] |
Wang S M, Zhang S H, Hu X D. Advances in the study of effect and mechanism of apigenin on hepatocellular carcinoma[J]. Trad Chin Drug Res Pharmacol, 2020, 31(5): 616-620. 王守梅, 张树辉, 胡旭东. 芹菜素抗肝细胞癌作用及机制的研究进展[J]. 中药新药与临床药理, 2020, 31(5): 616-620. DOI:10.19378/j.issn.1003-9783.2020.05.019 |
 2021, Vol. 29
2021, Vol. 29



