三角梅(Bougainvillea glabra)是紫茉莉科(Nyctaginaceae)三角梅属植物, 为常绿攀援状灌木, 原产于南美洲的巴西、秘鲁等国,因其发现者法国探险家、植物学家Louis-antoine de Bougainville而得名,意思为“宝巾”[1]。三角梅属中只有叶子花(B. spectabilia)、三角梅和秘鲁三角梅(B. peruviana)具有观赏价值[2-3]。三角梅喜光不耐寒,主要观赏部位是苞片,色素通过甜菜色素途径合成, 主要为甜菜红素和甜菜黄素,并通过两种色素间相对含量的转化实现对花色的调节,使苞片呈现不同颜色[4-5]。
甜菜色素途径的起始物是酪氨酸,中间产物多巴在不同酶的催化下分别合成环状多巴和甜菜醛氨酸,两者再自发形成甜菜红素,与甜菜黄素的积累不在同一个分支。葡糖基转移酶(glycosyltransferases, GTs)是甜菜色素代谢过程中重要的关键酶,该途径涉及的糖基转移酶分为2类:5-O、6-O糖基转移酶和环多巴5-糖基转移酶(cyclo-DOPA-5-glucosyltrans- ferase, cDOPA 5GT),其中环多巴糖苷在合成末端把糖基转移至甜菜苷配基上[6-7],产物在甜菜红素的总含量中占比较大,该过程可以是环状多巴先被cDOPA 5GT催化形成环多巴葡萄糖,再与甜菜醛氨酸结合,也可以是环状多巴先结合甜菜醛氨酸,再催化连接糖基形成甜菜苷。三角梅的优势色素是甜菜红素,在苞片表皮和对紫外线较为敏感的组织中积累[8-9],其积累量与葡糖基转移酶表达量相关。葡糖基转移酶目前已在植物类黄酮生物合成中被大量鉴别,但在甜菜色素代谢途径的生物合成中还较少报道,本研究对三角梅的cDOPA 5GT基因进行了同源克隆,并对cDOPA 5GT蛋白进行了生物信息学分析,同时对三角梅cDOPA 5GT基因的表达和甜菜红素的积累进行了分析,初步探讨了甜菜红素的积累与光照的相关性,为研究三角梅甜菜红素的生物合成提供试验基础。
1 材料和方法 1.1 材料试验用三角梅(Bougainvillea glabra)购买后于实验室中培育,由同一母本扦插批量培养。挑选花期花蕾数量较多且生长一致的三角梅植株,在花芽发育初期,将植株分成二组,一组正常日照(对照),另一组用黑色塑料膜包裹进行遮光处理(试验组)。2周后,选取大小和形态一致的苞片作为试验材料。
1.2 cDOPA 5GT基因的克隆按照柱式植物RNAout 2.0试剂盒说明书提取三角梅花期苞片总RNA[10]。按照Thermo公司反转录试剂盒说明书合成cDNA,以cDNA为模板,进行PCR扩增。根据NCBI中植物UGT基因同源比对结果,设计1对特异引物GUTBDS (5'-CGGGGT- ACCATGGAGTATAACTCAGAAACAGAGCACA-3', 引入Kpn I酶切位点)和UGTBDX (5'-CCGCTCGA- GTCATTTATCCTTACTCGTTTTAGCTGAG-3',引入Xho I酶切位点),以反转录产物为模板扩增三角梅苞片UGT基因,反应体系总体积为30 μL,包含Max DNA Polymerase 15 μL、cDNA 1 μL、UDPBDS和UDPBDX引物各0.5 μL和ddH2O 13 μL, PCR产物经1.5%琼脂糖凝胶电泳后,回收目的片段在末端添加多聚A尾,连接pMD19-T载体并转入大肠杆菌DH5α感受态中,筛选阳性转化子送上海英潍捷基贸易有限公司进行测序,将序列命名为cDOPA 5GT。
1.3 生物信息学分析采用BLAST P软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸同源序列比对分析;采用ProtParam软件(http://expasy.org/tools/protparam/html)进行蛋白质理化性质分析;采用PSIPRED软件(http://bioinf.cs.ucl.ac.uk/psipred)进行蛋白二级结构预测;采用SWISS MODEL软件(https://swissmodel.expasy.org/interactive)进行蛋白三级结构预测; 采用Signal P 4.1软件(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测;采用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM)进行蛋白跨膜结构预测。采用MEGA 6.0软件构建系统进化树,进行系统进化分析。
1.4 实时荧光定量PCR分析根据cDOPA 5GT全长序列设计1对荧光定量引物cDOPA 5GTqS和cDOPA 5GTqX,以18S rRNA基因作为内参[11],采用实时荧光定量PCR技术分析遮光处理对cDOPA 5GT基因表达量的影响。PCR反应体系总体积为15 μL,包含SYBR Premix Ex Taq II 7.5 μL、cDNA 1.0 μL、引物各0.5 μL和ddH2O 5.5 μL,反应程序为:95℃ 3 min,95℃ 10 s, 64.5℃(cDOPA 5GT)/55.7℃ (18s rRNA) 30 s, 72℃ 40 s, 72℃ 10 min, 共39次循环。
1.5 甜菜红素含量的测定甜菜红素含量的测定采用改进的Stintzing等[12]方法,称取0.15 g三角梅苞片干粉于预冷的研钵中,加入预冷的甲醇2 mL研磨,全部转入10 mL离心管中;置于4℃冰箱中30 min;然后在16 099.2×g下离心10 min并收集沉淀,加入4 mL ddH2O重悬沉淀,置于4℃冰箱中30 min;在16 099.2×g下离心10 min后收集上清液;重复操作1次,合并上清液用ddH2O定容至10 mL,在波长536 nm处测定吸光值,甜菜红素含量(C, mg/g)=(A×M×V×1000)/ (ε×m)[6, 13],式中, A为536 nm下的吸光度, M为甜菜红素的相对摩尔质量(550.47 g/mol),V为溶液的总体积(L),ε为甜菜红素的摩尔消光系数[5.66× 104 L/(mol·cm)],m为样品质量(g)。
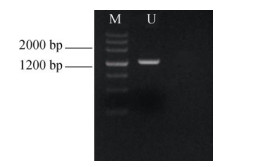
2 结果和分析 2.1 cDOPA 5GT基因的克隆以三角梅苞片cDNA为模板进行PCR扩增, 获得了一条长为1 446 bp的片段(图 1),测序结果与预期吻合。经Blast P序列比对分析表明该片段序列与叶子花葡糖基转移酶基因的相似度高达99%,命名为cDOPA 5GT,GeneBank登录号为MT239387。
|
图 1 cDOPA 5GT基因的PCR扩增。M: DNA Marker; U: cDOPA 5GT。 Fig. 1 PCR amplification of cDOPA 5GT. M: DNA Marker; U: cDOPA 5GTPCR. |
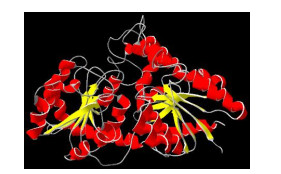
理化性质和结构预测 cDOPA 5GT基因编码482个氨基酸,BLAST分析表明cDOPA 5GT氨基酸序列的保守性相对较差,与同科植物紫茉莉(Mirabilis jalapa,登录号BAD91803.1)的葡糖基转移酶的氨基酸序列相似度为65%,而与奎奴亚藜(Chenopodium quinoa, 登录号XP021748306.1)和马齿苋(Spainacia oleracea, 登录号XP021847933.1)的相似度为63%和62%。cDOPA 5GT的相对分子质量为54.66 kD,蛋白等电点(PI)为5.77,为酸性稳定亲水性蛋白,推测的分子式为C2463H3779N655O712S22; 同时,该蛋白中含有22种氨基酸,其中47个带正电荷,61个带负电荷,含量较多的为亮氨酸(Leu, 10%), 而酪氨酸(Tyr)和半胱氨酸(Cys)较少,仅为1.7%和1%。利用PSIPRED预测cDOPA 5GT蛋白二级结构主要由α-螺旋和无规则卷曲构成,还有一定量的折叠结构。应用SWISS MODEL预测蛋白三级结构如图 2。采用在线工具Signal P4.1分析结果表明,cDOPA 5GT蛋白不具有信号肽结构; TMHMM预测cDOPA 5GT蛋白可能为跨膜蛋白。
|
图 2 三级结构预测 Fig. 2 Tertiary structure prediction |
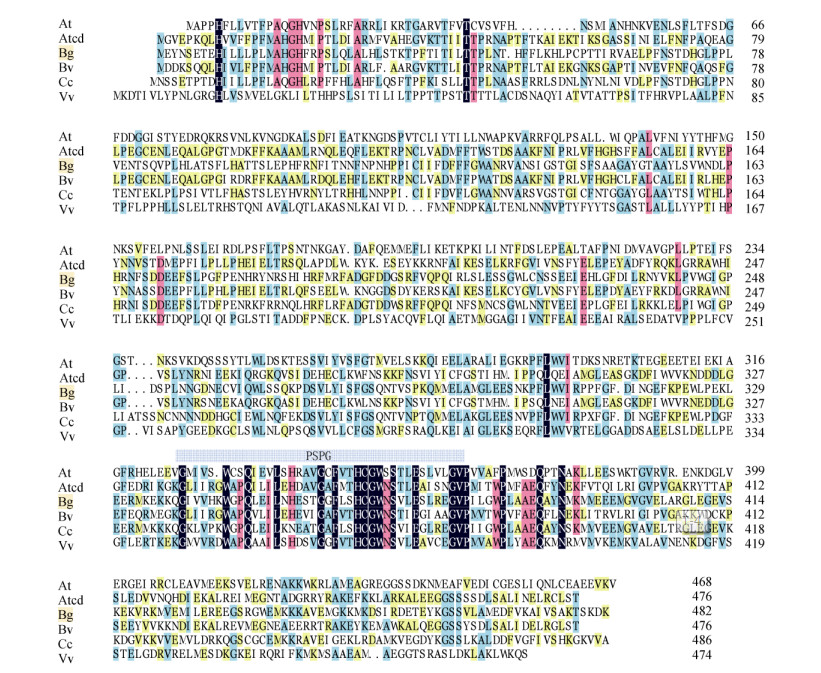
序列分析 通过BLAST P比对,cDOPA 5GT蛋白存在1个Glycosyltransferase-GTB-type超家族成员PLN02863结构区域(图 3)。不同植物5GT基因编码的氨基酸序列差异很大,保守性较差。三角梅cDOPA 5GT的C-端具有UGTs家族的44个氨基酸高度保守序列PSPG (图 4),说明三角梅cDOPA 5GT基因编码的蛋白是可溶性的酶,葡糖基结合位点可能是WGPQLEILNHESTGGFLSHCGWNSVLE SLREGVPILGWPLAAEQ。

|
图 3 BLAST P序列比对结果 Fig. 3 Sequence alignment result by BLAST P |
|
图 4 cDOPA 5GT氨基酸序列的保守结构域预测。At:拟南芥; Atcd:苋菜; Bg:三角梅; Bv:甜菜; Cc:鸡冠花; Vv:葡萄。 Fig. 4 Deduced conservation domains in amino acid sequence of cDOPA 5GT. At: Arabidopsis thaliana; Atcd: Amaranthus tricolor; Bg: Bougainvillea glabra; Bv: Beta vulgaris; Cc: Celosia cristata; Vv: Vitis vinifera. |
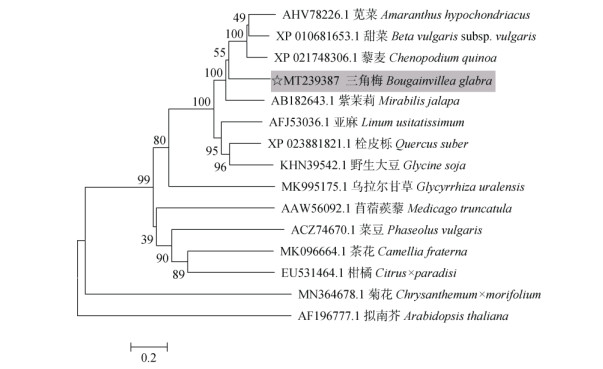
将cDOPA 5GT蛋白的氨基酸序列与NCBI上已知的其他植物UTGs蛋白的氨基酸序列进行比对,结果表明,三角梅cDOPA 5GT蛋白与紫茉莉(Mirabilis jalapa, 登录号AB182643.1)、甜菜(Beta vulgaris subsp. vulgaris, 登录号XP010681653.1)的亲缘关系较近,而与拟南芥(Arabidopsis thaliana, 登录号AF196777.1)、菊花(Chrysanthemum×morifolium, 登录号MN364678.1)的亲缘关系较远(图 5)。
|
图 5 基于UTGs氨基酸序列的系统进化分析 Fig. 5 Phylogenetic analysis based on amino acid sequences of UTGs |
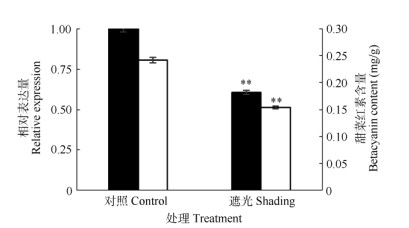
荧光定量分析结果表明(图 6),遮光处理后, cDOPA 5GT基因表达量明显下降(P < 0.01),而且遮光处理的三角梅甜菜红素含量也下降(P < 0.01)。这表明三角梅苞片中的cDOPA 5GT基因表达受光照的调节,其表达量和甜菜红素含量的Pearson相关系数为0.9998,呈极显著正相关,表明cDOPA 5GT基因在其甜菜红素合成通路中作用重要。
|
图 6 cDOPA 5GT的相对表达量(■)和甜菜红素含量(□)。**: P < 0.01。 Fig. 6 Relative expression (■) of cDOPA 5GT, and betacyanin content (□). **: P < 0.01. |
糖基化反应是植物体内重要的次生代谢反应, 糖基转移酶(GTase)催化特定位点的糖基化反应合成糖苷。GTs被分为99个家族[14],其中以尿嘧啶核糖基转移酶苷二磷酸-葡萄糖(UDP-sugar)为供体的UGTs属于家族1,是植物主要的糖基转移酶。本研究获得的糖基转移酶在C-末端含有该家族特有的植物次生产物糖基转移酶(PSPG)基序,因此推测cDOPA 5GT蛋白属于UGT-1家族。UGT表达量的提高能够促进重要次生代谢产物的合成,在大肠杆菌BL21中表达红景天(Rhodiola sachalinensis)的UGT73B6基因,获得了8种酚苷类天然产物[15]; 拟南芥(Arabidopsis) UGT的异位表达提高了花青素和原花青素的含量,并赋予拟南芥较高的耐光性[16]。糖基转移酶是分歧较多的多源基因家族,目前的研究表明UGTs与糖基受体结合的结构域没有显著保守性,尚未有某个特定的氨基酸可以决定UGTs的酶学特征,尽管已有研究表明甜菜色素积累与糖基转移酶转录量正相关[17-19],但三角梅植物的基因组序列尚未公布,其cDOPA 5GT还有待深入研究。
甜菜红素在多数石竹目植物中替代花青素使植物产生艳丽的颜色,目前尚未发现同一种植物同时存在这两种色素,但有报道表明参与两种色素途径的酶和转录因子可以在不含此色素的植物中相互表达[20-22],可能是甜菜红素和花青素具有相同的进化起源,合成途径相类似[7, 23]。甜菜红素合成受多种因素的影响,其中光对色素的累积影响较大[24], 而蓝光比红光更有利于甜菜红色素的积累[25]。本研究结果表明,遮光会影响糖基转移酶基因的表达, 相对表达量降低了38.3%,同时甜菜红素的合成也降低36.3%,这表明光照与三角梅色素合成呈极显著相关。本试验是自然光照培养植物,虽然有报道探讨了光质、光强对甜菜红素合成的影响,但光改变后上游代谢物的流向未见报道研究,同时遮光并非必然降低基因表达量,在适当的遮光率下,关键酶基因的表达量可能还比全光照高,如30%的遮阴处理,珠子参(Panax japonicus var. major)皂苷合成关键酶的表达量和皂苷的积累都得到提升[26],可能光照率对不同关键酶的活性影响不一样,造成目标代谢物合成受多因素影响,因此在三角梅甜菜色素合成的光照条件上还需要进一步摸索。对于三角梅而言,艳丽的色彩中缺少了蓝色系,而蓝色是甜菜红色素途径不产生的下游产物,显示蓝色的是黄酮类化合物,为花青素代谢途径,而有研究表明花青素代谢途径和甜菜色素代谢途径有相同的起源,结合本研究结果,甜菜红色素代谢重要关键酶之一的糖基转移酶基因表达和甜菜红素含量成正相关关系,那么今后是否可以利用基因工程手段将编码类黄酮-3'5'-羟化酶(F3', 5'H)的基因引入下调某些甜菜色素途径关键酶基因,从而达到内源表达花青素代谢途径的下游产物,促使花色素苷的合成转向翠雀素糖苷的合成方向[27],使三角梅苞片颜色更丰富, 是未来值得深入探讨的课题。
| [1] |
XU S X, WANG L S, SHU Q Y, et al. Progress of study of the biology of the resource plant bougainvillea[J]. Chin Bull Bot, 2008, 25(4): 483-490. 徐夙侠, 王亮生, 舒庆艳, 等. 三角梅属植物的生物学研究进展[J]. 植物学通报, 2008, 25(4): 483-490. DOI:10.3969/j.issn.1674-3466.2008.04.015 |
| [2] |
Huang Y J. ISSR analysis of germplasm resources of Bongainvillea brasiliensis Raeusch[D]. Fuzhou: Fujian Agriculture and Forestry University, 2010: 1-2. 黄彦晶.三角梅(Bongainvillea brasiliensis Raeusch.)种质资源的ISSR分析[D].福州: 福建农林大学, 2010: 1-2. |
| [3] |
TANG Y J, WU X Y, CAO W J. Genetic diversity and relationship of Bougainvillea germplasm resources based on SRAP markers[J]. J Trop Subtrop Bot, 2014, 22(2): 147-154. 唐源江, 武晓燕, 曹雯静. 基于SRAP的叶子花种质资源遗传多样性及遗传关系分析[J]. 热带亚热带植物学报, 2014, 22(2): 147-154. DOI:10.3969/j.issn.1005-3395.2014.02.007 |
| [4] |
Lee D W, Collins T M. Phylogenetic and ontogenetic influences on the distribution of anthocyanins and betacyanins in leaves of tropical plants[J]. Int J Plant Sci, 2001, 162(5): 1141-1153. DOI:10.1086/321926 |
| [5] |
KUGLER F, Stintzing F C, Carle R. Characterisation of betalain patterns of differently coloured inflorescences from Gomphrena globosa L. and Bougainvillea sp. by HPLC-DAD-ESI-MSn[J]. Anal Bioanal Chem, 2007, 387(2): 637-648. DOI:10.1007/s00216-006-0897-0 |
| [6] |
Zheng X L. Studies on physiology, biochemistry and molecular biology on betalain synthesis in Amaranthus tricolor[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016: 15-22. 郑学立.苋菜甜菜红素合成的生理生化与分子生物学研究[D].福州: 福建农林大学, 2016: 15-22. |
| [7] |
Sakuta M. Diversity in plant red pigments:Anthocyanins and beta-cyanins[J]. Plant Biotechnol Rep, 2014, 8(1): 37-48. DOI:10.1007/s11816-013-0294-z |
| [8] |
Wang C Q, Liu T, Wang B S. Advances in betalain research in higher plants[J]. Chin Bull Bot, 2006, 23(3): 302-311. 王长泉, 刘涛, 王宝山. 植物甜菜素研究进展[J]. 植物学通报, 2006, 23(3): 302-311. DOI:10.3969/j.issn.1674-3466.2006.03.011 |
| [9] |
Bock K W. The UDP-glycosyltransferase (UGT) superfamily expressed in humans, insects and plants:Animal-plant arms-race and co-evolution[J]. Biochem Pharmacol, 2016, 99: 11-17. DOI:10.1016/j.bcp.2015.10.001 |
| [10] |
Sun R, Liu S, Tang Z Z, et al. β-Amyrin synthase from Conyza blinii expressed in Saccharomyces cerevisiae[J]. FEBS Open Biol, 2017, 7(10): 1575-1585. DOI:10.1002/2211-5463.12299 |
| [11] |
ZHOU X F, WANG J, SHI H W, et al. The exploration of 18S rRNA for quantitative RT-PCR as reference gene in plant[J]. J Jilin Norm Univ (Nat Sci), 2016, 37(2): 115-119. 周晓馥, 王晶, 史宏伟, 等. 18S rRNA作为植物实时荧光定量PCR内参基因的探究[J]. 吉林师范大学学报(自然科学版), 2016, 37(2): 115-119. DOI:10.16862/j.cnki.issn1674-3873.2016.02.025 |
| [12] |
Stintzing F C, Schieber A, Carle R. Betacyanins in fruits from red-purple pitaya, Hylocereus polyrhizus (Weber) Britton & Rose[J]. Food Chem, 2002, 77(1): 101-106. DOI:10.1016/s0308-8146(01)00374-0 |
| [13] |
Zhao S Z, Sun H Z, Chen M, et al. Light-regulated betacyanin accumulation in euhalophyte Suaeda salsa calli[J]. Plant Cell Tiss Org Cult, 2010, 102(1): 99-107. DOI:10.1007/s11240-010-9710-z |
| [14] |
Qin J J, Sun C Y, Zhang M P, et al. Classification, function and evolution of plant UDP-glycosyltransferase[J]. Genom Appl Biol, 2018, 37(1): 440-450. 秦晶晶, 孙春玉, 张美萍, 等. 植物UDP-糖基转移酶分类、功能以及进化[J]. 基因组学与应用生物学, 2018, 37(1): 440-450. DOI:10.13417/j.gab.037.000440 |
| [15] |
HE Q L, BAI Y F, ZHOU W, et al. Biocatalysis of phenolic glycosides natural products in Escherichia coli strain using UGT73B6[J]. Bio-technol Bull, 2017, 33(11): 136-142. 何庆林, 白艳芬, 周威, 等. 利用糖基转移酶UGT73B6在大肠杆菌中生物催化酚苷类天然产物[J]. 生物技术通报, 2017, 33(11): 136-142. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0363 |
| [16] |
RAO M J, Xu Y T, Huang Y, et al. Ectopic expression of citrus UDP-GLUCOSYL TRANSFERASE gene enhances anthocyanin and proanthocyanidins contents and confers high light tolerance in Arabi-dopsis[J]. BMC Plant Biol, 2019, 19(1): 603. DOI:10.1186/s12870-019-2212-1 |
| [17] |
SEPÚLVEDA-JIMÉNEZ G, Rueda-Benítez P, Porta H, et al. A red beet (Beta vulgaris) UDP-glucosyltransferase gene induced by wounding, bacterial infiltration and oxidative stress[J]. J Exp Bot, 2004, 56(412): 605-611. DOI:10.1093/jxb/eri036 |
| [18] |
SASAKI N, WADA K, KODA T, et al. Isolation and characterization of cDNAs encoding an enzyme with glucosyltransferase activity for cyclo-DOPA from four o'clocks and feather cockscombs[J]. Plant Cell Physiol, 2005, 46(4): 666-670. DOI:10.1093/pcp/pci064 |
| [19] |
Hatlestad G J, Lloyd A. The betalain secondary metabolic network[M]//CHEN C X. Pigments in Fruits and Vegetables. New York: Springer, 2015: 127-140. doi: 10.1007/978-1-4939-2356-4_6.
|
| [20] |
Cheng M N, Huang Z J, Hua Q Z, et al. The WRKY transcription factor HpWRKY44 regulates CytP450-like1 expression in red pitaya fruit (Hylocereus polyrhizus)[J]. Hort Res, 2017, 4: 17039. DOI:10.1038/hortres.2017.39 |
| [21] |
Xu S X, Huang Q Y, Lin C S, et al. Transcriptome comparison reveals candidate genes responsible for the betalain-/anthocyanidin-production in bougainvilleas[J]. Funct Plant Biol, 2016, 43(3): 278-286. DOI:10.1071/FP15246 |
| [22] |
XU S X, HUANG Q Y, LIN C S, et al. Progress of betalains biology[J]. Subtrop Plant Sci, 2019, 48(4): 378-383. 徐夙侠, 黄青云, 林春松, 等. 甜菜色素的生物学研究进展[J]. 亚热带植物科学, 2019, 48(4): 378-383. DOI:10.3969/j.issn.1009-7791.2019.04.014 |
| [23] |
Hatlestad G J, Akhavan N A, SUNNADENIYA R M, et al. The beet Y locus encodes an anthocyanin MYB-like protein that activates the betalain red pigment pathway[J]. Nat Genet, 2015, 47(1): 92-96. DOI:10.1038/ng.3163 |
| [24] |
WONG Y M, SIOW L F. Effects of heat, pH, antioxidant, agitation and light on betacyanin stability using red-fleshed dragon fruit (Hylocereus polyrhizus) juice and concentrate as models[J]. J Food Sci Technol, 2015, 52(5): 3086-3092. DOI:10.1007/s13197-014-1362-2 |
| [25] |
ZHENG X L, LIU S C, XIE L Y, et al. Promoter-cloning, protein subcellular localization, and expression analysis for AmaDOPA5-GT gene of Amaranth tricolor[J]. Fujian J Agric Sci, 2015, 30(11): 1064-1070. 郑学立, 刘生财, 谢礼洋, 等. 苋菜AmaDOPA5-GT基因的启动子克隆、亚细胞定位及表达分析[J]. 福建农业学报, 2015, 30(11): 1064-1070. DOI:10.3969/j.issn.1008-0384.2015.11.008 |
| [26] |
HUANG W J, SUN X C, LI B, et al. Effects of shading on key enzyme genesexpression and accumulation of saponins in Panax japonicus var. major[J]. China J Chin Mat Med, 2018, 43(19): 3855-3861. 黄文静, 孙晓春, 李铂, 等. 遮阴对珠子参皂苷合成关键酶基因表达和皂苷积累的影响[J]. 中国中药杂志, 2018, 43(19): 3855-3861. DOI:10.19540/j.cnki.cjcmm.20180528.007 |
| [27] |
LI M R, CHEN J T, SUN Z J, et al. Advances in molecular breeding of ornamental plants[J]. J Trop Subtrop Bot, 2003, 11(1): 87-92. 李美茹, 陈金婷, 孙梓健, 等. 花卉分子育种的研究进展[J]. 热带亚热带植物学报, 2003, 11(1): 87-92. DOI:10.3969/j.issn.1005-3395.2003.01.017 |
 2021, Vol. 29
2021, Vol. 29

