2a. 海南大学生态与环境学院, 海口 570228;
2b. 海南大学植物保护学院, 海口 570228;
2c. 海南大学生命健康学院, 海口 570228
2a. School of Ecological and Environmental Sciences, Hainan University, Haikou 570228, China;
2b. School of Plant Protection, Hainan University, Haikou 570228, China;
2c. School of Life and Health, Hainan University, Haikou 570228, China
干旱和盐是影响植物生长发育的两个最重要和最常见的环境胁迫因子[1]。生长在海岸带的植物常遭受海浪、海风、潮汐等因子带来的盐胁迫影响,同时由于滩涂沙地保水能力较差,干旱胁迫在海岸带也十分常见。从而导致此区域植物经常面临水分亏缺和盐分的双重胁迫[2]。干旱不仅影响植物的形态发育、还会扰乱其生理过程,如影响水分吸收、叶绿素合成和抗氧化酶活性等,严重时还会阻碍植物生长甚至危及其生存[3–4]。同样,盐胁迫也会引起植物气孔关闭、叶绿素含量降低、光合作用减弱、水分利用效率降低、离子失衡和细胞毒性增加等使植物生长受到抑制[5–6]。但有研究表明,一些植物在旱盐复合胁迫下还具备一定的交叉适应性[6]。适量添加盐能够改善干旱胁迫下冬小麦(Triticum aestivum)的渗透调节能力和体内供水状况[7];桔梗(Platycodon grandiflorum)叶绿素含量及抗氧化酶活力在旱-盐复合胁迫下显著提高,丙二醛含量显著降低[8]。以往研究主要集中在农作物和草本植物,热带陆生木本植物对旱-盐复合胁迫是否具备一定的交叉适应性目前仍不清楚。另外,种植密度是调节植物生物量的常见方法,通常高密度种植不利于增加木本植物生物量和产量[9]。而环境胁迫梯度假说认为, 当环境胁迫程度较大时,物种之间的竞争会逐渐减弱甚至转变为互利关系[10–11]。随水淹程度增加,空心莲子草(Alternanthera philoxeroides)个体之间的竞争强度逐渐减弱,促进作用逐渐增强[12];低水分条件下车桑子(Dodonaea viscosa)茎生物量和总生物量随种植密度的增加逐渐增加[13];干旱条件下高密度栽培更有利于延缓棉花叶片衰老,提高生长速率和物质生产能力[14]。因此,为了弥补海岸带生态脆弱性和缓解沿海地区生态环境恶化,有必要开展旱-盐复合胁迫与种植密度交互作用对木本植物生长发育影响的研究。
当前海岸带人工防护林树种仅有木麻黄林和椰子林,存在物种单一、林分老化以及生长不稳定等诸多问题[15–17],故深入了解陆生木本植物对海岸环境的适应机制,对于增加海岸带防护林树种,提高防护林物种多样性、稳定性和抗逆性具有重要意义。降香黄檀(Dalbergia odorifera)为豆科(Leguminosae)蝶形花亚科(Papilionoideae)黄檀属落叶半落叶乔木, 主要分布在我国广东、广西、海南等地区,为海南特有树种,具有重要的医疗、经济和生态价值。前人研究表明降香黄檀幼苗具备一定的固氮、耐旱、耐盐和耐水淹的能力,可作为湿地和河岸带植被修复的潜在适宜树种[18–19]。因此,我们推测降香黄檀幼苗能在旱-盐复合胁迫的海岸环境下生长且高密度种植更有助于植株生物量积累, 为海岸带生态防护林树种的筛选和栽植方式提供理论依据。
1 材料和方法 1.1 材料和设计1 a生降香黄檀(Dalbergia odorifera)幼苗于2021年1月购自海南省乐东县尖峰岭(18°39′ N,108°44′ E), 将幼苗附带的土壤和培养袋去除后种植于海南大学海甸校区(20°03′ N,110°20′ E)温室大棚的塑料长条形盆中(长×宽×高=60 cm×20 cm×14 cm),土壤为红壤土和沙土(V/V,2:1),每盆17.16 kg;全氮1.69 g/kg; 全磷7.49 g/kg;有机碳7.5 g/kg;pH值6.12。
前期降香黄檀幼苗响应盐浓度梯度的预试验结果表明,幼苗在150 mmol/L NaCl下具有一定的耐受性,因此取150 mmol/L NaCl溶液对降香黄檀进行旱-盐复合胁迫处理。采用3因素(水分、浇盐、种植密度)完全随机设计,设置3组种植密度,分别为每盆1株(DⅠ)、2株(DⅡ)、3株(DⅢ)。浇水模式参考Goharrizi等[20]的方法并稍作修改,设置95%~ 100%田间持水量的对照组(CK);25%~30%田间持水量+0 mmol/L NaCl的干旱处理组(D);150 mmol/L NaCl+95%~100%田间持水量的盐胁迫组(S);25%~ 30%田间容量+150 mmol/L NaCl的旱-盐复合胁迫处理组(SD);每天以自来水补充水分,每2 d浇灌1次相应的盐溶液。试验共计12个处理,每处理5个生物学重复,每个重复2盆,总计120盆幼苗。缓苗2个月后,修剪幼苗地上部分至土壤表面5 cm处,再经过大约4个月待长势稳定后,选择60盆健壮、无病虫害、外部形态长势基本一致的幼苗进行处理。处理50 d后叶片开始变黄,因此,50 d后测量生长指标,并对胁迫后的幼苗根、茎、叶进行采样,保存于-80 ℃,进行后续生理生化分析。
1.2 指标测定 1.2.1 生长参数的测定株高(H)采用卷尺(精确到0.1 cm)测量,并计算株高增长量(ΔH);使用游标卡尺(精确到0.01 mm)在植株离地面3~4 cm处测量植株基径,并计算基径增长量(ΔD);使用便携式激光叶面积仪LI-3000C (Li-Cor, Inc., USA)测定每株幼苗的总叶面积(TLA);茎鲜重(SFW)、叶鲜重(LFW)使用电子天平(精确到0.001 g)称量,每株幼苗主根的长度(MRL)用卷尺(精确到0.1 cm)测量。
1.2.2 生理生化指标的测定过氧化氢酶(CAT)测定按照试剂盒(北京索莱宝科技有限公司, 中国)操作,单位用U/(mg FW·min)表示。谷胱甘肽还原酶(GR)和谷胱甘肽含量(GSH)参照李萍萍[21]的方法测定,其中GR的测定方法稍作修改:使用1.5 mmol NADPH启动反应,以不加NADPH为对照,用分光光度计在波长340 nm处每30 s测定1次吸光值,检测时长2 min,单位用U/(mg FW·min)表示。叶片叶绿素含量、相对电导率、可溶性蛋白和可溶性糖含量参考高俊凤[22]的方法。叶片相对含水量的测定采用烘干称重法[22], 将采摘的叶片洗净后,用电子天平称取鲜重(FW), 然后用蒸馏水浸泡数小时,称取饱和水重(SW)后放入80 ℃烘箱烘干称取干重(DW),相对含水量(RWC)=(FW–DW)/(SW–DW)×100%。
1.3 对生长的综合评价分析综合评价值是判断植物受非生物胁迫程度的重要指标,数值越大表示植物生长状态越佳[23]。采用SPSS 21.0软件进行主成分分析以降低数据维度,然后选择累积方差占总方差的90%以上的组分,根据各组分的权重计算隶属函数值[24],参考Li等[25]的方法计算综合评价值。各组分的权重Wi=
所有数据采用SPSS 21.0软件进行统计分析。处理间均值比较采用单因素方差(One-Way ANOVA)分析进行,不同处理间的差异使用Duncan多重比较法检验(P < 0.05)。另外,水分、盐分、种植密度和三者交互效应采用多因素方差分析(Multi-ANOVA)评估。
2 结果和分析 2.1 对生长发育的影响由表 1可见,在DⅠ下,单一胁迫(S、D)和复合胁迫(SD)均显著抑制了株高增量(ΔH)、基茎增量(ΔD)和茎鲜重(SFW) (P < 0.05);与CK相比,S显著降低了ΔH、ΔD和SFW;然而,与S相比,D和SD均显著降低了ΔH、ΔD、主根长(MRL)和SFH; 与D相比,SD显著降低了ΔD、TLA和叶鲜重(LFW); 在DⅡ条件下,与CK相比,S、D和SD均显著降低了ΔH、TLA、MRL和LFW;与S相比,D和SD均显著抑制了ΔH、ΔD和SFW,但D显著降低了MRL;与D相比,SD显著降低了ΔH、ΔH、TLA、MRL和LFW,但对SFW无显著差异。在DⅢ条件下,与CK相比,胁迫处理均显著抑制了ΔH、ΔD、MRL和SFW;同样,相比单一胁迫,叶面积在SD下显著减少了27.01% (CK vs SD)、11.68% (S vs SD)、12.47% (D vs SD)。此外,与DⅠ相比,CK处理中的DⅡ、DⅢ显著降低了ΔH、ΔD和MRL;S、D处理中DⅢ显著降低了ΔH、MRL和SFW。在SD处理下,与DⅡ相比,DⅢ显著降低了MRL,但ΔD无显著影响。
| 表 1 胁迫对降香黄檀生长的影响 Table 1 Effect of stress on growth of Dalbergia odorifera |
由表 2可见,在DⅠ下,各胁迫处理均显著降低了总叶绿素(Chl a+b),分别下降了20.31% (CK vs S)、51.04% (CK vs D)、46.87% (CK vs SD);D和SD显著减少了Chl a、Chl b和类胡萝卜素(Caro)的含量(P < 0.05),但S无显著差异。在DⅡ下,S、D和SD均显著降低了Chl a、Chl b和Chl a+b量;另外,与S相比,D和SD均显著降低了Chl a、Chl b、Caro和Chl a+b,但与D相比,SD无显著差异;在DⅢ中呈现相同的规律,说明相比于S胁迫处理,D和SD胁迫显著抑制了叶绿素的合成。与DⅠ、DⅡ相比,DⅢ的SD处理显著降低了Chl a、Chl b和Chl a+b含量。
| 表 2 胁迫对叶片光合色素的影响 Table 2 Effect of stress on photosynthetic pigments in leaves |
由图 1可见,在DⅠ条件下,与CK相比,SD处理的RWC显著降低了23.99%;D和SD均显著减少了RWC,但S无显著差异;在DⅡ条件下,与CK相比,D和SD均显著降低了RWC;与S、D相比,SD减少了RWC 30.61% (S vs SD)、20.82% (D vs SD);在DⅢ条件下呈现相同的规律,与CK相比,S、D和SD均显著降低了RWC;与S、D相比, SD显著降低了RWC,降低率分别为33.25% (S vs SD)、26.49% (D vs SD)。与DⅠ和DⅡ相比,DⅢ显著抑制了RWC。
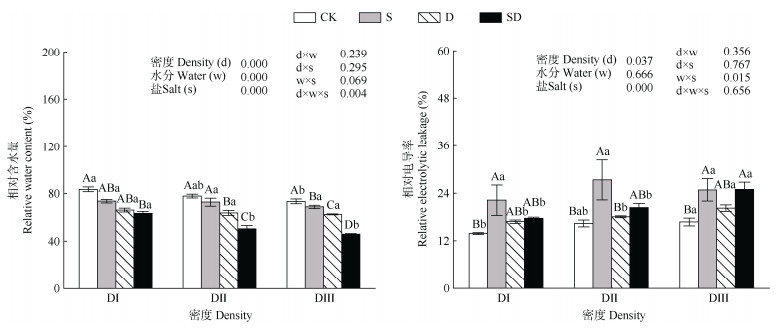
|
图 1 胁迫对降香黄檀叶片相对含水量和相对电导率的影响 Fig. 1 Effect of stress on relative water content and relative electrolytic leakage of Dalbergia odorifera leaves |
在DⅠ和DⅡ条件下,与CK相比,S处理显著提高了REL,分别增加37.65%、39.95% (P < 0.05);S与SD处理间无显著差异;在DⅢ条件下,S和SD均显著增加了REL,分别为32.23% (CK vs S)、32.65% (CK vs SD)。在CK和SD处理下,与DⅠ和DⅡ相比,DⅢ显著提高了REL。
2.3.2 对可溶性蛋白(SP)和可溶性糖(SS)的影响由图 2可见,在DⅠ条件下,与CK相比,S、D和SD均显著提高了SP和SS含量(P < 0.05);与S和D相比,SD显著提高了SP和SS含量,增幅分别为2.70% (S vs SD)、7.46% (D vs SD)、26.40% (S vs SD)、31.90% (D vs SD);DⅡ条件下呈现相同的趋势。DⅢ条件下,与S相比,SD显著提高了SP和SS含量,但D显著降低了SP和SS含量;在SD处理中,随着密度的增加,SP含量呈现显著上升的趋势。
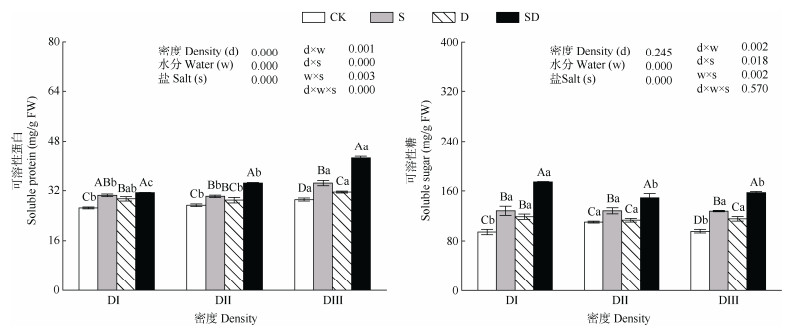
|
图 2 胁迫对叶片可溶性内含物的影响 Fig. 2 Effect of stress on soluble substances of Dalbergia odorifera leaves |
从图 3可见,在DⅠ条件下,与CK相比,S、D和SD处理均显著提高了CAT活性和GR活性。与S相比,D显著提高了GR活性,而SD显著增加CAT活性达25.56% (S vs SD);在DⅡ条件下, 与CK相比,S、D和SD均显著提高CAT、GR活性; 与S相比,D和SD均显著提高了GR活性,分别增加315.82% (S vs D)、335.58% (S vs SD),且以SD的最高;与D相比,SD显著提高了CAT活性、GR活性和GSH含量;在DⅢ条件下,与S相比,D显著增加了GR活性,而SD显著提高了GSH含量35.31%(S vs SD),而与D相比,SD也显著增加了GSH含量68.19% (D vs SD)。在CK组,随着密度增加,CAT活性逐渐显著增加;在SD胁迫下,随着密度的增加,GR活性和GSH含量呈先增加后降低的趋势,但CAT活性无显著差异。
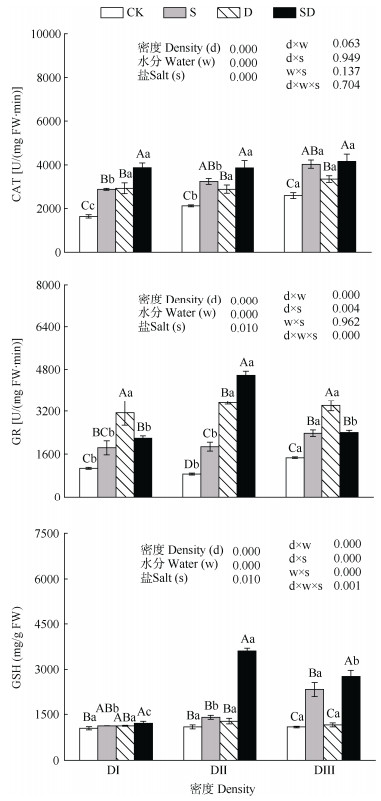
|
图 3 胁迫对叶片过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)活性和谷胱甘肽(GSH)含量的影响 Fig. 3 Effect of stress on activities of catalase (CAT), glutathione reductase (GR) and glutathione (GSH) content of Dalbergia odorifera leaves |
从表 3可见,对形态和生理性状指标进行降维后得到4组特征值,第1个初始特征值为65.130%,第2个特征值为11.744%,第3个特征值为10.481%,第4个特征值为4.972%,累积分量达到90%以上。分析表明DⅠ种植密度下CK、S、D和SD组的生长状况相对较好,最终的综合评价值分别为0.873%、0.733%、0.411%、0.382%。而DⅢ种植密度下CK、S、D和SD组的生长状况相对较差, 综合评价值分别为0.556%、0.408%、0.266%、0.216%。
| 表 3 隶属函数分析 Table 3 Membership function analysis |
干旱和盐是常见的非生物胁迫之一,严重限制着许多陆生植物的生长和存活。前期研究表明,干旱和盐胁迫会显著抑制降香黄檀的生长,降低幼苗的气孔导度、叶绿素含量、叶面积、水分利用效率以及光合速率[26–27]。本研究中降香黄檀幼苗在50 d旱-盐复合胁迫下未观测到死亡,表明降香黄檀具备一定耐旱-盐复合胁迫的能力。尽管如此,旱-盐复合胁迫仍然降低了降香黄檀的生长和地上生物量积累,推测这一现象与旱-盐复合胁迫下幼苗叶绿素含量的下降有关,较低的叶绿素含量和气孔导度会降低植株净光合速率和水分利用效率,不利于植物生长[28–29]。另外,可能还与旱-盐复合胁迫下幼苗主根长以及总叶面积的显著降低有关,较低的总叶面积不利于光的捕获[25],根系作为植物感受盐害和干旱逆境的信号器官,也是吸收养分和水分的重要部位,可通过调节自身生长来适应各种环境[30],较短的主根长不利于水分和养分的吸收[31],叶片相对含水量减少也证明了这一点。相对电导率(REL)是衡量植物细胞膜透性的重要指标,数值越高说明细胞膜遭到的破坏程度越大[32–33]。本研究中无论是单一还是复合胁迫,相对电导率都有显著增加,尤其在盐胁迫和复合胁迫中,这可能是由于盐胁迫下植物通常积累了大量的Na+和Cl–,而过度累积的Na+和Cl–会引起细胞膜破坏,电解质泄露,细胞稳态失衡,产生多余的活性氧物质,最终导致叶绿素降解而不利于植株生长[34–36]。然而,植物不是完全被动的, 它们在与干旱和盐胁迫环境的长期斗争中已经形成了多种有效的生理机制来增强其抗氧化胁迫的能力[37]。可溶性蛋白和可溶性糖作为重要的渗透物质能够有效的维持植物体内水分平衡,随旱-盐复合胁迫程度增加而增大,表明降香黄檀采取了积极主动策略来降低氧化胁迫对幼苗的伤害,这与张冠初等[32]报道干旱和盐胁迫下花生(Arachis hypogaea)体内可溶性糖和可溶性蛋白显著增加的结果相吻合。谷胱甘肽还原酶和过氧化氢酶作为抗氧化系统的重要保护酶,可消除细胞内多余的过氧化氢减轻活性氧物质对细胞膜的损伤[28],在本研究中,降香黄檀在复合胁迫下谷胱甘肽还原酶活性显著较低, 表明植物受到严重胁迫后体内过多的电解质泄露和活性氧物质导致其活性受到抑制[38],相反,过氧化氢酶活性显著升高,增强了幼苗对盐和干旱胁迫的抗性[39],可能是由于过氧化氢酶不需要提供还原性有效物来维持功能,导致其对细胞氧化还原状态不敏感,功能不受胁迫的影响,这与Lu等[28]报道盐生草(Halogeton glomeratus)幼苗在干旱和盐复合胁迫下过氧化氢酶活性显著增加的研究结果一致。此外,从综合评价值也可以看出,与单一胁迫相比, 复合胁迫下降香黄檀幼苗生长受到的负面影响更大。因此,降香黄檀在旱-盐复合胁迫下未表现出交叉适应性,原因可能是由于旱-盐复合胁迫对植物生长发育产生了“加性效应”[1],由此可见旱-盐复合胁迫对降香黄檀的负面影响大于单一胁迫。
3.2 旱-盐复合胁迫和种植密度对降香黄檀的影响除了筛选物种外,科学制定种植密度也是植被恢复的关键。种植密度对植物群体的光合有效辐射、气温、风速、相对湿度等小气候因子有显著影响,这些影响反馈到群体的有效贮积上会扰乱生物量的积累[40]。本研究中在旱-盐复合胁迫处理下, 随种植密度增加降香黄檀株高增长量、主根长和地上生物量显著降低,表明在旱-盐复合胁迫的环境下种植密度增大会加剧幼苗对养分、水分和光照资源的竞争,为了在资源有限的环境中生存,通过改变根系形态特征(缩短根长)进行自我调节对环境的适应,从而导致生物量积累减少[41]。本研究表明密度和水分二者交互效应对株高增长量和基径增长量并无显著影响,但密度、水分和盐分三者交互效应显著影响了株高增长量和基径增长量,说明盐分处理加剧了幼苗在缺水状态下的竞争作用。然而,一般认为植物在竞争性和耐受性之间存在权衡,环境适宜时,植物能获得较多资源,此时竞争比较重要;随着环境压力增大,植物的耐受能力占主导地位, 除了通过变化生长形态之外,还通过生理生化方面来适应环境[42–43]。本研究中,与DⅠ密度下的SD处理相比,DⅢ与SD交互作用下谷胱甘肽含量和谷胱甘肽还原酶活性随密度增加先增加后降低,原因可能是旱-盐复合胁迫与种植密度三者交互作用使降香黄檀幼苗种内通过对水分、阳光等资源的竞争,进一步加剧胁迫后酶活性受到抑制,导致保护酶不足以消除体内过多的活性氧物质,从而抑制植株的生长,这一点与魏鑫等[44]报道种植密度对丹参(Salvia miltiorrhiza)体内抗氧化酶的影响结果相似。因此,旱-盐复合胁迫环境下降香黄檀幼苗种内关系为相互竞争,低密度栽植模式更有利于幼苗的长势。
综上,与单一胁迫相比,降香黄檀在旱-盐复合胁迫下受到的抑制更显著,并未表现出旱-盐交叉适应性,但降香黄檀具有一定抗旱-盐复合胁迫的能力,其不仅通过提高可溶性糖和可溶性蛋白来保持体内水分含量,还通过增加过氧化氢酶、谷胱甘肽还原酶活性等多种途径来提高旱-盐复合胁迫的适应性。旱-盐复合胁迫与种植密度交互作用下,随种植密度增加,降香黄檀生长受到更严重的抑制作用,种内间产生竞争关系,不利于幼苗生长。因此,降香黄檀可作为海岸带区域修复树种,但苗期种植过程中不宜采取高密度种植。本研究对热带海岸带区域植被筛选和植被恢复与重建过程具有重要的现实意义。
| [1] |
SUN C X, GAO X X, FU J Q, et al. Metabolic response of maize (Zea mays L.) plants to combined drought and salt stress[J]. Plant Soil, 2015, 388(1/2): 99-117. DOI:10.1007/s11104-014-2309-0 |
| [2] |
WU X L. Water ecological characteristics of Casuarina equisetifolia protection forest in Fujian coastal area[D]. Fuzhou: Fujian Agriculture & Forestry University, 2002: 1–52. 吴锡麟. 福建海岸带木麻黄防护林水分生态的初步研究[D]. 福州: 福建农林大学, 2002: 1–52. |
| [3] |
LI L J, MIAO L F, LI D D, et al. Effects of drought and nitrogen application on the growth and chlorophyll fluorescence characteristics of Dalbergia odorifera T. Chen-Hevea brasiliensis Muell. Arg. seedlings[J]. Plant Sci J, 2023, 41(3): 358-369. 李丽君, 苗灵凤, 李大东, 等. 干旱、施氮对降香黄檀-橡胶树幼苗生长和叶绿素荧光特性的影响[J]. 植物科学学报, 2023, 41(3): 358-369. DOI:10.11913/PSJ.2095-0837.22196 |
| [4] |
ZHENG Q Z, TAN H Y, GAO X, et al. Effects of drought, salt and their combined stress on physiology and biochemistry characteristics of Hordeum vulgare seedlings[J]. Jiangsu Agric Sci, 2020, 48(1): 97-103. 郑庆柱, 谭海运, 高雪, 等. 干旱、盐胁迫及盐旱复合胁迫对青稞幼苗生理生化特性的影响[J]. 江苏农业科学, 2020, 48(1): 97-103. DOI:10.15889/j.issn.1002-1302.2020.01.017 |
| [5] |
DE SEDAS A, GONZÁLEZ Y, WINTER K, et al. Seedling responses to salinity of 26 Neotropical tree species[J]. AoB Plants, 2019, 11(6): plz062. DOI:10.1093/aobpla/plz062 |
| [6] |
MA L J, WANG L L, MEI Y X, et al. Cross adaptation tolerance in rice seedlings exposed to PEG induced salinity and drought stress[J]. Int J Agric Biol, 2016, 18(3): 535-541. DOI:10.17957/IJAB/15.0122 |
| [7] |
CHEN C S, XIE Z X, LIU X J. Interactive effects of drought and salt stresses on winter wheat seedlings growth and physiological characterristics of stress-resistance[J]. Chin J Appl Ecol, 2009, 20(4): 811-816. 陈成升, 谢志霞, 刘小京. 旱盐互作对冬小麦幼苗生长及其抗逆生理特性的影响[J]. 应用生态学报, 2009, 20(4): 811-816. |
| [8] |
LI D S. Effects of drought-salt stress on physiological characteristics of Platycodon grandiflorum seedling[J]. Shanxi J Agric Sci, 2016, 62(7): 38-40. 李堆淑. 旱盐交叉胁迫对桔梗幼苗生理特征的影响[J]. 陕西农业科学, 2016, 62(7): 38-40. DOI:10.3969/j.issn.0488-5368.2016.07.012 |
| [9] |
DING G J. Study on biomass and productivity of masson pine planting stand Ⅰ. Biomass and density effect of different planting density[J]. J Fujian College For, 2003, 23(1): 34-38. 丁贵杰. 马尾松人工林生物量和生产力研究Ⅰ. 不同造林密度生物量及密度效应[J]. 福建林学院学报, 2003, 23(1): 34-38. DOI:10.3969/j.issn.1001-389X.2003.01.009 |
| [10] |
XIANG L S, MIAO L F, YANG F. Drought and nitrogen application modulate the morphological and physiological responses of Dalbergia odorifera to different niche neighbors[J]. Front Plant Sci, 2021, 12: 664122. DOI:10.3389/fpls.2021.664122 |
| [11] |
YANG F, ZHANG J, CISSE E H M, et al. Competitive relationship between Cleistocalyx operculatus and Syzygium jambos under well-watered conditions transforms into a mutualistic relationship under waterlogging stress[J]. Front Plant Sci, 2022, 13: 869418. DOI:10.3389/fpls.2022.869418 |
| [12] |
YU G L. Effects of waterlogging on intraspecific interactions of the clonal herb Alternanthera philoxeroides[J]. Chin J Plant Ecol, 2011, 35(9): 973-980. 于国磊. 水淹对克隆植物空心莲子草种内关系的影响[J]. 植物生态学报, 2011, 35(9): 973-980. DOI:10.3724/SP.J.1258.2011.00973 |
| [13] |
WANG X M, YAN B G, SHI L T, et al. Effects of water and planting density on the growth characteristics and intraspecific relationships of Dodonaea viscosa in a dry-hot valley[J]. Acta Ecol Sin, 2020, 40(21): 7767-7776. 王雪梅, 闫帮国, 史亮涛, 等. 水分和种植密度对干热河谷车桑子生长性状及种内相互关系的影响[J]. 生态学报, 2020, 40(21): 7767-7776. DOI:10.5846/stxb202002130246 |
| [14] |
NIU Y P, CHEN Z K, YANG L C, et al. Effect of drip irrigation pattern and planting density on growth and yield performance of cotton in arid area[J]. Acta Agronom Sin, 2016, 42(10): 1506-1515. 牛玉萍, 陈宗奎, 杨林川, 等. 干旱区滴灌模式和种植密度对棉花生长和产量性能的影响[J]. 作物学报, 2016, 42(10): 1506-1515. DOI:10.3724/SP.J.1006.2016.01506 |
| [15] |
LIN C F. Research on reforestation technology of Casuarina equisetifolia forest in coastal zone[J]. Intro Consul, 2006(3): 37-39. 林传凤. 海岸带木麻黄防护林更新造林技术研究[J]. 引进与咨询, 2006(3): 37-39. DOI:10.3969/j.issn.1673-8683.2006.03.016 |
| [16] |
LI M J. Study on protection function and soil properties of several Casuarina mixed forests along the back of coastal sandy land[J]. Anhui Agric Sci, 2010, 16(13): 188-189. 李茂瑾. 滨海沙地后沿几种木麻黄混交林防护功能与土壤性质研究[J]. 安徽农业学报, 2010, 16(13): 188-189. DOI:10.3969/j.issn.1007-7731.2010.13.088 |
| [17] |
ZHANG C F. Study on the status of coastal shelterbelt and landscape shelterbelt construction planning in Haikou city[D]. Haikou: Hainan University, 2010: 1–73. 张彩凤. 海口市海岸防护林现状及景观海防林规划建设研究[D]. 海口: 海南大学, 2010: 1–73. |
| [18] |
CISSE E H M, LI D D, ZHANG J, et al. Responses of woody plant Dalbergia odorifera treated with glycine betaine to drought and cold stresses: Involvement of the alternative oxidase[J]. Biol Plant, 2022, 66(1): 56-66. DOI:10.32615/bp.2021.062 |
| [19] |
JIANG B H, DING Y, MIAO L F, et al. Effects of waterlogging and salt stresses on the physiological and ecological characteristics of Dalbergia odorifera seedling[J]. Nat Sci J Hainan Univ, 2020, 38(2): 132-140. 姜百惠, 丁扬, 苗灵凤, 等. 淹水和盐胁迫对降香黄檀植株生理生态特性的影响[J]. 海南大学学报(自然科学版), 2020, 38(2): 132-140. DOI:10.15886/j.cnki.hdxbzkb.2020.0019 |
| [20] |
GOHARRIZI K J, AMIRMAHANI F, SALEHI F. Assessment of changes in physiological and biochemical traits in four Pistachio rootstocks under drought, salinity and drought + salinity stresses[J]. Physiol Plant, 2020, 168(4): 973-989. DOI:10.1111/ppl.13042 |
| [21] |
LI P P, Study on antioxidant properties of heteromorphic leaves of Populus euphratica Oliv. [D]. Beijing: Beijing Forestry University, 2019. 李萍萍. 胡杨异形叶抗氧化特性的研究[D]. 北京: 北京林业大学, 2019. |
| [22] |
GAO J F. Experimental Supervision of Plant Physiology[M]. Beijing: High Education Press, 2006: 74-77. 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-77. |
| [23] |
LI D D, MIAO L F, TIAN M J, et al. Differences in eco-physiological responses to the removal of adventitious roots between Syzygium nervosum A. Cunn. ex DC. and Syzygium cumini (L.) Skeels saplings under waterlogging[J]. Ann Forest Sci, 2023, 80(1): 13. DOI:10.1186/s13595-023-01180-0 |
| [24] |
YAN S P, CHONG P F, ZHAO M. Effect of salt stress on the photosynthetic characteristics and endogenous hormones, and a comprehensive evaluation of salt tolerance in Reaumuria soongorica seedlings[J]. Plant Signal Behav, 2022, 17(1): 2031782. DOI:10.1080/15592324.2022.2031782 |
| [25] |
LI D D, GUO L Y, TIAN M J, et al. Effects of waterlogging stress on the neighboring relationships between Cleistocalyx operculatus (Roxb.) Merr. and Dalbergia odorifera T. Chen saplings[J]. Forests, 2023, 14(2): 377. DOI:10.3390/f14020377 |
| [26] |
ZHANG L J. Effects of drought and salt stress on physiological and ecological responses of Dalbergia odorifera T. Chen to exogenous substances application[D]. Haikou: Hainan University, 2019. 张丽佳. 干旱、盐胁迫下降香黄檀对外源物质应用的生理生态响应[D]. 海口: 海南大学, 2019. |
| [27] |
LI D D, WANG H B, YANG F, et al. Effects of simulated eutrophic waterlogging and post-waterlogging drought on the eco-physiological characteristics of Dalbergia odorifera[J]. J Trop Subtrop Bot, 2024, 32(5): 651-659. 李大东, 王海波, 杨帆, 等. 富营养化水体水淹及水淹后干旱对降香黄檀生理生态的影响[J]. 热带亚热带植物学报, 2024, 32(5): 651-659. DOI:10.11926/jtsb.4816 |
| [28] |
LU Y, ZHANG B, LI L, et al. Negative effects of long-term exposure to salinity, drought, and combined stresses on halophyte Halogeton glomeratus[J]. Physiol Plant, 2021, 173(4): 2307-2322. DOI:10.1111/ppl.13581 |
| [29] |
ALAM H, KHATTAK J Z K, KSIKSI T S, et al. Negative impact of long-term exposure of salinity and drought stress on native Tetraena mandavillei L.[J]. Physiol Plant, 2021, 172(2): 1336-1351. DOI:10.1111/ppl.13273 |
| [30] |
ZHENG X, YANG Z X, HAO D M, et al. Response of Rumex hanus by roots to drought after rehydration[J]. Arid Zone Res, 2022, 39(1): 240-249. 郑旭, 杨志鑫, 郝东梅, 等. 盐碱地食叶草细根对干旱复水后的响应[J]. 干旱区研究, 2022, 39(1): 240-249. DOI:10.13866/j.azr.2022.01.23 |
| [31] |
CARMINATI A, VETTERLEIN D, WELLER U, et al. When roots lose contact[J]. Vadose Zone J, 2009, 8(3): 805-809. DOI:10.2136/vzj2008.0147 |
| [32] |
ZHANG G C, ZHANG Z M, CI D W, et al. Effects of drought and salt stress on osmotic regulator and antioxidase activities[J]. Acta Agric Boreali-Sin, 2018, 33(3): 176-181. 张冠初, 张智猛, 慈敦伟, 等. 干旱和盐胁迫对花生渗透调节和抗氧化酶活性的影响[J]. 华北农学报, 2018, 33(3): 176-181. DOI:10.7668/hbnxb.2018.03.026 |
| [33] |
HNILIČKOVÁ H, HNILIČKA F, ORSÁK M, et al. Effect of salt stress on growth, electrolyte leakage, Na+ and K+ content in selected plant species[J]. Plant Soil Environ, 2019, 65(2): 90-96. DOI:10.17221/620/2018-PSE |
| [34] |
ABDELGAWAD H, ZINTA G, HEGAB M M, et al. High salinity induces different oxidative stress and antioxidant responses in maize seedlings organs[J]. Front Plant Sci, 2016, 7: 276. DOI:10.3389/fpls.2016.00276 |
| [35] |
CHEN B S, MIAO L F, LI D D, et al. Differential eco-physiological responses to waterlogging and salinity stresses between Cleistocalyx operculatus (Roxb.) Merr. et Perry and Syzygium cumini (L.) Skeels seedlings[J]. Plant Sci J, 2023, 41(5): 677-686. 陈柏燊, 苗灵凤, 李大东, 等. 水翁和乌墨幼苗对水淹-盐胁迫的生理生态差异响应[J]. 植物科学学报, 2023, 41(5): 677-686. DOI:10.11913/PSJ.2095-0837.22316 |
| [36] |
KRASENSKY J, JONAK C. Drought, salt, and temperature stress-induced metabolic rearrangements and regulatory networks[J]. J Exp Bot, 2012, 63(4): 1593-1608. DOI:10.1093/jxb/err460 |
| [37] |
ZHANG L J. The differential responses and physiological mechanisms of three transgenic sweet potato in response to drought/salt stress[D]. Yangling: Northwest A&F University, 2017. 张丽娟. 三种转基因甘薯响应干旱/盐胁迫的差异和生理机制[D]. 杨凌: 西北农林科技大学, 2017. |
| [38] |
AONO M, SAJI H, FUJIYAMA K, et al. Decrease in activity of glutathione reductase enhances paraquat sensitivity in transgenic Nicotiana tabacum[J]. Plant Physiol, 1995, 107(2): 645-648. DOI:10.1104/pp.107.2.645 |
| [39] |
CAI Z Q, GAO Q. Comparative physiological and biochemical mechanisms of salt tolerance in five contrasting highland quinoa cultivars[J]. BMC Plant Biol, 2020, 20(1): 70. DOI:10.1186/s12870-020-2279-8 |
| [40] |
ZENG C C, WANG Z X, CHEN J P, et al. The effects of different water treatments on intraspecific interactions of Cynodon dactylon[J]. Acta Ecol Sin, 2016, 36(3): 696-704. 曾成城, 王振夏, 陈锦平, 等. 不同水分处理对狗牙根种内相互作用的影响[J]. 生态学报, 2016, 36(3): 696-704. DOI:10.5846/stxb201404290858 |
| [41] |
SHEN S C, XU G F, ZHANG F D, et al. Morphological and growth responses of Pistia stratiotes to different densities and its impact on soil nutrients[J]. Ecol Environ Sci, 2013, 22(6): 1041-1047. 申时才, 徐高峰, 张付斗, 等. 不同密度水浮莲的形态和生长反应及其对土壤养分的影响[J]. 生态环境学报, 2013, 22(6): 1041-1047. DOI:10.3969/j.issn.1674-5906.2013.06.021 |
| [42] |
BOSSE U, FRENZEL P. Activity and distribution of methane-oxidizing bacteria in flooded rice soil microcosms and in rice plants (Oryza sativa)[J]. Appl Environ Microbiol, 1997, 63(4): 1199-1207. DOI:10.1128/aem.63.4.1199-1207.1997 |
| [43] |
VISSER E J W, COLMER T D, BLOM C W P M, et al. Changes in growth, porosity, and radial oxygen loss from adventitious roots of selected mono- and dicotyledonous wetland species with contrasting types of aerenchyma[J]. Plant Cell Environ, 2000, 23(11): 1237-1245. DOI:10.1046/j.1365-3040.2000.00628.x |
| [44] |
WEI X. Effect of adding nitrogenous fertilizer and planting density on the growth and physiological characteristics of Salvia miltiorrhiza[D]. Luoyang: Henan University of Science and Technology, 2013: 1–49. 魏鑫. 施氮和种植密度对丹参生长及生理特性的影响[D]. 洛阳: 河南科技大学, 2013: 1–49. |
 2025, Vol. 33
2025, Vol. 33



