香蕉是芭蕉科(Musaceae)芭蕉属(Musa)大型常绿单子叶草本植物,主要分布在热带、亚热带地区,因其营养价值高、口感好、风味独特深受全世界消费者喜爱[1],在我国的广西、福建、广东、海南、云南、台湾等地广泛种植[2]。香蕉是典型的呼吸跃变型水果,采后贮藏过程中极易染病,香蕉炭疽病是香蕉贮运过程的主要病害之一,由香蕉炭疽菌(Colletotrichum musae)引起[3],其具有潜伏侵染特性,在果实发育阶段不表现出症状,但随着采后果实成熟,便出现黑色、凹陷的病斑并产生橙红色的孢子,加速果实腐烂,导致果实营养流失、风味变差、品质降低[4–6]。目前,该病的防治以喷洒化学杀菌剂为主,如多菌灵、丙氯嗪和嘧菌酯,但长期使用化学杀菌剂不仅会使病原菌产生抗药性,同时会对人体健康造成一定隐患,也会对环境造成破坏[7–8]。目前,环境友好、健康安全的防治方法越来越成为人们关注的焦点[9],已有许多研究探讨了微生物或植物生长过程中产生的次生代谢产物对植物病原真菌的抑制活性,均发现其具有良好的应用潜力[10–11]。
溪黄草(Isodon serra)别名熊胆草、风血草、黄汁草等,为唇形科(Labiatae)香茶菜属植物,因其喜生于山谷明湿溪旁,新鲜叶片揉碎有黄汁而得名, 主要分布于江西、广东、广西、福建等地[12]。溪黄草是民间常用中草药,含有萜类、酚类、神经酰胺、苯丙素、有机酸、甾醇等成分,具有抗氧化、抑菌、抗炎、抗肿瘤等活性[13–14]。有研究表明,溪黄草提取物对金黄色葡萄球菌、白色念珠菌、酿酒酵母、枯草芽孢杆菌、蜡样芽孢杆菌、李斯特菌和痢疾志贺菌等细菌或真菌均有较强的抑制作用[15–17]。
目前关于溪黄草提取物对香蕉炭疽菌抑制作用的研究还较少。本文研究了溪黄草提取物对香蕉炭疽菌菌丝生长的抑制能力和对香蕉果实炭疽病的生物防治效果,并通过分析其对菌丝细胞完整性的破坏情况以及对能量代谢相关酶活性的影响情况,初步探讨其抑菌机理,以期揭示溪黄草提取物对香蕉炭疽病的防治能力及其应用潜力,为开发溪黄草提取物作为安全、环保、高效、天然的水果保鲜剂提供理论依据。
1 材料和方法 1.1 材料和设备溪黄草(Isodon serra)于2023年8月采摘自福建省龙岩市武平县下坝村溪黄草种植基地(24°52′52″ N, 116°2′19″ E),采集生长期约6个月、株高在70 cm以上的植株地上部分作为试验样品。香蕉炭疽菌(Colletotrichum musae)由河南省工业微生物菌种工程技术研究中心分离鉴定,菌种编号为BNCC226660。琥珀酸脱氢酶(succinate dehydrogenase,SDH)活性检测试剂盒、苹果酸脱氢酶(malate dehydrogenase, MDH)活性检测试剂盒、ATP合成酶活性检测试剂盒、Ca2+Mg2+-ATP酶活性检测试剂盒购于北京索莱宝科技有限公司。
iMark酶标仪(美国Biorad公司);FE38电导率仪(梅特勒托利多科技有限公司);DMi8倒置荧光显微镜(德国徕卡公司);JSM-6380LV扫描电子显微镜(日本JEOL公司);HT7700透射电镜(日本日立公司)。
1.2 方法溪黄草提取物制备 洗净溪黄草表面杂质, 将其置于60 ℃烘箱中烘干至恒重,粉碎后过40目筛,按照质量体积比1:20的料液比将粉末浸泡于体积分数为70%的乙醇中,以240 W的功率超声辅助提取30 min,随后置于摇床中以180 r/min的转速振摇提取60 min,9 190 ×g离心15 min,重复提取3次,合并上清液。提取液采用50 ℃减压旋转蒸发至无乙醇味,获得醇提物浓缩液,经冷冻干燥后得到溪黄草醇提物冻干粉,得率为16.54%。将上述未经冻干的醇提物浓缩液依次用石油醚、乙酸乙酯、正丁醇进行液-液分部萃取,剩余部分为水相萃取液,各相萃取液经旋蒸、冷冻干燥,得到石油醚、乙酸乙酯、正丁醇、水相萃取部位,得率分别为2.63%、2.71%、2.81%和10.15%,所有提取物均置于4 ℃冰箱中保存备用。为方便描述,获得的乙醇提取物简称Et,石油醚萃取部位简称Et-PE,乙酸乙酯萃取部位简称Et-EA,正丁醇萃取部位简称Et-nBu,水相萃取物简称Et-Aq。
提取物对菌丝生长的抑制 参考Li等[18]的方法并做适当修改。采用10%二甲基亚砜(DMSO)溶解溪黄草提取物,并将其添加到提前融化并冷却到约50 ℃的PDA中进行充分混合,将上述混合液迅速倒入直径为90 mm的无菌培养皿中,静置凝固。用直径为6 mm的打孔器打取香蕉炭疽菌菌饼,将其移接到上述带药培养基上,设置加入10% DMSO的培养基为空白对照。将所有培养基放置到28 ℃培养箱中培养,观察记录菌丝生长情况,采用十字交叉法测量菌落直径。空白对照组生长到84 h时,菌丝长至培养皿直径的三分之二左右,因此采用培养84 h的菌落直径来计算生长抑制率。每个处理重复3次。按以下公式计算菌丝生长抑制率:抑制率(%)= (对照组菌落直径-处理组菌落直径)/(对照组菌落直径-6 mm)×100%。
提取物对炭疽病的防治效果 防治试验参照翁甜等[19]的方法并做适当修改。挑选八成熟、无明显损伤和病斑的香蕉,洗净后自然晾干。用灭菌的打孔器(直径为6 mm)和刀片在香蕉表面切出深度为2 mm的伤口,接入香蕉炭疽菌菌块,在恒温恒湿箱(25 ℃,80%湿度)贮藏24 h,随后将浓度为0 (即对照组, CK)、0.5、2.0、4.0 mg/mL的溪黄草提取物溶液均匀喷洒于香蕉表面,待表面干燥后继续放入恒温恒湿箱中,每隔24 h测量病斑直径。采用0.5 mg/mL多菌灵作为阳性对照。每个处理选取3根香蕉,试验重复3次。
提取物对菌丝细胞壁完整性的影响 在200 mL PDB中加入4块直径为6 mm的香蕉炭疽菌菌饼,28 ℃下振荡培养2 d,9 190 ×g离心15 min收集菌丝,用PBS溶液清洗菌丝2次,准确称取0.1 g菌丝到15 mL离心管中,分别加入10 mL浓度为0 (CK)、0.5、1.0、2.0 mg/mL的溪黄草提取物溶液,置于28 ℃恒温摇床中振摇处理8 h。CFW染色参考翁甜等[20]的方法,取出少量菌丝加入10 μL CFW染色液,反应10 s后再加入10 μL 10% (w/v) NaOH溶液充分混合,吸取适量液体到载玻片上, 置于倒置荧光显微镜下观察,每个处理重复3次。
菌丝胞外相对电导率测定 菌丝胞内物质泄露情况测定参考王颖等[21]的方法并稍做修改。准确称取1.5 g菌丝到无菌锥形瓶中,分别加入60 mL浓度分别为0 (CK)、0.5、1.0、2.0 mg/mL的溪黄草提取物溶液,充分混匀后立即测定电导率,记为初始电导率L0。上述混合液置于28 ℃恒温摇床中振摇,分别在2、4、6、8 h时取出10 mL,用电导率仪测定电导率,记为L1。将混合液在沸水中处理10 min,冷却后再测定其电导率,记为L2。每个处理重复3次。相对电导率(%)=(L1–L0)/(L2–L0)×100%。
菌丝形态和超微结构观察 菌丝处理后,取少量菌丝用5%戊二醛溶液固定4 h,将样品送至福建省农科院质标所电镜室进行扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察。
能量代谢相关酶活性测定 菌丝处理后, SDH、MDH、ATP合成酶、ATP酶活性按照检测试剂盒说明书进行测定,每个处理重复3次。
1.3 数据统计和分析试验数据统计和回归分析采用Excel 2007,结果以平均值±标准误表示;采用SPSS 22.0统计软件进行ANOVA方差分析,P < 0.05表示差异显著;采用Origin 2019b软件作图。
2 结果和分析 2.1 对香蕉炭疽菌的抑制活性 2.1.1 对香蕉炭疽菌菌丝生长的影响从图 1: A, B可见,随着培养时间延长,2 mg/mL不同提取物处理的菌丝生长速度存在显著差异,其中CK组和Et-Aq组的菌丝生长情况接近,培养96 h后,其菌丝基本长满平板,菌落直径分别为8.00和8.01 cm,而Et、Et-PE、Et-EA、Et-nBu处理的菌丝生长均受到一定抑制,培养96 h后菌落直径分别为2.57、2.18、2.93和4.18 cm,Et-PE处理的菌丝生长速度最慢。从图 1: C可见,在一定质量浓度范围内,不同溪黄草提取物对菌丝生长的抑制率均与浓度呈对数函数关系(Et-Aq除外),随着浓度提高,抑制率先迅速上升后趋于平缓。由表 1可知,Et、Et-PE、Et-EA、Et-nBu对菌丝生长的EC50分别为0.27、0.18、0.31、1.51 mg/mL,抑制能力为Et-PE > Et > Et-EA > Et-nBu > Et-Aq。综上,溪黄草醇提物及其不同极性溶剂萃取部位中,抑制香蕉炭疽菌活性最强的是Et-PE。
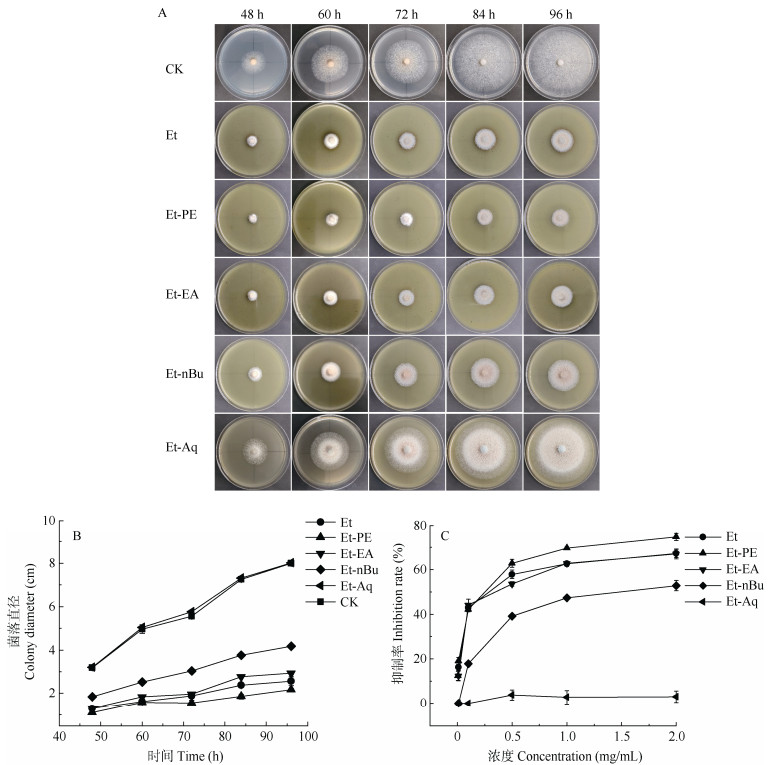
|
图 1 溪黄草提取物对香蕉炭疽菌菌丝生长的影响。CK: 空白对照; Et: 醇提物; Et-PE: 石油醚萃取部位; Et-EA: 乙酸乙酯萃取部位; Et-nBu: 正丁醇萃取部位; Et-Aq: 水相萃取部位。下同 Fig. 1 Effect of Isodon serra extract on mycelia growth of Colletotrichum musae. CK: Blank control; Et: Ethanol extract; Et-PE: Petroleum ether fraction; Et-EA: Ethyl acetate fraction; Et-nBu: n-Butanol fraction; Et-Aq: Aqueous fraction. The same below |
| 表 1 溪黄草提取物对香蕉炭疽菌菌丝生长的抑制活性 Table 1 Inhibitory activity of Isodon serra extract on Colletotrichum musae mycelia growth |
上述研究结果表明Et-PE的抑菌活性最强,因此重点研究Et-PE对香蕉果实炭疽病防治情况(图 2)。CK组香蕉的病斑随着储藏时间的延长逐渐增大, 接种5 d后病斑直径增长到14.56 mm。不同浓度Et-PE处理后,病斑直径增长速度出现不同程度的减缓,且处理浓度越高增长速度越慢。经0.5、2.0和4.0 mg/mL Et-PE处理的香蕉病斑直径分别增长到11.22、9.78、8.88 mm,比CK组分别减小38.96%、55.84%、66.23%。0.5 mg/mL多菌灵处理的病斑直径为7.94 mm,略低于4.0 mg/mL Et-PE处理组,但二者无显著性差异(P > 0.05),说明Et-PE处理香蕉果实能显著抑制香蕉炭疽病的发生。
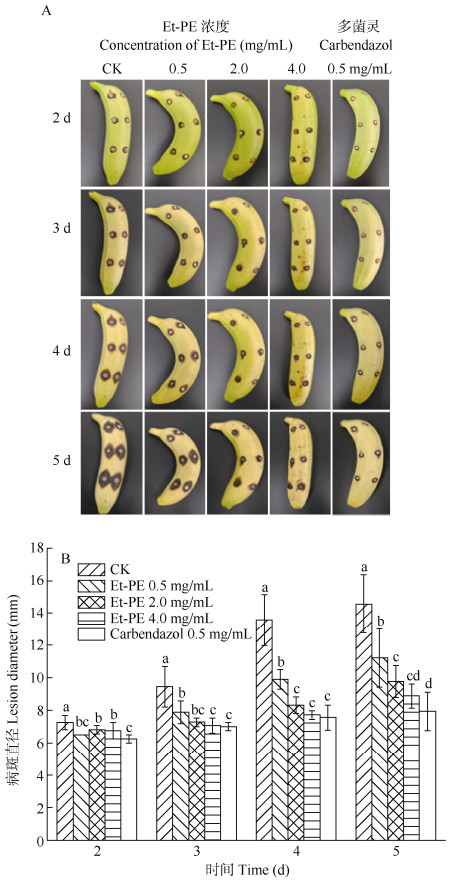
|
图 2 Et-PE对香蕉炭疽病防治效果 Fig. 2 Controlling effect of Et-PE against postharvest anthracnose on banana |
采用Et-PE来研究溪黄草提取物的抑菌机理。根据CFW染色后菌丝蓝色荧光的强弱可以判断细胞壁中几丁质含量变化,从而分析细胞壁完整性(图 3: A), 与CK对比,经Et-PE处理的菌丝蓝色荧光均不同程度减弱,处理浓度越高,荧光越弱,说明Et-PE能显著降低细胞壁中几丁质含量,破坏香蕉炭疽菌菌丝细胞壁的完整性,且破坏程度呈浓度依赖性。在SEM和TEM下观察Et-PE处理后菌丝的形态结构变化(图 3: B), 在SEM下,CK的表面相对完整光滑,没有明显皱纹和裂纹,0.5 mg/mL Et-PE处理的菌丝表面略显粗糙,出现凹陷和裂纹,菌丝萎缩变细,而2.0 mg/mL Et-PE处理后,菌丝表面出现明显褶皱、萎缩和凹陷,甚至出现菌丝体干瘪裂解的情况。在TEM下,CK的菌丝截面呈规则的圆形,细胞结构完整,能看到明显的液泡,细胞壁与细胞膜紧密相连,0.5 mg/mL Et-PE处理的菌丝细胞壁结构变得疏松,呈现略微增厚的现象,而2.0 mg/mL Et-PE处理后,菌丝出现严重的质壁分离,细胞膜皱缩,细胞质解体。从图 3: C可见,CK的相对电导率变化不显著,而Et-PE处理2~8 h的相对电导率显著升高,且处理浓度越高升高趋势越明显,2.0 mg/mL Et-PE处理的相对电导率由26.10%上升至80.93%,说明Et-PE能破坏菌丝的细胞壁和细胞膜,从而使胞内电解质发生泄漏,导致相对电导率升高。

|
图 3 Et-PE处理对香蕉炭疽菌菌丝细胞完整性的影响 Fig. 3 Effect of Et-PE on the integrity of Colletotrichum musae mycelia |
SDH、MDH、ATP合成酶、ATP酶是能量代谢过程中重要的酶,对于香蕉炭疽菌菌丝的正常生长起重要作用。从图 4可见,2.0 mg/mL Et-PE处理后酶活性显著下降(P < 0.05),SDH活性由317.81下降到242.94 U/g,MDH活性由0.544下降到0.215 U/mg, ATP合成酶活性由120.36下降到109.51 nmol/(min·g), ATP酶活性由40.47下降到27.52 μmol/(h·g),分别下降23.56%、60.51%、9.01%和32.01%。可见,Et-PE处理能显著影响香蕉炭疽菌能量代谢相关酶的活性,从而影响其正常生长。
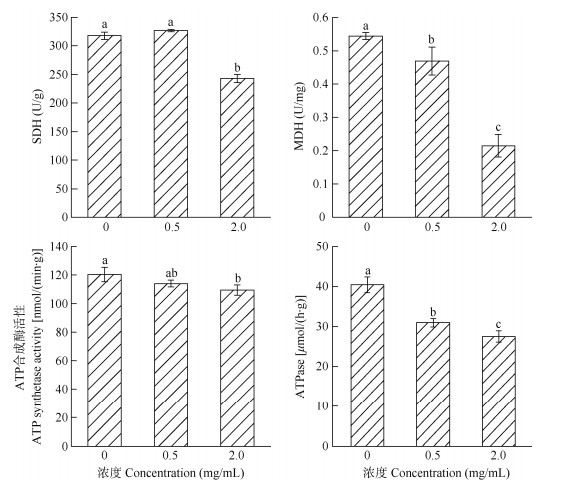
|
图 4 Et-PE处理对菌丝能量代谢相关酶活性的影响 Fig. 4 Effect of Et-PE on enzyme activities related to energy metabolism of Colletotrichum musae mycelia |
植物源天然产物主要是指植物在生命活动过程中产生的所有代谢产物的集合,具有多种生物活性成分,如酚类、黄酮、萜类、生物碱、有机酸等[22],这些活性物质具备显著的抗氧化和抑菌功能,将其开发为天然抑菌剂具有安全、高效、可持续等优点。刘启凤等[23]研究表明中南鱼藤(Derris fordii)枝叶甲醇提取物抑制香蕉炭疽菌菌丝生长的EC50为0.24 mg/mL;夏玉莲等[24]研究表明10 mg/mL的双叶细辛(Asarum caulescens)乙酸乙酯提取物在质量浓度为10 mg/mL时对香蕉炭疽病的防治效果优于0.2 mg/mL多菌灵;Bazie等[25]采用金合欢(Acacia albida)、牧豆树(Prosopis juliflora)和蓟罂粟(Argemone mexicana)叶片水提物(20 mg/mL)处理香蕉果实,果实的炭疽病发病率由对照的100%分别降为29.8%、40.3%和62.2%。本研究中,溪黄草醇提物及其石油醚萃取部位抑制菌丝生长的EC50分别为0.27和0.18 mg/mL, 4 mg/mL石油醚萃取部位处理可使香蕉炭疽病病斑直径减小66.23%,与0.5 mg/mL多菌灵的抑制活性无显著差异,说明溪黄草提取物对香蕉炭疽菌具有显著的抑制能力。Li等[18]对比了杠柳(Periploca sepium)根皮甲醇提取物的三氯甲烷萃取部位和正丁醇萃取部位对7种植物病原真菌的抑制活性,结果表明极性较低的三氯甲烷部位对大部分真菌的抑制能力最强。吴光旭等[26]研究表明开口箭(Tupistra chinensis)乙酸乙酯萃取部位抑制香蕉炭疽菌孢子萌发和菌丝生长的能力大于甲醇提取物和正丁醇萃取部位。本研究中,溪黄草醇提物的4个不同极性溶剂萃取部位,也是极性最弱的石油醚萃取部位对香蕉炭疽菌菌丝生长抑制能力最强,与前人结果相似。根据相似相溶原理,溪黄草中抑制香蕉炭疽菌的活性物质多为极性较弱的物质,这可能是因为极性较弱的成分具有较大的脂溶性,更容易结合在细胞的膜结构中,从而对真菌造成破坏作用。前人研究结果表明香茶菜属植物中富含的二萜类化合物具有显著的抑菌作用[27–28]。Zhou等[29]从溪黄草石油醚萃取部位中分离鉴定出10种松香烷二萜,包括16-乙酰氧基丁香酚、石斛碱E、石斛碱F、15-羟基-20-脱氧鼠尾草酚、3α-扁柏醇等。研究认为二萜类化合物中的α-亚甲基环戊酮系统是其抗菌作用的活性中心,其作用机理是通过一个类似于迈克尔加成的反应,使活性中心与病菌中的巯基酶相结合而发挥作用[30]。
真菌细胞壁、细胞膜是真菌与外界环境的边界屏障,能维持细胞形态、抵抗外来物质入侵,对细胞起到保护作用[31]。有研究表明,柠檬醛、辛醛和松油醇3种挥发性化合物对柑橘酸腐菌的抑制作用是由于其能显著破坏细胞膜完整性,导致胞内物质泄露[32]。朱新月等[33]研究表明,天然产物Antidesmone抑制香蕉炭疽菌的机理在于使菌丝细胞发生质壁分离、细胞壁变厚和细胞组织崩解,处理后的细胞膜相对渗透率提高72.81%。Qiao等[34]研究表明台湾乳菇(Chymacyparis taiwanensis)中提取的桧柏醇能破坏香蕉炭疽菌细胞膜完整性,导致细胞质泄露,最终使细胞死亡。本研究表明溪黄草石油醚萃取部位能显著破坏香蕉炭疽菌细胞壁和细胞膜的完整性,使胞内电解质发生泄露,菌丝发生皱缩、裂解,与上述研究结果一致,说明破坏细胞完整性是其抑制香蕉炭疽菌的机理之一。
三羧酸循环(TCA)是发生在真核生物线粒体中的重要代谢途径之一,也是生物体获取能量的主要来源。TCA途径被干扰或抑制会导致微生物的生长发育和繁殖出现减慢甚至衰亡,因此,TCA途径的关键酶是抑菌剂发挥作用的重要靶标[35]。SDH和MDH都是三羧酸循环中的关键酶,前者催化琥珀酸氧化为富马酸和FADH2,后者催化苹果酸和草酰乙酸之间的可逆转换[36]。有研究表明5 µg/mL扁蒴藤素处理核盘菌菌丝,可使SDH和MDH酶活性分别比CK组下降75%和79.4%[36]。本研究表明,香蕉炭疽菌菌丝经溪黄草石油醚萃取部位处理后, SDH和MDH活性分别下降23.56%和60.51%。ATP合成酶和ATP酶与生物能量代谢密切相关,前者可通过磷酸化ADP产生ATP[37],后者则能分解ATP产生能量[38]。本研究中,菌丝经溪黄草石油醚萃取部位处理后ATP合成酶和ATP酶活性分别比CK组下降9.01%和32.01%。这说明通过影响TCA代谢途径和菌体能量代谢相关酶的活性来抑制菌丝正常生长,是溪黄草石油醚萃取部位对香蕉炭疽菌的另一抑菌机理。
综上,溪黄草提取物能有效抑制香蕉炭疽菌菌丝生长,其中以石油醚萃取部位的抑制能力最强,其抑菌机理可能是由于破坏菌丝细胞结构的完整性,使胞内电解质发生泄漏,同时影响菌丝能量代谢相关酶活性,从而抑制菌丝正常生长。溪黄草提取物是防治香蕉炭疽病潜在的天然、优质来源。
| [1] |
YANG Z K, LI M R, ZHAI X D, et al. Development and characterrization of sodium alginate/tea tree essential oil nanoemulsion active film containing TiO2 nanoparticles for banana packaging[J]. Int J Biol Macromol, 2022, 213: 145-154. DOI:10.1016/j.ijbiomac.2022.05.164 |
| [2] |
WANG T G, HU H G, SUN D Q, et al. Fruit quality analysis and fuzzy comprehensive evaluation of five new banana strains[J]. Chin J Trop Crops, 2022, 43(2): 271-276. 王天果, 胡会刚, 孙德权, 等. 5个新品系香蕉的果实品质分析及模糊综合评判[J]. 热带作物学报, 2022, 43(2): 271-276. DOI:10.3969/j.issn.1000-2561.2022.02.006 |
| [3] |
CHE J M, LIU G H, LIU B, et al. Control of banana postharvest anthracnose by Brevibacillus sp. strains[J]. Microbiol China, 2020, 47(6): 1753-1762. 车建美, 刘国红, 刘波, 等. 短芽胞杆菌对香蕉采后炭疽病的防治[J]. 微生物学通报, 2020, 47(6): 1753-1762. DOI:10.13344/j.microbiol.china.190817 |
| [4] |
ZENG W D, FENG J T, WEI Y Z, et al. Biocontrol efficiency and potential mechanism of Streptomyces distatochromogenes XT34 against postharvest anthracnose caused by Colletotrichum musae on banana fruit[J]. Postharv Biol Technol, 2024, 212: 112899. DOI:10.1016/j.postharvbio.2024.112899 |
| [5] |
GAO Y S, LI Y X, LI F F, et al. Phenyllactic acid treatment for controlling anthracnose disease (Colletotrichum musae) and preserving banana fruit quality during storage[J]. Physiol Mol Plant Pathol, 2024, 129: 102181. |
| [6] |
FENTA L, MEKONNEN H, GASHAW T. Biocontrol potential of trichoderma and yeast against postharvest fruit fungal diseases: A review[J]. World News Nat Sci, 2019, 27: 153-173. |
| [7] |
ROTOLO C, DE MICCOLIS A R M, DONGIOVANNI C, et al. Use of biocontrol agents and botanicals in integrated management of Botrytis cinerea in table grape vineyards[J]. Pest Manag Sci, 2018, 74(3): 715-725. DOI:10.1002/ps.4767 |
| [8] |
LEITE I C H L, SILVA R A, SANTOS J E C C, et al. Analysis of Colletotrichum musae populations from Brazil reveals the presence of isolates with high competitive ability and reduced sensitivity to postharvest fungicides[J]. Plant Pathol, 2020, 69(8): 1529-1539. DOI:10.1111/ppa.13229 |
| [9] |
HU Z, FAN K, YU Y N, et al. Antifungal and field-control effects of eugenol and carvacrol on Ustilaginoidea virens[J]. Chin J Biol Control, 2023, 39(6): 1446-1454. 胡政, 范楷, 于伊楠, 等. 丁香酚和香芹酚对稻曲病菌的抑菌作用及田间防效评价[J]. 中国生物防治学报, 2023, 39(6): 1446-1454. DOI:10.16409/j.cnki.2095-039x.2023.02.061 |
| [10] |
WANG R, CHEN S W, YU Y Y, et al. Antibacterial metabolites of endophytic Aspergillus sp. HU0206 isolated from Spinifex littoreus[J]. J Trop Subtrop Bot, 2023, 31(5): 736-740. 王瑞, 陈少微, 于燕燕, 等. 老鼠艻内生曲霉HU0206的抗细菌活性代谢成分[J]. 热带亚热带植物学报, 2023, 31(5): 736-740. DOI:10.11926/jtsb.4646 |
| [11] |
LI S S, ZOU H, YANG M, et al. Antifungal activity and chemical composition of five Rosmarinus essential oils controlling Fusarium oxysporum, the causal agent of Anoectochilus roxburghii stem rot[J]. Chin J Biol Control, 2023, 39(4): 950-960. 李珊珊, 邹晖, 杨敏, 等. 5个不同品系迷迭香精油对金线莲尖孢镰刀菌的抑菌活性及GC-MS成分分析[J]. 中国生物防治学报, 2023, 39(4): 950-960. DOI:10.16409/j.cnki.2095-039x.2023.02.041 |
| [12] |
SUN L Q, QIAN F, LI Y M, et al. Research progress on chemical constituents and pharmacological effects of Linearstripe Rabdosia herb from various origins[J]. Acad J Shanghai Univ Trad Chin Med, 2020, 34(6): 88-98. 孙礼芹, 钱菲, 李医明, 等. 多基源溪黄草的化学成分和药理作用研究进展[J]. 上海中医药大学学报, 2020, 34(6): 88-98. DOI:10.16306/j.1008-861x.2020.06.014 |
| [13] |
LIN L Z, DONG Y, YANG B, et al. Chemical constituents and biological activity of Chinese medicinal herb 'Xihuangcao'[J]. Comb Chem High Throughput Screening, 2011, 14(8): 720-729. DOI:10.2174/138620711796504352 |
| [14] |
ZHOU W T, XIE H H. Phenylpropanoids, megastigmanes, alkaloid, and alkyl glycosides from Isodon serra[J]. J Trop Subtrop Bot, 2018, 26(2): 185-190. 周文婷, 谢海辉. 溪黄草的苯丙素、大柱香波龙烷、生物碱和烷基糖苷类成分[J]. 热带亚热带植物学报, 2018, 26(2): 185-190. DOI:10.11926/jtsb.3790 |
| [15] |
MO X L, QIU W F, HUANG S S, et al. Antibacterial and antifungal activities of different plant resources of herba Isodon serra[J]. Mod Chin Med, 2016, 18(8): 980-984. 莫小路, 邱蔚芬, 黄珊珊, 等. 溪黄草不同基原植物的抗菌和抗真菌活性研究[J]. 中国现代中药, 2016, 18(8): 980-984. DOI:10.13313/j.issn.1673-4890.2016.8.008 |
| [16] |
LIN L Z, ZHU D S, ZOU L W, et al. Antibacterial activity-guided purification and identification of a novel C-20 oxygenated ent-kaurane from Rabdosia serra (Maxim.) Hara[J]. Food Chem, 2013, 139(1/2/3/4): 902-909. DOI:10.1016/j.foodchem.2013.01.001 |
| [17] |
ZHOU W T, XIE H H, XU X Y, et al. Phenolic constituents from Isodon lophanthoides var. graciliflorus and their antioxidant and antibacterial activities[J]. J Funct Foods, 2014, 6: 492-498. DOI:10.1016/j.jff.2013.11.015 |
| [18] |
LI Y K, AIOUB A A A, LV B, et al. Antifungal activity of pregnane glycosides isolated from Periploca sepium root barks against various phytopathogenic fungi[J]. Ind Crops Prod, 2019, 132: 150-155. DOI:10.1016/j.indcrop.2019.02.009 |
| [19] |
WANG Y, QIAO Y H, ZHANG M W, et al. Potential value of small-molecule organic acids for the control of postharvest gray mold caused by Botrytis cinerea[J]. Pestic Biochem Physiol, 2021, 177: 104884. DOI:10.1016/j.pestbp.2021.104884 |
| [20] |
WENG T, WANG Y Q, LONG C A. Inhibitory mechanism of geraniol against Geotrichum citri-aurantii in citrus[J]. Food Sci, 2023, 44(1): 14-21. 翁甜, 王昱晴, 龙超安. 香叶醇对柑橘酸腐病菌的抑菌机制[J]. 食品科学, 2023, 44(1): 14-21. DOI:10.7506/spkx1002-6630-20220214-087 |
| [21] |
WANG Y, LI L, HU J. Compound screening and synergistic antibacterial properties of Litsea cubeba essential oils[J]. Fine Chem, 2023, 40(1): 146-152. 王颖, 李琳, 胡静. 基于山苍子精油的复配筛选及协同抗菌性能[J]. 精细化工, 2023, 40(1): 146-152. DOI:10.13550/j.jxhg.20220400 |
| [22] |
LIANG J J, CHEN Y Y, WANG Y, et al. Research progress on natural products of main horticultural plants in China[J]. J Zhejiang Univ (Agric Life Sci), 2021, 47(6): 683-694. 梁姣娇, 陈云义, 王岳, 等. 我国主要园艺植物天然产物研究进展[J]. 浙江大学学报(农业与生命科学版), 2021, 47(6): 683-694. DOI:10.3785/j.issn.1008-9209.2021.06.151 |
| [23] |
LIU Q F, ZHANG B J, YIN F M, et al. Fungistatic activity of the extracts from the twigs and leaves of Derris fordii against plant pathogenic fungi[J]. J Trop Biol, 2022, 13(3): 227-234. 刘启凤, 张北京, 尹丰满, 等. 中南鱼藤枝叶提取物对植物病原真菌的抑菌活性[J]. 热带生物学报, 2022, 13(3): 227-234. DOI:10.15886/j.cnki.rdswxb.2022.03.004 |
| [24] |
XIA Y L, CAO Y, WU X F, et al. Antifungal activity of methanol extracts of Asarum caulescens Maxim. against twelve agricultural plant pathogenic fungi[J]. Acta Agric Univ Jiangxi, 2021, 43(4): 797-806. 夏玉莲, 曹云, 伍显锋, 等. 双叶细辛甲醇提取物对12种农业病原真菌抑菌活性研究[J]. 江西农业大学学报, 2021, 43(4): 797-806. DOI:10.13836/j.jjau.2021088 |
| [25] |
BAZIE S, AYALEW A, WOLDETSADIK K. Integrated management of postharvest banana anthracnose (Colletotrichum musae) through plant extracts and hot water treatment[J]. Crop Prot, 2014, 66: 14-18. DOI:10.1016/j.cropro.2014.08.011 |
| [26] |
WU G X, YANG X L, LIU A Y, et al. Antifungal activity of Tupistra chinensis extract against Colletotrichum musae of postharvest banana[J]. Trans CSAE, 2007, 23(7): 235-240. 吴光旭, 杨小玲, 刘爱媛, 等. 开口箭提取物对采后香蕉抗炭疽病菌活性的研究[J]. 农业工程学报, 2007, 23(7): 235-240. DOI:10.3321/j.issn:1002-6819.2007.07.046 |
| [27] |
SUN H D, HUANG S X, HAN Q B. Diterpenoids from Isodon species and their biological activities[J]. Nat Prod Rep, 2006, 23(5): 673-698. DOI:10.1039/b604174d |
| [28] |
HU J J, LI B L, XIE J D, et al. Two new 7, 20-epoxy-ent-kaurane diterpenoids from the aerial parts of Isodon serra[J]. Nat Prod Res, 2022, 36(8): 2021-2027. DOI:10.1080/14786419.2020.1841189 |
| [29] |
ZHOU W T, XIE H H, WU P, et al. Abietane diterpenoids from Isodon lophanthoides var. graciliflorus and their cytotoxicity[J]. Food Chem, 2013, 136(2): 1110-1116. DOI:10.1016/j.foodchem.2012.08.015 |
| [30] |
SUN H D, XU Y L, JIANG B. Diterpenoids from Isodon Species[M]. Beijing: Science Press, 2001: 91-92. 孙汉董, 许云龙, 姜北. 香茶菜属植物二萜化合物[M]. 北京: 科学出版社, 2001: 91-92. |
| [31] |
XING M, FEI P, GUO L, et al. Antibacterial activity, mechanism and application of plant-derived natural products in food preservation[J]. J Nucl Agric Sci, 2021, 35(8): 1875-1882. 邢敏, 费鹏, 郭鸰, 等. 植物源天然产物的抑菌作用机理及在食品保藏中的应用[J]. 核农学报, 2021, 35(8): 1875-1882. DOI:10.11869/j.issn.100-8551.2021.08.1875 |
| [32] |
ZHOU H E, TAO N G, JIA L. Antifungal activity of citral, octanal and α-terpineol against Geotrichum citri-aurantii[J]. Food Control, 2014, 37: 277-283. DOI:10.1016/j.foodcont.2013.09.057 |
| [33] |
ZHU X Y. Priliminary studies on the mechanism of funfiicidal lead compounds HAINU-18 and antidesmone against Colletotrichum musae [D]. Haikou: Hainan University, 2020. 朱新月. 杀菌先导化合物HAINU-18和Antidesmone对香蕉炭疽菌的初步作用机制研究[D]. 海口: 海南大学, 2020. |
| [34] |
QIAO Y H, XU L T, XU G Y, et al. Efficacy and potential mechanism of hinokitiol against postharvest anthracnose of banana caused by Colletotrichum musae[J]. LWT, 2022, 161: 113334. DOI:10.1016/j.lwt.2022.113334 |
| [35] |
JU J. Study on the synergistic inhibitory mechanism of eugenol and citral against Penicillium roqueforti and Aspergillus niger [D]. Wuxi: Jiangnan University, 2021. 鞠健. 丁香酚和柠檬醛对娄地青霉和黑曲霉的协同抑菌机理探究[D]. 无锡: 江南大学, 2021. |
| [36] |
ZHAO W B, ZHAO Z M, MA Y, et al. Antifungal activity and preliminary mechanism of pristimerin against Sclerotinia sclerotiorum[J]. Ind Crops Prod, 2022, 185: 115124. DOI:10.1016/j.indcrop.2022.115124 |
| [37] |
CAO X Y, ZHANG X Y, YE J P. Regulation of mitochondrial ATP synthase inhibitor 1 in cellular energy metabolism[J]. Chin J Cell Biol, 2020, 42(4): 682-690. 曹昕昱, 章小英, 叶建平. 线粒体ATP合成酶抑制因子1在细胞能量代谢中的调节作用[J]. 中国细胞生物学学报, 2020, 42(4): 682-690. DOI:10.11844/cjcb.2020.04.0016 |
| [38] |
YAN T L, XU J Y, CHEN T, et al. Effects of PM2.5 and O3 sub-chronic combined exposure on ATP amount and ATPase activities in rats nasal mucosa[J]. J Peking Univ (Health Sci), 2024, 56(4): 687-692. 阎腾龙, 胥嘉钰, 陈田, 等. 亚慢性PM2.5和O3共同暴露对大鼠鼻黏膜ATP总量及ATP酶活性的影响[J]. 北京大学学报(医学版), 2024, 56(4): 687-692. DOI:10.19723/j.issn.1671-167X.2024.04.023 |
 2025, Vol. 33
2025, Vol. 33


