快速的工业化、城市化和农业发展导致了显著的氮沉降,欧洲和北美地区在20世纪80年代氮沉降的峰值就已达到115 kg N/(hm2·a)[1]。一方面,氮沉降会为植物生长提供一定的施肥效应,另一方面,氮沉降也会改变生态系统结构和功能,影响生态系统碳循环[2–3]。根系是植物吸收养分和水分的重要器官,在陆地生态系统的碳和养分循环中发挥着至关重要的作用[4]。在全球氮沉降加剧的背景下,植物根系会对土壤氮有效性的变化产生可塑性响应[5],是植物对环境变化适应能力最直接的体现, 因此,长期氮沉降背景下,植物根系如何响应已成为生态学家关注的研究热点之一[6–7]。
根系生物量及其分布情况决定了植物获取资源的能力,体现植物对环境的适应力与对环境中养分的竞争力[8],并且植物在氮添加的背景下会主动协调地上与地下部分生物量的分配[9]。目前对于氮添加如何影响根系生物量的研究结果并不一致,有研究表明氮添加会显著增加根系生物量, 这种变化会随着氮添加浓度的增加而增加, 施氮会改变所选研究区的贫瘠土壤的养分状况,进而改变植物生长环境,促进植物根系生物量的增加[10]。但也有研究表明根系生物量因为氮添加而下降,其原因是细根生物量会在养分有效度梯度上保持相对恒定以保证细根周转率随养分有效度的增加而增加[11–12],从而促进植物生长。研究氮添加会对根系生物量产生何种影响将有助于了解在氮沉降背景下碳储量和碳循环的响应模式。不同径级的根系在植物生长过程中承担着不同的功能,一般认为,细根主要承担养分吸收功能而粗根主要承担养分运输功能,氮添加对不同径级的根系会产生不同的影响[13]。Meta分析也证实,在热带、亚热带地区氮添加对细根生物量没有显著影响,但会提高粗根生物量,从而增加总根系生物量[4]。因此,在氮添加对根系生物量的研究中要分别对不同径级的根系进行分析,从而揭示一定的规律。
长期氮沉降会影响根系生物量及其分布特征, 根系沿土壤深度的垂直分布格局是了解森林生态系统物质流动的有用信息。根系生物量的垂直分布格局通常用根系生物量消减系数β来表征[14]。有研究结果表明,土壤养分与根系生物量消减系数β呈正相关,因此土壤养分可能是根系生物量垂直分布的主要控制因素[15]。本文研究长期氮添加对于不同径级及不同土层的根系生物量分配的影响,有助于进一步了解氮添加对植物资源获取策略和森林生态系统生产力的影响。
植物为了适应大气氮沉降的增加,也会通过改变细根形态特征来平衡森林的养分吸收和运输[16]。细根比根长、比表面积和组织密度是衡量细根资源分配和养分吸收的重要参数。比根长和组织密度之间存在着一种权衡关系,说明了细根在养分获取方面存在着一种快速获取资源型策略或保守型获取资源策略的权衡关系。研究表明,2 a的N添加会显著增加细根比根长,以提高养分获取能力[17]。但长期的N添加并没有改变比根长反而降低组织密度, 这是由于组织密度较低的细根根尖较年轻, 营养吸收效率较高,更倾向于依赖自身结构获取养分[18]。因此,根系在氮沉降背景下都更倾向于提升自身的养分获取能力,主要是通过改变根系的形态特征。目前的研究主要集中于同一树种,针对于氮沉降背景下群落水平上根系的响应还鲜有报道。
我国氮沉降的格局呈现出由东南向西北逐渐减少的趋势,热带亚热带地区的氮沉降显著高于其他地区[19]。近年来我国亚热带地区氮沉降的影响逐渐受到关注,氮沉降对亚热带地区森林生态系统的研究也逐步开展[3],在亚热带氮沉降背景下,根系作为养分获取的主要策略,将会作何响应?亚热带天然常绿阔叶林中物种多样性丰富,并且生态系统较为稳定[20]。本文主要探究在长期氮沉降背景下, 不同径级的根系形态特征的差异以及根系生物量在不同直径、不同土层的分布特征,这为了解亚热带常绿阔叶林的根系生物量和形态特征如何响应长期氮沉降提供基础,为理解氮沉降背景下生态系统的碳氮循环过程提供科学依据。
1 材料和方法 1.1 研究区概况本研究试验样地在福建三明森林生态系统国家野外科学观测研究站的常绿阔叶林长期模拟氮沉降试验地,位于福建省三明市莘口镇格氏栲自然保护区(26°11′ N,117°28′ E)内。该地区为中亚热带季风气候,年均温19.5 ℃,年均降雨量约1 700 mm。试验地乔木层树种主要为米槠(Castanopsis carlesii)、杜英(Elaeocarpus decipiens)和马尾松(Pinus massoniana)等,林下倒木、枯立木较多,枯枝落叶层厚约5~8 cm, 土壤为花岗岩发育的红壤。
1.2 方法本试验依托2011年7月建立的常绿阔叶林长期模拟氮沉降试验样地。中国东部地区氮沉降达到38.9 kg N/(hm2·a)[21],本研究设置对照(CK)和氮添加处理(N),分别为0和80 kg N/(hm2·a),氮添加处理是自然氮水平的2倍。每个处理设立4块重复样地,样方大小为20 m×20 m。从2012年10月开始施氮,每次施氮时间安排在每月月初,1年12次喷洒,每块样地用喷雾器喷洒20 L NH4NO3溶液,对照样地喷洒等量的去离子水,按照小区进行喷洒以保证均匀。
1.3 根系取样和处理本试验于2021年6月开展细根和土壤取样, 采用土芯法。使用内径为5 cm的土钻,钻取深度1 m,钻取位置为每块样地核心区规律均匀分布的8根微根管附近,土芯编号对应微根管编号。于实验室内将各土芯的0~10、10~20、20~40、40~60、60~80和80~100 cm土层中的根系分别全部挑出,获取的根系均用去离子水清洗,根据根的颜色、外形等区分活根和死根,将死根去除,活根按0~1、1~2和2~5 mm分为3个径级。由于本次取样不对树种进行区分, 所获得的根系样品混合在一起并使用根系扫描仪(EPSON V370)扫描。扫描后的图像用Win-RHIZO (Pro 2009b)根图像分析软件获取细根形态指标。之后将根系样品于65 ℃烘箱烘干48 h后称重,获取细根生物量数据,计算比根长(cm/g)=根长/干重, 比根表面积(cm2/g)=根表面积/干重,根组织密度(g/cm3)=干重/根体积,细根生物量密度(g/m3)=细根质量×106/[π(土钻内径/2)2×土钻长度],根系生物量消减系数(β)被认为是一个指示根系垂直分布的指标,β值越高,根系分布越深,β值越低,根系分布越浅[22],根据公式Y=1-βd[14]计算,式中,Y为累积比, 为地表到深度d的根系生物量比例;d为土层深度。
1.4 土壤理化性质测定土芯中的根系挑出来后,将同一样地相同土层8个土芯混合均匀,取1/4的新鲜土壤,清除凋落物、石块、小动物残体后过2 mm筛,取100 g土壤自然风干。其余置于冰箱冷藏用于测定理化性质;土壤pH用pH计(Starter 300, OHAUS, 美国)测定;土壤铵态氮和硝态氮含量用KCl溶液浸提; 土壤速效磷含量用酸解法,用流动分析仪(Scalar Scan++, Scalar, 荷兰)测定;土壤总碳、总氮含量用碳氮元素分析仪(VARIO ELIII Element Analyzer, 德国)测定。
1.5 数据分析利用SPSS 21.0对数据进行统计分析,用混合线性模型检验氮添加、径级和土层的交互作用对细根形态和生物量的影响;利用混合线性模型检验氮添加和土层对土壤理化性质包括矿质氮、速效磷、总碳、总氮、总磷的影响,显著性水平设为P < 0.05。图中数据均为平均值和标准误差。利用Origin 2021软件绘图,利用R语言4.3.1对根系生物量数据进行处理并绘制根系生物量散点图。
2 结果和分析 2.1 氮添加对土壤因子的影响混合线性模型结果表明,氮添加(N)会显著增加矿质氮含量(P < 0.05),但N处理对速效磷、总碳、总氮、总磷含量均无显著影响(P < 0.05)(图 1, 2)。土层会对矿质氮、速效磷、总碳、总氮和总磷含量产生显著负影响,矿质氮、速效磷、总碳、总氮含量均在0~10 cm土层最高,随土层深度而减少,其中总碳含量随土层深度持续减少,而40~60和80~100 cm土层间的矿质氮、速效磷、总氮含量没有显著差异。与表层0~20 cm土壤相比,40~60和80~100 cm土层土壤总磷含量更低。
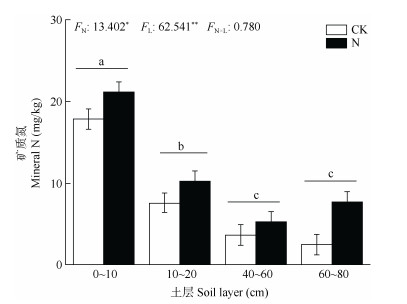
|
图 1 氮添加对土壤矿质氮含量的影响。CK: 对照; N: 氮添加; L: 土层; 柱上不同字母表示差异显著(P < 0.05)。*: P < 0.05; **: P < 0.01。下同 Fig. 1 Effects of nitrogen addition on soil mineral nitrogen content. CK: Control; N: Nitrogen addition; L: Soil layer. Different letters upon column indicate significant difference at 0.05 level. *: P < 0.05; **: P < 0.01. The same below |

|
图 2 氮添加对土壤的总磷、总氮、总碳、速效磷含量的影响 Fig. 2 Effects of nitrogen addition on contents of total P, total N, total C and available P in soil |
氮添加和径级交互不会对根系生物量产生显著影响,但径级会对根系生物量产生显著影响(表 1)。N添加与否,0~1 mm径级的根系生物量都显著高于1~2和2~5 mm径级的,径级和土层的交互作用对根系生物量有显著影响(图 3)。0~1 mm径级下,根生物量随土层深度呈先增加后下降的驼峰型变化趋势,1~2和2~5 mm径级下,根生物量随土层深度呈先下降后增加的U型变化趋势,但CK和N添加2条线的变化趋势相同,因此两者间不存在显著差异(图 4, 表4)。氮添加和径级的交互作用都对根系生物量消减系数(β)没有显著影响(图 5)。
| 表 1 N添加、径级、土层及其交互作用对细根形态和根系生物量密度的影响(F值) Table 1 F value of N addition, diameter classes, soil layers and their interactions on fine root morphology and root biomass density |
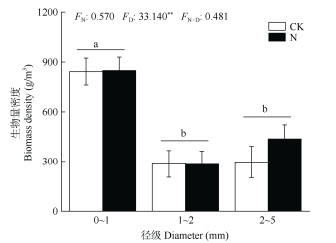
|
图 3 N添加对根生物量密度的影响 Fig. 3 Effect of N addition on root biomass density |
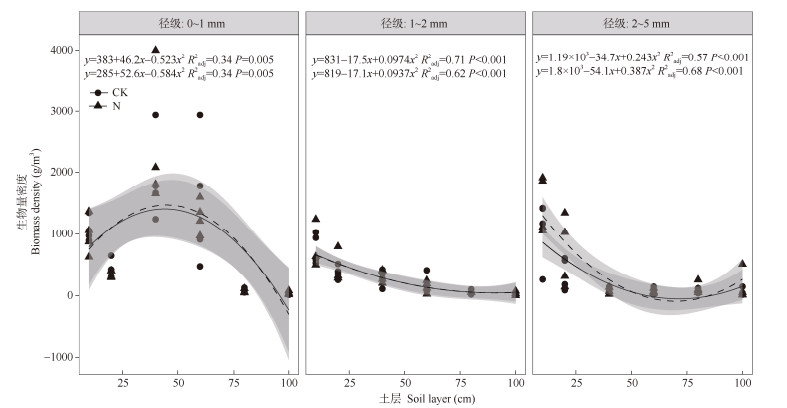
|
图 4 根系生物量的拟合线性模型 Fig. 4 Fitting linear model of root biomass |
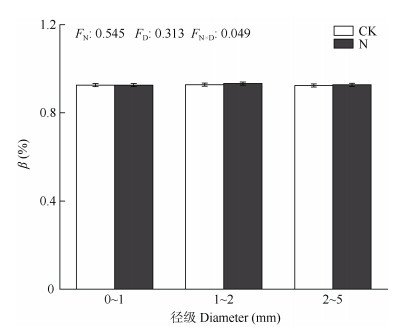
|
图 5 氮添加对根系消减系数(β)的影响 Fig. 5 Effect of N addition on the regression coefficient (β) |
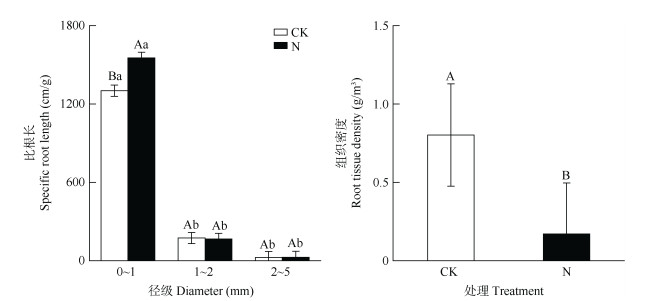
氮添加、土层和径级间的交互作用均对比根长、比表面积和组织密度没有显著影响(表 1)。氮添加和径级的交互作用对比根长有显著影响,氮添加处理会显著增加0~1 mm径级的比根长。氮添加的根组织密度会显著减小(图 6),氮添加对比表面积没有显著影响。径级和土层的交互作用会对细根比根长和比表面积产生显著差异,且径级和土层也分别会对细根比根长和比表面积有显著影响。
|
图 6 氮添加对根组织密度和比根长的影响。柱上不同小写和大写字母分别表示不同径级和不同处理间存在显著差异(P < 0.05)。 Fig. 6 Effect of N addition on tissue density and root length. Different small and capital letters indicate significant difference among different diameter classes and different treatments at 0.05 level, respectively. |
植物根系的生物量占植物总生物量的16%~63%, 并且根系生物量在空间上的分布决定植物获取资源的能力,因此根系生物量在植物获取养分能力和维持地上部分的生长中起着重要作用[23]。目前对于氮添加如何影响根系生物量存在很大争议[24]。刘欢等[25]对1 a生杉木(Cunninghamia lanceolata)幼苗采用盆栽试验并进行指数施肥,总周期为200 d, 期间施肥20次, 研究结果表明,施肥显著增加苗高、地径和生物量,促进植物生长。鲁显楷等[26]研究表明4 a的氮添加显著增加杉木的细根生物量,并且会随着氮添加浓度的增加而增加,这主要是由于施氮增加了杉木幼树的树高和胸径,为满足地上部分的生长,植物根系的生物量也会相对增加。Wang等[28]研究表明,2 a不同程度的施氮处理均未显著增加根系的总生物量,可能是由于不同树种的生长特性和施氮时长差异造成。2 a的周期可能时间较短,根系生物量随氮添加的变化不显著。目前关于短周期施氮对生物量的影响居多,而长期氮添加背景下根系生物量如何变化的相关研究有一定意义。本研究的施氮周期长达10 a,氮添加处理对根系生物量没有显著影响。相较于4 a施氮试验选取实验对象为针叶林,本研究中10 a施氮周期选取的树种为阔叶林,Bai等[28]研究表明阔叶林的根系生物量要显著高于针叶林的,施氮可能会改变阔叶林的根系生物量,但其增加或减少的根系生物量未达显著水平。有研究表明,长期氮添加会导致土壤酸化加重,植物受铝毒害威胁的风险加大[29],导致在群落水平上各物种之间对碳同化增加的生物量具有一定的抵消作用,从而各物种总体的生物量变化不显著。本研究表明氮添加并没有对根系生物量消减系数β产生显著影响,因此长期的氮添加没有改变根系生物量的分布特征。氮肥是作物生长必须的营养元素, 并且氮的浓度会对根系生物量的垂直分布产生影响。氮添加可以减轻表层土壤的养分限制,因此会减少对表层细根的投入,降低表层的生物量,施氮会增大根系生物量消减系数β,进一步说明生物量向更深的土层分布[30–31]。这与本研究结果不一致, 由于根系生物量在土壤垂直分布上的变化会受到土壤养分有效性、土壤因子、环境因子、林龄等的影响[32]。本研究在氮添加的背景下,速效磷、总氮和总碳含量都随土层逐渐减少,这正与根系生物量在土层间的分布特征一致。目前,很少有研究揭示根系垂直分布对氮沉降的响应,阐明氮沉降对不同土层根系生物量的影响将有助于准确评价地下碳动态[33]。
3.2 氮添加对细根形态特征的影响氮添加会首先引起土壤中的氮养分变化进而影响细根的形态特征,如比根长会随氮添加浓度的增加而增大, 从而优化自身吸收养分的能力[34]。许多研究表明不同径级根系所吸收养分的能力存在差异[35–36]。一般而言,0~1 mm径级细根对养分变化响应更为敏感[37],这与本研究结果一致,氮添加显著提高0~1 mm径级细根的比根长。这主要是由于氮添加会显著增加土壤中的矿质氮的含量,因此细根会改变自身的比根长来提升养分获取能力,而0~1 mm径级的细根的养分吸收能力最强。由于细根的长度与氮添加持续时间呈正相关[38],因此长期氮沉降背景下的根系会变得更长、更细来增加与土壤的接触面积,加快氮养分的交换速率,以应对未来长期氮沉降的挑战[18]。有研究表明,氮添加处理下,细根的组织密度会降低,但比根长会增加,根系的资源获取策略会向快速获取资源的策略转变[16, 39]。长期氮添加处理会引起常绿阔叶林群落中植物物种组成发生变化,导致拥有高组织密度的保守型根性状的物种丰度减少,而有利于拥有获取型根性状的物种丰度增加,从而在群落水平上导致细根形态性状发生适应氮有效性增加的变化。本研究氮添加与土层的交互作用并没有对细根形态特征产生显著影响,因为土壤矿质氮和速效磷随土层变化的趋势在对照和氮添加处理间无显著差异,而细根的形态特征与土壤中的养分变化密切相关。这也可能解释了细根形态特征随土层变化的趋势不受氮添加影响这一现象。本文综合分析模拟氮沉降对亚热带常绿阔叶林细根形态特征的影响,弥补了过去对亚热带地区氮沉降如何影响根系形态特征的缺失,为揭示大气氮沉降对常绿阔叶林结构和功能的影响提供新的地下视角。但本研究仅仅将不同物种的根系混合一起,而并未做出物种的区分,只能在群落水平上表征一种整体的变化趋势,可能并不能准确解释氮添加对不同物种的根系形态特征的影响机制。为进一步真实反映长期氮沉降对天然常绿阔叶林变化的影响,因此在之后的研究中应该将不同物种及其根系性状联系起来,这将成为探索氮添加对根系综合影响的关键。
综上,在长期的氮沉降背景下,根系的比根长和组织密度会发生显著变化,由此改变根系的养分获取策略,更好的适应环境变化。相较于形态特征,根系的生物量变化不显著,其主要随着土层逐渐降低,与土壤中的养分变化趋势一致。这表明亚热带常绿阔叶林长期氮沉降会通过改变根系生物量和形态特征影响植物的养分获取策略,甚至改变物种组成,保留下能够更好的适应氮有效性变化的物种,从而提升生态系统的生产力。
| [1] |
LIU X J, ZHANG Y, HAN W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459-462. DOI:10.1038/nature11917 |
| [2] |
YU G R, JIA Y L, HE N P, et al. Stabilization of atmospheric nitrogen deposition in China over the past decade[J]. Nat Geosci, 2019, 12(6): 424-429. DOI:10.1038/s41561-019-0352-4 |
| [3] |
VAN GROENIGEN J W, VAN KESSEL C, HUNGATE B A, et al. Sequestering soil organic carbon: A nitrogen dilemma[J]. Environ Sci Technol, 2017, 51(9): 4738-4739. DOI:10.1021/acs.est.7b01427 |
| [4] |
LI W B, JIN C J, GUAN D X, et al. The effects of simulated nitrogen deposition on plant root traits: A meta-analysis[J]. Soil Biol Biochem, 2015, 82: 112-118. DOI:10.1016/j.soilbio.2015.01.001 |
| [5] |
JIA L Q, CHEN G S, ZHANG L H, et al. Plastic responses of fine root morphology and architecture traits to nitrogen addition in ectomycorrhizal and arbuscular mycorrhizal tree species in an evergreen broadleaved forest[J]. Chin J Appl Ecol, 2021, 32(2): 529-537. 贾林巧, 陈光水, 张礼宏, 等. 常绿阔叶林外生和丛枝菌根树种细根形态和构型性状对氮添加的可塑性响应[J]. 应用生态学报, 2021, 32(2): 529-537. DOI:10.13287/j.1001-9332.202102.025 |
| [6] |
LIN S Y, SHAO L J, HUI C, et al. The effect of temperature on the developmental rates of seedling emergence and leaf-unfolding in two dwarf bamboo species[J]. Trees, 2018, 32(3): 751-763. DOI:10.1007/s00468-018-1669-0 |
| [7] |
SONG Z P, HOU J H. Provenance differences in functional traits and N: P stoichiometry of the leaves and roots of Pinus tabulaeformis seedlings under N addition[J]. Glob Ecol Conserv, 2020, 21: e00826. DOI:10.1016/j.gecco.2019.e00826 |
| [8] |
DU M X, ZHOU X R, ZHOU Z Y, et al. Vertical root distribution characteristics of Amorpha fruticosa on southern Mu Us Sandy Land[J]. Acta Pratacult Sin, 2014, 23(2): 125-132. 杜明新, 周向睿, 周志宇, 等. 毛乌素沙南缘紫穗槐根系垂直分布特征[J]. 草业学报, 2014, 23(2): 125-132. DOI:10.11686/cyxb20140215 |
| [9] |
WANG J, GUAN X, ZHANG W D, et al. Responses of biomass allocation patterns to nitrogen addition of Cunninghamia lanceolata seedlings[J]. Chin J Plant Ecol, 2021, 45(11): 1231-1240. 王娇, 关欣, 张伟东, 等. 杉木幼苗生物量分配格局对氮添加的响应[J]. 植物生态学报, 2021, 45(11): 1231-1240. DOI:10.17521/cjpe.2021.0135 |
| [10] |
ZHANG R, WANG Y, JIN G Q, et al. Nitrogen addition affects root growth, phosphorus and nitrogen efficiency of three provenances of Schima superba in barren soil[J]. Acta Ecolo Sin, 2013, 33(12): 3611-3621. 张蕊, 王艺, 金国庆, 等. 施氮对木荷3个种源幼苗根系发育和氮磷效率的影响[J]. 生态学报, 2013, 33(12): 3611-3621. DOI:10.5846/stxb201210191453 |
| [11] |
HERMANS C, HAMMOND J P, WHITE P J, et al. How do plants respond to nutrient shortage by biomass allocation?[J]. Trends Plant Sci, 2006, 11(12): 610-617. DOI:10.1016/j.tplants.2006.10.007 |
| [12] |
SON Y, HWANG J H. Fine root biomass production and turnover in a fertilized Larix leptolepis plantation in central Korea[J]. Ecol Res, 2003, 18(3): 339-346. DOI:10.1046/j.1440-1703.2003.00559.x |
| [13] |
LEI P F, SCHERER-LORENZEN M, BAUHUS J. Belowground facilitation and competition in young tree species mixtures[J]. For Ecol Manage, 2012, 265: 191-200. DOI:10.1016/j.foreco.2011.10.033 |
| [14] |
GALE M R, GRIGAL D F. Vertical root distributions of northern tree species in relation to successional status[J]. Can J For Res, 1987, 17(8): 829-834. DOI:10.1139/x87-131 |
| [15] |
NEWMAN G S, COBLE A A, HASKINS K E, et al. The expanding role of deep roots during long‐term terrestrial ecosystem development[J]. J Ecol, 2020, 108(6): 2256-2269. DOI:10.1111/1365-2745.13444 |
| [16] |
FRESCHET G T, ROUMET C, COMAS L H, et al. Root traits as drivers of plant and ecosystem functioning: Current understanding, pitfalls and future research needs[J]. New Phytol, 2021, 232(3): 1123-1158. DOI:10.1111/nph.17072 |
| [17] |
DING G Q, YU L Z, WANG Z Q, et al. Effects of fertilization on fine root morphology of Larix kaempferi[J]. J NE For Univ, 2010, 38(5): 16-19. 丁国泉, 于立忠, 王政权, 等. 施肥对日本落叶松细根形态的影响[J]. 东北林业大学学报, 2010, 38(5): 16-19. DOI:10.3969/j.issn.1000-5382.2010.05.004 |
| [18] |
GAO W C, CHEN D M, HU X P, et al. Nitrogen deposition drives the intricate changes of fine root traits[J]. Glob Ecol Conserv, 2023, 43: e02443. DOI:10.1016/j.gecco.2023.e02443 |
| [19] |
CAO L, COOPS N C, HERMOSILLA T, et al. Using small-footprint discrete and full-waveform airborne LiDAR metrics to estimate total biomass and biomass components in subtropical forests[J]. Remote Sens, 2014, 6(8): 7110-7135. DOI:10.3390/rs6087110 |
| [20] |
HUANG Q L, LI Y H. A brief review on the research of natural broad-leaved forest in the mid-subtropical zone[J]. J Fujian Coll For, 1999, 19(2): 189-192. 黄清麟, 李元红. 中亚热带天然阔叶林研究综述[J]. 福建林学院学报, 1999, 19(2): 189-192. DOI:10.3969/j.issn.1001-389X.1999.02.024 |
| [21] |
LIU L, XU W, WEN Z, et al. Modeling global oceanic nitrogen deposition from food systems and its mitigation potential by reducing overuse of fertilizers[J]. Proc Natl Acad Sci USA, 2023, 120(17): e2221459120. DOI:10.1073/pnas.2221459120 |
| [22] |
WANG S, HUANG Y, SUN W J, et al. Mapping the vertical distribution of maize roots in China in relation to climate and soil texture[J]. J Plant Ecol, 2018, 11(6): 899-908. DOI:10.1093/jpe/rty015 |
| [23] |
ERKTAN A, MCCORMACK M L, ROUMET C. Frontiers in root ecology: Recent advances and future challenges[J]. Plant Soil, 2018, 424(1/2): 1-9. DOI:10.1007/s11104-018-3618-5 |
| [24] |
RASSE D P. Nitrogen deposition and atmospheric CO2 interactions on fine root dynamics in temperate forests: A theoretical model analysis[J]. Glob Change Biol, 2002, 8(5): 486-503. DOI:10.1046/j.1365-2486.2002.00481.x |
| [25] |
LIU H, WANG C Q, WU J S, et al. Growth and N accumulation in seedlings of Cunninghamia lanceolata clones with N exponential fertilization[J]. J Zhejiang A&F Univ, 2017, 34(3): 459-464. 刘欢, 王超琦, 吴家森, 等. 氮素指数施肥对1年生杉木苗生长及氮素积累的影响[J]. 浙江农林大学学报, 2017, 34(3): 459-464. DOI:10.11833/j.issn.2095-0756.2017.03.011 |
| [26] |
LU X K, MO J M, ZHANG W, et al. Effects of simulated atmospheric nitrogen deposition on forest ecosystems in China: An overview[J]. J Trop Subtrop Bot, 2019, 27(5): 500-522. 鲁显楷, 莫江明, 张炜, 等. 模拟大气氮沉降对中国森林生态系统影响的研究进展[J]. 热带亚热带植物学报, 2019, 27(5): 500-522. DOI:10.11926/jtsb.4113 |
| [27] |
WANG G L, LIU F. Carbon allocation of Chinese pine seedlings along a nitrogen addition gradient[J]. For Ecol Manage, 2014, 334: 114-121. DOI:10.1016/j.foreco.2014.09.004 |
| [28] |
BAI W M, GUO D L, TIAN Q Y, et al. Differential responses of grasses and forbs led to marked reduction in below-ground productivity in temperate steppe following chronic N deposition[J]. J Ecol, 2015, 103(6): 1570-1579. DOI:10.1111/1365-2745.12468 |
| [29] |
ZHANG Z L, LIU G D, ZHANG F C, et al. Effects of nitrogen content on growth and hydraulic characteristics of peach (Prunus persica L.) seedlings under different soil moisture conditions[J]. J For Res, 2014, 25(2): 365-375. DOI:10.1007/s11676-014-0464-z |
| [30] |
ELAZAB A, SERRET M D, ARAUS J L. Interactive effect of water and nitrogen regimes on plant growth, root traits and water status of old and modern durum wheat genotypes[J]. Planta, 2016, 244(1): 125-144. DOI:10.1007/s00425-016-2500-z |
| [31] |
WANG C Y, LIU W X, LI Q X, et al. Effects of different irrigation and nitrogen regimes on root growth and its correlation with above-ground plant parts in high-yielding wheat under field conditions[J]. Field Crops Res, 2014, 165: 138-149. DOI:10.1016/j.fcr.2014.04.011 |
| [32] |
YU P, WHITE P J, HOCHHOLDINGER F, et al. Phenotypic plasticity of the maize root system in response to heterogeneous nitrogen availability[J]. Planta, 2014, 240(4): 667-678. DOI:10.1007/s00425-014-2150-y |
| [33] |
GENG Q H, MA X C, LIAO J H, et al. Contrasting nutrient-mediated responses between surface and deep fine root biomass to N addition in poplar plantations on the east coast of China[J]. For Ecol Manage, 2021, 490: 119152. DOI:10.1016/j.foreco.2021.119152 |
| [34] |
YAN G Y, CHEN F, ZHANG X, et al. Spatial and temporal effects of nitrogen addition on root morphology and growth in a boreal forest[J]. Geoderma, 2017, 303: 178-187. DOI:10.1016/j.geoderma.2017.05.030 |
| [35] |
BURTON A J, JARVEY J C, JARVI M P, et al. Chronic N deposition alters root respiration-tissue N relationship in northern hardwood forests[J]. Glob Change Biol, 2012, 18(1): 258-266. DOI:10.1111/j.1365-2486.2011.02527.x |
| [36] |
YUAN Z Y, CHEN H Y H, REICH P B. Global-scale latitudinal patterns of plant fine-root nitrogen and phosphorus[J]. Nat Commun, 2011, 2(1): 344. DOI:10.1038/ncomms1346 |
| [37] |
MCGRODDY M E, DAUFRESNE T, HEDIN L O. Scaling of C: N: P stoichiometry in forests worldwide: Implications of terrestrial Redfield-type ratios[J]. Ecology, 2004, 85(9): 2390-2401. DOI:10.1890/03-0351 |
| [38] |
WANG J, WANG G X, FU Y, et al. Short-term effects of nitrogen deposition on soil respiration components in two alpine coniferous forests, southeastern Xizang Plateau[J]. J For Res, 2019, 30(3): 1029-1041. DOI:10.1007/s11676-018-0678-6 |
| [39] |
FRESCHET G T, AERTS R, CORNELISSEN J H C. A plant economics spectrum of litter decomposability[J]. Funct Ecol, 2012, 26(1): 56-65. DOI:10.1111/j.1365-2435.2011.01913.x |
 2025, Vol. 33
2025, Vol. 33



