2. 广西壮族自治区中国科学院广西植物研究所, 广西 桂林 541006
2. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China
植物生态化学计量学是一门主要研究植物组织和器官营养元素含量及动态变化规律的学科[1], 其中叶片生态化学计量特征是该领域的主要研究内容之一。林下植物是森林生态系统中的重要组成部分,扮演着关键角色,对维持森林结构和功能具有重要意义,如调节森林土壤养分和水分循环、减少C固存和N动态过程中温室气体排放等[2]。一般来说,林下植物包括乔木幼树、灌木、草本和藤本等多种生活型[3]。由于系统进化过程、生理生态特征和生长环境的差异,林下不同生活型植物对C、N、P、K、Ca和Mg元素的需求差异会较大[4]。根据生物地球化学生态位假说,不同植物物种会具有独特的营养元素需求,从而形成不同植物物种的化学计量特征生态位[5–6],这可能是植物多样性形成和维持的重要原因之一。因此,研究林下植物叶片元素化学计量特征对于探究森林林下植物多样性的形成和维持有重要的意义。
研究表明,植物叶片生态化学计量特征与系统发育密切相关,这意味着植物叶片生态化学计量特征受系统发育的影响[7]。过去有研究在不同地区的植物中发现了叶片生态化学计量特征有显著的系统发育信号[8–9],这意味着植物叶片化学计量特征在进化过程中存在系统发育保守性,即亲缘关系较近的植物物种具有更相似的叶片生态化学计量特征[8]。然而,一些研究表明不同叶片生态化学计量特征之间的系统发育信号存在不同的显著性水平, Sardans等[10]对欧洲森林树种叶片生态化学计量特征的研究表明,N、K、Ca、Mg等元素含量和P/Ca、K/Ca、P/Mg、K/Mg等比值具有显著的系统发育信号,但P含量和N/P、N/K、P/K、Ca/Mg等比值则没有明显的系统发育信号。这些不同特征间系统发育信号的差异通常与进化过程有关[11]。进化过程的常见描述模型包括布朗运动模型、生态位提升和填充模型、稳定选择模型等[12]。然而,最近的研究表明,叶片化学计量特征的最优进化过程往往向一个或多个最优值的稳定选择演化[13–15],Bai等[15]的研究表明,在亚热带常绿阔叶林,草本植物在进化过程中具有较高的叶片N、P、K含量最优值,相比之下,木本植物的叶片N、P、K含量最优值较低。在稳定选择过程中, 亲缘关系较远的物种叶片生态化学计量特征会围绕最优值波动,导致亲缘关系远的物种也具有相似的叶片化学计量特征,从而削弱了系统发育信号。此外,在叶片化学计量特征进化过程中,某些元素含量之间存在协同进化关系。叶片N和P含量常常在系统发育上呈显著正相关,表明这2种元素在植物物种多样化过程中存在显著的协同演化关系[15–16]。因此,研究叶片化学计量特征与系统发育的关系需要综合考虑叶片化学计量特征的系统发育信号、进化过程和特征之间的协同进化等因素。
亚热带常绿阔叶林是一种重要的森林生态系统类型,被认为是全球生物多样性的重要聚集地[17]。该类型森林的一个显著特征是林下植物多样性的主导地位,因为冠层乔木在亚热带森林植物组成中所占比例往往不到20%[17]。然而,过去的研究往往对林下植物多样性关注不够,甚至忽视了其重要性[2]。因此,本研究旨在调查亚热带常绿阔叶林林下乔木幼树、草本、灌木和藤本等各种生活型植物的叶片化学计量特征,分析这些特征在物种多样化过程中的系统发育信号、进化过程以及特征之间的协同进化关系。本研究提出3个科学问题:(1) 林下植物叶片化学计量特征是否受到生活型的显著影响?(2) 林下植物叶片化学计量特征是否有显著的系统发育信号和稳定选择过程?(3) 林下植物叶片化学计量特征是否存在显著的元素协同进化?通过解决这些问题,可以深入了解林下植物物种多样化过程中叶片化学计量特征的演化机制,有助于更好地理解亚热带常绿阔叶林林下植物多样性形成和维持的机制,为保护亚热带森林植物多样性提供理论和实践基础。
1 材料和方法 1.1 研究区概况本研究选取了广西漓江源森林生态系统国家定位观测研究站常绿阔叶林1号样地进行野外调查和采样。该样地位于广西东北部的猫儿山国家级自然保护区,地理位置为25°50′ N,110°49′ E,海拔为950~1200 m[18]。猫儿山保护区是我国南方典型的亚热带山地地区,属于亚热带季风湿润气候, 年均降水量为3 342.0 mm,年均温14.0 ℃[15]。该保护区中常绿阔叶林是分布面积最大的植被类型,也是该区森林植被自然演替系列中的顶级群落类型。常绿阔叶林在维护该地区生态平衡和保护生物多样性等方面起着至关重要的作用。根据本研究对土样的分析结果,调查和取样点土壤pH值为4.55~4.69, 可交换阳离子容量20.06~29.05 me/100 g。土壤中有机质、全N、全P、全K、全Ca和全Mg含量分别为6.61%、0.27%、0.06%、2.34%、0.34%和0.65%。这些数据提供了该样地土壤性质的重要信息,有助于了解林下植物生长的土壤背景。
1.2 叶片样品采集和分析在研究样地的资料和实地踏查的基础上,制定了林下植物叶片样品的采集原则和方法。(1) 乔木幼树选择树高小于2.0 m或胸径小于2 cm的个体; (2) 同种植物采集不少于3株(丛)的样本;(3) 采集叶片不会对植株的生长产生影响或者只造成轻微影响;(4) 每种植物随机选择植株,并从其上、中、下不同部位采集正常、成熟且无病虫害的叶片,每种植物采集的叶片总鲜重约为50 g。
共采集了50种植物的叶片样品, 其中,乔木幼树15种,灌木10种,草本15种,藤本10种(表 1)。叶片样品在烘箱中(恒温65 ℃)烘干至恒重,然后经过粉碎和磨粉后再测定其C、N、P、K、Ca和Mg等营养元素的含量。使用Vario MAX CN元素分析仪测定C和N含量,使用电感耦合等离子体发射光谱技术(iCAP Qc, Thermo Fisher Scientific)测定P、K、Ca和Mg含量[14]。对于每种植物、每个指标重复测定至少3次,取平均值。
| 表 1 采集植物 Table 1 List of collected species |
使用SPSS 22.0软件进行数据的统计分析。首先,检验叶片化学计量特征数据是否符合正态分布,如果数据不符合正态分布,则采用对数转换的方法来使其符合正态分布。参考Sardans等[10]的方法对叶片化学计量特征数据进行主成分分析(PCA), 主成分分析得到的前2个主成分(PC1和PC2)解释了大部分的特征变异。采用单因素方差分析和多重比较检验叶片化学计量特征以及PC1和PC2得分是否受到生活型的显著影响。方差分析结果中如果方差齐性,采用最小显著差异法进行不同生活型的多重比较。如果方差不齐性,则用Tamhane’s T2法进行多重比较。
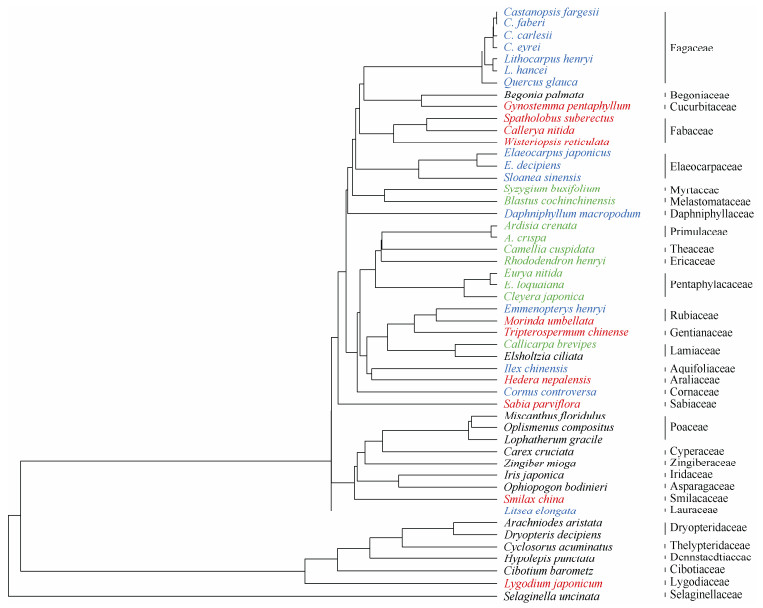
使用R4.2.3软件进行系统发育比较分析。利用V. PhyloMaker包中的Scenario 3构建了50种植物的系统发育树[19](图 1)。对叶片化学计量特征进行一系列的系统发育比较分析。首先,利用Blomberg’s K方法[20]检测性状系统发育信号的显著性。使用PHYLOSIGNAL包中的phyloSignal功能检验系统发育信号[21],通过对系统发育树随机置换999次得到的零模型比较来评估信号。其次,比较叶片化学计量特征的进化模型,包括布朗运动(BM)模型、Pagel’s δ模型和Ornstein-Uhlenbeck (OU)模型。BM是一种随机进化模型,描述物种性状通过随机漫步以恒定速率(即sigma)演化。Pagel’s δ是一种适应性进化模型,描述物种性状进化速率随时间加速或减速,δ值小于1表示性状进化在较早时期爆发(即生态位填充模型),δ值大于1表示性状进化在较晚时期爆发(即生态位提升模型)。使用GEIGER软件包中的fitContinuous函数对BM和Pagel’s δ模型进行拟合[22];使用Caper软件包中的pgls函数检验δ是否与1有显著差异[23]。OU模型也是一种适应性进化模型,描述物种性状在稳定选择作用力(即ɑ)下围绕1个或多个最优值进化。使用mvMORPH软件包中的mvOU函数对所有物种拟合单一最优值(OU1)和4个最优值(OUM), 以检验乔木幼树(OptSa)、灌木(OptSh)、草本(OptH)和藤本(OptC)等生活型之间的最优值是否有所不同。对于BM、Pagel’s δ、OU1和OUM模型的比较是基于经过样本大小校正的赤池信息准则(AICc)[13–14],具有最低AICc值的模型被认为是最适合的。最后,为了检验元素之间的协同进化,利用系统发育广义最小二乘法和系统发育协方差矩阵分析叶片化学计量特征之间的相关性[24]。使用Caper软件包中的pgls函数来检验特征之间相关性的强弱[23]。
|
图 1 亚热带常绿阔叶林林下植物的系统发育关系[19]。蓝: 乔木幼树; 绿: 灌木; 黑: 草本; 红色: 藤本。 Fig. 1 Phylogenetic relationships of understory species ina subtropical evergreen broad-leaved forest[19]. Blue: Tree sapling; Green: Shrub; Black: Herb; Red: Climber. |
从表 2可见,50种林下植物叶片的C、N、P、K、Ca和Mg平均含量分别为417.43、22.86、1.39、11.55、9.83和2.89 g/kg,以C含量最高,P含量最低。叶片的C/N、C/P、C/K、C/Ca、C/Mg、N/P、N/K、N/Ca、N/Mg、P/K、P/Ca、P/Mg、K/Ca、K/Mg和Ca/Mg分别为19.28、342.55、43.90、70.82、203.75、17.78、2.27、3.93、11.50、0.14、0.24、0.68、1.98、5.38和4.03,C/P最大,P/K最小。
| 表 2 林下植物叶片元素含量(g/kg)及其化学计量比值、PC1和PC2得分 Table 2 Leaf element concentrations (g/kg) and their stoichiometric ratios and the PC1 and PC2 scores in understory plants with different life forms |
大部分叶片化学计量特征受到生活型的显著影响。多重比较结果表明,草本的C含量显著低于乔木幼树和灌木,N、K含量显著高于乔木幼树和灌木,Mg含量显著低于乔木幼树和藤本。藤本的K含量显著高于乔木幼树和灌木。化学计量比也在不同生活型间存在显著差异,藤本的C/N、C/K显著低于乔木幼树和灌木,P/K显著低于乔木幼树和草本。草本的C/N、C/K显著低于乔木幼树和灌木,C/P显著低于灌木,但C/Mg、N/Mg、P/Mg、K/Mg显著高于其他3种生活型植物。
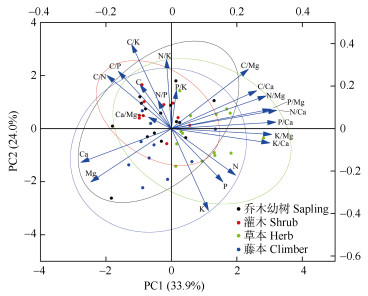
主成分分析结果表明,PC1和PC2分别解释了总方差的33.9%和24.0%,两者合计达57.9% (图 2)。其中,C、Ca和Mg含量以及C/N、C/P、C/K、N/P、N/K和Ca/Mg等与PC1呈负相关;而N、P、K、Ca和Mg含量以及K/Mg、K/Ca与PC2呈负相关。在不同生活型植物中,草本植物的PC1得分与其他3种生活型植物的得分存在差异显著,而藤本植物的PC2得分与乔木幼树、灌木也存在差异显著(表 2)。这进一步表明了不同生活型植物叶片化学计量特征存在明显差异。
|
图 2 林下植物叶片元素含量及其化学计量比值的主成分分析 Fig. 2 Principal component analysis of leaf element concentrations and their stoichiometric ratios in leaves of understory species |
Blomberg’s K检验结果表明,林下50种植物的叶片元素含量及化学计量比的K值均小于1 (表 3)。其中,N、P含量以及C/P、P/Ca、K/Ca呈现显著的系统发育信号(P < 0.05),而C、K、Ca和Mg含量和其他12个化学计量比则无显著的系统发育信号。
| 表 3 林下植物叶片元素含量及其化学计量比的系统发育信号 Table 3 Phylogenetic signal of leaf element concentrations and their stoichiometric ratios of understory species |
进化模型拟合结果表明,50种植物叶片元素含量在BM模型、OU1模型、OUM模型和Pagel’δ模型中的AICc平均值分别为23.17、-50.18、-56.97和-44.03 (表 4)。OUM模型的AICc值最小,而BM模型的AICc值最大,表明OUM模型是最佳拟合模型,而BM模型则是最差的拟合模型。
| 表 4 林下植物叶片元素含量的进化模型拟合结果 Table 4 Fitting results of evolutionary models for leaf element concentrations of understory species |
BM模型的sigsq值为0.000 20~0.005 85,OU1模型的α值为14.5~13 846.5,Pagel’δ模型的δ值为29.4~118.4,表明叶片元素含量在不同进化模型中的进化速率差异很大。在OUM模型下,叶片C含量的OptSa较高,N、P含量的OptH较高,K、Ca、Mg含量的OptC较高。这意味着乔木幼树有较高的叶片C含量最优值,草本植物有较高的叶片N、P含量最优值,而藤本植物有较高的叶片K、Ca、Mg含量最优值,反映了不同生活型植物在进化上围绕不同的叶片元素含量最优值波动。
由表 5可见,叶片元素含量间的相关性强度存在差异。C含量与P含量呈显著强相关;N含量与P、K含量呈强相关;P含量与K、Mg含量呈强相关;K含量与Mg含量呈强相关;Ca和Mg含量呈强相关。但C含量与N、K、Ca、Mg含量之间呈弱相关;N含量与Ca、Mg含量之间呈弱相关;P含量与Ca含量之间呈弱相关;K含量与Ca含量之间呈弱相关。
| 表 5 叶片元素含量间相关性的系统发育广义最小二乘回归分析 Table 5 Phylogenetic generalized least squares regression analyses for the correlations among leaf element concentrations |
本研究表明,林下不同生活型植物的叶片C、N、K、Mg含量及C/N、C/P、C/K、C/Mg、N/Mg、P/K、P/Mg、K/Mg存在显著差异,说明不同生活型植物的生长和进化对不同元素含量的需求存在明显差异,这与前人的研究结果一致,Bai等[15]对亚热带山地常绿阔叶林的研究表明,草本植物和木本植物的元素含量存在显著差异[15],这可能反映了不同生活型的林下植物在元素利用策略和生态适应性上存在差异。
草本植物与其他3种生活型的植物在叶片元素含量方面存在较大的差异。草本植物的N、K含量显著高于乔木幼树和灌木植物,C和Mg含量显著低于乔木幼树。同时,C、Mg含量也分别显著低于灌木植物和藤本植物。生命周期较短、生长速率较快的植物叶片元素含量往往高于生命周期较长、生长速率较慢的植物,此外,生长速度快的部位通常P含量相对较高而N/P、C/P相对较低,即生长速率假说[1, 25]。草本植物中较高的N、K含量可能是因为其生命周期较短,生长速率较快,同时,草本植物相对较高的P含量和相对较低的N/P、C/P值也支持了生长速率假说。根据Saura-Mas等[26]的研究,当植物受到破坏(例如被啃食或践踏)后,新产生的体细胞壁会较薄从而导致植物的C含量降低,而草本植物植株矮小,地上结构较不持久等特征使得其更加容易受到影响[27],所以食草动物啃食可能也是草本植物C含量较低的原因之一[26]。此外,草本植物中较低的Ca和Mg含量可能是由于所采集的草本植物多数为禾本目(Poales)和水龙骨目(Polypodiales),已有研究证明这2个目的植物Ca、Mg含量偏低[28–29]。
适宜植物生长的N、P、K、Ca、Mg元素含量分别为15~40、2~5、5~40、0.5~10、1.5~3.5 mg/g[30]。本研究表明,所有植物的N和K含量、乔木幼树、灌木、草本的Mg含量及灌木和草本植物的Ca含量均在上述范围之内,因此可以满足其生长需求。乔木幼树和藤本植物的Ca含量以及藤本植物的Mg含量略高,但并未达到具有毒性的临界含量(Ca > 100 mg/g,Mg > 15 mg/g)。这表明略高的Ca、Mg含量可能会对它们的生长产生一定的限制,但并未严重到影响植物的存活[31]。然而,所有植物的P含量都低于它们的适宜生长P含量要求,这表明P会对林下不同生活型植物的生长产生限制作用[15]。
在一定程度上,叶片元素化学计量特征能够反映植物的资源获取策略[32],并且可以揭示植物的营养利用效率。比如,C/N和C/P值表示植物叶片吸收单位营养后能够将其转化为C的能力[33]。C/N和C/P值越大,表明植物对N、P元素的利用效率越高[34]。在本研究中,灌木的C/N值高于全球平均水平,而乔木幼树、草本和藤本植物的C/N值均低于全球平均水平;4种生活型植物的C/P值均高于全球平均水平[35]。这表明相比全球植物,本研究中的灌木N利用效率较高,而乔木幼树、草本和藤本植物N利用效率较低,但不同生活型植物的P利用效率都较高[34]。这种较高P利用效率可能表明P元素在植物生长中起到限制作用[36]。N/P值可以用来确定植物叶片生长受到营养元素限制的程度。当N/P小于14时,植物生长主要受到N限制;当N/P大于16时,植物生长主要受到P限制[37]。本研究表明4种生活型植物的N/P值均大于16,主要受到P限制。根据其他相关研究,具有较低C/P、N/P的植物可能具有更高的生长速率[1]。本研究草本植物的C/P值最低,乔木幼树N/P值最低,表明亚热带常绿阔叶林林下环境中,草本植物和乔木幼树具有较高的生长速率。
许多研究表明,在亚热带森林环境中,植物的生长通常受到P限制。本研究的多角度叶片化学计量特征分析得出了与前人一致的结果[38]。这可能是由于在酸性土壤中(样地土壤pH值4.55~4.69),P元素容易与Fe、Al元素结合,导致植物对P元素的吸收率降低[38]。
3.2 林下植物生态化学计量特征的进化本研究结果表明,4种生活型的林下植物叶片元素含量及其比值的K值均为0~1,可采用随机模拟来比较系统发育信号与实际观察之间的差异[39]。结果表明N含量和P含量的系统发育信号的显著性小于0.05,系统发育信号显著,表明在林下植物的进化过程中,这2种营养元素的相似性与系统发育相关性之间存在一定的正向关系[15]。然而,其他元素如C、K、Ca和Mg含量的系统发育信号却都不显著。另外,林下植物的化学计量比除C/P、P/Ca、K/Ca呈现显著的系统发育信号外,均无显著的系统发育信号,这表明不同叶片化学计量特征的系统发育信号保守性存在差别。
植物叶片化学计量特征在进化过程中具有系统发育保守性,意味着亲缘关系越近的物种应该比亲缘关系疏远的物种叶片生态化学计量特征相似性更高[8]。在本研究中,N、P含量和C/P、P/Ca、K/Ca具有系统发育保守性,因此亲缘关系越近的林下植物叶片N、P含量和C/P、P/Ca、K/Ca会越接近。
然而,前人的研究表明,不同的气候环境和土壤条件以及物种间的竞争相互作用可能会综合影响叶片元素含量的系统发育信号显著性[7]。C、K、Ca和Mg含量以及其他12个化学计量较弱的系统发育信号,可能表明它们在某些非生物因素影响下,产生了一定的趋同效应,使得亲缘关系较远的物种表现出了相似的植物性状,从而呈现出较弱的系统发育信号[7, 40]。
在几种进化模型中,BM模型的AICc值平均最高,因此无法有效解释植物系统发育过程中的变化。这也表明,林下植物的叶片元素含量不会以单一速率在进化过程中无限制变化,即植物元素含量不会趋向于极端值(比如0或接近无穷大)[7, 41]。因此,植物元素含量可能会在进化出最适宜生长的组成和比例后逐渐趋于稳定。在所有进化模型中, OUM模型的平均AICc值最低,因此是最佳的进化模型。在OUM模型下,C含量的OptSa较高,N、P含量的OptH较高,K、Ca、Mg含量的OptC较高,这表明乔木幼树在进化上选择了较高的叶片C元素含量最优值,这可能和乔木幼树的干物质积累有关[42]。草本植物选择了较高的叶片N、P含量最优值,这可能是因为草本植物生长速度快,生命周期短,故需要N元素帮助加快生长速度和P元素帮助繁衍后代,这和前人[43]的研究结果类似。藤本植物选择了较高的叶片K、Ca、Mg含量最优值,这可能是藤本植物为了通过K元素扩大气孔开放进而促进光合作用[44],同时Ca、Mg元素可以帮助维持叶片细胞壁化学的稳定性[45]。不同生活型的植物选择不同元素含量的最优值以进化出不同的生理特性,从而达到增加自身竞争优势的目的。物种的进化过程能够决定物种竞争能力的相似性,如果物种能够进化出不同的生理特性,那么他们的竞争能力相似性会相对更高,这使得物种间发生竞争排斥的几率会更低,从而在补偿作用下,实现不同生活型的植物物种多样化[46]。对于同一生活型植物多样化的原因, 我们推测可能是在亚热带季风性气候的影响下,林下环境除光照外的环境资源(水分、温度等)会出现比较明显的季节性变化[47]。由于不同植物物种对不同环境资源有着不同的需求程度,它们的开花物候、结实物候等可能在时间生态位上产生了一定程度的分化[47]。肉果型植物和干果型植物由于对环境水分需求的不同,在结果物候上会产生差异[47]。而由于物候分化,植物物种间对资源的竞争会在时间维度上有所减弱。这可能是同一生活型植物能够实现物种多样化的原因之一[47]。
在OU1模型下,系统发育惯性(ɑ值)可以使叶片元素含量维持在最佳组合的范围内,可以作为一个进化过滤器来排除叶片元素组成不适宜生长的植物[15]。本研究中,α值为14.5~13 846.5,与布朗过程相比,α值越大,沿着系统发育树分支的性状进化速率越快[7],同时维持元素含量的稳定选择强度也越大。这种稳定选择强度大的趋势对植物很重要,因为它有助于叶片元素含量维持在较好的状态,从而帮助植物适应特定环境并生存下去[15]。本研究结果表明,N含量的α值最小,K含量的最大,C含量也较大,这说明该亚热带常绿阔叶林中,林下植物物种维持N含量的稳定选择强度较低,这使得N含量在植物生长过程中相对不够稳定。而维持C、K含量的稳定选择强度更高,这使得C、K含量能够在植物生长过程中以较快的速度适应环境条件并得到更好的维持[15, 48]。在Pagel’δ模型下, 当δ值小于1.0时,说明物种性状在进化早期变化更快,而后期逐渐趋于稳定(即生态位填充模型)。当δ值大于1.0时,意味着在物种进化过程中,晚期进化对物种性状的贡献更大(即生态位提升模型)[49]。在本研究中,6种营养元素含量的δ值均大于1.0, 这表明物种晚期进化在物种进化过程中的影响较早期更为显著。
另外,叶片元素含量之间的相关性强度不同, 比如C含量与P含量呈显著强相关;但与N、K、Ca、Mg含量之间呈弱相关;N含量与P、K含量呈强相关,但与Ca、Mg含量之间呈弱相关;P含量与K、Mg含量呈强相关,但与Ca含量之间呈弱相关;K含量与Mg含量呈强相关,但与Ca含量之间呈弱相关等。元素含量之间的强相关性表明在植物生长进化过程中,营养元素之间的协调进化可能存在系统发育效应[14, 50]。
本研究通过对不同生活型林下植物的叶片元素含量及化学计量比的分析发现,亚热带常绿阔叶林林下植物在生长过程中受到P限制。同时还发现叶片化学计量特征在不同生活型的植物间存在显著差异,这从一定程度上解释了生活型多样化的这一现象。通过进一步对叶片化学计量特征系统发育和进化过程的探索,发现了不少叶片元素含量及比值有显著的系统发育信号,表明亲缘关系近的物种具有某些相似的叶片化学计量特征。本研究发现OUM模型是最佳进化模型,这表明不同生活型植物在进化过程中会稳定选择叶片元素含量最优值, 使得植物表现出了不同的化学计量特征和生理特性,从而在竞争中得以存活。本研究证实了亚热带林下植物物种多样化过程中存在叶片生态化学计量特征系统发育保守性和不同生活型植物围绕最优叶片元素含量值的稳定选择,这2种驱动力推动了亚热带常绿阔叶林林下植物多样性的形成和维持。
| [1] |
STERNER R W, ELSER J J. Ecological Stoichiometry: The Biology of Elements from Molecules to the Biosphere[M]. Princeton: Princeton University Press, 2002.
|
| [2] |
DENG J J, FANG S, FANG X M, et al. Forest understory vegetation study: Current status and future trends[J]. For Res, 2023, 3(1): 6. DOI:10.48130/fr-2023-0006 |
| [3] |
BARTELS S F, CHEN H Y H. Interactions between overstorey and understorey vegetation along an overstorey compositional gradient[J]. J Veg Sci, 2013, 24(3): 543-552. DOI:10.1111/j.1654-1103.2012.01479.x |
| [4] |
DE LA RIVA E G, VILLAR R, PÉREZ-RAMOS I M, et al. Relationships between leaf mass per area and nutrient concentrations in 98 Mediterranean woody species are determined by phylogeny, habitat and leaf habit[J]. Trees, 2018, 32(2): 497-510. DOI:10.1007/s00468-017-1646-z |
| [5] |
PEÑUELAS J, SARDANS J, OGAYA R, et al. Nutrient stoichiometric relations and biogeochemical niche in coexisting plant species: Effect of simulated climate change[J]. Pol J Ecol, 2008, 56(4): 613-622. |
| [6] |
PEÑUELAS J, FERNÁNDEZ-MARTÍNEZ M, CIAIS P, et al. The bioelements, the elementome, and the "biogeochemical niche"[J]. Ecology, 2019, 100(5): e02652. DOI:10.1002/ecy.2652 |
| [7] |
BAI K D, LV S H, NING S J, et al. Leaf nutrient concentrations associated with phylogeny, leaf habit and soil chemistry in tropical karst seasonal rainforest tree species[J]. Plant Soil, 2019, 434(1/2): 305-326. DOI:10.1007/s11104-018-3858-4 |
| [8] |
PEÑUELAS J, SARDANS J, LLUSIÀ J, et al. Faster returns on 'leaf economics' and different biogeochemical niche in invasive compared with native plant species[J]. Glob Chang Biol, 2010, 16(8): 2171-2185. DOI:10.1111/j.1365-2486.2009.02054.x |
| [9] |
SARDANS J, ALONSO R, CARNICER J, et al. Factors influencing the foliar elemental composition and stoichiometry in forest trees in Spain[J]. Perspect Plant Ecol Evol Syst, 2016, 18: 52-69. DOI:10.1016/j.ppees.2016.01.001 |
| [10] |
SARDANS J, JANSSENS I A, ALONSO R, et al. Foliar elemental composition of European forest tree species associated with evolutionary traits and present environmental and competitive conditions[J]. Glob Ecol Biogeogr, 2015, 24(2): 240-255. DOI:10.1111/geb.12253 |
| [11] |
REVELL L J, HARMON L J, COLLAR D C. Phylogenetic signal, evolutionary process, and rate[J]. Syst Biol, 2008, 57(4): 591-601. DOI:10.1080/10635150802302427 |
| [12] |
COOPER N, JETZ W, FRECKLETON R P. Phylogenetic comparative approaches for studying niche conservatism[J]. J Evol Biol, 2010, 23(12): 2529-2539. DOI:10.1111/j.1420-9101.2010.02144.x |
| [13] |
FERNÁNDEZ-MARTÍNEZ M, LLUSIÀ J, FILELLA I, et al. Nutrientrich plants emit a less intense blend of volatile isoprenoids[J]. New Phytol, 2018, 220(3): 773-784. DOI:10.1111/nph.14889 |
| [14] |
BAI K D, WEI Y G, ZHANG D N, et al. Contrasting effects of light, soil chemistry and phylogeny on leaf nutrient concentrations in cavedwelling plants[J]. Plant Soil, 2020, 448(1): 105-120. DOI:10.1007/s11104-020-04422-6 |
| [15] |
BAI K D, ZHOU X W, LÜ S H, et al. Biogeochemical niche conservatism relates to plant species diversification and life form evolution in a subtropical montane evergreen broad-leaved forest[J]. Ecol Evol, 2022, 12(12): e9587. DOI:10.1002/ece3.9587 |
| [16] |
WIGLEY B J, SLINGSBY J A, DÍAZ S, et al. Leaf traits of African woody savanna species across climate and soil fertility gradients: Evidence for conservative versus acquisitive resource-use strategies[J]. J Ecol, 2016, 104(5): 1357-1369. DOI:10.1111/1365-2745.12598 |
| [17] |
TAYLOR A, WEIGELT P, DENELLE P, et al. The contribution of plant life and growth forms to global gradients of vascular plant diversity[J]. New Phytol, 2023, 240(4): 1548-1560. DOI:10.1111/nph.19011 |
| [18] |
BAI K D, HE C X, WAN X C, et al. Leaf economics of evergreen and deciduous tree species along an elevational gradient in a subtropical mountain[J]. AoB Plants, 2015, 7: plv064. DOI:10.1093/aobpla/plv064 |
| [19] |
JIN Y, QIAN H. V. PhyloMaker: An R package that can generate very large phylogenies for vascular plants[J]. Ecography, 2019, 42(8): 1353-1359. DOI:10.1111/ecog.04434 |
| [20] |
BLOMBERG S P, GARLAND T JR, IVES A R. Testing for phylogenetic signal in comparative data: Behavioral traits are more labile[J]. Evolution, 2003, 57(4): 717-745. DOI:10.1111/j.0014-3820.2003.tb00285.x |
| [21] |
KECK F, RIMET F, BOUCHEZ A, et al. Phylosignal: An R package to measure, test, and explore the phylogenetic signal[J]. Ecol Evol, 2016, 6(9): 2774-2780. DOI:10.1002/ece3.2051 |
| [22] |
HARMON L J, WEIR J T, BROCK C D, et al. GEIGER: Investigating evolutionary radiations[J]. Bioinformatics, 2008, 24(1): 129-131. DOI:10.1093/bioinformatics/btm538 |
| [23] |
ORME D, FRECKLETON R P, THOMAS G H, et al. Caper: Comparative analyses of phylogenetics and evolution in R[J]. Methods Ecol Evol, 2012, 3: 145-151. DOI:10.1111/j.2041-210X.2011.00132.x |
| [24] |
MCCORMACK M L, KAPROTH M A, CAVENDER-BARES J, et al. Climate and phylogenetic history structure morphological and architectural trait variation among fine-root orders[J]. New Phytol, 2020, 228(6): 1824-1834. DOI:10.1111/nph.16804 |
| [25] |
YAN K, FU D G, HE F, et al. Leaf nutrient stoichiometry of plants in the phosphorus-enriched soils of the Lake Dianchi watershed, southwestern China[J]. Chin J Plant Ecol, 2011, 35(4): 353-361. 阎凯, 付登高, 何峰, 等. 滇池流域富磷区不同土壤磷水平下植物叶片的养分化学计量特征[J]. 植物生态学报, 2011, 35(4): 353-361. DOI:10.3724/SP.J.1258.2011.00353 |
| [26] |
SAURA-MAS S, LLORET F. Leaf and shoot water content and leaf dry matter content of Mediterranean woody species with different postfire regenerative strategies[J]. Ann Bot, 2007, 99(3): 545-554. DOI:10.1093/aob/mcl284 |
| [27] |
SPICER M E, RADHAMONI H V N, DUGUID M C, et al. Herbaceous plant diversity in forest ecosystems: Patterns, mechanisms, and threats[J]. Plant Ecol, 2022, 223(2): 117-129. DOI:10.1007/s11258-021-01202-9 |
| [28] |
FUNK J L, AMATANGELO K L. Physiological mechanisms drive differing foliar calcium content in ferns and angiosperms[J]. Oecologia, 2013, 173(1): 23-32. DOI:10.1007/s00442-013-2591-1 |
| [29] |
NEUGEBAUER K, BROADLEY M R, EL-SEREHY H A, et al. Variation in the angiosperm ionome[J]. Physiol Plant, 2018, 163(3): 306-322. DOI:10.1111/ppl.12700 |
| [30] |
KIRKBY E A. Introduction, definition, and classification of nutrients [M]// Marschner's Mineral Nutrition of Plants. Netherlands: Academic Press, 2023: 3–9. doi: 10.1016/b978-0-12-819773-8.00016-2.
|
| [31] |
WHITE P J, BROWN P H. Plant nutrition for sustainable development and global health[J]. Ann Bot, 2010, 105(7): 1073-1080. DOI:10.1093/aob/mcq085 |
| [32] |
ZENG D H, CHEN G S. Ecological stoichiometry: A science to explore the complexity of living systems[J]. Acta Phytoecol Sin, 2005, 29(6): 1007-1019. 曾德慧, 陈广生. 生态化学计量学: 复杂生命系统奥秘的探索[J]. 植物生态学报, 2005, 29(6): 1007-1019. DOI:10.17521/cjpe.2005.0120 |
| [33] |
HUANG J J, WANG X H. Leaf nutrient and structural characteristics of 32 evergreen broad-leaved species[J]. J E China Norm Univ (Nat Sci), 2003(1): 92-97. 黄建军, 王希华. 浙江天童32种常绿阔叶树叶片的营养及结构特征[J]. 华东师范大学学报(自然科学版), 2003(1): 92-97. DOI:10.3969/j.issn.1000-5641.2003.01.016 |
| [34] |
WANG H B, XU X, YANG W Q, et al. The ecological stoichiometry of carbon, nitrogen and phosphorus in urban garden plants with different life forms and its response to typhoon Hagupit[J]. Acta Ecol Sin, 2021, 41(22): 8931-8938. 王怀宾, 胥晓, 杨万勤, 等. 城市园林不同生活型植物叶片碳、氮、磷生态化学计量特征及其对台风的响应[J]. 生态学报, 2021, 41(22): 8931-8938. DOI:10.5846/stxb202105271396 |
| [35] |
ELSER J J, FAGAN W F, DENNO R F, et al. Nutritional constraints in terrestrial and freshwater food webs[J]. Nature, 2000, 408(6812): 578-580. DOI:10.1038/35046058 |
| [36] |
AERTS R, CHAPIN F S Ⅲ. The mineral nutrition of wild plants revisited: A re-evaluation of processes and patterns [M]// Advances in Ecological Research. New York: Academic Press, 1999, 30: 1–67. doi: 10.1016/s0065-2504(08)60016-1.
|
| [37] |
KOERSELMAN W, MEULEMAN A F M. The vegetation N: P ratio: A new tool to detect the nature of nutrient limitation[J]. J Appl Ecol, 1996, 33(6): 1441-1450. DOI:10.2307/2404783 |
| [38] |
CUI P X, SHEN Z H, FU P L, et al. Comparison of foliar element contents of plants from natural forests with different substrates in southern China[J]. Acta Ecol Sin, 2020, 40(24): 9148-9163. 崔培鑫, 申智骅, 付培立, 等. 中国南方生长于不同基质的天然林植物叶片元素含量特征比较[J]. 生态学报, 2020, 40(24): 9148-9163. DOI:10.5846/stxb202001160138 |
| [39] |
SHOU J J, XUE Q H, WANG X Y, et al. Studies on affecting factors of leaf senescence phenology in a subtropical evergreen broad-leaved forest in Gutianshan, Zhejiang Province[J]. J Trop Subtrop Bot, 2023, 31(2): 181-191. 寿佳君, 薛乾怀, 王鑫洋, 等. 浙江古田山亚热带常绿阔叶林叶衰老物候影响因子研究[J]. 热带亚热带植物学报, 2023, 31(2): 181-191. DOI:10.11926/jtsb.4582 |
| [40] |
LI A G, CAI S F, LUO S Z, et al. C, N, and P stoichiometry for leaf litter of 62 woody species in a subtropical evergreen broadleaved forest[J]. Chin J Appl Ecol, 2023, 34(5): 1153-1160. 李澳归, 蔡世锋, 罗素珍, 等. 亚热带常绿阔叶林62种木本植物凋落叶碳氮磷化学计量特征[J]. 应用生态学报, 2023, 34(5): 1153-1160. DOI:10.13287/j.1001-9332.202305.005 |
| [41] |
PAN X, CORNELISSEN J H C, ZHAO W W, et al. Experimental evidence that the Ornstein-Uhlenbeck model best describes the evolution of leaf litter decomposability[J]. Ecol Evol, 2014, 4(17): 3339-3349. DOI:10.1002/ece3.1115 |
| [42] |
XIANG W H, HUANG Z H, YAN W D, et al. Review on coupling of interactive functions between carbon and nitrogen cycles in forest ecosystems[J]. Acta Ecol Sin, 2006, 26(7): 2365-2372. 项文化, 黄志宏, 闫文德, 等. 森林生态系统碳氮循环功能耦合研究综述[J]. 生态学报, 2006, 26(7): 2365-2372. DOI:10.3321/j.issn:1000-0933.2006.07.040 |
| [43] |
LIU X J, SHAN Q, LI Y Y. Leaf carbon, nitrogen and phosphorus stoichiometry in 72 understory plants species in Kanas taiga[J]. Ecol Environ Sci, 2020, 29(7): 1302-1309. 刘小菊, 单奇, 李园园. 喀纳斯泰加林林下72种植物叶片的碳、氮、磷化学计量特征[J]. 生态环境学报, 2020, 29(7): 1302-1309. DOI:10.16258/j.cnki.1674-5906.2020.07.003 |
| [44] |
RAWAT J, PANDEY N, SAXENA J. Role of potassium in plant photosynthesis, transport, growth and yield [M]// IQBAL N, UMAR S. Role of Potassium in Abiotic Stress. Singapore: Springer, 2022: 1–14. doi: 10.1007/978-981-16-4461-0_1.
|
| [45] |
WHITE P J, BROADLEY M R, EL-SEREHY H A, et al. Linear relationships between shoot magnesium and calcium concentrations among angiosperm species are associated with cell wall chemistry[J]. Ann Bot, 2018, 122(2): 221-226. DOI:10.1093/aob/mcy062 |
| [46] |
BENGTSSON J, FAGERSTRÖM T, RYDIN H. Competition and coexistence in plant communities[J]. Trends Ecol Evol, 1994, 9(7): 246-250. DOI:10.1016/0169-5347(94)90289-5 |
| [47] |
PAN Y Q, DU Y J, CHEN W D, et al. Can plant phenology explain species coexistence: A case study in the subtropical evergreen broadleaved forest of Gutianshan, Zhejiang, China[J]. Sci Sin Vitae, 2020, 50(4): 362-372. 潘元琪, 杜彦君, 陈文德, 等. 植物物候是否能解释物种共存: 以浙江古田山亚热带常绿阔叶林为例[J]. 中国科学: 生命科学, 2020, 50(4): 362-372. DOI:10.1360/SSV-2019-0064 |
| [48] |
HANSEN T F. Stabilizing selection and the comparative analysis of adaptation[J]. Evolution, 1997, 51(5): 1341-1351. DOI:10.2307/2411186 |
| [49] |
PAGEL M. Inferring the historical patterns of biological evolution[J]. Nature, 1999, 401(6756): 877-884. DOI:10.1038/44766 |
| [50] |
DONOVAN L A, MAHERALI H, CARUSO C M, et al. The evolution of the worldwide leaf economics spectrum[J]. Trends Ecol Evol, 2011, 26(2): 88-95. DOI:10.1016/j.tree.2010.11.011 |
 2024, Vol. 32
2024, Vol. 32


