2. 肇庆学院生命科学学院, 广东 肇庆 526061
2. School of Life Science, Zhaoqing University, Zhaoqing 526061, Guangdong, China
在自然条件下,植物与土壤根际微生物之间联系紧密,根际微生物种类繁多,对植物的生长发育、环境适应发挥重要作用[1–2],在植物根际定殖的微生物为其宿主提供了许多有益的功能[3]。植物可以通过根系代谢活动为根际微生物生长发育提供营养物质, 如产生根系分泌物等,从而形成不同的根际微生物群落和微生境[4]。同植物的根际微生物群落结构及多样性存在差异[5],同种植物不同品种的根际微生物群落之间也存在差异[6]。由于植物根际土壤微生物群落具有明显特异性,因此研究不同植物的根际微生物,有助于认识微生物群落功能并发掘功能类群。
我国南方石灰岩发育强烈、景观类型多样,呈现峰林、峰丛、洼地、峡谷等地貌[7]。广东省石灰岩区面积约1.45万km2,主要分布在粤北地区,粤中、粤西、粤东各地也有零星分布。石灰岩生境石缝遍布, 土壤瘠薄,不成片,生境隔离明显,促进了植物物种的分化和形成,所以石灰岩生境特有植物较多[8]。石灰岩特有植物不仅发挥重要的生态功能,而且是石灰岩生境变迁的重要指示植物[9],是石灰岩地区植物适应性演化研究的理想素材。大桥虎耳草(Saxifraga daqiaoensis)、癞叶秋海棠(Begonia leprosa)、淡黄报春苣苔(Primulina alutacea)、多莛报春苣苔(P. polycephala)和阳山报春苣苔(P. yangshanensis)是5种分布于我国南方石灰岩地区的特有植物,其中癞叶秋海棠的生长范围较为广布,在广东和广西地区都有分布, 其余4种植物仅在广东北部有发现[10–12]。5种植物均为多年生草本,对环境要求较高,生境特殊,适宜生长在石灰岩山地的潮湿石头上。
目前,国内学者已从潜在适生区预测、生长发育特性、表型可塑性等方面对石灰岩特有植物进行研究[13–15]。根际微生物在植物生长方面具有非常重要的作用,然而对石灰岩特有植物根际微生物群落的研究较少,对其群落特征和功能较少了解。因此,本文以5种广东北部石灰岩特有植物为研究对象, 分析其群落特征及功能,研究土壤环境因子与细菌群落结构、多样性的相关性,探讨不同石灰岩特有植物根际土壤细菌的共性和差异,为石灰岩特有植物引种驯化提供土壤微环境数据。
1 材料和方法 1.1 研究区概况广东石灰岩地区地跨中亚热带和南亚热带, 属湿润性亚热带季风气候类型。年平均气温19 ℃~ 22 ℃,日夜温差较大,夏季日间岩石表面温度高达60 ℃~70 ℃,而夜间则迅速降温。石灰岩分布区内,大部分地区年平均降雨量1 500~1 800 mm,地层透水性大,地面十分干旱[16]。土壤多为石灰岩冲积土,主要积聚于山体中下部及岩缝中,并伴有一定厚度的枯枝落叶层;在粤北山体高大的石灰岩山中下部有发育较好的土壤,土层也较深厚。广东石灰岩地区植被盖度均较低,多为灌丛状植被,仅个别地区山林高大的石灰岩山中下部有发育较好的天然次生林。
1.2 根际土壤样品采集在广东北部的阳山、英德和曲江石灰岩山地选取分布相对集中的大桥虎耳草(Saxifraga daqiaoensis)、癞叶秋海棠(Begonia leprosa)、淡黄报春苣苔(Primulina alutacea)、多莛报春苣苔(P. polycephala)、阳山报春苣苔(P. yangshanensis)生长的石灰岩生境。分别选取生长状况相近的目标植物,每种植物进行5次重复采样,去除表层枯枝落叶,挖出整株植物,采用“抖根法”[17]收集根际土壤。将每种植物的土壤样品混合均匀并分成2份,一份带回实验室自然风干,过2 mm筛,用于土壤理化性质的测定;另一份放于–80 ℃冰箱保存,用于土壤微生物DNA提取。土壤信息见表 1。
| 表 1 5种石灰岩特有植物根际土壤采集信息 Table 1 Rhizoshphere soil information of limestone endemic plants |
土壤理化性质参照《土壤农化分析》[18]测定。土壤pH值采用pH计测定,水土混合液配比为2.5:1;土壤有机碳采用重铬酸钾容量法测定;土壤全氮采用凯氏定氮法测定;土壤全磷采用氢氧化钠熔融-钼锑抗比色法测定;土壤全钾采用氢氧化钠熔融-分光光度法测定;土壤碱解氮采用碱解扩散法测定;土壤速效磷采用碳酸氢钠-钼锑抗比色法测定;土壤速效钾采用醋酸铵-火焰光度法测定;土壤交换性钙采用原子吸收分光光度法测定。
1.4 根际土壤微生物DNA提取、PCR扩增和测序使用参照土壤DNA提取试剂盒(OMEGA E.Z. N.A. Soil DNA Kit, USA)说明书提取根际土壤微生物总DNA, 用1%的琼脂糖凝胶电泳检测提取质量, 用NanoDrop One检测DNA的浓度和纯度。对细菌16S rDNA序列的V4区进行扩增,所用引物为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)[19]。PCR反应体系为: 25 μL的2×Premix Taq, 1 μL的Primer-F (10 mmol/L), 1 μL的Primer-R (10 mmol/L),3 μL的DNA (20 ng/μL)和20 μL的Nuclease-free water。PCR反应程序为:94 ℃ 5 min, 30个循环(94 ℃ 30 s; 52 ℃ 30 s; 72 ℃ 30 s),72 ℃ 10 min, 4 ℃直到反应完成。用1%琼脂糖凝胶电泳检测PCR产物的片段长度和浓度后,采用Illumina HiSeq2500测序平台(Guangdong Magigene Biotechnology Co., Ltd. Guangzhou, China)进行PE250测序。测序工作委托广东美格基因科技有限公司完成。
1.5 数据处理和分析利用Trimmomatic (0.33)软件分别对双端的Raw Reads数据进行质量过滤后,用FLASH (1.2.11)软件对双端测序数据进行拼接,获得Raw Tag[20]。然后根据序列首尾两端的barcode和引物信息等,利用Mothur (1.35.1)软件进行Raw Tags序列质量过滤, 最终得到Clean Tags。利用usearch (10)软件对所有样品的全部Clean Tags进行聚类,默认以97%的一致性将序列聚类成为OTU (Operational Taxonomic Units), 将出现频数最高的序列作为每个OTU的代表性序列。利用QIIME (1.9.1)去除嵌合体和singleton, 然后在各个水平注释各样本群落物种组成信息,对比数据库为Silva (https://www.arbsilva.de/)。使用QIIME软件包中的alpha_diversity.py脚本进行α多样性指数计算,其种包括Observed species、Chao1、Shannon、Simpson。使用SPSS (27.0.1)对所有数据进行单因素方差分析(ANOVA)。利用R (4.2.1)生成细菌群落柱形图,完成PCoA分析、Spearman相关性等分析和作图。采用Galaxy在线网站(https://huttenhower.sph.harvard.edu/galaxy/)完成组间物种差异显著性分析(LEfSe分析)。细菌功能和代谢途径预测采用PICR RSt2 (22.1.0)软件进行分析[21]。采用FAPROTA数据库(http://www.zoology.ubc.ca/louca/FAPROTAX/)预测细菌功能[22]。
2 结果和分析 2.1 根际土壤理化性质5种石灰岩特有植物根际土壤理化特征不尽相同(表 2)。所有土壤均属于碱性土,但不同植物的根际土碱度有显著差异(P < 0.05),其中大桥虎耳草、阳山报春苣苔、淡黄报春苣苔的根际土壤pH显著高于多莛报春苣苔和癞叶秋海棠。癞叶秋海棠根际土壤的有机质、全氮、全磷、碱解氮、速效磷、速效钾、交换性钙的值均最高,大桥虎耳草根际土壤的全钾和速效钾的值均最低,阳山报春苣苔的全磷和速效磷的值均最低,多莛报春苣苔根际土壤的有机质、全氮、碱解氮、交换性钙的值均最低,但其全钾的值最高。
| 表 2 5种石灰岩特有植物根际土壤理化性质 Table 2 Rhizosphere soil properties of five limestone endemic plants |
5种石灰岩特有植物根际细菌群落丰富度与多样性存在区别。由表 3可知,5种植物根际土壤细菌群落Observed species指数为大桥虎耳草 > 阳山报春苣苔 > 多莛报春柱苣苔 > 淡黄报春苣苔 > 癞叶秋海棠,Chao1指数为阳山报春苣苔 > 大桥虎耳草 > 多莛报春苣苔 > 淡黄报春苣苔 > 癞叶秋海棠,虽然5种植物的Observed species指数稍有不同,但大桥虎耳草和阳山报春苣苔的Observed species指数和Chao1指数均无显著差异,因此,土壤细菌丰富度趋势相同。香农指数为大桥虎耳草 > 阳山报春苣苔 > 多莛报春苣苔 > 淡黄报春苣苔 > 癞叶秋海棠;大桥虎耳草与阳山报春苣苔根际土壤细菌的辛普森指数差异不显著,但与癞叶秋海棠存在显著差异,多莛报春苣苔与其他4种植物差异不显著。
| 表 3 5种石灰岩特有植物根际细菌丰富度和多样性指数 Table 3 Abundance and diversity indexes of rhizosphere bacterial among five limestone endemic plants |
5种植物根际土壤样品中共检测出细菌42门113纲250目315科498属。由图 1可见,在门分类水平上,相对丰度含量较高(> 1%)的根际土壤细菌共有13个,其中绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)是绝对优势门,约占所有细菌总数的77.33%~90.64%。硝化螺旋菌门(Nitrospirae)仅在癞叶秋海棠和阳山报春苣苔根际土壤细菌中相对丰度 > 1%,匿杆菌门(Latescibacteria)和Rokubacteria仅在癞叶秋海棠根际土壤细菌中相对丰度 > 1%,蓝细菌门(Cyanobacteria)仅在大桥虎耳根际土壤细菌中相对丰度 > 1%,Entotheonellaeota仅在阳山报春苣苔根际土壤细菌中相对丰度 > 1%。
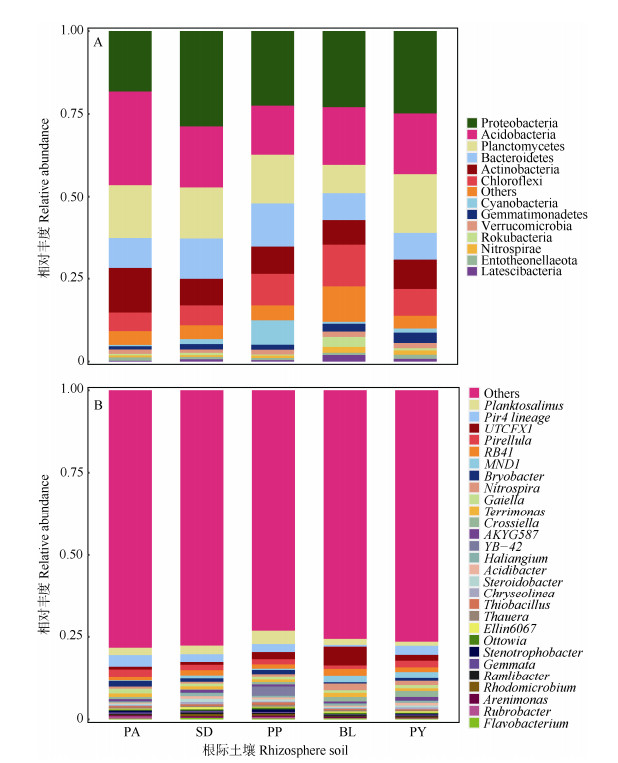
|
图 1 门(A)和属(B)水平上5种石灰岩特有植物根际土壤细菌群落的相对丰度。PA: 淡黄报春苣苔; PY: 阳山报春苣苔; BL: 癞叶秋海棠; PP: 多莛报春苣苔; SD: 大桥虎耳草。下同 Fig. 1 Relative abundance of rhizosphere bacterial community among five limestone endemic plants at phylum (A) and genus (B) level. PA: Primulina alutacea; PY: P. yangshanensis; BL: Begonia leprosa; PP: P. polycephala; SD: Saxifraga daqiaoensis. The same below |
在属的分类水平上,相对丰度 > 1%的属有13个, 其中小梨形菌属(Pirellula)、Planktosalinus和RB41是5种植物根际土细菌群落的共有优势菌属。从植物种类看,淡黄报春苣苔根际土壤中相对丰度 > 1%的属分别为Pir4_lineage (3.48%)、小梨形菌属(2.23%)、Planktosalinus (2.19%)、Bryobacter (1.65%)、Gaiella (1.47%)、RB41 (1.26%)和Terrimonas (1.1%),其中Pir4_lineage占主导地位。大桥虎耳草根际土壤中相对丰度 > 1%的属分别为Planktosalinus (2.58%)、Pir4_lineage (2.33%)、RB41 (1.62%)、小梨形菌属(1.58%)、MND1 (1.09%)和Bryobacter (1.04%),其中Planktosalinus占主导地位。多莛报春苣苔根际土壤中相对丰度 > 1%的属分别为Planktosalinus (4.00%)、YB-42 (2.79%)、Pir4_lineage (2.40%)、UTCFX1 (2.10%)、小梨形菌属(1.60%)、Bryobacter (1.31%)、RB41(1.27%)、Gaiella (1.05%),其中Planktosalinus占主导地位。癞叶秋海棠根际土壤中相对丰度 > 1%的属分别为UTCFX1 (5.66%)、MND1 (2.19%)、RB41 (2.07%)、硝化螺旋菌属(Nitrospira, 2.03%)、Planktosalinus (1.85%)、Crossiella (1.40%)、Terrimonas (1.22%)、小梨形菌属(1.02%),其中UTCFX1占主导地位。阳山报春苣苔根际土壤中相对丰度 > 1%的属分别为Pir4_lineage (2.73%)、小梨形菌属(1.99%)、MND1 (1.95%)、Crossiella (1.77%)、UTCFX1 (1.74%)、RB41 (1.46%)、Nitrospira (1.28%)、Planktosalinus (1.20%)、AKYG587 (1.04%),其中Pir4_lineage占主导地位。
对不同样品进行重抽样,使不同样品的测序深度在同一水平下,基于均一化处理后的结果分析它们共有和特有的OTU数量。大桥虎耳草、癞叶秋海棠、淡黄报春苣苔、多莛报春苣苔和阳山报春苣苔之间共有的OTU数为302,占各自根际土壤细菌OTU总数的21.57%、25.90%、27.21%、22.91%和22.17%;5种植物根际土壤特有OTU数分别为324、284、239、307和330,占各自根际土壤细菌OTU总数的23.14%、24.36%、21.73%、23.29%和24.23%,其中阳山报春苣苔根际土壤细菌特有OTU数最多,淡黄报春苣苔根际土壤细菌特有OTU数最少。两两共有OTU数量比较,多莛报春苣苔与大桥虎耳草根际共有的OTU数量最多,为总OTU数量的24.08%,淡黄报春苣苔和癞叶秋海棠共有的OTU数量最少,为总OTU数量的16.86%,说明多莛报春苣苔与大桥虎耳草根际土壤中细菌群落组成最相似,淡黄报春苣苔与癞叶秋海棠根际土壤中细菌群落组成差异最大。
2.4 根际细菌β多样性和差异细菌分析基于Unweighted Unifrac和Weighted Unifrac距离,对5种石灰岩特有植物根际土壤细菌群落进行PCoA分析,采用贡献率最大的主坐标组合进行作图(图 2)。Unweighted Unifrac分析结果表明PCoA1是尽可能最大解释数据变化的主坐标成分,解释率为9.16%;PCoA2次之,解释率为8.17%,2个主要成分解释了17.33%的细菌群落。在PCoA1上, 淡黄报春苣苔与多莛报春苣苔根际土壤细菌群落距离接近,大桥虎耳草与多莛报春苣苔根际土壤细菌群落距离接近,以上三者与癞叶秋海棠根际土壤细菌群落距离较远。阳山报春苣苔根际土壤细菌群落位置靠近癞叶秋海棠和大桥虎耳草的,结构有一定的相似性。Weighted Unifrac分析结果表明2个主要成分解释了37.69%的细菌群落,总体来看癞叶秋海棠根际土壤细菌群落位置与其他4种植物的距离较远,尤其是与淡黄报春苣苔。淡黄报春苣苔、多莛报春苣苔、大桥虎耳草和阳山报春苣苔根际土壤中的细菌群落距离较小,差异不大。
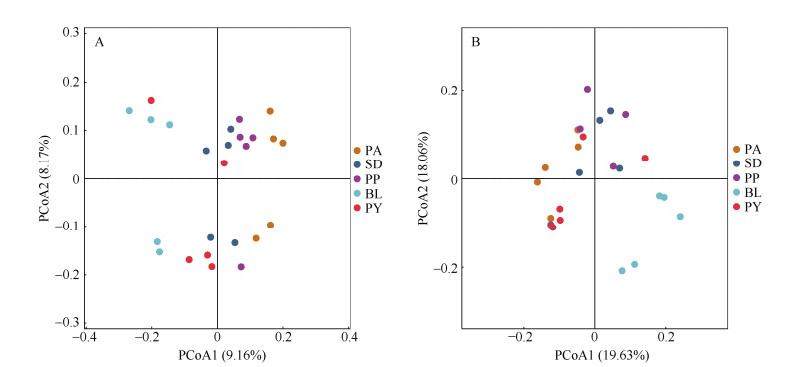
|
图 2 5种石灰岩特有植物根际土壤细菌群落的PCoA分析。A: 基于Unweigheted Unifrac距离; B: 基于Weigheted Unifrac距离。 Fig. 2 PCoA Analysis of rhizosphere bacterial community among five limestone endemic plants. A: Based on Unweigheted Unifrac distance; B: Based on Unweigheted Unifrac distance. |
采用LEfSe分析从门到属筛选生物标志物,探讨5种石灰岩特有植物根际土细菌群落在丰度上有显著差异的物种。由图 3: B可见,LDA≥3.5的水平上共有78种差异物种,其中大桥虎耳草、癞叶秋海棠、淡黄报春苣苔、多莛报春苣苔、阳山报春苣苔根际土壤细菌群落中分别有4、25、25、15、9种。淡黄报春苣苔和癞叶秋海棠与其他3种植物根际土壤细菌群落相比,显著富集的细菌数量更多。由图 3: A可知,大桥虎耳草根际土中γ-变形菌纲(Gammaproteobacteria)和黏球菌目(Myxococcales)的物种较为丰富;癞叶秋海棠根际土中富集的细菌主要包括厌氧绳菌纲(Anaerolineae)、硝化螺旋菌门、匿杆菌门、Crossiella、Pedosphaerales、Rokubacteria、Betaproteobacteriales、KF_JG30_B3、Pla4_lineage、OM190和Subgroup_22物种;淡黄报春苣苔根际土壤中富集的细菌主要包括酸杆菌门、浮霉菌纲(Planctomycetacia)、红杆菌纲(Rubrobacteria)、Corynebacteriales、Propionibacteriales、Flavisolibacter和Actinomarinales物种;蓝细菌门和绿弯菌纲(Chloroflexia)物种在多莛报春苣苔根际土中显著富集;阳山报春苣苔根际土中,δ-变形菌纲(Deltaproteobacteria)、浮霉菌门、芽单胞菌门(Gemmatimonadetes)、Gammaproteobacteria_Incertae_Sedis和Ardenticatenales物种显著富集。
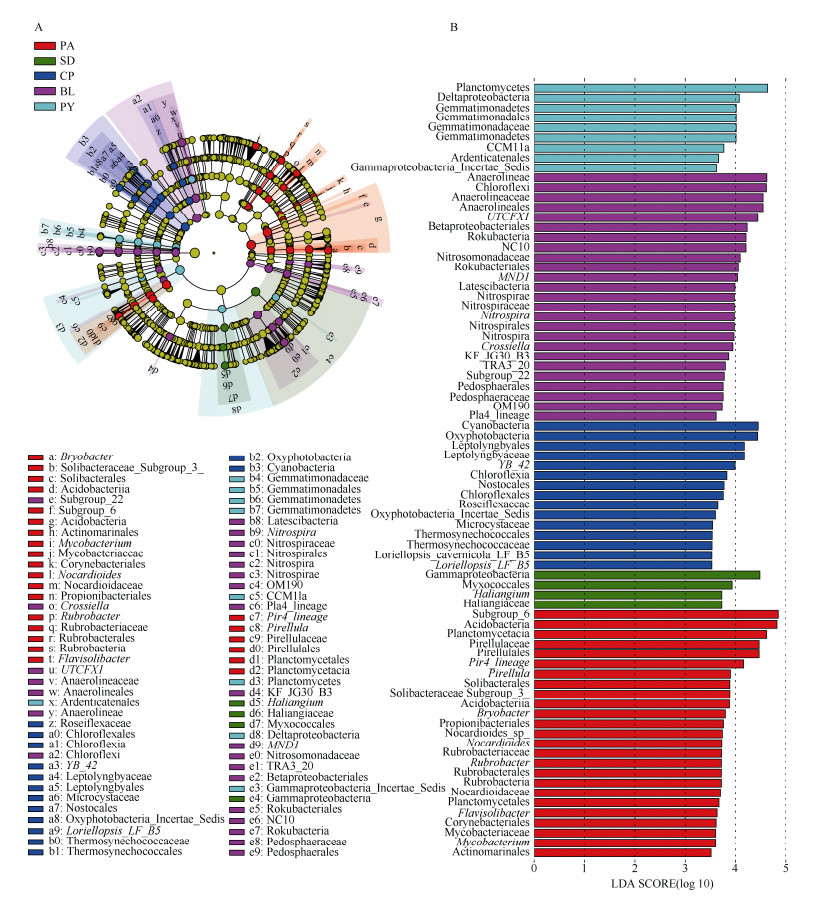
|
图 3 5种石灰岩特有植物根际土壤细菌物种进化分支(A)和显著差异物种LDA值分布(B) Fig. 3 Taxonomic cladogram of rhizosphere bacterial community among five limestone plants (A) and LDA value distribution of significantly different species (B) |
分别将5种植物根际土中相对丰度前10的细菌门和属与土壤理化因子进行Spearman相关性分析(图 4)。在门分类水平上,变形菌门与土壤交换性钙、碱解氮、有机质、全氮呈显著负相关,与速效磷呈极显著负相关;酸杆菌门与土壤交换性钙、碱解氮、有机质、全氮呈显著正相关,与pH值呈显著负相关;放线菌门与土壤交换性钙、碱解氮、有机质、速效磷和全氮呈显著正相关;绿弯菌门与pH值呈显著正相关;芽单胞菌门与土壤速效磷呈极显著负相关,与全磷呈显著负相关;蓝细菌门与速效钾、全钾呈显著负相关;疣微菌门(Verrucomicrobia)与速效磷呈显著正相关。结合细菌组成分析中各门类占细菌丰度的比例,土壤速效磷、交换性钙、碱解氮、有机质、pH值和全氮对5种植物根际细菌群落组成起主要作用。
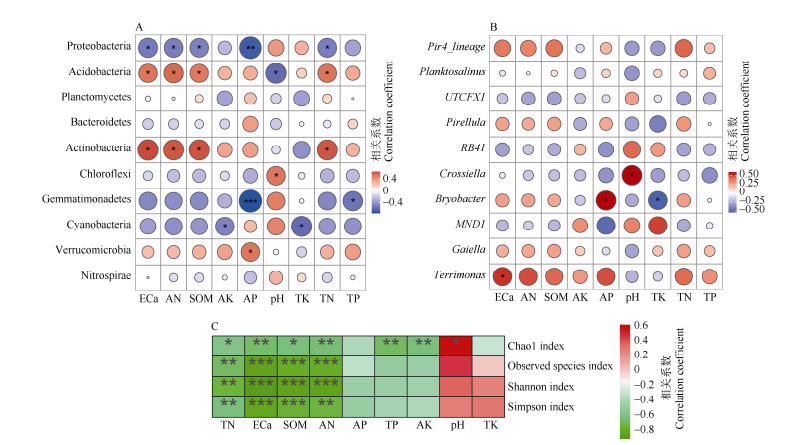
|
图 4 5种石灰岩特有植物根际土壤细菌门相对丰度(A)、属相对丰度(B)、α多样性指数(C)与土壤理化性质的Spearman相关性热图。TP、AK、AP、TN、ECa、SOM、AN、pH、TK见表 2。*: P < 0.05; **: P < 0.01; ***: P < 0.001。下同 Fig. 4 Spearman correlation map between rhizosphere soil properties and relative abundance of bacterial phylum (A), relative abundance of bacterial genus (B), baterial alpha diversity (C) in five limestone endemic plants. TP, AK, AP, TN, ECa, SOM, AN, pH, TK see Table 2; *: P < 0.05; **: P < 0.01; ***: P < 0.001. The same below |
在属分类水平上,Crossiella与土壤pH值呈显著正相关;硫杆状菌属(Terrimonas)与土壤交换性钙呈显著正相关;Bryobacter与速效磷呈显著正相关,与全钾呈显著负相关;其余7属与土壤理化因子关系不显著。此外,土壤有机质和全氮虽与10属的细菌相关性未达显著水平,但两者与细菌属的相关性几乎相同,均对Pir4_lineage、Planktosalinus、小梨形菌属、Bryobacter、Gaiella和Terrimonas有正相关性。结合细菌组成分析中各属类占细菌丰度的比例,土壤交换性钙、速效磷、pH值和全钾对5种植物根际细菌群落组成起主要作用。
土壤理化因子和细菌群落α多样性的相关性表明(图 4: C), 土壤全氮、交换性钙、有机质、碱解氮均与Chao1指数、观测到的物种数、香农指数、辛普森指数呈显著或极显著负相关;全磷和速效钾与Chao1指数呈极显著负相关,而pH值与Chao1指数呈显著正相关;其余因子与土壤细菌多样性指数相关性均未达到显著性水平。总体而言,土壤全氮、交换性钙、有机质、碱解氮对5种植物根际细菌群落多样性影响较为显著。
2.6 根际土壤细菌群落功能分析通过PICRUSt2对5种植物根际土壤细菌代谢功能进行预测(图 5),结果表明5种植物根际土壤细菌群落一级功能层共有6类生物代谢功能,其中新陈代谢功能的平均相对丰度最大(75.34%),环境信息处理的平均相对丰度最小,仅为23.13%。二级功能层分析表明共有47个子功能组,其中氨基酸代谢、辅助因子和维生素代谢、碳水化合物代谢、其他氨基酸代谢、其他次生代谢物的生物合成、外源生物降解与代谢、全局概览通路所占比例最高(大于5%),且其所属一级功能层均为新陈代谢。
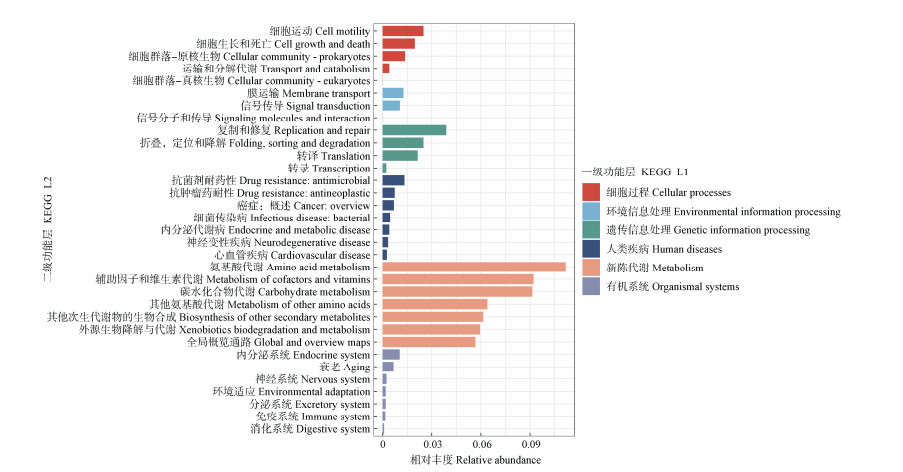
|
图 5 5种石灰岩特有植物根际土壤细菌KEGG通路注释情况 Fig. 5 KEGG pathway of rhizosphere bacterial community among five limestone endemic plants |
基于FAPROTAX对5种植物根际土壤细菌进行功能预测分析,一共有65种细菌功能被注释(图 6),5种植物根际土壤相对丰度 > 1%的优势功能类群有9种,其中,化能异养型、好氧化能异养型、硝化作用型和好氧氨氧化型细菌是5种植物共有的优势功能类群。不同植物根际细菌功能存在差异(图 7),化能异养型功能类群在淡黄报春苣苔与癞叶秋海棠根际土之间差异显著(P < 0.05);好氧化异能型功能类群在癞叶秋海棠与淡黄报春苣苔、多莛报春苣苔与癞叶秋海棠根际土之间差异显著;硝酸还原作用型功能类群在淡黄报春苣苔与癞叶秋海棠、淡黄报春苣苔与阳山报春苣苔、多莛报春苣苔与癞叶秋海棠、多莛报春苣苔与阳山报春苣苔根际土之间差异显著。5种植物根际土的硝化作用型、好氧氨氧化型、好氧亚硝酸盐氧化型功能类群的相对丰度中,癞叶秋海棠高于其他4种植物。5种石灰岩特有植物根际土壤细菌中具有化能异养功能的细菌共有126属(表 4),相对丰度 > 1%的属分别为Bradyrhizobium、Roseomonas、Asticcacaulis、Bryobacter、Lautropia、Sphaerisporangium、Sphingobium、Mesorhizobium、Hyphomicrobium、Flavobacterium、Sphingomonas、Devosia、Rhizorhapis、Rhodococcus、Caulobacter、Micromonospora、Novosphingobium、Cupriavidus,其中Bradyrhizobium占比最高;具有好养化能异养功能的细菌共有115属,相对丰度 > 1%的属分别为Actinophytocola、Actinoplanes、Pseudonocardia、Bradyrhizobium、Streptomyces、Pedomicrobium、Devosia、Hyphomicrobium、Sphingomonas、Kibdelosporangium、Bryobacter、Mesorhizobium、Leptothrix、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、Nocardioides、Rhodoplanes、Kineosporia、Solirubrobacter、Novosphingobium,其中Actinophytocola占比最高;具有硝化作用功能和好氧氨氧化功能的细菌分别有10和8属,两者相对丰度 > 1%的属都是MND1、Ellin6067,其中占比最高的属都是MND1。
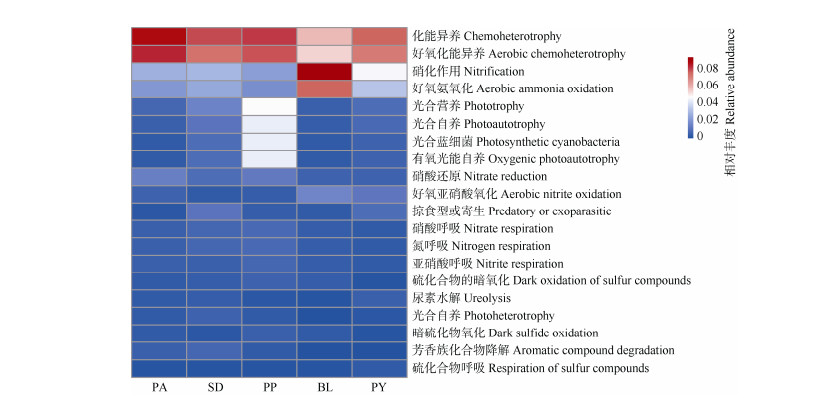
|
图 6 5种石灰岩特有植物根际土壤细菌相对丰度前20的功能型 Fig. 6 Function prediction of rhizosphere bacteria among five limestone endemic plants in top 20 relative abundance |
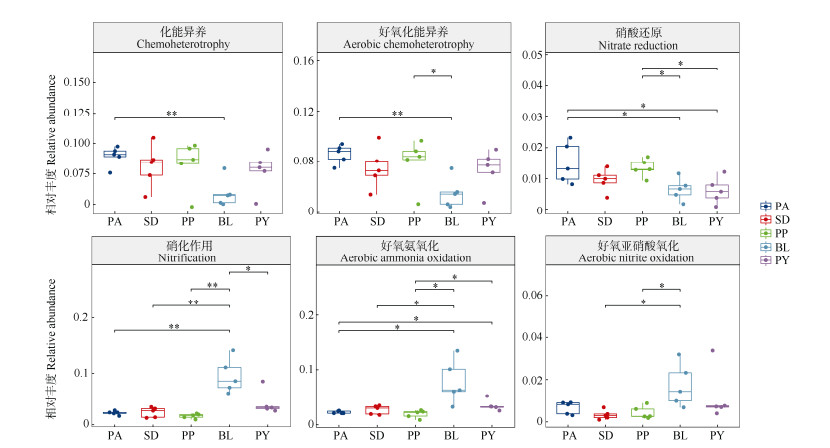
|
图 7 5种石灰岩特有植物根际土壤细菌功能组间差异检验 Fig. 7 Difference test of rhizosphere bacterial functional groups of five limestone endemic plants |
| 表 4 属水平上5种石灰岩特有植物根际土壤细菌群落对应的功能 Table 4 Corresponding functions of bacterial communities in rhizosphere of five limestone endemic plants at genus level |
根际微生物群落可以作为植物的功能驱动者, 扩展植物的代谢能力,改善营养吸收、提供免疫调节和增强抗逆境胁迫等功能[23]。植物也会分泌复杂的有机物质为植物根系微生物创造了独特的生存环境,招募对自身生长代谢有益的微生物[24]。本研究中,5种特有植物根际土壤细菌群落多样性和丰富度各异。LEfSe分析结果表明,不同植物富集了不同的细菌类群,同属于报春苣苔属的淡黄报春苣苔、阳山报春苣苔和多莛报春苣苔根际优势细菌群落组成上较为相似,与其他2种植物差异亦不显著,但5种特有植物根际优势细菌群落相对丰度存在差异,低丰度细菌群落的组成也不同,与前人对同属植物[25]和不同种植物[26]根际微生物群落的研究结果略微相似。可能是因为5种植物根际微环境各异,根际土壤理化性质不一致,形成了多样的细菌群落结构。植物为了适应不同生态环境,通过根系活动改变其根际环境,进一步影响某些根际细菌群落的丰度或多样性,使得根际微生物群落在土壤分布中也存在空间异质性[27]。
生物的群落结构存在生境异质性,土壤生态环境的不同造成微生物群落结构的组成和相对丰度不同,但微生物群落仍然存在一定的共性,而生态环境相似的地区土壤微生物结构较为相似[28]。本研究结果得出,酸杆菌门、变形菌门、浮霉菌门、放线菌门、拟杆菌门和绿弯菌门是5种石灰岩特有植物根际细菌群落的优势门。喀斯特常绿阔叶林土壤细菌群落研究结果表明,优势细菌相对丰度从小到大分别为变形菌门、放线菌门、酸杆菌门、绿弯菌门、奇古菌门(Thaumarchaeota)[29];石灰岩地区的竹叶椒(Zanthoxylum armatum)根际细菌优势菌群为变形菌门、酸杆菌门和疣微菌门(Verrucomicrobia)[30];石灰岩地区的报春苣苔(Primulina tabacum)根际细菌优势菌群为变形菌门、放线菌门、酸杆菌门[31];干旱荒漠地的柠条(Caragana korshinskii)根际细菌优势菌群为放线菌门、变形菌门、酸杆菌门、绿弯菌门、拟杆菌门[32];藏北高寒草原3种植物根际细菌优势菌群为酸杆菌门、变形菌门、奇古菌门、放线菌门、芽单胞菌门(Gemmatimonadetes)[33];盐碱地6种植物根际细菌优势菌群为厚壁菌门(Firmicutes)、变形菌门、放线菌门[34]。对比5种石灰岩特有植物根际细菌优势群落与以上植物根际或环境细菌优势群落,部分类群相似,但相对丰度有较大差异,且存在如浮霉菌门等独特类群。
由于不同植物的遗传背景和物质代谢过程不同,根际分泌物产生差异,造成了不同的根际微环境[35]。根据土壤理化性质结果,5种石灰岩植物根际土中,交换性钙含量较高,与石灰岩山地土壤的主要特点比较吻合[36],且所有土壤均属于碱性土, 说明这5种植物长期适应石灰岩山地环境,产生了喜钙性和耐碱性。5种植物中,癞叶秋海棠根际土壤的有机质、全氮、全磷、碱解氮、速效磷、速效钾、交换性钙的值最高,说明癞叶秋海棠更能聚合离子或更偏好石灰岩环境,比其他4种植物更适合生存于石灰岩地区。植物类型和土壤理化性质是影响植物根际细菌结构组成和多样性的重要因素之一[37]。5种植物细菌群落多样性存在差异,土壤全氮、交换性钙、有机质、碱解氮是影响这5种植物根际细菌群落多样性的主要因子。相关研究表明变形菌门与土壤全氮和有机质含量显著相关[34, 38], Spearman相关性分析也表明5种植物根际变形菌门相对丰度与全氮和有机质含量呈显著负相关。酸杆菌门相对丰度与土壤有机质、全氮呈显著正相关, 这在银北渍化土壤中6种耐盐碱植物根际细菌群落结构[34]和碱蓬(Suaeda glauca)对根际土壤细菌群落结构影响[39]的研究结果相似。土壤pH值是土壤中酸杆菌丰度和多样性的重要影响因子,与土壤中酸杆菌的相对丰度呈显著负相关的关系[40],而本研究结果表明5种植物根际土中酸杆菌门相对丰度与pH值也呈显著负相关。虽然以上细菌群落的宿主植物、宿主植物的生长时期以及生境等不同,但对某些特定土壤理化因子有专一性。此外,变形菌门与土壤速效磷有显著相关性,变形菌门和酸杆菌门与土壤交换性钙、碱解氮有显著相关性。酸杆菌门和变形菌门是5种植物根际土壤中的优势门,它们如发生改变,可能会改变整个根际微生物组成结构。因此,结合变形菌门、酸杆菌门与土壤理化因子相关性结果,推测出对5种植物根际土壤细菌群落组成起主导作用的土壤理化因子是速效磷、交换性钙、碱解氮、有机质、pH和全氮。
本研究中,利用KEGG代谢途径对5种特有植物根际土壤细菌功能进行预测,5种植物根际土壤细菌共涉及新陈代谢等6个代谢通路,分属于47个子功能,充分证明其功能上的丰富性。在一级功能层中,代谢功能系统占比最大,说明代谢在5种植物根际土壤细菌生长中有着极其重要的作用。有研究表明,功能基因中代谢功能的主要作用是通过摄取氨基酸、碳水化合物、维生素等营养物质来保证细菌的生长[41]。本研究的二级功能层中与氨基酸代谢、辅助因子和维生素代谢和碳水化合物代谢占比较高。氨基酸代谢可以帮助细菌吸收氨基酸,有利于加速有机物矿化,促进植物氮素吸收利用[42]; 辅助因子和维生素代谢功能与细菌固碳和光合作用有关,促进植物的碳循环[43];碳水化合物代谢与固氮、溶磷等作用密切相关,有利于植物的氮、磷循环[44]。本研究使用FAPROTAX对5种特有植物根际土壤样本进行功能预测分析,结果表明5种植物共有的主导功能类群为化能异养型、好氧化能异养型、硝化作用型和好氧氨氧化型。不同植物的根际土壤细菌功能类群存在差异,癞叶秋海棠根际土细菌的硝化作用型、好养氨氧化型和好氧亚硝酸盐氧化型的相对丰度高于其他4种植物,表明有更高比例的细菌参与癞叶秋海棠根际土壤氮循环,而癞叶秋海棠根际土的全氮、碱解氮含量最高,说明癞叶秋海棠根际土壤细菌可能协助其对氮的吸收。在细菌种类层面上,5种植物根际细菌中具有化能异养和好养化能异养功能的细菌种类较多,2种功能中占比最高的属分别是慢生根瘤菌属(Bradyrhizobium)和Actinophytocola;具有硝化作用和好氨氧化功能的细菌种类较少,两者丰度最高的属都为MND1。化能异养型和好氧化能异养型细菌参与土壤碳氮循环过程[45],硝化作用型和好氨氧化型细菌参与土壤氮循环过程。因此,推测这些细菌类群通过参与土壤碳氮循环影响这5种植物生长。此外, 优势菌群之一的变形菌门,具有更快的生长速度, 可以释放并帮助根系吸收植物可利用的钾、磷和其他微量营养元素[46],对微生物群落结构非常重要。相对丰度较低的蓝细菌门是根瘤菌的三大菌门之一, 在极端环境中也能生长,还能与一些植物共生, 能提高植物的光合作用与固氮能力[47]。石灰岩地区土壤养分贫瘠,土体浅薄,且淋溶较大,导致养分无法长时间保持,推测5种植物可能借助根际土壤细菌复杂的酶来分解植被凋落物和根际沉积物,利用细菌氨基酸代谢、辅助因子和维生素代谢、碳水化合物代谢、其他氨基酸代谢、其他次生代谢物的生物合成、外源生物降解与代谢等功能,使环境的碳氮循环效率提升[48],促进5种植物对养分的吸收利用,从而保证自身的生长,维持在特殊土壤环境的生存。
由于土壤微生物的多样性以及根际土壤自身的复杂性,传统的分离培养技术无法对大多数微生物进行深入研究,而使用16S扩增子测序技术可以直接研究根际微生物群落的组成及多样性,并能较为客观地反映其中低丰度的重要功能微生物。本研究使用的16S扩增子测序技术研究5种石灰岩特有植物,多数类群(如绿弯菌门)的细菌限于培养条件,无法获得[49]。然而16S扩增子测序获得的序列,在种的水平注释比例较低,宏基因组测序则能鉴定微生物到种水平甚至菌株水平,能进一步挖掘具有应用价值的菌群以及微生物群落之间、微生物与环境之间的关系[50]。在营养物质匮乏的石灰岩地区,这些定殖在根际土壤中的功能细菌可能通过代谢作用适应其所处的环境而得以存活并对宿主植物发挥着一定的作用。因此,后续仍需将分离培养方法和宏基因组测序技术结合起来分析,这样既能真实和准确地反映出土壤中微生物的结构组成和多样性,也能分离获得具有重要价值的生态功能菌株,为丰富石灰岩地区微生物资源,进一步探讨石灰岩地区特有植物与微生物互作的方式与机制提供参考。
综上,5种特有植物根际的功能细菌通过自身代谢功能参与土壤养分循环,将土壤环境中的物质转化成可吸收利用的养分,帮助植物在石灰岩地区生长。其中,癞叶秋海棠根际更能聚合离子和聚集更高比例的有益细菌,比其他4种植物更适合生存于石灰岩地区。本研究为进一步认识石灰岩特有植物根际土壤细菌群落特征和功能提供了理论依据, 也为后续石灰岩特有植物引种驯化提供土壤微环境数据。
| [1] |
RAAIJMAKERS J M, PAULITZ T C, STEINBERG C, et al. The rhizosphere: A playground and battlefield for soilborne pathogens and beneficial microorganisms[J]. Plant Soil, 2009, 321(1): 341-361. DOI:10.1007/s11104-008-9568-6 |
| [2] |
YUAN J, ZHAO J, WEN T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Microbiome, 2018, 6(1): 156. DOI:10.1186/s40168-018-0537-x |
| [3] |
BANO S, WU X G, ZHANG X J. Towards sustainable agriculture: Rhizosphere microbiome engineering[J]. Appl Microbiol Biotechnol, 2021, 105(19): 7141-7160. DOI:10.1007/s00253-021-11555-w |
| [4] |
SONG Y, LI X N, YAO S, et al. Correlations between soil metabolomics and bacterial community structures in the pepper rhizosphere under plastic greenhouse cultivation[J]. Sci Total Environ, 2020, 728: 138439. DOI:10.1016/j.scitotenv.2020.138439 |
| [5] |
TURNER T R, RAMAKRISHNAN K, WALSHAW J, et al. Comparative metatranscriptomics reveals kingdom level changes in the rhizosphere microbiome of plants[J]. ISME J, 2013, 7(12): 2248-2258. DOI:10.1038/ismej.2013.119 |
| [6] |
ZHENG T J, WANG M J. Research on the diversity and difference of rhizosphere microbial community of different blueberries[J]. N Hort, 2022(14): 76-86. 郑天骄, 王梦姣. 不同蓝莓根际微生物群落结构多样性及其差异[J]. 北方园艺, 2022(14): 76-86. DOI:10.11937/bfyy.20220166 |
| [7] |
ZHANG G, ZHENG C Y, LI Y F, et al. Impact of ecological restoration of rocky desertification on soil biodiversity in karst area: A review[J]. Acta Ecol Sin, 2023, 43(1): 432-440. 张国, 郑春燕, 李钰飞, 等. 喀斯特地区石漠化生态修复对土壤生物多样性的影响[J]. 生态学报, 2023, 43(1): 432-440. DOI:10.5846/stxb202107081831 |
| [8] |
WANG K L, ZHANG C H, CHEN H S, et al. Karst landscapes of China: Patterns, ecosystem processes and services[J]. Landscape Ecol, 2019, 34(12): 2743-2763. DOI:10.1007/s10980-019-00912-w |
| [9] |
WU J, QIN F, WANG W, et al. Research progress of soil and peculiar plants in limestone areas of China[J]. J Jiangsu For Sci Technol, 2010, 37(2): 50-54. 吴静, 秦飞, 王维, 等. 我国石灰岩地区特有植物研究进展[J]. 江苏林业科技, 2010, 37(2): 50-54. DOI:10.3969/j.issn.1001-7380.2010.02.015 |
| [10] |
WANG F G, YE Y S, XING F W. Saxifraga daqiaoensis (Saxifragaceae), a new species from Guangdong, China[J]. Ann Bot Fenn, 2008, 45(3): 237-239. DOI:10.5735/085.045.0313 |
| [11] |
PAN B, WANG B M, HE J Y, et al. Primulina versicolor and P. alutacea spp. nov. (Gesneriaceae), two new species with yellow flowers from northern Guangdong, China[J]. Edinburgh J Bot, 2016, 73(1): 25-37. DOI:10.1017/S0960428615000268 |
| [12] |
GUO J, PAN B, LIU J, et al. Three new species of Primulina (Gesneriaceae) from limestone karsts of China based on morphological and molecular evidence[J]. Bot Stud, 2015, 56(1): 34. DOI:10.1186/s40529-015-0115-5 |
| [13] |
WANG H D, YUAN C J, YANG R, et al. Prediction of the potential suitable area of endemic plant Rhododendron pudingense in Guizhou Province based on MaxEnt model[J]. J S Agric, 2023, 54(3): 938-947. 王浩东, 袁丛军, 杨瑞, 等. 基于MaxEnt模型的贵州特有植物普定杜鹃花潜在适生区预测[J]. 南方农业学报, 2023, 54(3): 938-947. DOI:10.3969/j.issn.2095-1191.2023.03.030 |
| [14] |
LIU B Y, TANG H, WANG M L, et al. Seed germination and seedling growth and development characteristics of Llicicum difengpi, an endemic plant of karst region[J]. Seed, 2021, 40(1): 63-68. 刘宝玉, 唐辉, 王满莲, 等. 喀斯特特有植物地枫皮种子萌发及幼苗生长发育特性研究[J]. 种子, 2021, 40(1): 63-68. DOI:10.16590/j.cnki.1001-4705.2021.01.063 |
| [15] |
CHENG J, LIU J M, WANG D, et al. Plastic response of the karst endemic plant Juglans regia L. f. luodianense seedings to light intensity[J]. Chin J Appl Environ Biol, 2021, 27(1): 23-30. 程晶, 刘济明, 王灯, 等. 喀斯特特有植物罗甸小米核桃幼苗对光照强度的可塑性响应[J]. 应用与环境生物学报, 2021, 27(1): 23-30. DOI:10.19675/j.cnki.1006-687x.2020.09012 |
| [16] |
HE D Q, AO H X. The limestone hill forest vegetation in Guangdong Province and its recovery[J]. Trop Geogr, 1993, 13(3): 213-218. 何道泉, 敖惠修. 广东石灰岩地区的森林植被及其恢复问题[J]. 热带地理, 1993, 13(3): 213-218. |
| [17] |
LU H F, LASHARI M S, LIU X Y, et al. Changes in soil microbial community structure and enzyme activity with amendment of biocharmanure compost and pyroligneous solution in a saline soil from Central China[J]. Eur J Soil Biol, 2015, 70: 67-76. DOI:10.1016/j.ejsobi.2015.07.005 |
| [18] |
BAO S D. Soil Agrochemical Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000: 1-495. 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000: 1-495. |
| [19] |
MORI H, MARUYAMA F, KATO H, et al. Design and experimental application of a novel non-degenerate universal primer set that amplifies prokaryotic 16S rRNA genes with a low possibility to amplify eukaryotic rRNA genes[J]. DNA Res, 2014, 21(2): 217-227. DOI:10.1093/dnares/dst052 |
| [20] |
BOLGER A M, LOHSE M, USADEL B. Trimmomatic: A flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114-2120. DOI:10.1093/bioinformatics/btu170 |
| [21] |
DOUGLAS G M, MAFFEI V J, ZANEVELD J R, et al. PICRUSt2 for prediction of metagenome functions[J]. Nat Biotechnol, 2020, 38(6): 685-688. DOI:10.1038/s41587-020-0548-6 |
| [22] |
LOUCA S, PARFREY L W, DOEBELI M. Decoupling function and taxonomy in the global ocean microbiome[J]. Science, 2016, 353(6305): 1272-1277. DOI:10.1126/science.aaf4507 |
| [23] |
CORDOVEZ V, DINI-ANDREOTE F, CARRIÓN V J, et al. Ecology and evolution of plant microbiomes[J]. Annu Rev Microbiol, 2019, 73(1): 69-88. DOI:10.1146/annurev-micro-090817-062524 |
| [24] |
KONG H G, SONG G C, RYU C M. Inheritance of seed and rhizosphere microbial communities through plant-soil feedback and soil memory[J]. Environ Microbiol Rep, 2019, 11(4): 479-486. DOI:10.1111/1758-2229.12760 |
| [25] |
JING X Y, SUN L Q, LI S Y, et al. Rhizospheric microorganisms diversity analysis of Opisthopappus sp.[J]. J Agric Sci Technol, 2021, 23(3): 193-200. 景晓雅, 孙柳清, 李尚彧, 等. 太行菊属植物根际土壤微生物多样性初步研究[J]. 中国农业科技导报, 2021, 23(3): 193-200. DOI:10.13304/j.nykjdb.2019.0735 |
| [26] |
LI M Y, WANG J L, ZHOU Q, et al. Analysis on the rhizosphere fungal community structure of four halophytes in southern Xinjiang[J]. Acta Ecol Sin, 2021, 41(21): 8484-8495. 李明源, 王继莲, 周茜, 等. 南疆四种盐生植物根际土壤真菌群落结构特征[J]. 生态学报, 2021, 41(21): 8484-8495. DOI:10.5846/stxb202009032296 |
| [27] |
LI H, SU J Q, YANG X R, et al. Distinct rhizosphere effect on active and total bacterial communities in paddy soils[J]. Sci Total Environ, 2019, 649: 422-430. DOI:10.1016/j.scitotenv.2018.08.373 |
| [28] |
ZHU P, CHEN R S, SONG Y X, et al. Soil bacterial community composition and diversity of four representative vegetation types in the middle section of the Qilian Mountains, China[J]. Acta Ecol Sin, 2017, 37(10): 3505-3514. 朱平, 陈仁升, 宋耀选, 等. 祁连山中部4种典型植被类型土壤细菌群落结构差异[J]. 生态学报, 2017, 37(10): 3505-3514. DOI:10.5846/stxb.201602290348 |
| [29] |
CHEN L, SONG T Q, WANG H, et al. Soil bacterial diversity and optimal sampling number in the Mulun karst evergreen and deciduous broad-leaved mixed forest[J]. Acta Ecol Sin, 2019, 39(9): 3287-3296. 陈莉, 宋同清, 王华, 等. 木论喀斯特常绿落叶阔叶混交林土壤细菌多样性及其最优采样数[J]. 生态学报, 2019, 39(9): 3287-3296. DOI:10.5846/stxb201711152038 |
| [30] |
LIU X, WANG S J, LIU X M, et al. Compositional characteristics and variations of soil microbial community in karst area of Puding County, Guizhou Province, China[J]. Earth Environ, 2015, 43(5): 490-497. 刘兴, 王世杰, 刘秀明, 等. 贵州喀斯特地区土壤细菌群落结构特征及变化[J]. 地球与环境, 2015, 43(5): 490-497. DOI:10.14050/j.cnki.1672-9250.2015.05.002 |
| [31] |
SU D, BAO E Y, WANG J. Microbiome composition in rhizosphere and bulk soil of calciphilous plant Primulina tabacum[J]. J Agric Sci Technol, 2020, 22(10): 149-156. 苏迪, 鲍恩俣, 王进. 适钙植物报春苣苔根际土壤微生物群落结构[J]. 中国农业科技导报, 2020, 22(10): 149-156. DOI:10.13304/j.nykjdb.2019.0522 |
| [32] |
ZHANG C L, SHANG X R, ZHAO X, et al. Diversity and structure of rhizosphere bacteria community of Caragana korshinskii in the cold and dry area[J]. N Hort, 2021(17): 97-103. 张春林, 尚晓蕊, 赵鑫, 等. 寒旱区柠条根际细菌群落结构与多样性研究[J]. 北方园艺, 2021(17): 97-103. DOI:10.11937/bfyy.20210375 |
| [33] |
FU L J, LI X Q, FAN J H, et al. Analysis of rhizosphere soil bacterial community structure diversity and root characteristics of typical plants in alpine steppe of northern Xizang[J]. Atca Agrest Sin, 2022, 30(5): 1131-1140. 付莉娇, 李雪琴, 范继辉, 等. 藏北高寒草原典型植物根际土壤细菌群落结构多样性及根系特征分析[J]. 草地学报, 2022, 30(5): 1131-1140. DOI:10.11733/j.issn.1007-0435.2022.05.013 |
| [34] |
DAI J X, TIAN P Y, ZHANG Y, et al. Rhizobacteria community structure and diversity of six salt-tolerant plants in Yinbei saline soil[J]. Acta Ecol Sin, 2019, 39(8): 2705-2714. 代金霞, 田平雅, 张莹, 等. 银北盐渍化土壤中6种耐盐植物根际细菌群落结构及其多样性[J]. 生态学报, 2019, 39(8): 2705-2714. DOI:10.5846/stxb201804240929 |
| [35] |
CHEN L, XIN X L, ZHANG J B, et al. Soil characteristics overwhelm cultivar effects on the structure and assembly of root-associated microbiomes of modern maize[J]. Pedosphere, 2019, 29(3): 360-373. DOI:10.1016/S1002-0160(17)60370-9 |
| [36] |
TU Y L. A analysis of flora and Ecologicai characteristics of karst scrubs in Guizhou Province[J]. J Guizhou Norm Univ (Nat Sci), 1995, 13(3): 1-8. 屠玉麟. 贵州喀斯特灌丛区系与生态特征分析[J]. 贵州师范大学学报(自然科学版), 1995, 13(3): 1-8. |
| [37] |
LI X Z, RUI J P, XIONG J B, et al. Functional potential of soil microbial communities in the maize rhizosphere[J]. PLoS One, 2014, 9(11): e112609. DOI:10.1371/journal.pone.0112609 |
| [38] |
NA X F, ZHENG G Q, PENG L, et al. Microbial biodiversity in rhizosphere of Lycium bararum L. relative to cultivation history[J]. Acta Pedol Sin, 2016, 53(1): 241-252. 纳小凡, 郑国琦, 彭励, 等. 不同种植年限宁夏枸杞根际微生物多样性变化[J]. 土壤学报, 2016, 53(1): 241-252. DOI:10.11766/trxb201503030643 |
| [39] |
SUN Y H, ZHAO Y H, KONG L Z L, et al. Effects of Suaeda glauca at different growth stages on bacterial community structure in the rhizosphere soil[J]. Chin J Grassland, 2022, 44(1): 78-86. 孙一航, 赵一航, 孔令泽来, 等. 不同生长时期碱蓬对根际土壤细菌群落结构的影响[J]. 中国草地学报, 2022, 44(1): 78-86. DOI:10.16742/j.zgcdxb.20210175 |
| [40] |
GRIFFITHS R I, THOMSON B C, JAMES P, et al. The bacterial biogeography of British soils[J]. Environ Microbiol, 2011, 13(6): 1642-1654. DOI:10.1111/j.1462-2920.2011.02480.x |
| [41] |
RAHMAN M S, QUADIR Q F, RAHMAN A, et al. Screening and characterization of phosphorus solubilizing bacteria and their effect on rice seedlings[J]. Res Agric Livest Fish, 2015, 1(1): 27-35. DOI:10.3329/ralf.v1i1.22353 |
| [42] |
POLÓNIA A R M, CLEARY D F R, DUARTE L N, et al. Composition of archaea in seawater, sediment, and sponges in the Kepulauan Seribu reef system, Indonesia[J]. Microb Ecol, 2014, 67(3): 553-567. DOI:10.1007/s00248-013-0365-2 |
| [43] |
MA X, LUO Z Z, ZHANG Y Q, et al. Distribution characteristics and ecological function predictions of soil bacterial communities in rainfed alfalfa fields on the Loess Plateau[J]. Acta Pratacult Sin, 2021, 30(3): 54-67. 马欣, 罗珠珠, 张耀全, 等. 黄土高原雨养区不同种植年限紫花苜蓿土壤细菌群落特征与生态功能预测[J]. 草业学报, 2021, 30(3): 54-67. DOI:10.11686/cyxb2020381 |
| [44] |
BROMKE M A. Amino acid biosynthesis pathways in diatoms[J]. Metabolites, 2013, 3(2): 294-311. DOI:10.3390/metabo3020294 |
| [45] |
RIVETT D W, BELL T. Abundance determines the functional role of bacterial phylotypes in complex communities[J]. Nat Microbiol, 2018, 3(7): 767-772. DOI:10.1038/s41564-018-0180-0 |
| [46] |
ZHANG R F, VIVANCO J M, SHEN Q R. The unseen rhizosphere root-soil-microbe interactions for crop production[J]. Curr Opin Microbiol, 2017, 37: 8-14. DOI:10.1016/j.mib.2017.03.008 |
| [47] |
WANG Y Z, PAN T G, KE Y Q. Study and utilization on symbiotic relation between microbes and plants[J]. Chin J Eco-Agric, 2003, 11(3): 95-98. 王元贞, 潘廷国, 柯玉琴. 微生物与植物共生关系的研究及其利用[J]. 中国生态农业学报, 2003, 11(3): 95-98. |
| [48] |
WANG H, NIU D K, HU D N, et al. Effects of different fertilization on soil nitrogen and microbial community and function in Camellia oleifera forest[J]. J Plant Nutr Fertil, 2014, 20(6): 1468-1476. 王华, 牛德奎, 胡冬南, 等. 不同肥料对油茶林土壤氮素含量、微生物群落及其功能的影响[J]. 植物营养与肥料学报, 2014, 20(6): 1468-1476. DOI:10.11674/zwyf.2014.0617 |
| [49] |
XIAN W D, ZHANG X T, LI W J. Research status and prospect on bacterial phylum Chloroflexi[J]. Acta Microbiol Sin, 2020, 60(9): 1801-1820. 鲜文东, 张潇橦, 李文均. 绿弯菌的研究现状及展望[J]. 微生物学报, 2020, 60(9): 1801-1820. DOI:10.13343/j.cnki.wsxb.20200463 |
| [50] |
ZHANG C L, ZHANG Y M, DING Z J, et al. Contribution of microbial inter-kingdom balance to plant health[J]. Mol Plant, 2019, 12(2): 148-149. DOI:10.1016/j.molp.2019.01.016 |
 2024, Vol. 32
2024, Vol. 32


