2. 中国林业科学研究院热带林业研究所, 热带林业研究国家林业和草原局重点实验室, 广州 510520
2. Key Laboratory of Tropical Forestry Research, National Forestry, and Grassland Administration, Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China
植物组织培养是一种不同于传统繁殖方法的常用技术,可以实现物种的大规模无性繁殖,其主要受外植体类型、培养基组成、植物生长调节剂和培养条件等多个因素的影响。目前,该技术已广泛应用于许多重要森林树种的大规模繁殖。培养基提供的矿物质营养素的类型和浓度决定了植物组织增殖的速度和形态生长质量。磷作为植物生长发育不可缺少的矿质营养元素之一,参与植物体内多个生理生化反应,如光合磷酸化、能量代谢、光合作用、呼吸作用、氧化还原反应、信号转导及碳水化合物的合成与运转等,是培养基中基本而又大量的营养元素,对植物生长发育起着不可替代的作用[1–3]。研究表明,不同磷水平下林木形态和生理生化水平会发生显著变化,如大花序桉(Eucalyptus cloeziana)[4]、马尾松(Pinus massoniana)[5]、尾巨桉(E. grandis×E. urophylla)[6]等的幼苗中均有研究。而关于磷营养对林木丛生芽诱导及其生长发育影响的研究尚不完善。
黑木相思(Acacia melanoxylon),也叫澳洲黑檀,为含羞草科(Mimosaceae)金合欢属乔木,耐瘠薄, 具固氮根瘤,枯落物丰富,改土性能良好。自20世纪90年代引入中国后,黑木相思已成为我国华南地区速生丰产、珍贵用材和生态公益等多用途树种。国内关于黑木相思种源家系试验、组培快繁[7]和无性选育[8–9]等方面已有较多研究。磷对黑木相思幼苗生长发育具有重要影响[10]。本研究以黑木相思无性系SR17增殖苗为材料,设置0.9、1.2、1.6、2.0、2.4、2.7 mmol/L 6个供磷量梯度的增殖培养基,继代培养1和2个周期时,分别调查丛生芽的生长特性、生物量、叶绿素含量和矿质元素含量,分析不同磷水平对黑木相思丛生芽生长发育的影响, 筛选最适供磷量,为研究磷对林木增殖苗丛生芽诱导的机理奠定基础,为黑木相思无性系工厂化育苗提供依据。
1 材料和方法 1.1 材料采用单因素实验设计,以黑木相思增殖培养基(MS+蔗糖30 g/L+6-BA 0.3 mg/L+IBA 0.2 mg/L+琼脂6 g/L)为基础,以KH2PO4为磷源,设置0.9 (P1)、1.2 (P2)、1.6 (P3)、2.0 (P4)、2.4 (P5)和2.7 mmol/L (P6)共6个磷水平,并分别加入1.8、1.5、1.1、0.7、0.3、0 mmol/L KCl使不同处理中钾含量保持一致。将不同磷水平的培养基分装至240 mL容积的玻璃组培瓶中,每瓶装30 mL,经121 ℃高压蒸汽灭菌15 min。以黑木相思(Acacia melanoxylon) SR17组培苗为材料,选择生长势一致的增殖苗,切取约2 cm长的单芽接种于培养基中,每瓶接种6个芽,每处理接种28瓶,继代周期35 d。培养温度约26 ℃,相对湿度约60%,光强约36 µmol/(m2·s),光/暗周期为12 h/12 h。
1.2 生长指标的测定分别于继代1 (S1)和2 (S2)周期时,调查每丛生芽中高于0.5 cm的芽数量,用游标卡尺测定每丛生芽中最高芽的长度及基部愈伤组织的最大长和最大宽。愈伤组织大小=最大长×最大宽×最大高。每处理测定28瓶,每瓶5个丛生芽。
1.3 生物量的测定于2个继代周期后,去掉丛生芽基部愈伤组织,用天平称量丛生芽的鲜重,然后装入纸袋中,于60 ℃烘至恒重,再称量干重,计算含水率=(鲜重–干重)/鲜重×100%。由于1个丛生芽过小,每瓶5个丛生芽作为1组,每处理测定28组。
1.4 光合色素含量的测定2个继代周期后,去掉丛生芽基部愈伤组织, 采用分光光度法测定丛生芽的叶绿素和类胡萝卜素含量[11]。用80%丙酮为提取液,测定波长440、645和663 nm下的吸光值A440、A645和A663, 计算叶绿素和类胡萝卜素含量。叶绿素a=12.7×A663–2.69×A645×稀释倍数/重量、叶绿素b=22.9×A645– 4.68×A663×稀释倍数/重量、类胡萝卜素=4.7×A440–0.27×(叶绿素a+叶绿素b)×稀释倍数/重量。每瓶5个丛生芽作为1组,每处理测定5组。
1.5 矿质元素含量的测定2个继代周期后,去掉丛生芽基部愈伤组织, 测定丛生芽氮、磷、钾含量。采用凯氏定氮法测定氮含量;紫外可见分光光度计测定磷含量;火焰光度计测定钾含量[12]。每瓶5个丛生芽作为1组,每处理测定5组。
1.6 数据的统计分析采用Microsoft Excel 2017和Origin 2019软件进行数据处理与作图,采用SPSS 25.0对数据进行方差分析和Duncan多重比较。
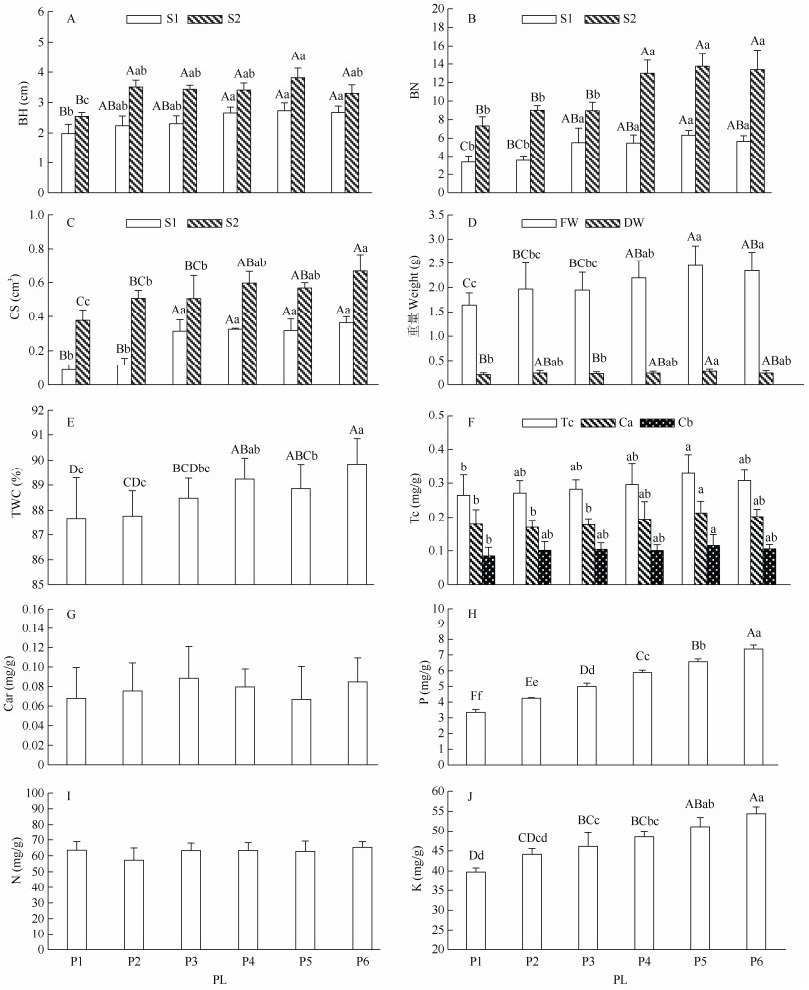
2 结果和分析 2.1 磷对丛生芽生长的影响黑木相思丛生芽在不同磷水平增殖培养基中培养1~2个继代周期后的生长情况见图 1。由图 2: A~C可知,S1的P4~P6处理芽较高,以P5最高, 为2.73 cm; P3~P6处理的芽数量极显著增多,以P5最多, 达6.3个;P3~P6处理的基部愈伤组织极显著增大,以P6的最大,为0.71 cm3。S2的P2~P6处理的芽极显著高于P1,以P5的最高,为3.81 cm;P4~P6处理的芽数量极显著增多,以P5的最多,达13.8个。随着磷水平的增加,P1~P6处理的基部愈伤组织大小呈增大趋势,以P6的最大,为0.70 cm3。另外,相同磷水平下,S2比S1的芽高增长了1.24~1.60倍;芽数量增多了1.72~2.57倍;愈伤组织体积增加了1.84~4.26倍。可见,高水平磷(P5~P6)促进黑木相思丛生芽的高度、数量和基部愈伤组织的快速发育。

|
图 1 黑木相思丛生芽的生长情况。S1: 1个继代周期;S2: 2个继代周期;P1: 0.9 mmol/L KH2PO4; P2: 1.2 mmol/L KH2PO4; P3: 1.6 mmol/L KH2PO4; P4: 2.0 mmol/L KH2PO4; P5: 2.4 mmol/L KH2PO4; P6: 2.7 mmol/L KH2PO4。下同 Fig. 1 Cluster bud growth of Acacia melanoxylon. S1: 1 cycle of subgeneration; S2: 2 cycles of subgeneration; P1: 0.9 mmol/L KH2PO4; P2: 1.2 mmol/L KH2PO4; P3: 1.6 mmol/L KH2PO4; P4: 2.0 mmol/L KH2PO4; P5: 2.4 mmol/L KH2PO4; P6: 2.7 mmol/L KH2PO4. The same below |
|
图 2 磷对黑木相思丛生芽的生长和生理指标的影响。柱上小写和大写字母分别表示差异显著(P < 0.05)和极显著(P < 0.01)。PL: 磷水平; BH: 高度; BN: 数量; CS: 愈伤组织体积; FW: 鲜重; DW: 干重; TWC: 组织含水率; Ca: 叶绿素a; Cb: 叶绿素b; Tc: 总叶绿素; Car: 类胡萝卜素。下同 Fig. 2 Effect phosphorus on growth and physiological characteristics of Acacia melanoxylon cluster buds. Small and capital letters upon column indicate significant differences at 0.05 and 0.01 levels, respectively. PL: Phosphorus level; BH: Bud height; BN: Bud number; CS: Callus size; FW: Fresh weight; DW: Dry weight; TWC: Tissue water content; Ca: Chlorophyll a; Cb: Chlorophyll b; Tc: Total chlorophyll content; Car: Carotenoid. The same below |
由图 2: D, E可知,P5处理的芽鲜重和干重均最高,分别为2.45和0.27 g;P1处理的均极显著低于P5,分别为P5的67.02%和74.40%。随磷水平的增加, 丛生芽的组织含水率逐渐增高,为87.67%~89.84%, 以P6的最高。可见,高磷水平(P5和P6)促进了黑木相思丛生芽生物量和水分的积累。
2.3 磷对丛生芽光合色素含量的影响由图 2: F, G可知,P1处理的芽总叶绿素含量、叶绿素a和叶绿素b含量均最低,分别为264.61、177.81和84.92 ng/g。随磷水平的增加,芽中叶绿素含量逐渐增加,以P5为最高,分别为P1的1.24、1.20和1.36倍,显著高于P1。不同磷水平处理的芽中类胡萝卜素含量的差异均未达显著水平,其中P3和P6含量较高,分别为88.52和84.85 ng/g,P1和P5含量较低,分别为67.84和66.88 ng/g。可见, 磷可以影响黑木相思丛生芽叶绿素的含量,从而影响光合作用。
2.4 磷对丛生芽矿质元素含量的影响由图 2: H~J可知,随培养基中磷水平的增加, 丛生芽中磷含量增加,差异达极显著水平,P2~P6处理的磷含量分别为P1的1.27、1.49、1.76、1.96和2.20倍。随培养基中磷水平的增加,丛生芽中钾含量也逐渐增加,P2~P6分别为P1的1.11、1.16、1.22、1.28和1.37倍;P1~P6处理的氮含量差异不显著, 以P2最低,为57.31 mg/g,P6最高,为65.23 mg/g。这说明磷可以影响黑木相思丛生芽中矿质元素的平衡,高水平磷的积累促进芽对钾的吸收,但对氮的吸收无明显作用。
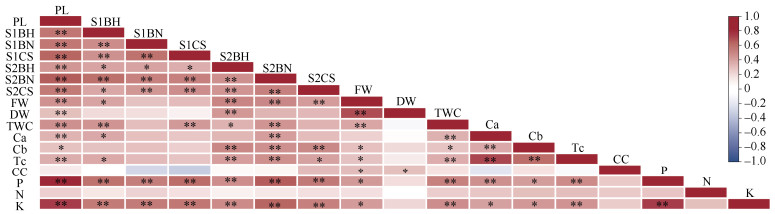
2.5 相关性分析利用Pearson相关性分析法分析磷水平、丛生芽高度和数量、基部愈伤组织体积、生物量和组织含水率、光合色素含量和矿质元素含量间的相关性(图 3)。结果表明,磷水平与S1和S2芽的高度、数量、基部愈伤组织、鲜重、干重、组织含水率和总叶绿素、叶绿素a、叶绿素b、磷、钾含量呈显著或极显著正相关。丛生芽中磷和钾含量与S1和S2芽的高度、数量、基部愈伤组织体积、鲜重、组织含水率、叶绿素含量呈显著或极显著正相关。S1和S2芽的高度、数量、基部愈伤组织体积间呈显著或极显著正相关。丛生芽的鲜重与S1芽的高度和S2芽的高度、数量、基部愈伤组织体积、叶绿素b、总叶绿素、类胡萝卜素、磷、钾含量呈显著或极显著正相关;干重与S2芽的高度、类胡萝卜素含量呈显著或极显著正相关。可见,磷水平对黑木相思丛生芽的生长发育具有密切影响;磷与钾元素协同影响黑木相思丛生芽的生长发育。
|
图 3 磷水平与丛生芽生长发育特性间的相关性。*: P < 0.05;**: P < 0.01。 Fig. 3 Relationship between phosphorus levels and growth and development indexes of cluster bud. *: P < 0.05;**: P < 0.01. |
磷在细胞生命活动中具有重要作用,是DNA、RNA、ATP等许多生物活性物质的组成元素,对细胞分裂、繁殖和分生组织发育有着重要的意义。植物为了适应低磷环境,进化出复杂的调节机制,通过感知外部和内部的磷浓度形成局部和系统的信号通路,从而调节磷的获取、再分配以及磷的利用效率,最终促使植物的最优化发育[13]。本研究表明,高水平磷对黑木相思丛生芽的发育有明显的促进作用,黑木相思丛生芽的高度和数量在P5水平下最佳, 可能是由于低水平磷造成了缺磷环境,影响细胞分裂,抑制芽分化[14],从而影响丛生芽的发育。油松(Pinus tabuliformis)增殖培养时,将MS培养基中的磷素浓度提高至原来的2倍,分化出的丛生芽数较多且芽色浓绿,生长健壮[15]。青钱柳(Cyclocarya paliurus)愈伤组织生长量会随KH2PO4浓度的增大呈现出先增大后减小的趋势,且当浓度提高至0.15倍时,愈伤组织生长量达到最大[16]。本研究表明高水平磷促进黑木相思芽基部愈伤组织增大, 因此, 适宜的磷浓度对丛生芽的生长与愈伤组织的诱导具有促进作用,可能是磷可以调控AIPT、BTF3、D2等正调控植物株高和叶片大小的基因和抑制GH3.2、GH3.6、GH3.8、ERF113、CYP73A4、CKX5等负调控的基因表达[17]。
3.2 磷对丛生芽光合色素含量的影响磷参与光合电子传递和植物能量代谢,影响ATPase的磷酸化过程和碳同化过程[18–19],对叶绿素合成和光合作用的运转有很大的影响。叶绿素是植物光合磷酸化反应中吸收光子和传递电子的主要色素,对植物光合产物的积累及植物的生长发育具有重要作用[20]。本研究表明,P1~P6处理间芽叶绿素含量的差异达显著水平,以P5水平最高,而磷水平对类胡萝卜素含量则无明显促进作用,这与对马尾松[5, 21]和黑木相思[10]的研究结果类似,低磷胁迫使幼苗叶绿素含量显著下降,可能是磷调控了光合作用关键基因PRGs的表达。有研究表明,低磷胁迫诱导了叶绿素降解相关基因SGR、NAC029、RCCR、CLH2的表达,抑制了叶绿素合成相关基因CHLG、PTC52的表达[17]。类胡萝卜素作为光保护剂和辅助色素,可以吸收过量的光能使植物免受伤害,其含量下降会降低植物光合器官的抗性[22]。低磷胁迫下大花序桉[4]和钝顶螺旋藻(Spirulina platensis)[23]的类胡萝卜素含量下降,而马尾松的变化不明显[5, 21],与本研究结果类似,说明磷对类胡萝卜素的影响还不够明确,有待进一步研究。
3.3 磷对丛生芽N、P、K含量的影响氮、磷和钾是植物生长发育所必需的大量营养元素,它们之间存在着复杂的互作效应,影响植物的生长和发育[24–25]。磷与钾存在协同作用的关系, 适当提高供磷水平可以促进钾的吸收,低磷胁迫下铁核桃(Juglans sigillata)[26]、尾巨桉[6]、脐橙枳(Poncirus trifoliate)和砧纽荷尔脐橙(Citrus sinensis)[27]对钾的吸收受限。对番茄(Lycopersicon esculentum)转录组学分析表明,外部钾或磷水平的变化会迅速诱导一些相关基因(编码TF、MAPK、MAPKK、14-3-3蛋白等)的表达,表明植物对磷和钾的响应信号通路存在交联作用[28]。相反,外部较高的K+浓度会抑制拟南芥(Arabidopsis thaliana)对磷的吸收,从而诱导磷酸盐饥饿反应(PSR)并上调磷酸吸收的相关基因[29]。磷对氮含量的作用还不明确,适宜的磷能明显提升马尾松[30]、烟草(Nicotiana tabacum)[31]和杉木(Cunninghamia lanceolata)[32]的氮含量,低磷胁迫下植物组织中含氮量会下降;但水稻(Oryza sativa)[33]施加不同磷肥,对氮的吸收量变化不大。研究表明,在外部氮/磷环境变化后,转录因子NIGT1.2、NO3–传感器AtNRT1.1/OsNRT1.1B和SPX协调氮磷信号传导,从而影响硝酸盐和磷酸盐的摄入[34–35]。由此说明,磷与氮和钾之间存在着密切的相互作用,它们之间通过一系列的内在机制调节从而最终影响植物有效吸收营养。本研究中黑木相思丛生芽中磷的积累对氮含量并未有明显的影响,因此,磷与氮之间的这种相互作用有待进一步探究。
综上,磷水平影响了黑木相思增殖苗丛生芽的生长发育、叶绿素含量及矿质元素的平衡。继代1和2个周期,2.0~2.7 mmol/L KH2PO4能促进黑木相思增殖苗丛生芽的高度、数量、基部愈伤组织快速生长,以2.4 mmol/L的效果最佳;第2个继代周期时, 1.2 mmol/L KH2PO4下丛生芽的高度、数量和基部愈伤组织体积的增长量最大;2.4 mmol/L KH2PO4下丛生芽的生物量、叶绿素含量积累效果最佳;随着培养基中磷水平的增加,丛生芽中磷和钾含量显著增加,氮含量无明显变化。Pearson相关性分析表明,磷水平与第1、2继代周期时丛生芽的高度、数量、基部愈伤组织体积、鲜重、干重、组织含水率和总叶绿素、叶绿素a、叶绿素b、磷、钾含量均呈显著或极显著正相关,说明磷对黑木相思丛生芽的生长发育具重要调控作用。
| [1] |
WHITE P J, HAMMOND J P. Phosphorus nutrition of terrestrial plants [M]// The Ecophysiology of Plant-Phosphorus Interactions. Dordrecht: Springer, 2008: 51–81. doi: 10.1007/978-1-4020-8435-5_4.
|
| [2] |
HAWKESFORD M J, CAKMAK I, COSKUN D, et al. Functions of macronutrients [M]// RENGEL Z, CAKMAK I, WHITE P J. Marschner's Mineral Nutrition of Plants. 4th ed. London: Academic Press, 2023: 201–281. doi: 10.1016/B978-0-12-819773-8.00019-8.
|
| [3] |
RAGHOTHAMA K G. Phosphate acquisition[J]. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50(1): 665-693. DOI:10.1146/annurev.arplant.50.1.665 |
| [4] |
HE B Y, LIU S N, YANG M, et al. Effects of low phosphorus stress on physiological characteristics of Eucalyptus coleziana seedling leaves[J]. SW China J Agric Sci, 2022, 35(2): 418-424. 何榜眼, 刘世男, 杨梅, 等. 低磷胁迫对大花序桉幼苗叶片生理指标的影响[J]. 西南农业学报, 2022, 35(2): 418-424. DOI:10.16213/j.cnki.scjas.2022.2.023 |
| [5] |
CHEN H Y, QUAN W X, LIU H Y, et al. Effects of Suillus luteus and S. bovinus on the physiological response and nutrient absorption of Pinus massoniana seedlings under phosphorus deficiency[J]. Plant Soil, 2022, 471(1/2): 577-590. DOI:10.1007/s11104-021-05211-5 |
| [6] |
YANG Q C, YANG M, CHENG F, et al. Effect of phosphorus on physiology and nutrient utilization of Eucalyptus urophylla×E. grandis tissue culture seedlings[J]. J NW A & F Univ (Nat Sci), 2023, 51(11): 65-75. 阳乾程, 杨梅, 程飞, 等. 磷对尾巨桉组培苗生理及养分利用的影响[J]. 西北农林科技大学学报(自然科学版), 2023, 51(11): 65-75. DOI:10.13207/j.cnki.jnwafu.2023.11.007 |
| [7] |
SU J Q, ZHANG F Q. Study on propagation technology about root sprout and tissue culture of Acacia melanoxylon[J]. Guangdong For Sci Technol, 2008, 24(3): 42-45. 苏锦强, 张方秋. 黑木相思根蘖促萌及组培繁育技术研究[J]. 广东林业科技, 2008, 24(3): 42-45. DOI:10.3969/j.issn.1006-4427.2008.03.008 |
| [8] |
LUO R, CHEN K K, QU B P, et al. Growth performance and early selection of Acacia melanoxylon clones at three sites[J]. Guangdong For Sci Technol, 2012, 28(5): 57-61. 罗锐, 陈考科, 曲保平, 等. 黑木相思无性系生长表现及早期选择[J]. 广东林业科技, 2012, 28(5): 57-61. DOI:10.3969/j.issn.1006-4427.2012.05.010 |
| [9] |
WU Q, ZENG B S, CHEN K K, et al. Early selection of Acacia melanoxylon clones[J]. Guangdong For Sci Technol, 2014, 30(6): 40-44. 吴清, 曾炳山, 陈考科, 等. 黑木相思无性系早期选择[J]. 广东林业科技, 2014, 30(6): 40-44. |
| [10] |
QIU Z F, FAN C J, ZENG B S. The physiological and biochemical responses of Acacia melanoxylon under phosphorus deficiency[J]. J SW For Univ, 2020, 40(6): 27-33. 裘珍飞, 范春节, 曾炳山. 缺磷培养下黑木相思苗木的生理生化响应[J]. 西南林业大学学报, 2020, 40(6): 27-33. DOI:10.11929/j.swfu.201910056 |
| [11] |
GAO J F. Experimental Guidance for Plant Physiology[M]. Beijing: Higher Education Press, 2006: 74-76. 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 74-76. |
| [12] |
LU R K. Methods for Agricultural Chemistry Analysis of Soil[M]. Beijing: China Agricultural Science and Technology Press, 2000. 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000. |
| [13] |
LYZENGA W J, LIU Z G, OLUKAYODE T, et al. Getting to the roots of N, P, and K uptake[J]. J Exp Bot, 2023, 74(6): 1784-1805. DOI:10.1093/jxb/erad035 |
| [14] |
ZHANG F S. New Trends in Soil and Plant Nutrition Research, Vol. 3[M]. Beijing: China Agriculture Press, 1995. 张福锁. 土壤与植物营养研究新动态, 第3卷[M]. 北京: 中国农业出版社, 1995. |
| [15] |
XIAO Y. Study on influence of the nitrogen, the phosphorus and the potassium element on embryo culture of Pinus tabulaeformis[D]. Yangling: Northwest A & F University, 2006. 肖颖. 氮、磷、钾元素对油松胚培养影响的研究[D]. 杨凌: 西北农林科技大学, 2006. |
| [16] |
SHANGGUAN X C, JIANG Y, MI L X, et al. Effects of five macronutrients on the growth and flavonoid accumulation of Cyclocarya paliurus callus[J]. Acta Agric Univ Jiangxi, 2011, 33(3): 502-507. 上官新晨, 蒋艳, 米丽雪, 等. 5种大量元素对青钱柳愈伤组织生长及黄酮类化合物积累的影响[J]. 江西农业大学学报, 2011, 33(3): 502-507. DOI:10.13836/j.jjau.2011090 |
| [17] |
SHE B Y. Study on the mechanisms of low phosphorus stress and OsGRF1 gene on the regulation of rice morphological and physiological traits[D]. Yangzhou: Yangzhou University, 2023. 佘冰雨. 低磷胁迫和OsGRF1基因调控水稻形态和生理性状的机制研究[D]. 扬州: 扬州大学, 2023. doi: 10.27441/d.cnki.gyzdu.2023.002426. |
| [18] |
CARSTENSEN A, HERDEAN A, SCHMIDT S B, et al. The impacts of phosphorus deficiency on the photosynthetic electron transport chain[J]. Plant Physiol, 2018, 177(1): 271-284. DOI:10.1104/pp.17.01624 |
| [19] |
XING D K, WU Y Y. Effect of phosphorus deficiency on photosynthetic inorganic carbon assimilation of three climber plant species[J]. Bot Stud, 2014, 55(1): 60. DOI:10.1186/s40529-014-0060-8 |
| [20] |
WANG P R, ZHANG F T, GAO J X, et al. An overview of chlorophyll biosynthesis in higher plants[J]. Acta Bot Boreali-Occid Sin, 2009, 29(3): 629-636. 王平荣, 张帆涛, 高家旭, 等. 高等植物叶绿素生物合成的研究进展[J]. 西北植物学报, 2009, 29(3): 629-636. DOI:10.3321/j.issn:1000-4025.2009.03.032 |
| [21] |
QIAO G, CUI B W, WEN X P, et al. Physiological and biochemical responses to low phosphorus stress for different masson pine (Pinus massoniana) provenances[J]. Seed, 2017, 36(8): 32-36. 乔光, 崔博文, 文晓鹏, 等. 不同种源马尾松幼苗对低磷胁迫的生理响应[J]. 种子, 2017, 36(8): 32-36. DOI:10.16590/j.cnki.1001-4705.2017.08.032 |
| [22] |
XU Y H, ZUO Y C, XI Y, et al. Influences of different Ca/P ratios and concentrations on growth characteristics of Lolium multiflorum[J]. J Agric Sci Technol, 2020, 22(5): 174-180. 徐彦红, 左意才, 席溢, 等. 不同钙磷配比及浓度对多花黑麦草生长特性的影响[J]. 中国农业科技导报, 2020, 22(5): 174-180. DOI:10.13304/j.nykjdb.2019.0167 |
| [23] |
CUI Y, LIU H Y, LI W Y, et al. Effect of nitrogen and phosphorous concentrations on growth, metabolites and chlorophyll fluorescence parameters of immobilized Spirulina platensis[J]. Acta Bot Boreali-Occid Sin, 2023, 43(1): 136-146. 崔岩, 刘海燕, 李武阳, 等. 固定化培养中氮磷浓度对钝顶螺旋藻生长及其代谢产物和叶绿素荧光参数的影响[J]. 西北植物学报, 2023, 43(1): 136-146. DOI:10.7606/j.issn.1000-4025.2023.01.0136 |
| [24] |
ROSENSTOCK N P, BERNER C, SMITS M M, et al. The role of phosphorus, magnesium and potassium availability in soil fungal exploration of mineral nutrient sources in Norway spruce forests[J]. New Phytol, 2016, 211(2): 542-553. DOI:10.1111/nph.13928 |
| [25] |
MILLA R, CASTRO-DÍEZ P, MAESTRO-MARTÍNEZ M, et al. Relationships between phenology and the remobilization of nitrogen, phosphorus and potassium in branches of eight Mediterranean evergreens[J]. New Phytol, 2005, 168(1): 167-178. DOI:10.1111/j.1469-8137.2005.01477.x |
| [26] |
ZANG C F, FAN W G, PAN X J. Effect of phosphorus levels on growth, morphological characteristics and leaf element contents of Juglans sigillata Dode seedlings[J]. Sci Agric Sin, 2016, 49(2): 319-330. 臧成凤, 樊卫国, 潘学军. 供磷水平对铁核桃实生苗生长、形态特征及叶片营养元素含量的影响[J]. 中国农业科学, 2016, 49(2): 319-330. DOI:10.3864/j.issn.0578-1752.2016.02.012 |
| [27] |
ZHANG Y Y, MA J L, GUAN G, et al. Differential response of nutrient content of new and old leaves of young navel orange to short-term deficiency of macroelements and secondary elements[J]. J Plant Nutr Fert, 2023, 29(2): 353-362. 张圆圆, 马金龙, 管冠, 等. 脐橙幼苗新老叶片养分含量对大、中量元素短期缺乏的差异性响应[J]. 植物营养与肥料学报, 2023, 29(2): 353-362. DOI:10.11674/zwyf.2022298 |
| [28] |
WANG Y H, GARVIN D F, KOCHIAN L V. Rapid induction of regulatory and transporter genes in response to phosphorus, potassium, and iron deficiencies in tomato roots: Evidence for cross talk and root/rhizosphere-mediated signals[J]. Plant Physiol, 2002, 130(3): 1361-1370. DOI:10.1104/PP.008854 |
| [29] |
RÓDENAS R, MARTÍNEZ V, NIEVES-CORDONES M, et al. High external K+ concentrations impair Pi nutrition, induce the phosphate starvation response, and reduce arsenic toxicity in Arabidopsis plants[J]. Int J Mol Sci, 2019, 20(9): 2237. DOI:10.3390/ijms20092237 |
| [30] |
QIN X J, DING G J. Effects of low phosphorus stress on absorption and utilization of nitrogen and potassium in different provenances Pinus massoniana seedlings[J]. J CS Univ For Technol, 2012, 32(4): 32-36. 秦晓佳, 丁贵杰. 低磷胁迫对不同种源马尾松幼苗氮钾吸收与利用的影响[J]. 中南林业科技大学学报, 2012, 32(4): 32-36. DOI:10.3969/j.issn.1673-923X.2012.04.007 |
| [31] |
JIA Z H, YI J H, FU J G, et al. Effects of phosphorus treatment on flue-cured tobacco growth physiological characteristics and root configuration[J]. Soils, 2011, 43(3): 388-391. 贾志红, 易建华, 符建国, 等. 磷肥处理对烤烟生长生理及根系构型的影响[J]. 土壤, 2011, 43(3): 388-391. DOI:10.13758/j.cnki.tr.2011.03.025 |
| [32] |
YU Q M, XU F L, WANG W L. Effect of nitrogen and phosphorus fertilization on biomass and nutrient distribution of Cunninghamia lanceolata seedlings[J]. J Plant Nutr Fert, 2014, 20(1): 118-128. 于钦民, 徐福利, 王渭玲. 氮、磷肥对杉木幼苗生物量及养分分配的影响[J]. 植物营养与肥料学报, 2014, 20(1): 118-128. DOI:10.11674/zwyf.2014.0113 |
| [33] |
ZHU B X. Study on screening the rice seedling substrates and substrates fertilizing for mechanical transplanting[D]. Wuhan: Huazhong Agricultural University, 2015. 朱冰心. 水稻机插秧育秧基质筛选及基质培肥效应研究[D]. 武汉: 华中农业大学, 2015. |
| [34] |
WANG X, WANG H F, CHEN Y, et al. The transcription factor NIGT1.2 modulates both phosphate uptake and nitrate influx during phosphate starvation in Arabidopsis and maize[J]. Plant Cell, 2020, 32(11): 3519-3534. DOI:10.1105/tpc.20.00361 |
| [35] |
WANG Y, CHEN Y F, WU W H. Potassium and phosphorus transport and signaling in plants[J]. J Integr Plant Biol, 2021, 63(1): 34-52. DOI:10.1111/jipb.13053 |
 2024, Vol. 32
2024, Vol. 32


