1b. 海南大学生命健康学院, 海口 570228;
1c. 海南大学植物保护学院, 海口 570228;
2. 海南省生态环境修复工程中心, 海口 570228;
3. 海南省农林环境过程与生态调控重点实验室, 海口 570228
1b. School of Life and Health Sciences, Hainan University, Haikou 570228, China;
1c. School of Plant Protection, Hainan University, Haikou 570228, China;
2. Center for Eco-Environmental Restoration Engineering of Hainan Province, Haikou 570228, China;
3. Key Laboratory of Agro-Forestry Environmental Processes and Ecological Regulation of Hainan Province, Haikou 570228, China
水淹是常见的非生物胁迫,目前全球有超过10%的土地受到水淹影响,尤其在热带和亚热带地区[1]。随着全球气候变化加剧,未来极端降雨事件发生的频率和强度还将进一步增加[2]。水淹不仅会稀释土壤养分浓度导致养分可用性降低[3],而且水淹诱导的养分缺乏还会干扰植物多种生理过程,如光合作用、呼吸和生长,最终导致叶片过早衰老, 甚至死亡。一些研究发现,增加养分供应有助于植物抵御水淹逆境[4]。增加水淹下土壤养分供应抑制了小麦(Triticum aestivum)光合作用、叶绿素含量以及茎生长速率的下降[5],促进了水芹(Oenanthe javanica)生物量积累[6],并增加了冬油菜(Brassica napus)和玉米(Zea mays)产量[7]。由此可见,富营养化水体水淹能增加一些草本和作物的水淹耐受性。然而, 目前关于热带陆生乔木植物响应富营养化水体水淹的实验证据有限,其机制尚不清楚。
干旱作为另一种常见的非生物胁迫,被认为是最具破坏性的逆境因子,随着全球气候变化和生态环境的不断恶化,对植物抗旱性的研究也愈加重视,被子植物对干旱胁迫的生理、生化和分子响应已有很多报道,尤其是一些农作物和经济林木的抗旱机制研究已经深入到基因工程水平。然而,单一干旱胁迫对植物的影响不同于水淹后的干旱胁迫。水淹后的干旱降低了白柳(Salix alba)根系对输水能力的调整[8];增强了小叶榆(Ulmus minor)根系对干旱的敏感性,尤其是对水淹更敏感的MDV2.3、MMJ1和RET基因型植物[9]。同时也有研究表明, 前期水淹不会增加植株对后期干旱胁迫的敏感性。水淹并未改变牛鞭草(Hemarthria altissima)光合特性对后期干旱的响应[10];与对照-干旱相比,水淹并未影响后期干旱下落羽杉(Taxodium distichum)和水杉(Metasequoia glyptostroboides)的生理生态适应能力[11];此外,水淹-干旱处理下,香根草的各项生长和生理指标差异均能随着处理周期的增加逐渐减小,并最终恢复或趋于稳定状态[12]。这表明植物对水淹-干旱胁迫的响应存在显著的种间差异。
海南岛属典型的热带季风气候,年内降水分为明显的干湿两季,旱涝急转发生频率高[13]。降香黄檀(Dalbergia odorifera)为豆科(Leguminosae)黄檀属半落叶乔木,海南特有的国家二级保护植物,具有重要的经济和生态价值。先前研究表明,降香黄檀具备一定的水淹耐受性,可作为热带地区水库消落区和河岸带植被修复的适宜树种[14]。然而,关于富营养水体对降香黄檀幼苗水淹耐受性的影响,以及前期水淹是否会影响降香黄檀幼苗后期干旱耐受性仍不清楚。鉴于此,本研究以降香黄檀幼苗为研究对象,通过模拟富营养化水淹及“水淹-干旱”交替胁迫,旨在探究降香黄檀幼苗对富营养化水体的响应;并揭示前期水淹对后期降香黄檀幼苗耐旱能力的影响。其预期结果可为降香黄檀在消落区、河岸带、污染水体等特殊区域的合理应用提供一定的科学指导。
1 材料和方法 1.1 材料2019年12月将育苗袋中萌发并生长2个月的降香黄檀幼苗移栽到塑料盆中(口径21 cm、高19 cm), 置于海南大学(20°03′33.2″ N,110°20′16.9″ E)试验大棚内(阻挡降水,但保持外部相同的温度和光照)进行培养。待长势稳定后,修剪幼苗至离土面10 cm处,使其均匀生长。培养基质为沙土(红壤土: 河沙: 椰糠=4:2:1)。待发芽生长5个月后,选取长势相似且健康、平均株高为49.4 cm幼苗开展试验。试验期间平均温度为25.43 ℃,光照强度为200.83 μmol/(m2·s) (https://www.meteoblue.com/)。
1.2 试验设计试验采用完全随机设计,共分为2个阶段。第1阶段为水淹阶段:将幼苗随机分为对照(CK)、养分(H)、水淹(W)和模拟富营养化水淹(WH) 4个处理组。其中CK组:每天正常浇水1次(水分从盆底自由流出为止);H组:每7 d浇1/2浓度的Hoagland营养液1次,其余时间与CK组保持一致;W和WH组:将幼苗浸没在1个大的塑料桶中并每天补充水分维持离土面15 cm的水淹深度,且WH组每7 d添加1/2浓度的Hoagland营养液1次。Hoagland浓度依据富营养化水体中氮和磷含量选择(总氮和总磷含量分别大于0.3和0.02 mg/L时为富营养化水体)[15]。整个水淹阶段持续时间为100 d。第2阶段为干旱阶段,在第1阶段基础上将每个处理组直接转为干旱处理,即对照-干旱(CKD),养分-干旱(HD), 水淹-干旱(WD)和模拟富营养化水淹-干旱(WHD)。每天傍晚(18:00)通过人工称重的方法补充水分,以确保土壤含水量维持在40%田间持水量。每处理组4个重复,每个重复6株幼苗,整个干旱阶段持续时间为80 d。
1.3 方法形态生物量测定 每阶段试验结束后收获所有植株,参照蒲玉瑾等[16]的方法利用米尺(精确到0.01 cm)测量降香黄檀幼苗的茎高并计算茎高增量,并按照根、茎、叶分开,记录地上和地下生物量鲜重。
光合参数、水势和叶绿素含量测定 光合参数参考Li等[1]的方法测定,利用便携式光合测定系统LI-6400XT (LI-COR, Lincoln, NE, USA)于每阶段试验结束前一周内,选择晴朗的上午(08:30—11:30)测定植株的光合参数。选择每棵植株第3~5片(从顶芽往下数)完全展开的成熟叶片进行测量。为保证测量的科学性和准确性,测定时将叶面温度设置为28 ℃,光量子通量密度设置为1 500 μmol/(m2·s), 相对湿度控制在65%~70%。为得到准确的叶片水势,依据我们先前的研究结果[17],在试验结束时选取降香黄檀幼苗叶片水势相对稳定的时间段(上午09:00—10:00)使用WP4C露点水势仪(WP4C, Gene Company Limited, USA)在每棵植株上随机选择3片成熟的功能叶进行测定。叶绿素含量参考程贵文等[18]的方法测定。
可溶性蛋白、抗氧化物酶活性和活性氧物质测定 每阶段试验结束后,参考Bradford[19]的方法用考马斯亮蓝G-250测定可溶性蛋白含量,然后以牛血清白蛋白为标准,在分光光度计下测量595 nm处的吸光度。超氧化物歧化酶(SOD)和过氧化物酶(POD)活性分别采用氮蓝四唑光还原法和愈创木酚法测定[20]。H2O2含量参考Li等[1]方法测定,取0.3 g样品在3 mL预冷的丙酮中研磨成匀浆,然后,将匀浆在4 ℃下15 285×g离心5 min,留上清液,取1 mL上清液,加入0.1 mL 20% TiCl4,0.2 mL氨水混匀,经15 285×g离心5 min后,丢弃上清液,丙酮洗涤沉淀3次,再用2 mol/L H2SO4定容到5 mL。在分光光度计上读取410 nm处的吸光度值,用H2O2标准曲线计算H2O2含量,以μmol/g FW表示。
1.4 数据分析采用SPSS 23 (SPSS, Chicago, IL, USA)进行数据分析。分析前对数据进行方差齐性检验,不符合方差齐性时对数据进行对数转换。平均值间的比较采用单因素方差分析,各阶段中不同处理间的差异采用Duncan多重比较检验。双因素方差分析用来评估养分、水淹,以及养分和水淹的交互效应。利用Pearson’s相关系数分析形态、生物量和生理参数间的相关性。显著性水平设定为P < 0.05。主成分分析采用Canoco 5 (Microcomputer Power, Ithaca, NY, USA)进行。
2 结果和分析 2.1 对幼苗存活、生长和生物量的影响从表 1可见,第1阶段后CK和H组的植株存活率均为100%,而W和WH组的植株存活率略有下降,分别为87.87%和88.57%。与CK相比,H处理显著提高了降香黄檀幼苗的茎高增长量、地上、地下和总生物量积累,但W和WH处理显著降低了这些参数。与W相比,WH处理下的茎高增长量、地上、地下和总生物量积累无显著变化。第2阶段处理结束后,各处理的植株存活率均为100%。与CKD处理相比,HD和WHD处理下的幼苗茎高增长量分别提高了20%和220%,而WD处理的降低了48%。此外,同第1阶段相比,第2阶段WHD和WD组的生物量分别增加了32.48%和11.96%, 但是CKD和HD组的生物量分别降低了31.44%和11.78%。
| 表 1 不同处理对降香黄檀幼苗存活率、茎高增长量、生物量和生物量增长量的影响 Table 1 Effects of different treatments on survival rate, stem height increment, biomass, and biomass increment of Dalbergia odorifera seedlings |
从表 2可见,第1阶段后,H组的降香黄檀幼苗的净光合速率、气孔导度、叶绿素和类胡萝卜素含量最高。与CK相比,W和WH处理显著降低了幼苗的净光合速率、气孔导度、叶绿素及类胡萝卜素含量。与W处理相比,WH处理显著提高了幼苗的叶绿素a和总叶绿素含量,但是降低了幼苗的气孔导度。第2阶段后,与CKD相比,HD处理显著降低了幼苗的叶绿素a、叶绿素b和总叶绿素含量,但增加了类胡萝卜素的含量;WD处理对色素含量无显著影响,而显著提高了幼苗的净光合速率和气孔导度;WHD处理显著提高了幼苗的净光合速率、叶绿素b和总叶绿素含量,而降低了幼苗的叶绿素a和类胡萝卜素含量。与WD相比,WHD提高了幼苗的叶绿素b和总叶绿素含量,降低了幼苗的气孔导度、叶绿素a和类胡萝卜素含量。
| 表 2 不同处理对降香黄檀幼苗净光合速率、气孔导度和叶绿素含量的影响 Table 2 Effect of different treatments on net photosynthesis rate, stomatal conductance and chlorophyll content of Dalbergia odorifera seedlings |
在第1阶段中,与CK处理相比,H处理显著增加了叶片的POD活性,降低了叶片水势,而对叶片的SOD活性、可溶性蛋白和H2O2含量无显著影响(图 1);W和WH处理增加了叶片的SOD和POD活性、可溶性蛋白和H2O2含量,但降低了叶片的水势。与W相比,WH处理具有更低的SOD和POD活性以及更高的可溶性蛋白含量。此外,在第2阶段,与CKD相比,HD、WD和WHD处理均显著降低了叶片的SOD活性,可溶性蛋白和H2O2含量,并且WHD组中具有最低的SOD活性和H2O2含量。
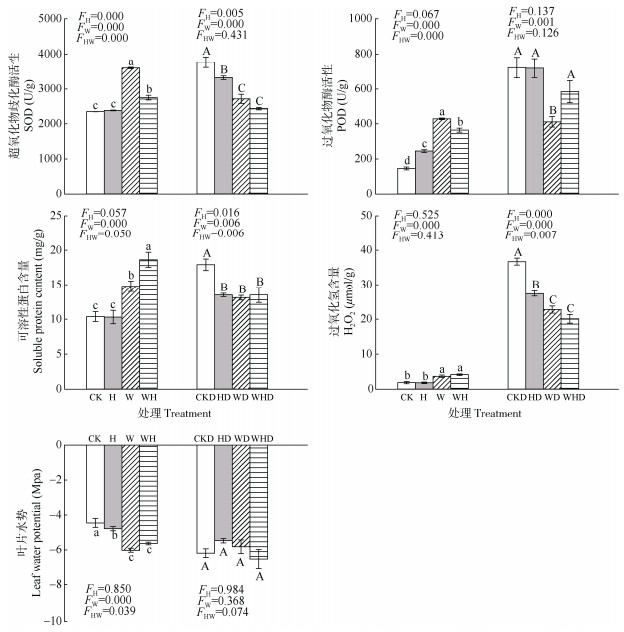
|
图 1 降香黄檀幼苗叶片SOD、POD活性、可溶性蛋白、过氧化氢含量和水势的变化 Fig. 1 Changes in activities of SOD, POD, contents of soluble protein, H2O2, and leaf water potential of Dalbergia odorifera seedlings |
第1阶段和第2阶段处理下SPSS均提取了2个主成分。第一主成分(PC1)和第二主成分(PC2)方差贡献率分别为94.02%、4.58%和67.87%、29.33%,累计方差贡献率分别为98.6%和97.2%。从图 2可见,分布于第一、第二象限的W处理组和WH处理组下幼苗的所有形态和生理指标与分布于第三、第四象限的CK和H处理组沿第1主成分(PC1)彼此分离。在第2阶段,分布于第三、第四象限的WD和WHD组处理的降香黄檀也可沿第1主成分与分布于第一、第二象限的CKD和HD组彼此分离。此外,PCA表明第1阶段叶片水势(Ψleaf)、POD、SOD与过氧化氢(H2O2)等是影响PC1的主要因素,PC2主要受到气孔导度(gs)的影响。第2阶段气孔导度、POD、净光合速率(A)、SOD和总生物量增长量(TBI)是影响PC1的主要因素, PC2主要受到茎高增量(SHI)和可溶性蛋白(SP)的影响。
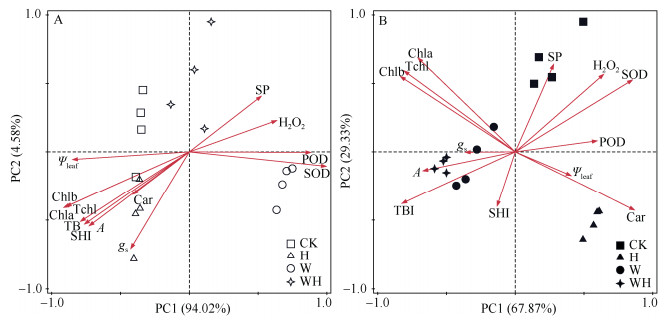
|
图 2 降香黄檀幼苗生理生态特征的主成分分析。A: 第1阶段; B: 第2阶段; SOD: 超氧化物歧化酶; POD: 过氧化物酶; SP: 可溶性蛋白; H2O2: 过氧化氢; Ψleaf: 叶片水势。下同 Fig. 2 PCA based on eco-physiological traits of Dalbergia odorifera seedlings. A: 1st stage; B: 2nd stage; SOD: Superoxide dismutase; POD: Peroxidase; SP: Soluble protein; H2O2: Hdrogen peroxide; Ψleaf: Leaf water potential. The same below |
第1阶段,幼苗的生物量(TB)与茎高增量(SHI)、叶片水势(Ψleaf)、叶绿素含量、净光合速率(A)和气孔导度(gs)呈显著的正相关关系,而与H2O2和可溶性蛋白(SP)含量、SOD和POD活性呈显著的负相关关系(表 3)。第2阶段,生物量增长量(TBI)与A呈显著的正相关关系,但是与H2O2和SP含量、SOD和POD活性呈显著的负相关关系。
| 表 3 水淹(下三角)和干旱(上三角)对降香黄檀幼苗形态、生物量和生理参数间的相关系数 Table 3 Correlation coefficients among morphological, biomass, and physiological traits of Dalbergia odorifera seedlings under waterlogging (lower triangle) and drought (upper triangle) |
水淹是常见的非生物胁迫之一,严重限制着许多陆生植物的生长和存活。大量研究表明,水淹下土壤氧气的迅速枯竭,将导致植物根系由有氧呼吸向低能量的ATP发酵转变,土壤Mn2+和Fe2+含量增加、NO3–和SO42–缺乏以及有毒代谢产物积累[21–22], 从而导致许多陆生植物的死亡。本研究中降香黄檀在100 d水淹胁迫下的存活率仍高达87.87%,表明降香黄檀具备一定的水淹耐受性。尽管如此,长时间水淹胁迫仍然抑制了降香黄檀的生长和生物量积累。推测这可能与叶片水势下降有关,前期研究表明降香黄檀叶片水势在日变化上呈V字形,9:00—13:00具有相对稳定的叶片水势[17]。而根据稳态条件下可以良好估计叶片水势的研究结论[23–25],W处理下叶片水势的显著降低表明降香黄檀幼苗受到了严重的水分胁迫。另一方面这也可能与W处理下降香黄檀叶片中活性氧物质的过量累积密切相关, 过量的活性氧物质累积会严重损伤降香黄檀光合器官、加速叶绿素降解,进而抑制叶片的光合能力[25]。此外,养分是植物生长发育的重要保证,不足或过剩将影响植株正常生长。增加养分供应有利于淹水植物生长和生物量积累[5,26–27],本研究也得到类似结果,WH处理提高了降香黄檀茎高增量和生物量。相关研究表明,养分处理可显著降低降香黄檀幼苗叶片的相对电导率和丙二醛含量[28]。本研究中, WH处理降低了SOD和POD等抗氧化酶活性,因此推测富营养化水体缓解了水淹胁迫对降香黄檀的伤害(如质膜透性),从而能更好保护细胞膜。一方面,完整的细胞膜系统能使降香黄檀具有较高的光系统活性。另一方面,水体富营养化可能导致植物氮素富集,以Rubisco和氨基酸的形式留存在体内, 增加降香黄檀叶片叶绿素含量,进而直接或间接影响了植物的光合作用,而光合能力又进一步影响了植物的生长和生物量的积累。可见,富营养化在一定程度上可缓解水淹对降香黄檀生长的消极影响。
干旱作为另一种常见的非生物胁迫,被认为是最具破坏性的环境因子。植物对干旱的生理、生化和分子响应的研究较多[29–31]。有研究表明[8–9],因前期水淹对根系的损伤可增加后期干旱对植株的伤害,所以单一干旱对植物的生长影响不同于水淹后的干旱。但也有研究表明,水淹并不会增加植株对后期干旱的敏感性[11]。本研究中,CKD和HD处理的生物量比W处理的显著降低,但WD处理的却显著增加,这说明前期水淹有利于降香黄檀幼苗在后期干旱条件下的生长,可能与降香黄檀幼苗在WD处理下具有比CKD和HD处理更低的H2O2、可溶性蛋白含量和SOD、POD活性密切相关,因为较低的活性氧和抗氧化物质(酶)表明植物遭受的氧化伤害较低[32]。本研究结果表明,WD处理降香黄檀幼苗的净光合速率和气孔导度显著高于CKD和HD。此外,WHD处理的生物量增长量显著高于WD, 可能与WHD具有比WD更低的H2O2含量和SOD活性有关;其次,可能还与降香黄檀幼苗地下生物量的显著增加有关,较高根系生物量通常有利于植株从土壤中吸收更多养分以满足其生长需求。另外, WHD的土壤养分含量高于WD也可能是形成此结果的内因,养分含量尤其是氮素含量较高通常有利于植物叶绿素的合成[33],这也与WHD幼苗比WD具有更高的总叶绿素和更低的类胡萝卜素含量一致。因此,前期水淹,尤其是富营养化水体水淹不仅能降低降香黄檀幼苗对后期干旱胁迫的敏感性, 而且有利于其生物量积累。
综上所述,降香黄檀幼苗具有较好的耐淹和耐旱(或水淹-干旱)能力。富营养化水体水淹可在一定程度上缓解水淹对降香黄檀幼苗造成的伤害,从而提高其水淹耐受性。前期水淹尤其是富营养化水体水淹不仅不会增加幼苗对后期干旱胁迫的敏感性, 而且有利于幼苗生物量的积累。本研究结果为养分供应如何减轻水淹和水淹后干旱对植物的消极影响提供了新的见解。同时,降香黄檀可考虑作为热带及亚热带地区水库消落带、河岸带和富营养化水体水陆过渡带的适宜木本植物之一,本研究为这些区域在植被恢复和重建过程中的植被筛选提供了一定的参考和科学依据。
| [1] |
LI D D, CISSE E H M, GUO L Y, et al. Comparable and adaptable strategies to waterlogging stress regulated by adventitious roots between two contrasting species[J]. Tree Physiol, 2022, 42(5): 971-988. DOI:10.1093/treephys/tpab165 |
| [2] |
KREUZWIESER J, RENNENBERG H. Molecular and physiological responses of trees to waterlogging stress[J]. Plant Cell Environ, 2014, 37(10): 2245-2259. DOI:10.1111/pce.12310 |
| [3] |
PANG J Y, ROSS J, ZHOU M X, et al. Amelioration of detrimental effects of waterlogging by foliar nutrient sprays in barley[J]. Funct Plant Biol, 2007, 34(3): 221-227. DOI:10.1071/FP06158 |
| [4] |
XIE Y H, REN B, LI F. Increased nutrient supply facilitates acclimation to high-water level in the marsh plant Deyeuxia angustifolia: The response of root morphology[J]. Aquat Bot, 2009, 91(1): 1-5. DOI:10.1016/j.aquabot.2008.12.004 |
| [5] |
HUANG B R, JOHNSON J W, NESMITH S, et al. Growth, physiological and anatomical responses of two wheat genotypes to waterlogging and nutrient supply[J]. J Exp Bot, 1994, 45(2): 193-202. DOI:10.1093/jxb/45.2.193 |
| [6] |
ZHANG S, LEI D D, WANG C, et al. Effect of eutrophic water body on antioxidant system and nutritional quality of Oenanthe javanica DC.[J]. Acta Bot Boreali-Occid Sin, 2018, 38(3): 510-516. 张帅, 雷代东, 王晨, 等. 富营养化水体对水芹抗氧化系统和营养品质的影响[J]. 西北植物学报, 2018, 38(3): 510-516. DOI:10.7606/j.issn.1000-4025.2018.03.0510 |
| [7] |
TIAN G L, QI D L, ZHU J Q, et al. Effects of nitrogen fertilizer rates and waterlogging on leaf physiological characteristics and grain yield of maize[J]. Arch Agron Soil Sci, 2021, 67(7): 863-875. DOI:10.1080/03650340.2020.1791830 |
| [8] |
DOFFO G N, MONTEOLIVA S E, RODRÍGUEZ M E, et al. Physiological responses to alternative flooding and drought stress episodes in two willow (Salix spp.) clones[J]. Can J For Res, 2017, 47(2): 174-182. DOI:10.1139/cjfr-2016-0202 |
| [9] |
MARTÍNEZ-ARIAS C, SOBRINO-PLATA J, MACAYA-SANZ D, et al. Changes in plant function and root mycobiome caused by flood and drought in a riparian tree[J]. Tree Physiol, 2020, 40(7): 886-903. DOI:10.1093/treephys/tpaa031 |
| [10] |
HAN W J, BAI L L, LI C X, et al. Effects of flooding on the photosynthetic response of Hemarthria altissima to drought[J]. Acta Ecol Sin, 2016, 36(18): 5712-5724. 韩文娇, 白林利, 李昌晓, 等. 前期水淹对牛鞭草后期干旱胁迫光合生理响应的影响[J]. 生态学报, 2016, 36(18): 5712-5724. DOI:10.5846/stxb201507181513 |
| [11] |
BAI L L, HAN W J, LI C X. Effects of simulated waterlogging on growth, physiological and biochemical characteristics of Metasequoia glyptostroboides seedlings[J]. J Zhejiang Univ (Agric Life Sci), 2015, 41(5): 505-515. 白林利, 韩文娇, 李昌晓. 模拟水淹对水杉苗木生长与生理生化特性的影响[J]. 浙江大学学报(农业与生命科学版), 2015, 41(5): 505-515. DOI:10.3785/j.issn.1008-9209.2014.09.292 |
| [12] |
LI M Y, LIU G, XIAO H, et al. Respones of physiological adaptability of Vetiveria zizanioides on alternating flooding-drought stress[J]. Bull Soil Water Conserv, 2014, 34(2): 48-52. 李铭怡, 刘刚, 肖海, 等. 香根草光合特性对水淹-干旱交替胁迫的响应[J]. 水土保持通报, 2014, 34(2): 48-52. DOI:10.13961/j.cnki.stbctb.2014.02.011 |
| [13] |
ZHANG Y Q, LI D L. Drought-flood abrupt alternation and its atmospheric circulation characteristics during flood season in southern China[J]. Clim Environ Res, 2019, 24(4): 430-444. 张玉琴, 李栋梁. 华南汛期旱涝急转及其大气环流特征[J]. 气候与环境研究, 2019, 24(4): 430-444. DOI:10.3878/j.issn.1006-9585.2018.18024 |
| [14] |
JIANG B H, DING Y, MIAO L F, et al. Effects of waterlogging and salt stresses on the physiological and ecological characteristics of Dalbergia odorifera seedling[J]. Nat Sci J Hainan Univ, 2020, 38(2): 132-140. 姜百惠, 丁扬, 苗灵凤, 等. 淹水和盐胁迫对降香黄檀植株生理生态特性的影响[J]. 海南大学学报(自然科学版), 2020, 38(2): 132-140. DOI:10.15886/j.cnki.hdxbzkb.2020.0019 |
| [15] |
TANG S B, WANG H C, GE B Z, et al. Environmental Organic Pollution Chemistry[M]. Beijing: Metallurgical Industry Press, 1996: 228–229. 唐森本, 王欢畅, 葛碧洲, 等. 环境有机污染化学[M]. 北京: 冶金工业出版社, 1996: 228–229. |
| [16] |
PU Y J, ZHANG L J, MIAO L F, et al. Effects of different calcium concentrations on the growth and physiological characteristics of Dalbergia odorifera under low temperatures[J]. Plant Sci J, 2019, 37(2): 251-259. 蒲玉瑾, 张丽佳, 苗灵凤, 等. 不同钙离子浓度对低温下降香黄檀幼苗生长及生理特性的影响[J]. 植物科学学报, 2019, 37(2): 251-259. DOI:10.11913/PSJ.2095-0837.2019.20251 |
| [17] |
MIAO L F, ZHANG L J, PU Y J, et al. Factors that affect measurement using the WP4C dewpoint potential meter to determine water potential: Illustrated by the case of Dalbergia odorifera[J]. Plant Sci J, 2017, 35(1): 93-98. 苗灵凤, 张丽佳, 蒲玉瑾, 等. WP4C露点水势仪测定植物叶片水势时的影响因素——以降香黄檀为例[J]. 植物科学学报, 2017, 35(1): 93-98. DOI:10.11913/PSJ.2095-0837.2017.10093 |
| [18] |
CHENG G W, GONG H E, YAN S B, et al. Comparison of chlorophyll extraction methods in Camellia oleifera[J]. Hubei For Sci Technol, 2017, 46(6): 11-13. 程贵文, 龚洪恩, 颜送宝, 等. 油茶叶绿素提取方法的比较研究[J]. 湖北林业科技, 2017, 46(6): 11-13. |
| [19] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3 |
| [20] |
XIE J H, CHAI T T, XU R, et al. Induction of defense-related enzymes in patchouli inoculated with virulent Ralstonia solanacearum[J]. Electron J Biotechnol, 2017, 27: 63-69. DOI:10.1016/j.ejbt.2017.03.007 |
| [21] |
MALIK A I, COLMER T D, LAMBERS H, et al. Short-term waterlogging has long-term effects on the growth and physiology of wheat[J]. New Phytol, 2002, 153(2): 225-236. DOI:10.1046/j.0028-646X.2001.00318.x |
| [22] |
XIE R J, ZHENG L, JIAO Y, et al. Understanding physiological and molecular mechanisms of citrus rootstock seedlings in response to root zone hypoxia by RNA-Seq[J]. Environ Exp Bot, 2021, 192: 104647. DOI:10.1016/j.envexpbot.2021.104647 |
| [23] |
HERPPICH W B, VON WILLERT D J. Dynamic changes in leaf bulk water relations during stomatal oscillations in mangrove species: Continuous analysis using a dewpoint hygrometer[J]. Physiol Plant, 1995, 94(3): 479-485. DOI:10.1111/j.1399-3054.1995.tb00957.x |
| [24] |
SCOFFONI C, MCKOWN A D, RAWLS M, et al. Dynamics of leaf hydraulic conductance with water status: Quantification and analysis of species differences under steady state[J]. J Exp Bot, 2012, 63(2): 643-658. DOI:10.1093/jxb/err270 |
| [25] |
MARTINS S C V, SANGLARD M L, MORAIS L E, et al. How do coffee trees deal with severe natural droughts? An analysis of hydraulic, diffusive and biochemical components at the leaf level[J]. Trees, 2019, 33(6): 1679-1693. DOI:10.1007/s00468-019-01889-4 |
| [26] |
LI D D, MIAO L F, CISSE E H M, et al. Dissecting the below- and aboveground specific responses of two waterlogging tolerant arbor species to nutrient supply under waterlogging conditions[J]. Tree Physiol, 2023, 43(3): 390-403. |
| [27] |
ZHANG J. Study on Pterocarya stenoptera & Salix babylonica's removal effect on nitrogen & phosphorus in eutrophic water[D]. Nanjing: Nanjing Forestry University, 2011. 张娟. 枫杨、垂柳对水体中氮磷污染的净化效果研究[D]. 南京: 南京林业大学, 2011. |
| [28] |
GUO L Y, MIAO L F, LI D D, et al. Effects of nitrogen addition and warming on growth, development, and physiological characteristics of Dalbergia odorifera T. Chen seedlings[J]. Plant Sci J, 2022, 40(2): 259-268. 郭璐瑶, 苗灵凤, 李大东, 等. 施氮和增温对降香黄檀幼苗生长发育和生理特征的影响[J]. 植物科学学报, 2022, 40(2): 259-268. DOI:10.11913/PSJ.2095-0837.2022.20259 |
| [29] |
KIM J M, TO T K, ISHIDA J, et al. Transition of chromatin status during the process of recovery from drought stress in Arabidopsis thaliana[J]. Plant Cell Physiol, 2012, 53(5): 847-856. DOI:10.1093/pcp/pcs053 |
| [30] |
HARB A, KRISHNAN A, AMBAVARAM M M R, et al. Molecular and physiological analysis of drought stress in Arabidopsis reveals early responses leading to acclimation in plant growth[J]. Plant Physiol, 2010, 154(3): 1254-1271. DOI:10.1104/pp.110.161752 |
| [31] |
BLUM A. Osmotic adjustment is a prime drought stress adaptive engine in support of plant production[J]. Plant Cell Environ, 2017, 40(1): 4-10. DOI:10.1111/pce.12800 |
| [32] |
QIU S, HUANG S Z, WANG H Y. Effect of Cd stress on the activity of four antioxidases in Iris pseudacorus seedlings[J]. J Plant Resour Environ, 2008, 17(1): 28-32. 仇硕, 黄苏珍, 王鸿燕. Cd胁迫对黄菖蒲幼苗4种抗氧化酶活性的影响[J]. 植物资源与环境学报, 2008, 17(1): 28-32. DOI:10.3969/j.issn.1674-7895.2008.01.005 |
| [33] |
DENG J X, WEI J G, YU H, et al. Effects of different fertilization treatments on growth and physiological indexes of seedling of Vaccinium corymbosum and physicochemical properties of soil[J]. J Plant Resour Environ, 2021, 30(2): 28-34. 邓家欣, 韦继光, 於虹, 等. 不同施肥处理对高丛越橘幼苗生长和生理指标及土壤理化性质的影响[J]. 植物资源与环境学报, 2021, 30(2): 28-34. DOI:10.3969/j.issn.1674-7895.2021.02.04 |
 2024, Vol. 32
2024, Vol. 32


