2. 北京大学, 深圳研究生院深圳市循环经济重点实验室,广东 深圳 518005
2. Key Laboratory for Environmental and Urban Sciences Shenzhen Graduate School, Peking University, Shenzhen 518055, Guangdong, China
在自然界中,土壤养分在空间上往往具有高度的异质性,且多呈斑块状分布[1]。传统意义上,所有直径小于2 mm的根都被称为细根,但由于其在获取细根形态与功能多样性上的局限,目前多采取功能模块法将细根进一步划分为吸收根与运输根[2]。吸收根是植物从土壤中获取资源的主要器官[2–3],植物在长期进化过程中,为了应对土壤资源异质性,会通过改变其根系形态性状来增加对养分的获取[4–5]。此外,植物根系会根据养分斑块的类型与浓度来调整其养分获取策略[6]。大部分研究均表明在养分斑块中植物细根的形态性状会发生变化,王雁南等[7]的研究表明猪毛蒿(Artemisia scoparia)在高氮斑块中,比根长、比表面积都显著提高;邹显花[8]对杉木(Cunninghamia lanceolata)的研究表明在富磷斑块中,杉木根表面积、根长、根体积显著提高。细根受土壤资源影响而呈现出的表型变化称为细根的可塑性响应,是植物适应环境养分(尤其氮和磷)异质性的一种主要策略[9]。
菌根是指植物根系与土壤真菌所形成的具有互利共生关系的共生体,在这一共生体中,菌根真菌从根系获得碳水化合物,并为植物提供氮磷等营养物质[10]。不同的菌根类型能够影响林木细根对养分空间异质性的响应。氮、磷是土壤养分的重要组成部分,也是植物生长发育过程中不可缺少的元素。目前关于细根形态性状对氮添加的可塑性响应的研究已有相关报道,Wang等[11]的研究表明外生菌根树种红松(Pinus koraiensis)和丛枝菌根树种云杉(Picea koraiensis)的比根长对氮添加有显著的负可塑性响应;郝倩葳等[12]对外生菌根树种麻栎(Quercus acutissima)细根形态性状的研究表明,麻栎的比根长对氮添加有显著的正可塑性响应;贾林巧等[13]对丛枝菌根树种木荷(Schima superba)和外生菌根树种罗浮栲(Castanopsis faberi)的研究表明,罗浮栲细根的比根长和比表面积对氮添加有显著的正可塑性响应,而木荷细根形态性状无显著变化。由此可见,关于细根形态性状对氮添加的可塑性响应已经展开了一些研究,但不同菌根类型树种细根形态性状的氮可塑性响应的方向和强度仍存在较大的不确定性。
相对于氮添加,有关磷添加对不同菌根类型树种细根形态可塑性影响的研究较少。研究表明,磷添加显著提高了外生菌根树种色木槭(Acer mono)细根的比根长和直径[5],及丛枝菌根植物白羊草(Bothriochloa ischaemum)细根的比根长和比表面积[14];也有研究表明,外生菌根树种和丛枝菌根树种细根的比根长、比根表面积对磷添加均无显著影响[15]。因此,外生菌根与丛枝菌根树种细根形态性状对磷添加可塑性响应的方向与强度是很不清晰的,尤其在如人工林这样生长环境一致条件下的不同菌根类型(外生与丛枝)树种间的差异。
丛枝菌根和外生菌根是2种主要的菌根真菌类型,它们与大多数树种(> 80%)的根部形成共生关系,从而大大提高树木对土壤养分的获取[16–17]。外生菌根真菌通过产生水解和氧化的胞外酶降解土壤有机质,并从中挖掘养分(尤其是氮),从而促进养分的获取[18–19];而大多数丛枝菌根真菌仅具有有限的酶促能力,并主要通过吸收无机养分(尤其是磷)以供应植物[17, 20]。因此,丛枝菌根与外生菌根真菌在氮和磷养分获取方式上的不同,可能会影响细根形态性状的可塑性响应,但有关二者细根形态性状对氮和磷添加间可塑性响应差异的研究尚未报道。我国的亚热带地区是氮沉降十分严重的一个区域[21], 近年来,氮沉降的持续加剧一方面直接影响了土壤氮含量,另一方面随着氮的输入可能会增加植物对于磷的需求, 且亚热带陆地生态系统本身受磷限制严重, 磷可能逐渐成为限制植物生长发育的关键[4, 22–23]。因此,相对于温带等其他陆地森林生态系统,亚热带地区森林细根形态性状对氮和磷的可塑性响应可能完全不同。
为此,本试验选取亚热带地区相似立地上的丛枝菌根树种杉木人工林与外生菌根树种米槠(Castanopsis carleisii)人工林为研究对象,旨在研究不同类型菌根树种对氮和磷添加的可塑性响应,探究林木应对氮和磷养分异质性的地下资源获取策略,为预测全球变化背景下亚热带森林生态系统的养分循环过程等提供理论依据。
1 材料和方法 1.1 研究区概况研究地点位于福建三明森林生态系统国家野外科学观测研究站(26º11′ N,117º28′ E),地形主要为低山丘陵,平均海拔400 m,属于中亚热带海洋季风气候,具有水热同季、冬冷夏热、湿润多雨的特点,年均温19.1 ℃,年均降雨量为1 749 mm, 主要集中于每年的3月—8月,相对湿度为81%。土壤类型以暗红壤为主、嵌以少量紫色土壤。在1979年, 对天然常绿阔叶林进行皆伐、炼山,并经过穴状整地后, 种植1 a生杉木与米槠, 造林密度为330 ind./hm2, 树龄约43 a。2021年调查时,杉木和米槠人工林的平均胸径分别为(19.8±2.02)和(32.13±3.1) cm。
1.2 试验设计于2021年3月,在杉木人工林和米槠人工林内分别建立了3块20 m×20 m样地,每个林分样地间距为15 m。采用内生长袋法进行原位试验,在每块样地内,使用直径5 cm的土钻随机钻取9个15 cm深的土芯,并将同一样地内的所有土芯混合,去除根系与杂质后,添加不同养分处理。设置施氮、施磷和对照(无添加) 3个处理,每个处理3个重复。参考Adams等[24]的试验方案,养分添加量设为目标林分土壤无机氮与速效磷背景值[杉木人工林和米槠人工林的土壤无机氮含量分别为(4.50±0.34)和(3.90± 0.16) mg/kg,速效磷含量分别为(2.31±0.24)和(3.01± 0.06) mg/kg]的4倍,即杉木人工林施氮(NH4NO3)量为18.00 mg/kg,施磷(KH2PO4)量为9.24 mg/kg; 米槠人工林施氮(NH4NO3)量为15.60 mg/kg,施磷(KH2PO4)量为12.04 mg/kg。拌入所添加的养分并混匀后,重新将均质原位表层土(0~15 cm)(135 g)放入直径5 cm、长15 cm、孔径为2 mm的尼龙网袋中[25], 填回钻取土芯时的土洞中,并用枯枝落叶覆盖。
1.3 根系样品采集和测定2021年8月收取内生长袋,挑出所有新长的细根,用自来水冲洗干净,参照McCormack等[3]的根系功能模块分类法,分出吸收根。处理好的细根用数字化扫描仪Espon scanner进行扫描,然后使用Win RHIZO (Pro 2009b)根系图像分析软件对细根图像进行形态指标的分析,获得细根直径、长度、表面积和体积,扫描完成后将样品放入65 ℃的烘箱烘至恒重,称量细根干重,进一步计算细根形态的相关指标,比根长(SRL, cm/g)=根长/生物量; 比表面积(SRA, cm2/g)=根表面积/生物量; 组织密度(RTD, g/cm3)=生物量/根体积。
参照Valladares等[26]的方法计算氮和磷可塑性响应,氮的可塑性响应=(施氮处理的指标值-对照指标值)/对照指标值×100%;磷的可塑性响应=(施磷处理的指标值-对照指标值)/对照指标值×100%。
1.4 土壤样品采集和测定在布设内生长袋时分别采集杉木和米槠人工林每块样地中表层0~15 cm的土壤,进行土壤基本理化性质的测定(图 1)。收取内生长袋后挑出里面所有的根,将同一样地内相同养分添加处理内生长袋内的土壤混合成一个样品,并使用连续流动分析仪(Skalar san++, Skalar, 荷兰)测定内生长袋矿质氮含量(KCl浸提法)和速效磷含量(M3浸提法)。
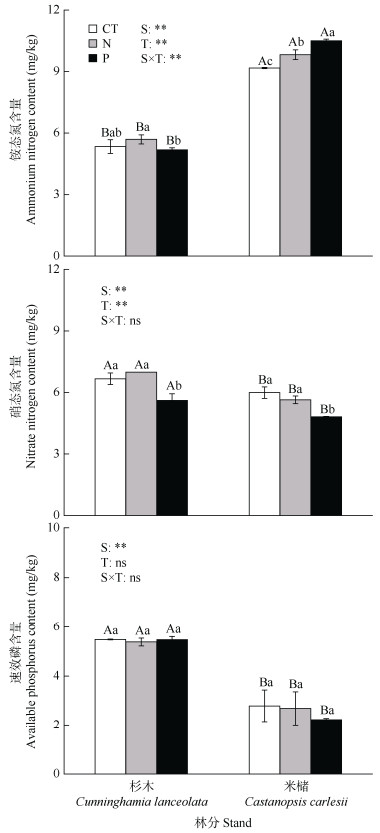
|
图 1 氮和磷添加处理下杉木和米槠人工林根袋土壤理化性质。CT: 对照; N: 施氮; P: 施磷; T: 处理; S: 林分; ns: P > 0.05; *: P < 0.05; **: P < 0.01。柱上不同小写和大写字母分别表示同一林分不同处理和同一处理不同林分间差异显著(P < 0.05)。下同 Fig. 1 Soil physical and chemical properties of root bags of Cunninghamia lanceolata and Castanopsis carlesii plantation under nitrogen and phosphorus addition treatments. CT: Control; N: Nitrogen addition; P: Phosphorus addition; T: Treatment; S: Stands. ns: P > 0.05; *: P < 0.05; **: P < 0.01. Different small and capital letters upon column indicate significant differences among different treatments in the same stand, and different stands under the same treatment at 0.05 level, respectively. The same below |
使用SPSS 22.0软件进行数据的处理与分析, 图表在Origin 2021中进行制作。利用混合线性模型分析林分、养分添加对土壤无机氮和速效磷含量、细根形态性状及其可塑性响应的影响。使用LSD检验同一林分类型不同处理间或同一处理不同林分类型间土壤理化性质、细根形态性状及其可塑性响应的差异。根据同一林分下施氮处理或施磷处理与对照的显著差异来判断细根形态性状是否具有显著的氮或磷可塑性响应。使用Pearson相关性分析细根形态性状的养分添加可塑性响应之间的相关性及细根不同形态性状的氮可塑性响应与磷可塑性响应间的相关性。
2 结果和分析 2.1 氮和磷添加对根袋土壤理化性质的影响从图 1可见,土壤铵态氮林分类型与处理的交互作用对含量具有显著影响,处理对土壤铵态氮含量影响因不同林分类型而异。氮添加处理下,米槠内生长袋土壤铵态氮显著提高了7.1%,磷添加的提高了14.6%。磷添加处理下, 杉木和米槠内生长袋土壤硝态氮含量分别显著降低了16.0%和19.6%; 但氮和磷添加处理对土壤速效磷均没有显著影响。所有处理下,杉木内生长袋土壤硝态氮和速效磷含量均显著大于米槠,铵态氮含量均显著小于米槠。
2.2 氮和磷添加对细根形态性状的影响从图 2可见,林分类型与处理的交互作用对细根平均根直径、比根长、比表面积、组织密度均具有显著影响,表明处理对平均根直径、比根长、比表面积和组织密度的影响因不同林分类型而异。所有处理中,杉木细根平均根直径和组织密度均显著高于米槠,米槠细根比根长均显著高于杉木。与对照相比,氮添加处理下,杉木平均根直径和组织密度分别显著提高了22.1%和12.5%,比表面积显著降低了17.0%;米槠比根长和比表面积显著提高了53.3%和41.6%,平均根直径与组织密度分别显著降低了8.0%和25.6%。磷添加处理下,杉木平均根直径和组织密度显著提高了39.9%和8.9%,比根长和比表面积显著降低了48.1%和30.9%;米槠比根长和比表面积显著提高了65.8%和51.4%,组织密度显著降低了28.0%。
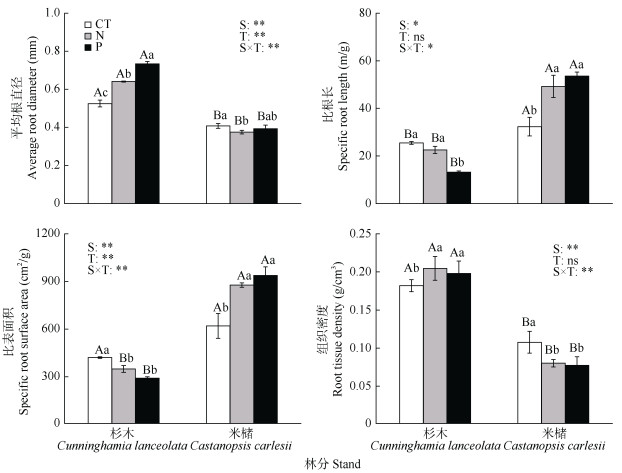
|
图 2 氮添加和磷添加对不同林分类型细根形态性状的影响 Fig. 2 Effects of nitrogen and phosphorus addition on fine root morphology traits of different stands |
由图 3可见,林分类型与处理的交互作用对比根长具有显著影响。杉木的细根平均直径和组织密度表现出显著的正的磷可塑性响应和氮可塑性响应, 比根长和比表面积表现出显著的负的磷可塑性响应,比表面积表现出显著的负的氮可塑性响应。米槠的比表面积和比根长表现出显著的正的磷可塑性响应和氮可塑性响应,组织密度表现出显著的负的磷可塑性响应和氮可塑性响应,平均根直径表现出显著的负的氮可塑性响应。
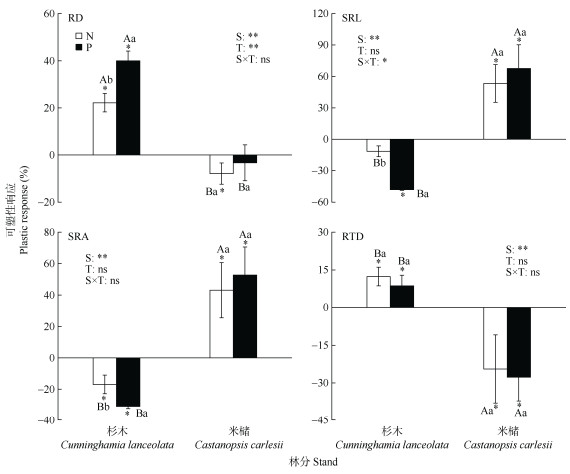
|
图 3 不同林分类型细根形态性状对氮和磷添加可塑性的响应。SRL: 比根长; SRA: 比表面积; RTD: 组织密度; AD: 平均根直径; N: 氮可塑性响应; P: 磷可塑性响应; *: P < 0.05。下同 Fig. 3 Plastic responses of fine root morphology traits of different stands to nitrogen and phosphorus addition. SRL: Specific root length; SRA: Specific root surface area; RTD: Root tissue density; AD: Average diameter; N: Nitrogen plasticity response; P: Phosphorus plasticity response; *: P < 0.05. The same below |
杉木和米槠间细根平均直径、比根长、比表面积和组织密度对氮和磷添加的可塑性响应均存在显著差异,杉木细根平均直径对氮和磷添加的可塑性响应均显著大于米槠,比根长、比表面积和组织密度对氮和磷添加的可塑性响应均显著小于米槠。杉木细根平均直径、比根长和比表面积对磷添加的可塑性响应显著大于氮添加的可塑性响应;米槠细根直径、比根长、比表面积和组织密度对氮添加和磷添加的可塑性响应无显著差异。
2.4 相关性分析由表 1可见,杉木和米槠细根比根长与比表面积,组织密度与直径对氮和磷添加的可塑性响应均具有极显著的正相关关系;组织密度与比根长、比表面积对氮和磷添加的可塑性响应具有显著的负相关关系;平均根直径与比根长、比表面积对氮和磷添加的可塑性响应具有显著的负相关关系。
| 表 1 细根形态性状与氮、磷添加的可塑性响应的相关系数 Table 1 Correlation coefficients between fine root morphological traits to nitrogen and phosphorus addition |
杉木和米槠细根的平均根直径、比根长、比表面积、组织密度对氮和磷添加的可塑性响应之间均具有显著的正相关关系,相关系数分别为0.994、0.963、0.985、0.887。
3 讨论和结论 3.1 杉木和米槠细根形态对氮和磷添加的可塑性响应本研究表明,杉木的细根直径和组织密度表现出显著的正的氮和磷可塑性,比表面积表现出显著的负的氮和磷可塑性。曲秋玲等[27]认为施氮显著提高了丛枝菌根植物白羊草(Bothriochloa ischaemun)的直径,减小了比根长;Yan等[28]对杉木根系形态的研究也表明,富磷斑块中的根系平均直径大于对照斑块,与本研究结果相似。有研究表明,低比根长、直径较粗的根生长缓慢但寿命长,采用资源保守型的策略;高比根长、直径较细的树种根系增长速度快,但寿命较短,采用资源获取型策略[3, 29]。杉木的细根直径显著大于米槠,比根长显著小于米槠,采用了资源保守型的策略,通过增大直径,减小比根长和比表面积的方法,延长了细根寿命。此外,有证据表明,粗根物种往往更多地依赖于真菌菌丝来增加吸收表面[30]。故丛枝菌根树种杉木可能通过降低细根形态性状的投入,提高对构建成本更低的菌丝的投资,达成和根系形态间的互补,更高效地获取养分[3]。
米槠细根比表面积和比根长表现出显著的正的磷和氮可塑性响应,组织密度表现出显著的负的磷和氮可塑性响应。郭伟等[31]对长白山阔叶红松林的研究表明,氮添加显著降低了细根直径,增加了比根长;丁国泉[32]认为施磷显著增加了外生菌根树种日本落叶松(Larix kaempferi)细根的比根长和比表面积。组织密度表示细根单位体积的生物量,与细根寿命有显著的正相关关系[33],米槠细根组织密度具有显著的负的氮和磷可塑性响应,说明其通过缩短细根寿命,增快细根自身的周转率,以提高在富氮和富磷斑块中的养分获取效率。米槠采用了降低细根组织密度,增加比根长和比表面积,扩大富养斑块中根系吸收面积,以快速占有资源的资源获取型策略。因此与丛枝菌根树种杉木相比,外生菌根树种米槠更加依赖于改变细根形态性状进行养分获取。在不同养分添加条件下,米槠形态性状可塑性响应方向均与杉木相反,说明二者采用了不同的养分获取策略,这可能因为丛枝菌根树种多为粗根树种[34],在养分有效性增加时,往往通过提高直径与组织密度延长细根寿命,并可能选择构建成本更低的菌根真菌来获取养分;而直径相对较细的外生菌根树种米槠在养分有效性增加时,往往更依赖于根系自身获取养分,反而可能减少对外生菌根菌的依赖。
杉木细根平均直径、比根长和比表面积对磷添加的可塑性响应均显著大于氮添加的可塑性响应。Yang等[15]的研究表明,与氮添加相比,杉木比根长对磷添加的响应更大。这可能因为: 一方面,丛枝菌根树种具有较开放的氮循环,土壤无机氮浓度往往较高[20, 35],并且亚热带森林长期受氮沉降影响, 植物的生长发育本身易受磷限制[35],因而杉木人工林可能受氮限制相对较小,而更容易受磷限制;另一方面,丛枝菌根树种主要依靠丛枝菌根真菌来增强磷的吸收[17],丛枝菌根真菌提供了90%的植物磷素[36–37]。在磷有效性提高时,丛枝菌根树种对菌根真菌的依赖可能增加,同时通过延长根系寿命而降低比根长和比表面积。因而在磷富集斑块内,丛枝菌根树种杉木细根形态性状表现出更大的可塑性响应。
米槠细根形态性状对氮和磷添加的可塑性响应均无显著差异,Yang等[15]对外生菌根树种马尾松(Pinus massoniana)的研究表明,氮和磷添加对马尾松根长的影响无显著差异。这可能因为外生菌根树种具有较封闭的氮素循环,其特点是土壤无机氮浓度较低,氮素循环速率较慢[20, 35],植物生长发育容易受到氮的限制。而本试验区土壤磷含量本身较低,米槠的生长发育很可能受到了氮和磷的共同限制,因此米槠细根形态性状在氮与磷可塑性间无显著差异。
3.2 细根形态性状对养分添加可塑性响应间的相关性本研究表明,杉木和米槠细根的比根长和比表面积对养分添加(包括氮添加和磷添加)可塑性响应存在显著的正相关。张礼宏[38]对亚热带常绿阔叶林4种树种的研究也得出了相似的结论。比根长表示单位生物量上的细根的长度,高比根长是植物高效吸收水分和养分的重要标志[39];比表面积表示单位生物量上的细根的表面积,其值越大,说明投入相同的成本有较高的养分利用效率[40],两者都是反映细根养分吸收效率的形态指标。细根通过提高比根长和比表面积以提高对养分斑块的利用效率,故二者对于养分添加响应呈现一致的变化规律。细根组织密度与比根长、比表面积对氮添加和磷添加的可塑性响应具有显著的负相关关系,平均根直径与比根长、比表面积对氮和磷添加的可塑性响应具有显著的负相关关系,表明在氮和磷添加条件下,细根的比根长和比表面积与直径和组织密度存在着权衡关系,根系通过增大单位生物量上的细根表面积,降低单位体积上的生物量,实现更高的相对生长率,提高资源获取效率[41],是根系适应土壤养分变化的策略。
杉木和米槠细根直径、比根长、比表面积和组织密度的氮和磷可塑性响应方向相同,且均具有显著的正相关关系。余明等[42]对樟树(Cinnamomum camphora)幼苗细根形态的研究发现,氮和磷添加均促进了樟树幼苗细根长度和表面积增加;Razaq等[5]的研究表明,色木槭(Acer pictum)细根的比根长均随着氮和磷养分的增加而增加。本研究中2树种细根在氮或磷富集斑块中的细根形态性状可塑性响应有同向变化的趋势,说明不同树种的生长发育可能受到了氮和磷的共同限制,这主要是因为植物对氮和磷的需求往往是相互伴随的。Reed等[43]对热带森林和Eisele等[44]对高原草地的研究表明,由于氮的固定往往需要大量的三磷酸腺苷,磷添加为植物组织三磷酸腺苷的产生提供了磷元素,所以氮固定速率往往随着磷吸收的增加而增加。Schleuss等[45]对地中海草地的研究表明,磷酸酶活性随着氮的输入而增加。因为催化土壤有机磷矿化的胞外酶中含有氮[46],生物体需要利用氮合成磷酸酶,促进对磷的获取。因此同一物种细根形态性状对氮磷添加往往表现出同向的可塑性。
本研究基于亚热带森林丛枝菌根杉木人工林和外生菌根米槠人工林的研究,探讨了不同菌根树种细根的形态性状对氮和磷添加的可塑性响应间的异同,反映了林木根系在获取养分过程中采取不同的应对策略,杉木采取了资源保守型策略,并可能更能依赖丛枝菌根菌;米槠采用了资源获取型策略,并可能降低对外生菌根菌的依赖。杉木对磷添加更敏感,米槠对氮添加和磷添加的可塑性响应无显著差异。这些对比鲜明的与菌根类型相关联的不同树种细根对氮和磷可塑性响应差异的研究,对于深入揭示亚热带森林养分获取策略和养分循环具有重要意义。但本研究并未测定根系菌根侵染率, 限制了根系与菌根菌觅食互补关系的研究。今后应结合细根化学、生理性状和菌根菌性状进一步探讨不同类型菌根树种对不同类型养分斑块的响应。
| [1] |
WANG S G, HOU Y L. Research advance in nitrogen nutrient patch in soil[J]. Agric Res Arid Areas, 2003, 21(2): 45-49. 王曙光, 侯彦林. 土壤中氮营养斑研究进展[J]. 干旱地区农业研究, 2003, 21(2): 45-49. DOI:10.3321/j.issn:1000-7601.2003.02.011 |
| [2] |
ROBINSON D, HODGE A, FITTER A. Constraints on the form and function of root systems [M]// KROON H, VISSER E J W. Root Ecology. Berlin: Springer, 2003: 1–31. doi: 10.1007/978-3-662-09784-7_1.
|
| [3] |
MCCORMACK M L, DICKIE I A, EISSENSTAT D M, et al. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes[J]. New Phytol, 2015, 207(3): 505-518. DOI:10.1111/nph.13363 |
| [4] |
LI Y, NIU S L, YU G R. Aggravated phosphorus limitation on biomass production under increasing nitrogen loading: A meta-analysis[J]. Glob Change Biol, 2016, 22(2): 934-943. DOI:10.1111/gcb.13125 |
| [5] |
RAZAQ M, ZHANG P, SHEN H L, et al. Influence of nitrogen and phosphorous on the growth and root morphology of Acer mono[J]. PLoS One, 2017, 12(2): e0171321. DOI:10.1371/journal.pone.0171321 |
| [6] |
WIJESINGHE D K, HUTCHINGS M J. The effects of spatial scale of environmental heterogeneity on the growth of a clonal plant: An experimental study with Glechoma hederacea[J]. J Ecol, 1997, 85(1): 17-28. DOI:10.2307/2960624 |
| [7] |
WANG Y N, DU F, SUI Y Y, et al. Morphological responses of six successional plant species in old-fields of the Loess Plateau to the pattern and level of nitrogen application in a pot experiment[J]. Acta Ecol Sin, 2017, 37(9): 2913-2925. 王雁南, 杜峰, 隋媛媛, 等. 黄土丘陵区撂荒群落演替序列种根系对氮素施肥方式和水平的形态响应[J]. 生态学报, 2017, 37(9): 2913-2925. DOI:10.5846/stxb201601180124 |
| [8] |
ZOU X H. Study on adaptation mechanism of Chinese fir to heterogeneous supply of phosphorus[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. 邹显花. 杉木对异质磷斑块胁迫适应机制的研究[D]. 福州: 福建农林大学, 2012. |
| [9] |
HODGE A. The plastic plant: Root responses to heterogeneous supplies of nutrients[J]. New Phytol, 2004, 162(1): 9-24. DOI:10.1111/j.1469-8137.2004.01015.x |
| [10] |
ALLEN M F. The Ecology of Mycorrhizae [M]. New York: Cambridge University Press, 1991: 113–118.
|
| [11] |
WANG W N, WANG Y, HOCH G, et al. Linkage of root morphology to anatomy with increasing nitrogen availability in six temperate tree species[J]. Plant Soil, 2018, 425(1): 189-200. DOI:10.1007/s11104-018-3563-3 |
| [12] |
HAO Q W. Effects of exogenous nutrients addition on growth characteristics and stoichiometric characteristics of fine roots of Quercus acutissima and Liquidambar formosana[D]. Nanjing: Nanjing Forestry University, 2021. 郝倩葳. 外源养分添加对麻栎和枫香细根生长性状及化学计量特征的影响[D]. 南京: 南京林业大学, 2021. doi: 10.27242/d.cnki.gnjlu.2021.000251 |
| [13] |
JIA L Q, CHEN G S, ZHANG L H, et al. Plastic responses of fine root morphology and architecture traits to nitrogen addition in ectomycorrhizal and arbuscular mycorrhizal tree species in an evergreen broad-leaved forest[J]. Chin J Appl Ecol, 2021, 32(2): 529-537. 贾林巧, 陈光水, 张礼宏, 等. 常绿阔叶林外生和丛枝菌根树种细根形态和构型性状对氮添加的可塑性响应[J]. 应用生态学报, 2021, 32(2): 529-537. DOI:10.13287/j.1001-9332.202102.025 |
| [14] |
XU B, GAO Z, WANG J, et al. Morphological changes in roots of Bothriochloa ischaemum intercropped with Lespedeza davurica following phosphorus application and water stress[J]. Plant Biosyst, 2015, 149(2): 298-306. DOI:10.1080/11263504.2013.823132 |
| [15] |
YANG Z Y, ZHOU B Z, GE X G, et al. Species-specific responses of root morphology of three co-existing tree species to nutrient patches reflect their root foraging strategies[J]. Front Plant Sci, 2021, 11: 618222. DOI:10.3389/fpls.2020.618222 |
| [16] |
SMITHWICK E A H, EISSENSTAT D M, LOVETT G M, et al. Root stress and nitrogen deposition: Consequences and research priorities[J]. New Phytol, 2013, 197(3): 712-719. DOI:10.1111/nph.12081 |
| [17] |
VAN DER HEIJDEN M G A, MARTIN F M, SELOSSE M A, et al. Mycorrhizal ecology and evolution: The past, the present, and the future[J]. New Phytol, 2015, 205(4): 1406-1423. DOI:10.1111/nph.13288 |
| [18] |
CHEEKE T E, PHILLIPS R P, BRZOSTEK E R, et al. Dominant mycorrhizal association of trees alters carbon and nutrient cycling by selecting for microbial groups with distinct enzyme function[J]. New Phytol, 2017, 214(1): 432-442. DOI:10.1111/nph.14343 |
| [19] |
STEIDINGER B S, CROWTHER T W, LIANG J, et al. Climatic controls of decomposition drive the global biogeography of forest-tree symbioses[J]. Nature, 2019, 569(7756): 404-408. DOI:10.1038/s41586-019-1128-0 |
| [20] |
PHILLIPS R P, BRZOSTEK E, MIDGLEY M G. The mycorrhizal-associated nutrient economy: A new framework for predicting carbon-nutrient couplings in temperate forests[J]. New Phytol, 2013, 199(1): 41-51. DOI:10.1111/nph.12221 |
| [21] |
LIU X J, ZHANG Y, HAN W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459-462. DOI:10.1038/nature11917 |
| [22] |
YUAN Z Y, CHEN H Y H. Decoupling of nitrogen and phosphorus in terrestrial plants associated with global changes[J]. Nat Climate Change, 2015, 5(5): 465-469. DOI:10.1038/nclimate2549 |
| [23] |
PENG Y F, PENG Z P, ZENG X T, et al. Effects of nitrogen-phosphorus imbalance on plant biomass production: A global perspective[J]. Plant Soil, 2019, 436(1): 245-252. DOI:10.1007/s11104-018-03927-5 |
| [24] |
ADAMS T S, MCCORMACK M L, EISSENSTAT D M. Foraging strategies in trees of different root morphology: The role of root life-span[J]. Tree Physiol, 2013, 33(9): 940-948. DOI:10.1093/treephys/tpt067 |
| [25] |
CHENG L, CHEN W L, ADAMS T S, et al. Mycorrhizal fungi and roots are complementary in foraging within nutrient patches[J]. Ecology, 2016, 97(10): 2815-2823. DOI:10.1002/ecy.1514 |
| [26] |
VALLADARES F, WRIGHT S J, LASSO E, et al. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest[J]. Ecology, 2000, 81(7): 1925-1936. DOI:10.1890/0012-9658(2000)081[1925:PPRTLO]2.0.CO;2 |
| [27] |
QU Q L, WANG G L, LIU G B, et al. Effect of N addition on root morphological characteristics and growth of Bothriochloa ischaemun[J]. Bull Soil Water Conserv, 2012, 32(2): 74-79. 曲秋玲, 王国梁, 刘国彬, 等. 施氮对白羊草细根形态和生长的影响[J]. 水土保持通报, 2012, 32(2): 74-79. DOI:10.13961/j.cnki.stbctb.2012.02.054 |
| [28] |
YAN X L, WANG C, MA X Q, et al. Root morphology and seedling growth of three tree species in southern China in response to homo-geneous and heterogeneous phosphorus supplies[J]. Trees, 2019, 33(5): 1283-1297. DOI:10.1007/s00468-019-01858-x |
| [29] |
FRESCHET G T, ROUMET C. Sampling roots to capture plant and soil functions[J]. Funct Ecol, 2017, 31(8): 1506-1518. DOI:10.1111/1365-2435.12883 |
| [30] |
RAVEN J A, EDWARDS D. Roots: Evolutionary origins and biogeo-chemical significance[J]. J Exp Bot, 2001, 52(S1): 381-401. DOI:10.1093/jexbot/52.suppl_1.381 |
| [31] |
GUO W, GONG H, HAN S J, et al. Effects of nitrogen-water interaction on fine root morphology and production in a mixed Pinus koraiensis forest in Changbai Mountains, northeastern China[J]. J Beijing For Univ, 2016, 38(4): 29-35. 郭伟, 宫浩, 韩士杰, 等. 氮、水交互对长白山阔叶红松林细根形态及生产量的影响[J]. 北京林业大学学报, 2016, 38(4): 29-35. DOI:10.13332/j.1000-1522.20150436 |
| [32] |
DING G Q. Impacts of two year's fertilization on root morphological characters and nutrient contents of fine roots in Japanese larch (Larix kaempferi) plantation[D]. Harbin: Northeast Forestry University, 2009. 丁国泉. 连续两年施肥对日本落叶松细根形态和养分含量影响研究[D]. 哈尔滨: 东北林业大学, 2009. |
| [33] |
KUMAR P, HALLGREN S W, ENSTONE D E, et al. Root anatomy of Pinus taeda L.: Seasonal and environmental effects on development in seedlings[J]. Trees, 2007, 21(6): 693-706. DOI:10.1007/s00468-007-0162-y |
| [34] |
FITTER A H. Magnolioid roots-hairs, architecture and mycorrhizal dependency[J]. New Phytol, 2004, 164(1): 15-16. DOI:10.1111/j.1469-8137.2004.01193.x |
| [35] |
LIN G G, GUO D L, LI L, et al. Contrasting effects of ectomycorrhizal and arbuscular mycorrhizal tropical tree species on soil nitrogen cycling: The potential mechanisms and corresponding adaptive strategies[J]. Oikos, 2018, 127(4): 518-530. DOI:10.1111/oik.04751 |
| [36] |
JAKOBSEN I, ABBOTT L K, ROBSON A D. External hyphae of vesicular-arbuscular mycorrhizal fungi associated with Trifolium subterraneum L.: 1. Spread of hyphae and phosphorus inflow into roots[J]. New Phytol, 1992, 120(3): 371-380. DOI:10.1111/j.1469-8137.1992.tb01077.x |
| [37] |
SMITH S E, SMITH F A. Roles of arbuscular mycorrhizas in plant nutrition and growth: New paradigms from cellular to ecosystem scales[J]. Annu Rev Plant Biol, 2011, 62: 227-250. DOI:10.1146/annurev-arplant-042110-103846 |
| [38] |
ZHANG L H. Plastic responses of fine root traits to N and P in ectomycorrhizal and arbuscular mycorrhizal tree species in an evergreen broadleaved forest[D]. Fuzhou: Fujian Normal University, 2019. 张礼宏. 常绿阔叶林外生菌根与内生菌根树种细根性状对N和P的可塑性响应[D]. 福州: 福建师范大学, 2019. doi: 10.27019/d.cnki.gfjsu.2019.000974. |
| [39] |
BERNTSON G M. Modelling root architecture: are there tradeoffs between efficiency and potential of resource acquisition?[J]. New Phytol, 1994, 127(3): 483-493. DOI:10.1111/j.1469-8137.1994.tb03966.x |
| [40] |
BAUHUS J, KHANNA P K, MENDEN N. Aboveground and belowground interactions in mixed plantations of Eucalyptus globulus and Acacia mearnsii[J]. Can J For Res, 2000, 30(12): 1886-1894. DOI:10.1139/x00-141 |
| [41] |
WAHL S, RYSER P. Root tissue structure is linked to ecological strategies of grasses[J]. New Phytol, 2000, 148(3): 459-471. DOI:10.1046/j.1469-8137.2000.00775.x |
| [42] |
YU M, CAI J H, XUE L. Responses of fine root morphology of Cinnamomum camphora seedlings to nitrogen and phosphorus additions and planting density[J]. Acta Ecol Sin, 2019, 39(20): 7641-7648. 余明, 蔡金桓, 薛立. 樟树(Cinnamomum camphora)幼苗细根形态对氮磷添加和幼苗密度的响应[J]. 生态学报, 2019, 39(20): 7641-7648. DOI:10.5846/stxb201809041884 |
| [43] |
REED S C, TOWNSEND A R, CLEVELAND C C, et al. Microbial community shifts influence patterns in tropical forest nitrogen fixation[J]. Oecologia, 2010, 164(2): 521-531. DOI:10.1007/s00442-010-1649-6 |
| [44] |
EISELE K A, SCHIMEL D S, KAPUSTKA L A, et al. Effects of available P and N: P ratios on non-symbiotic dinitrogen fixation in tallgrass prairie soils[J]. Oecologia, 1989, 79(4): 471-474. DOI:10.1007/BF00378663 |
| [45] |
SCHLEUSS P M, WIDDIG M, HEINTZ-BUSCHART A, et al. Interactions of nitrogen and phosphorus cycling promote P acquisition and explain synergistic plant-growth responses[J]. Ecology, 2020, 101(5): e03003. DOI:10.1002/ecy.3003 |
| [46] |
SPOHN M. Element cycling as driven by stoichiometric homeostasis of soil microorganisms[J]. Basic Appl Ecol, 2016, 17(6): 471-478. DOI:10.1016/j.baae.2016.05.003 |
 2024, Vol. 32
2024, Vol. 32


