2. 海南大学林学院, 海口 570228
2. School of Forestry, Hainan University, Haikou 570228, China
沉香是瑞香科(Thymelaeaceae)沉香属(Aquilaria)或拟沉香属(Gyrinops)植物在受到外界伤害后形成的含有树脂的木材。由于沉香的价值极高且国际需求量不断扩大,长期以来相关基原植物遭受滥砍滥伐,沉香的基原植物均作为濒危保护植物被列入《濒危野生动植物种国际贸易公约》(CITES)附录Ⅱ,目前已报道共有21种沉香属植物和9种拟沉香属植物[1–2]。沉香在医药、香文化、日化等领域中广泛应用,是一种名贵的传统药材和天然香料,被佛教、伊斯兰教和印度教等奉为稀世珍宝[2–3]。《中国药典》中记载沉香具有“行气止痛,温中止呕,纳气平喘”的作用[4]。1935—2020年间,从沉香中分离鉴定倍半萜和2-(2-苯乙基)色酮两大类特征性成分有400余个,倍半萜主要有桉烷型、艾里莫芬烷型、愈创木烷型、沉香螺旋烷型、杜松烷型、菖蒲烷型、深冬烷型和前深冬烷型8类,2-(2-苯乙基)色酮主要分为flindersia型2-(2-苯乙基)色酮、5,6,7,8-四氢-2-(2-苯乙基)色酮、环氧-5,6,7,8-四氢-2-(2-苯乙基)色酮和2-(2-苯乙基)色酮聚合物等[2]。现代药理研究表明,沉香中的化学成分具有抗炎、抗肿瘤、降血糖、抗菌和镇静镇痛等作用[4–5]。
瓦拉(Aquilaria walla)是瑞香科沉香属植物,属于中等高树种,可长至15 m,通常生长在年降雨量很高的低地潮湿地区,是斯里兰卡自然生长的唯一沉香基原植物,曾有报道称在印度西高止山脉南端发现野生瓦拉树但极为罕见[6]。在斯里兰卡,瓦拉曾被认作低价值树种,直到2012年7月高价值木材走私案中出现大量瓦拉木材从而引发人们的关注。受当地政府委托,Subasinghe教授首次对瓦拉树脂进行提取分离,通过气相色谱从2个地区共6棵瓦拉树脂中分析出6个沉香共有成分,包括产生木香和花香的愈创木烷型倍半萜和桉烷型倍半萜[6]。
本研究组前期对白木香(A. sinensis)、丝沉香(A. filaria)、柳叶拟沉香(G. salicifolia)和柯拉斯那沉香(A. crassna)的化学成分进行了系统研究,发现了一系列结构新颖、活性显著的倍半萜和2-(2-苯乙基)色酮类化合物[7–13],为瓦拉沉香化学成分的研究奠定基础。目前国内外关于瓦拉沉香化学成分研究的报道较少,本研究首次从瓦拉沉香中分离得到2个新的2-(2-苯乙基)色酮类化合物,为瓦拉沉香的评价标准制定和开发利用奠定了基础。
1 材料和方法 1.1 材料瓦拉沉香样品于2014年8月购于泰国曼谷,经中国热带农业科学院热带生物技术研究所戴好富研究员鉴定其基原植物是瑞香科沉香属瓦拉(Aquilaria walla),凭证标本(201408SLLK)现存放于中国热带农业科学院热带生物技术研究所。
小鼠单核巨噬细胞(RAW264.7)购于中国科学院干细胞库;人肝癌细胞系(BEL-7402)、人胃癌细胞系(SGC-7901)、人肺癌细胞系(A-549)、人髓系白血病细胞系(K-562)和人宫颈癌细胞系(Hela)购于中国科学院上海细胞生物学研究所细胞库类型培养库。DMEM培养基、胎牛血清、RPMI1640培养液(赛默飞世尔科技公司);脂多糖(lipopolysaccharide, LPS)、Griess试剂、槲皮素、阿霉素、四甲基偶氮唑蓝(美国Sigma公司)。氘代试剂(青岛腾龙微波科技有限公司),常用AR级有机试剂(天津市康科德科技有限公司)。
1.2 仪器安捷伦1260分析型高效液相色谱仪、安捷伦1260半制备型高效液相色谱仪(美国Agilent公司); Bruker AV-500型超导核磁仪(德国Bruker公司);质谱仪Bruker amazon SL公司);紫外光谱仪(UV-2550 Shimadzu);红外光谱仪(Nicolet 380美国赛默飞世尔Thermo公司);旋光仪MCP 5100 (奥地利Anton Paar有限公司);CA-1111冷却水循环装置(上海爱朗仪器有限公司);BSA-100A自动部分收集器(上海青浦沪西仪器厂); 旋转蒸发仪(德国Heidolph Laborota); METTLER TOLEDO ME204精密和分析天平[万分之一,梅特勒-托力多仪器(上海)公司];超净工作台(上海博讯实业有限公司医疗设备厂);ELX-800酶标仪(美国宝特公司);色谱硅胶板G,柱层析硅胶G (200~300和60~80目, H)(青岛海洋化工厂);凝胶Sephadex LH-20 (德国Merck公司)。
1.3 提取和分离用乙醚冷浸超声提取粉碎干燥后的瓦拉沉香样品(384.0 g),剩余残渣经过3.0 L工业乙醇加热回流提取5次,减压浓缩后得到瓦拉沉香样品乙醇提取物(129.0 g),取出部分乙醇提取物进行UHPLCMS分析和生物活性测试并留样。用水将瓦拉沉香的乙醇提取物稀释为悬浊液,再用3.0 L乙酸乙酯萃取3次,最终得到瓦拉沉香样品乙酸乙酯萃取物(107.8 g),取出部分乙酸乙酯提取物进行UHPLCMS分析和生物活性测试并留样。剩下的乙酸乙酯萃取物经减压硅胶柱色谱进行分离,以氯仿-甲醇系统(氯仿: 甲醇=200:1~15:1)梯度洗脱,得到11个流份(Frs. 1~Frs. 11)。Fr. 5 (3.2 g)经ODS柱色谱(甲醇: 水= 3:7~1:0)梯度洗脱,得到14个流份(Frs. 5-1~Frs. 14)。Fr. 5-1 (40.0 mg)经Sephadex LH-20凝胶柱(甲醇)洗脱,得到Fr. 5-1-1和Fr. 5-1-2流份。Fr. 5-1-1流份(30.0 mg)经半制备高效液相色谱(C18半制备柱, 16%乙腈-水)分离纯化得到化合物1 (4.5 mg, tR=43.3 min)和2 (2.6 mg, tR=47.0 min)。
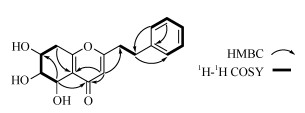
1.4 结构鉴定化合物1 无色油状,[α]D25+12.0 (c 0.10, MeOH); HR-ESI-MS m/z: 325.1005 [M + Na]+ (计算值C17H18NaO5, 325.104 6), 推断分子式为C17H18O5, 不饱和度为9。根据化合物1的1H和13C NMR谱图(表 1)可以看出, 结构中有3个次甲基[δC 67.0/δH 4.74 (1H, d, J = 3.6 Hz, H-5), δC 73.6/δH 3.93 (1H, dd, J = 3.6, 2.3 Hz, H-6), δC 65.9/δH 4.19 (1H, dt, J = 8.4, 2.1 Hz, H-7)],3个亚甲基[δC 32.4/δH 2.77 (2H, m, H-8), δC 34.0/δH 2.98 (2H, m, H-7′), 36.1/δH 2.89 (2H, m, H-8′)],1个单取代苯环[δC 141.2 (C-1′), δC 129.6/δH 7.27 (2H, m, H-2′, H-6′), δC 129.4/δH 7.20 (2H, m, H-3′, H-5′), δC 127.5/δH 7.20 (1H, m, H-4′)],2个双键[δC 170.8 (C-2), δC 113.9/δH 6.11 (1H, s, H-3)]和[δC 165.8 (C-9), δC 121.3 (C-10)],以及1个羰基信号[ δC 181.7 (C-4)]。HMBC谱中(图 1),H-3与C-4 (δC 181.7)和C-10 (δC 121.3)有相关信号,说明吡喃酮结构的存在。另外HMBC谱中H-3与C-10、H-5与C-3、H-6与C-10、H-7与C-9有相关信号,结合1H-1H COSY谱中H-5/H-6/H-7/H2-8相关信号的存在,确定了5,6,7-三羟基-5,6,7,8-四氢色酮的结构。再根据1H-1H COSY相关信号H2-7′/H2-8′,以及HMBC相关信号H-3/C-8′、H-2′/C-7′得出化合物1的平面结构(图 2)。
| 表 1 化合物1和2的1H (500 MHz, CD3OD)和13C NMR (125 MHz, CD3OD)数据 Table 1 1H (500 MHz) and 13C (125 MHz) NMR spectral data of compounds 1 and 2 in CD3OD |
|
图 1 化合物1的关键2D NMR相关信号 Fig. 1 Key 2D NMR correlations of compound 1 |
|
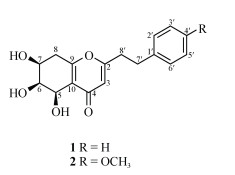
图 2 化合物1和2的结构 Fig. 2 Structures of compounds 1 and 2 |
通过将(5R,6S,7S)-5,6,7-三羟基-2-(4-羟基-3-甲氧基苯乙基)-5,6,7,8-四氢色酮的耦合常数[3J5, 6 (4.5 Hz)和3J7, 8 (6.0 Hz)]和CD曲线中的Cotton效应[CD (c 0.5 mg/mL, MeOH), λmax(Δε) 206 (+6.96), 246 (−13.58), 302 (+1.30) nm]与化合物1的耦合常数[3J5, 6 (3.6 Hz)、3J6, 7 (2.2 Hz)和3J7, 8 (8.4 Hz)]和CD曲线中的Cotton效应[CD (c 0.5 mg/mL, MeOH), λmax(Δε) 206 (+3.53), 239 (−12.15), 298 (+4.43) nm](图 3)进行对比,结果二者具有相似的耦合常数和Cotton效应[14], 从而确定化合物1的绝对构型为(5R,6S,7S)。综上所述,化合物1为新化合物,命名为(5R,6S,7S)-5,6,7-三羟基-2-(2-苯乙基)-5,6,7,8-四氢色酮。

|
图 3 化合物1和2的实测CD图谱 Fig. 3 Measured CD spectra of compounds 1 and 2 |
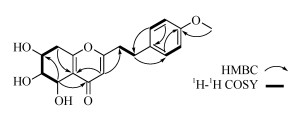
化合物2 无色油状,[a]D25+13.0 (c 0.10, MeOH); HR-ESI-MS: m/z 355.1152 [M + Na]+(计算值C18H20NaO6,355.1110),推断分子式为C18H20O6, 不饱和度为9。对比化合物2和1的1H和13C NMR数据(表 1),可见二者具有相似的结构,区别在于苯环上的取代以及结构中多了1个甲氧基。化合物2的1H NMR中呈现出了典型的AA′BB′苯环信号[δH 6.82 (2H, d, J = 7.7 Hz, H-2′, H-6′), δH 7.10 (2H, d, J = 7.7 Hz, H-3′, H-5′)],结合HMBC谱(图 4)中H-OCH3 (δH 3.76)与C-4′ (159.8)有相关信号,说明化合物2的苯环4位被甲氧基取代。通过对比化合物2和1的耦合常数和CD曲线(图 3),发现二者具有相似的耦合常数和Cotton效应,确定二者具有相同绝对构型。综上,化合物2为新化合物,命名为(5R,6S,7S)-5,6,7-三羟基-2-[2-(4-甲氧基苯基)乙基)-5,6,7,8-四氢色酮。
|
图 4 化合物2的关键2D NMR相关信号 Fig. 4 Key 2D NMR correlations of compound 2 |
采用LPS诱导小鼠单核巨噬细胞RAW264.7模型测试化合物的体外抗炎活性[15–18]。用含10% FBS的DMEM培养液于37 ℃、5% CO2培养箱中常规培养RAW264.7细胞。将1×105 CFU/mL细胞接种于96孔板中,分别设空白对照组、LPS诱导组、阳性槲皮素组和受试药物组,每组平行3次。置于37 ℃、5% CO2细胞培养箱中贴壁24 h后, 取100 μL上清液按照Griess法测定上清液中NO的含量,计算NO释放的半数抑制浓度(IC50)。结果表明化合物1和2无抑制LPS诱导RAW264.7产生NO的活性。
1.5.2 MTT法体外肿瘤细胞生长抑制活性测试采用四甲基偶氮唑盐比色法[19–20]对人肝癌细胞系(BEL-7402)、人胃癌细胞系(SGC-7901)、人肺癌细胞系(A-549)、人髓系白血病细胞系(K-562)和人宫颈癌细胞系(Hela)进行毒性测定。培养正常生长的肿瘤细胞,用含10%胎牛血清的RPMI1640培养液配成单细胞悬液,以5×104 CFU/mL接种到96孔板中(每孔200 μL),于37 ℃、5% CO2培养箱中培养24 h后,加入被试药物(初筛浓度5 μg/mL), 以顺铂为阳性对照,DMSO为阴性对照,终浓度均为5 μg/mL,各组平行3次。继续培养5 d,然后弃培养液(必要时离心),每孔加入0.04% MTT试剂100 μL, 同样条件下培养4 h。弃培养液(必要时离心),加入DMSO 150 μL/孔,混合均匀后于测定波长570 nm、参比波长655 nm下测定处理液和对照液吸收度,计算药物对肿瘤细胞生长的抑制率= (A对照–A给药)/A对照×100%。结果表明化合物1和2对以上5株肿瘤细胞不具有生长抑制作用。
1.5.3 酪氨酸酶抑制取130 μL溶于50 mmol/L磷酸盐缓冲液(PBS, pH=6.8)的酪氨酸酶与20 μL溶于DMSO的样品(初筛浓度为200 μg/mL)混合后转移到96孔板中,在37 ℃恒温培养箱中放置5 min后,待测组每孔再加50 μL 2 mmol/L酪氨酸溶液,在37 ℃下放置20 min。曲酸为阳性对照,DMSO为阴性对照,PBS代替底物作为空白对照,各组4次重复。在475 nm下用酶标仪测定每个孔的吸光度值,计算抑制率=[OD阴性–(OD样品–OD本底)]/(OD阴性–OD空白)×100%。结果表明, 在浓度为200 μg/mL时,化合物2对酪氨酸酶具有弱抑制作用,抑制率为(21.67±1.67)%,而化合物1不具有抑制作用[阳性对照曲酸IC50=(24.68±0.30) μmol/L]。
2 结果和讨论目前报道瓦拉沉香物质基础的研究较少。继2012年首次报道后,2014年Subasinghe等[21]通过GC-MS对3个瓦拉树群采集的16个样本进行分析,发现了19个化合物。2018年,本研究组对产地为斯里兰卡的瓦拉沉香进行了系统的化学成分分析, 用GC-MS分析其乙醚提取物并鉴定出26个化合物, 包括23个倍半萜类成分和1个2-(2-苯乙基)色酮类成分[22]。此后又陆续得到了倍半萜类化合物39个,2-(2-苯乙基)色酮类化合物20个[23–30],尚未发现5,6,7-三羟基-2-(2-苯乙基)-四氢色酮。本研究从斯里兰卡瓦拉沉香中分离鉴定出2个5,6,7-三羟基-2-(2-苯乙基)-四氢色酮类化合物均为新化合物,进一步丰富了该种沉香的化学成分结构类型。
目前尚无5,6,7-三羟基-2-(2-苯乙基)-四氢色酮类化合物具有生物活性的报道,本研究对2个化合物进行3种活性测试,结果表明均不具有抗炎活性和肿瘤细胞毒活性,化合物1无抑制酪氨酸酶的作用,化合物2对酪氨酸酶具有弱抑制作用。本研究为瓦拉沉香资源的进一步开发利用提供了物质基础依据。
| [1] |
LIU J. The distribution of global agarwood resources and current research of production methods[J]. China Food Drug Admin Mag, 2020(12): 108-110. 刘娟. 全球沉香资源的分布与结香方法的研究现状[J]. 中国食品药品监管, 2020(12): 108-110. DOI:10.3969/j.issn.1673-5390.2020.12.015 |
| [2] |
LI W, CHEN H Q, WANG H, et al. Natural products in agarwood and Aquilaria plants: Chemistry, biological activities and biosynthesis[J]. Nat Prod Rep, 2021, 38(3): 528-565. DOI:10.1039/D0NP00042F |
| [3] |
NAEF R. The volatile and semi-volatile constituents of agarwood, the infected heartwood of Aquilaria species: A review[J]. Flavour Fragr J, 2011, 26(2): 73-87. DOI:10.1002/ffj.2034 |
| [4] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China, Vol. 1[M]. Beijing: Medicine Science and Technology Press of China, 2020: 192-193. 国家药典委员会. 中华人民共和国药典, 一部[M]. 北京: 中国医药科技出版社, 2020: 192-193. |
| [5] |
IBRAHIM S R M, MOHAMED G A. Natural occurring 2-(2-phenylethyl) chromones, structure elucidation and biological activities[J]. Nat Prod Res, 2015, 29(16): 1489-1520. DOI:10.1080/14786419.2014.991323 |
| [6] |
SUBASINGHE S M C U P, HETTIARACHCHI D S, RATHNAMALALA E. Agarwood-type resin from Gyrinops walla Gaertn: A new discovery[J]. J Trop For Environ, 2012, 2(2): 43-48. DOI:10.31357/jtfe.v2i2.594 |
| [7] |
MI C N, YUAN J Z, ZHU M M, et al. 2-(2-Phenylethyl)chromone derivatives: Promising α-glucosidase inhibitors in agarwood from Aquilaria filaria[J]. Phytochemistry, 2021, 181: 112578. DOI:10.1016/j.phytochem.2020.112578 |
| [8] |
LIAO G, MEI W L, KONG F D, et al. 5,6,7,8-Tetrahydro-2-(2-phenylethyl)chromones from artificial agarwood of Aquilaria sinensis and their inhibitory activity against acetylcholinesterase[J]. Phytochemistry, 2017, 139: 98-108. DOI:10.1016/j.phytochem.2017.04.011 |
| [9] |
CHEN H Q, GUO F J, CAI C H, et al. Study on sesquiterpenes from agarwood originating from Gyrinops salicifolia[J]. China J Chin Mat Med, 2019, 44(11): 2274-2277. 柳叶拟沉香中倍半萜类化合物的研究[J]. 中国中药杂志, 2019, 44(11): 2274-2277. DOI:10.19540/j.cnki.cjcmm.20190321.203 |
| [10] |
LIU Y Y, WANG H, LI W, et al. Chemical constituents from agarwood "Hong-Tu" and their anti-inflammatory activity[J]. J Huazhong Norm Univ (Nat Sci), 2021, 55(4): 589-596. 红土沉香的化学成分及其抗炎活性研究[J]. 华中师范大学学报(自然科学版), 2021, 55(4): 589-596. DOI:10.19603/j.cnki.1000-1190.2021.04.013 |
| [11] |
HE D, WANG H, MEI W L, et al. Study on 5,6,7,8-tetrahydro-2-(2-phenylethyl)chromone derivatives of red soil agarwood Aquilaria crassna from Vietnam[J]. Chin Trad Herb Drugs, 2022, 53(1): 18-24. 红土沉香中5,6,7,8-四羟基-2-(2-苯乙基)色酮类化合物的研究[J]. 中草药, 2022, 53(1): 18-24. DOI:10.7501/j.issn.0253-2670.2022.01.004 |
| [12] |
LIU F Z, WANG H, LI W, et al. Filarones A and B, new anti-inflame-matory dimeric 2-(2-phenethyl)chromones from agarwood of Aquilaria filaria[J]. Phytochem Lett, 2021, 46: 11-14. DOI:10.1016/j.phytol.2021.09.008 |
| [13] |
HE D, DONG W H, LI W, et al. LC-MS-guided isolation of 2-(2-phenylethyl)chromone dimers from red soil agarwood of Aquilaria crassna[J]. Fitoterapia, 2022, 158: 105162. DOI:10.1016/j.fitote.2022.105162 |
| [14] |
HUO H X, GU Y F, SUN H, et al. Anti-inflammatory 2-(2-phenylethyl) chromone derivatives from Chinese agarwood[J]. Fitoterapia, 2017, 118: 49-55. DOI:10.1016/j.fitote.2017.02.009 |
| [15] |
DE LEO M, SALTOS M B V, PUENTE B F N, et al. Sesquiterpenes and diterpenes from Ambrosia arborescens[J]. Phytochemistry, 2010, 71(7): 804-809. DOI:10.1016/j.phytochem.2010.02.002 |
| [16] |
HUO H X, ZHU Z X, PANG D R, et al. Anti-neuroinflammatory sesquiterpenes from Chinese eaglewood[J]. Fitoterapia, 2015, 106: 115-121. DOI:10.1016/j.fitote.2015.08.009 |
| [17] |
PANG D R, LI S S, CHEN X N, et al. LC-MS guided isolation of two anti-inflammatory cyclic dihydrochalcane trimers from Chinese dragon's blood[J]. China J Chin Mat Med, 2019, 44(13): 2675-2679. LC-MS导向分离龙血竭中2个具有抗炎活性的二氢查耳烷环合型三聚体[J]. 中国中药杂志, 2019, 44(13): 2675-2679. DOI:10.19540/j.cnki.cjcmm.20190603.201 |
| [18] |
XING J Y, DU B Z, FENG X, et al. Phenolic constituents from stems of Ilex asprella[J]. China J Chin Mat Med, 2018, 43(21): 4267-4273. 岗梅茎中的酚类成分研究[J]. 中国中药杂志, 2018, 43(21): 4267-4273. DOI:10.19540/j.cnki.cjcmm.20180726.006 |
| [19] |
MOSMANN T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1/2): 55-63. DOI:10.1016/0022-1759(83)90303-4 |
| [20] |
YANG Y, CHEN H Q, KONG F D, et al. Dimeric sesquiterpenoid-4H-chromone derivatives from agarwood of Aquilaria crassna and their cytotoxicity[J]. Phytochemistry, 2018, 145: 207-213. DOI:10.1016/j.phytochem.2017.08.007 |
| [21] |
SUBASINGHE S M C U P, HETTIARACHCHI D S. Characterisation of agarwood type resin of Gyrinops walla Gaertn growing in selected populations in Sri Lanka[J]. Ind Crops Prod, 2015, 69: 76-79. DOI:10.1016/j.indcrop.2015.01.060 |
| [22] |
YANG Y L, LI W, MEI W L, et al. Biological activities and chemical constituents of a kind of wild agarwood from abroad[J]. Chin J Trop Crops, 2018, 39(12): 2473-2478. 一种国外野生沉香的生物活性和化学成分研究[J]. 热带作物学报, 2018, 39(12): 2473-2478. |
| [23] |
YANG L, YANG Y L, DONG W H, et al. Sesquiterpenoids and 2-(2-phenylethyl)chromones respectively acting as α-glucosidase and tyrosinase inhibitors from agarwood of an Aquilaria plant[J]. J Enzyme Inhib Med Chem, 2019, 34(1): 853-862. DOI:10.1080/14756366.2019.1576657 |
| [24] |
TIAN H, DONG W H, WANG H, et al. 2-(2-Phenylethyl) chromone derivatives of an agarwood from abroad[J]. Chin J Trop Crops, 2019, 40(8): 1626-1632. 一种国外沉香中2-(2-苯乙基)色酮类化合物研究[J]. 热带作物学报, 2019, 40(8): 1626-1632. DOI:10.3969/j.issn.1000-2561.2019.08.025 |
| [25] |
TIAN H, WANG H, YANG L, et al. Two new sesquiterpenoids from agarwood originated from Aquilaria sp.[J]. J Asian Nat Prod Res, 2020, 22(7): 626-631. DOI:10.1080/10286020.2019.1608955 |
| [26] |
YANG Y L, LI W, WANG H, et al. New tricyclic prezizaane sesquiterpenoids from agarwood[J]. Fitoterapia, 2019, 138: 104301. DOI:10.1016/j.fitote.2019.104301 |
| [27] |
LI W, YANG Y L, YANG L, et al. New sesquiterpenoids bearing 11-methyl ester group of agarwood[J]. Fitoterapia, 2020, 143: 104557. DOI:10.1016/j.fitote.2020.104557 |
| [28] |
WANG Y Y, WANG H, MI C N, et al. Two new 2-(2-phenethyl) chromone derivatives from agarwood of Aquilaria walla and their cytotoxicity[J]. Phytochem Lett, 2021, 42: 36-40. DOI:10.1016/j.phytol.2021.01.010 |
| [29] |
YUAN J Z, YANG Y L, LI W, et al. Zizaane-type sesquiterpenoids and their rearranged derivatives from agarwood of an Aquilaria plant[J]. Molecules, 2022, 27(1): 198. DOI:10.3390/molecules27010198 |
| [30] |
CHEN L Y, CHEN H Q, CAI C H, et al. Seven new 2-(2-phenethyl) chromone derivatives from agarwood of Aquilaria walla[J]. Fitoterapia, 2023, 165: 105421. DOI:10.1016/j.fitote.2022.105421 |
 2024, Vol. 32
2024, Vol. 32


