2. 云南中医药大学, 昆明 650500
2. Yunnan University of Chinese Medicine, Kunming 650500, China
罂粟科(Papaveraceae)紫金龙属(Dactylicapnos)植物分布于喜马拉雅地区至中国西部,全世界共有7种,其中4种分布于我国西南部,分别为紫金龙(D. scandens)、扭果紫金龙(D. torulosa)、宽果紫金龙(D. roylei)和丽江紫金龙(D. lichiangensis)。紫金龙又名串枝莲、豌豆七、豌豆跌打,白族语称“滋坚轮”,气微,味苦,性凉,以根入药[1–2]。紫金龙作为我国白族传统习用中草药,民间常用于治疗各种疼痛、高血压、跌打损伤等疾病[3]。随着对紫金龙植物活性成分的不断研究,目前已从该植物中分离得到甾体类、酚酸类、烷烃类、脂肪酸类、生物碱类等[4–6]多种骨架结构,其中以异喹啉生物碱为主[7],该类成分具有显著的抗炎、抗菌、抗心律失常、抗血小板凝聚、镇痛、松弛平滑肌等作用[8]。
近年来,由于抗生素滥用,致病微生物为适应环境变化不断进化变异,导致其对传统抗生素的耐药性日益增加,多重耐药菌不断出现,其引起的感染性疾病严重威胁着人类的健康,这是对抗生素疗效和抗生素研发速度的极大挑战,因此急需找到有效的抗微生物药物[9]。天然产物一直是新药研发的重要来源,且具有多靶点、不易产生耐药性等特点,或许从天然产物中寻找具有抗微生物活性的先导化合物可以为抗生素研发开拓新途径[10]。我们前期研究表明,紫金龙植物总生物碱部分具有一定的抗菌活性,且其主要成分普罗托品的抗微生物作用也已报道[11],但其他单体化合物的抗菌活性报道较少。受此启发,本研究以紫金龙干燥根为研究对象,运用经典的色谱分离手段和现代结构鉴定方法,共从其乙酸乙酯部位分离得到10个异喹啉类生物碱,并对分离得到的单体化合物进行了抗菌活性测定, 不仅丰富了紫金龙的化学物质基础,也为日后开发利用该植物资源提供了理论依据。
1 材料和方法 1.1 仪器和材料AVANCE400/AVANCE600型核磁共振波谱仪(德国布鲁克公司);Waters Xevo TQ-S三重四级杆质谱仪(美国沃特斯公司);LC-52制备型高效液相色谱仪(北京赛谱锐斯科技有限公司);C18MSⅡ色谱柱(10 mm×250 mm,日本半井公司);Sephadex LH-20葡聚糖凝胶(瑞典,安发玛西亚生物技术公司,粒径40~70 μm,批号10276077);硅胶GF254预制薄层色谱板(青岛海洋化工厂,100~200目,批号20200601);柱色谱硅胶(青岛海洋化工厂,200~300目,批号0190170);RP18柱色谱材料(德国默克公司,粒径40~63 μm,批号KU00503);HBS-1096B型酶标仪(南京德铁公司);高效液相所用乙腈为分析纯(西格玛奥德里奇贸易有限公司,批号WXBD4 328V);其他试剂均为工业级(重蒸后使用)。小檗碱(上海源叶生物科技有限公司,批号B21379)、琼脂(赛国生物科技有限公司,批号EZ6789D140)、MH肉汤培养基(广东环凯微生物科技有限公司,批号1096571)、沙氏液体培养基(广东环凯微生物科技有限公司,批号1097061)。
本实验所用植物样品于2019年9月采自云南省德宏州,经昆明医科大学胡炜彦教授鉴定为紫金龙(Dactylicapnos scandens)的干燥根,标本(No. 20190909)现存于昆明医科大学药学院暨云南省天然药物药理重点实验室。大肠杆菌(ATCC 8739)、金黄色葡萄球菌(ATCC 2592)、枯草芽孢杆菌(ATCC 6633)均来自美国典型培养物保藏中心(Rockville USA)。
1.2 提取和分离紫金龙根5.0 kg干燥后粉碎,用80%甲醇回流提取(每次溶剂25.0 L,回流3 h,提取4次),提取液减压回收溶剂,得到总浸膏400.0 g,总浸膏用pH= 2~3的盐酸水分散后过滤,滤液用氨水调pH至9~10,乙酸乙酯萃取,得乙酸乙酯层总生物碱13.1 g。乙酸乙酯层浸膏(13.1 g)经硅胶(200~300目)柱色谱分离,氯仿甲醇(1:0, 10:1, 9:1, 8:1, 7:1, 5:1, 0:1)梯度洗脱,合并得到5个组分(Fr.A~Fr.E)。Fr.A (1.2 g)经RPC18柱色谱,甲醇水(10:90~100:0)梯度洗脱,得到2个流分(Fr.A1~Fr.A2),Fr.A1经硅胶柱色谱,氯仿丙酮二乙胺(5:1:0.1)等度洗脱,得到2个流分(Fr.A11~Fr.A22),Fr.A11 (600.0 mg)以Sephadex LH20柱色谱(甲醇)洗脱得到化合物1 (93.1 mg); Fr.A21 (62.3 mg)以Sephadex LH20柱色谱(甲醇)洗脱及半制备液相纯化(乙腈水= 55:45),得到化合物4 (10.2 mg)和9 (7.3 mg)。Fr.B (1.0 g)经Sephadex LH20柱色谱(甲醇)洗脱得到3个流分(Fr.B1~Fr.B3), Fr.B1 (500.0 mg)经RPC18柱色谱,甲醇水(10:90~100:0)梯度洗脱及半制备液相纯化(乙腈水=70:30)得到化合物3 (2.3 mg);Fr.B2 (172.3 mg)重结晶得到化合物2 (100.3 mg)。Fr.C (3.1 g)经氯仿甲醇(10:1)等度洗脱得到化合物10 (132.7 mg)。Fr.D (1.2 g)经RPC18柱色谱,甲醇水(10:90~100:0)梯度洗脱得到3个流分(Fr.D1~Fr.D3),Fr.D1 (127.5 mg)经半制备液相纯化(乙腈水=45:55)得到化合物5 (2.3 mg)和6 (5.0 mg)。Fr.E (1.0 g)经RPC18柱色谱,甲醇水(10:90~100:0)梯度洗脱得到3个流分(Fr.E1~Fr.E3), Fr.E2 (35.7 mg)经半制备液相纯化(乙腈水=45:55)得到化合物7 (6.3 mg)和8 (2.7 mg)。化合物结构见图 1。
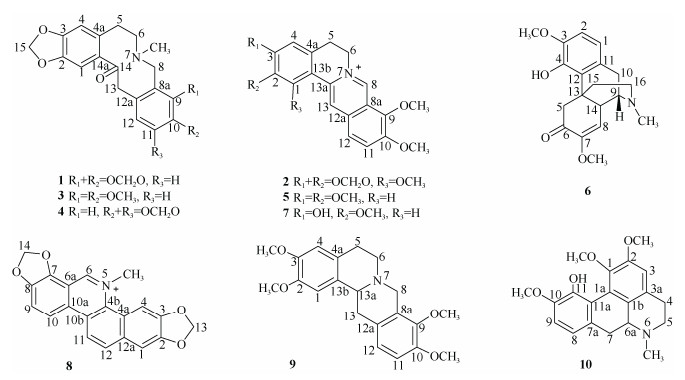
|
图 1 化合物1~10的化学结构 Fig. 1 Structures of compounds 1-10 |
化合物1 白色粉末,溶于氯仿、甲醇等溶剂。ESI-MS m/z: 354 [M + H]+,分子式为C20H19NO5。1H NMR (CDCl3, 400 MHz): δH 6.90 (1H, s, H-1), 6.67 (1H, d, J = 8.0 Hz, H-11), 6.65 (1H, d, J = 8.0 Hz, H-12), 6.62 (1H, s, H-4), 5.92 (2H, s, H-15), 5.90 (2H, s, H-16), 3.79 (2H, brs, H-8), 3.60 (2H, s, H-13), 2.89 (2H, m, H-5), 2.57 (2H, m, H-6), 1.95 (3H, s, N-CH3); 13C NMR (CDCl3, 100 MHz): δC 193.3 (C-14), 148.1 (C-3), 146.4 (C-2), 146.1 (C-9), 146.0 (C-10), 136.1 (C-4a), 132.7 (C-14a), 129.0 (C-12a), 125.1 (C-12), 117.8 (C-8a), 110.5 (C-4), 108.2 (C-1), 106.8 (C-11), 101.3 (C-15), 101.0 (C-16, -OCH2O-), 57.9 (C-6), 51.0 (C-8), 46.5 (C-13), 41.6 (N-CH3), 31.8 (C-5)。以上数据与文献[12]报道一致,故鉴定为普罗托品。
化合物2 白色结晶,溶于甲醇、DMSO等溶剂。ESI-MS m/z: 367 [M + H]+,分子式为C21H20NO5+。1H NMR (DMSO-d6, 400 MHz): δH 9.90 (1H, s, H-8), 8.92 (1H, s, H-13), 8.19 (1H, d, J = 9.2 Hz, H-12), 8.15 (1H, d, J = 9.2 Hz, H-11), 6.86 (1H, s, H-4), 6.16 (2H, s, -OCH2O-), 4.86 (2H, t, J = 5.2 Hz, H-6), 4.10 (3H, s, 9-OCH3), 4.09 (3H, s, 1-OCH3), 4.08 (3H, s, 10-OCH3), 3.14 (2H, t, J = 5.2 Hz, H-5); 13C NMR (DMSO-d6, 100 MHz): δC 150.9 (C-10), 150.5 (C-3), 145.4 (C-8), 143.6 (C-9), 141.5 (C-1), 136.5 (C-2), 134.9 (C-13a), 133.0 (C-12a), 132.5 (C-4a), 126.5 (C-11), 124.1 (C-12), 123.5 (C-13), 121.1 (C-8a), 112.8 (C-13b), 103.3 (C-4), 102.2 (-OCH2O-), 61.9 (9-OCH3), 60.3 (1-OCH3), 57.1 (10-OCH3), 55.2 (C-6), 27.4 (C-5)。以上数据与文献[13]报道一致, 故鉴定为1-甲氧基小檗碱。
化合物3 白色粉末,溶于甲醇、丙酮、DMSO等溶剂。ESI-MS m/z: 370 [M + H]+,分子式为C21H23NO5。1H NMR (DMSO-d6, 400 MHz): δH 6.96 (1H, s, H-1), 6.93 (1H, d, J = 8.2 Hz, H-12), 6.88 (1H, d, J = 8.2 Hz, H-11), 6.79 (1H, s, H-4), 5.99 (2H, s, H-15), 4.02 (2H, brs, H-13), 3.77 (3H, s, 9-OCH3), 3.70 (2H, brs, H-8), 3.65 (3H, s, 10-OCH3), 2.72 (2H, t, J = 4.8 Hz, H-6), 2.68 (2H, t, J = 4.8 Hz, H-5), 1.92 (3H, s, N-CH3); 13C NMR (DMSO-d6, 100 MHz): δC 194.9 (C-14), 150.9 (C-10), 147.3 (C-3), 146.3 (C-9), 145.5 (C-2), 135.0 (C-4a), 132.1 (C-14a), 127.9(C-8a), 127.5 (C-12), 127.3 (C-12a), 110.9 (C-11), 110.0 (C-4), 107.8 (C-1), 101.1 (C-15), 60.2 (9-OCH3), 56.5 (C-6), 55.5 (10-OCH3), 51.0 (C-8), 44.5 (C-13), 41.1 (N-CH3), 29.9 (C-5)。以上数据与文献[14]报道一致,故鉴定为别隐品碱。
化合物4 白色粉末,溶于甲醇、DMSO等溶剂。ESI-MS m/z: 354 [M + H]+,分子式为C20H19NO5。1H NMR (DMSO-d6, 400 MHz): δH 7.02 (1H, s, H-1), 6.82 (1H, s, H-4), 6.79 (1H, s, H-9), 6.72 (1H, s, H-12), 6.01 (2H, s, H-15), 5.99 (2H, s, -OCH2O-), 3.92 (2H, m, H-13), 3.50 (2H, brs, H-8), 2.89 (2H, t, J = 4.8 Hz, H-6), 2.75 (2H, t, J = 4.8 Hz, H-5), 2.10 (3H, s, N-CH3); 13C NMR (DMSO-d6, 100 MHz): δC 195.6 (C-14), 147.5 (C-2), 145.6 (C-10), 145.4 (C-3), 145.2 (C-11), 134.9 (C-4a), 130.7 (C-14a), 127.9 (C-12a), 124.2 (C-12), 115.9 (C-8a), 109.9 (C-4), 107.0 (C-1), 106.8 (C-9), 106.7 (C-12), 101.2 (C-15), 101.0 (-OCH2O-), 56.3 (C-6), 51.6 (C-8), 46.7 (C-13), 41.5 (N-CH3), 28.6 (C-5)。以上数据与文献[15]报道一致,故鉴定为伪普鲁托品。
化合物5 白色粉末,溶于甲醇等溶剂。ESI-MS m/z: 353 [M + H]+,分子式为C21H22NO4+。1H NMR (DMSO-d6, 600 MHz): δH 9.89 (1H, s, H-8), 9.10 (1H, s, H-13), 8.19 (1H, d, J = 9.4 Hz, H-11), 8.04 (1H, d, J = 9.4 Hz, H-12), 7.72 (1H, s, H-1), 7.10 (1H, s, H-4), 4.95 (2H, t, J = 6.6 Hz, H-6), 4.10 (3H, s, 9-OCH3), 4.06 (3H, s, 10-OCH3), 3.93 (3H, s, 3-OCH3), 3.86 (3H, s, 2-OCH3), 3.23 (2H, t, J = 6.6 Hz, H-5); 13C NMR (DMSO-d6, 150 MHz): δC 151.5 (C-3), 150.3 (C-10), 148.7 (C-2), 145.5 (C-8), 143.6 (C-9), 137.7 (C-13a), 133.1 (C-12a), 128.6 (C-4a), 126.8 (C-12), 123.5 (C-11), 121.4 (C-8a), 120.0 (C-13), 119.0 (C-13b), 111.3 (C-4), 108.8 (C-1), 62.0 (9-OCH3), 57.1 (10-OCH3), 56.2 (2-OCH3), 55.9 (3-OCH3), 55.4 (C-6), 26.0 (C-5)。以上数据与文献[16]报道一致,故鉴定为巴马汀。
化合物6 白色粉末,溶于甲醇、丙酮、DMSO等溶剂。ESI-MS m/z: 330 [M + H]+,分子式为C19H23NO4。1H NMR (DMSO-d6, 600 MHz): δH 8.75 (1H, s, 4-OH), 6.82 (1H, d, J = 8.4 Hz, H-1), 6.60 (1H, d, J = 8.4 Hz, H-2), 5.75 (1H, s, H-8), 3.73 (3H, s, 3-OCH3), 3.38 (3H, s, 7-OCH3), 3.14 (2H, m, H-10), 2.74 (3H, s, N-CH3), 2.51 (2H, m, H-16), 1.91 (2H, m, H-15); 13C NMR (DMSO-d6, 150 MHz): δC 191.6 (C-6), 151.9 (C-7), 146.0 (C-3), 145.1 (C-4), 126.9 (C-11), 121.1 (C-12), 118.4 (C-1), 112.8 (C-8), 110.5 (C-2), 57.2 (C-9), 55.8 (3-OCH3), 54.6 (7-OCH3), 41.9 (C-14), 47.3 (C-5), 47.2 (C-16), 40.1 (N-CH3), 38.6 (C-13), 32.9 (C-15), 23.6 (C-10)。以上数据与文献[17]报道一致,故鉴定为化青藤碱。
化合物7 白色粉末,溶于甲醇、DMSO等溶剂。ESI-MS m/z: 339 [M + H]+,分子式为C20H20NO4+。1H NMR (DMSO-d6, 600 MHz): δH 10.08 (1H, s, 3-OH), 9.85 (1H, s, H-8), 8.97 (1H, s, H-13), 8.20 (1H, d, J = 9.0 Hz, H-11), 8.02 (1H, d, J = 9.0 Hz, H-12), 7.69 (1H, s, H-1), 6.86 (1H, s, H-4), 4.91 (2H, t, J = 6.6 Hz, H-6), 4.10 (3H, s, 9-OCH3), 4.07 (3H, s, 10-OCH3), 3.94 (3H, s, 2-OCH3), 3.14 (2H, t, J = 6.6 Hz, H-5); 13C NMR (DMSO-d6, 150 MHz): δC 149.3 (C-2), 149.2 (C-3), 147.1 (C-9), 144.4 (C-8), 142.7 (C-10), 137.4 (C-4a), 132.4 (C-8a), 128.0 (C-12), 126.2 (C-11), 120.5 (C-12a), 120.4 (C-13a), 118.6 (C-13), 116.9 (C-13b), 114.1 (C-4), 108.7 (C-1), 61.1 (9-OCH3), 57.5 (10-OCH3), 55.4 (2-OCH3), 54.6 (C-6), 25.0 (C-5)。以上数据与文献[18]报道一致,故鉴定为药根碱。
化合物8 黄色粉末,溶于甲醇等溶剂。ESI-MS m/z: 349 [M + H]+,分子式为C20H14NO5+。1H NMR (DMSO-d6, 600 MHz): δH 10.14 (1H, s, H-6), 8.77 (1H, t, J = 9.0 Hz, H-9), 8.63 (1H, t, J =9.0 Hz, H-11), 8.30 (1H, s, H-4), 8.27 (1H, d, J =9.0 Hz, H-12), 8.11 (1H, t, J =9.0 Hz, H-10), 7.77 (1H, s, H-1), 6.60 (2H, s, H-13), 6.34 (2H, s, H-14), 4.92 (3H, s, N-CH3); 13C NMR (DMSO-d6, 150 MHz): δC 149.5 (C-6), 148.3 (C-2), 148.3 (C-3), 147.1 (C-8), 145.9 (C-7), 131.8 (C-12a), 131.1 (C-4b), 130.9 (C-12), 126.8 (C-10a), 126.3 (C-10b), 119.9 (C-4a), 119.6 (C-9), 118.5 (C-11), 116.9 (C-10), 109.1 (C-6a), 105.4 (C-1), 104.5 (C-14), 103.8 (C-4), 102.4 (C-13), 51.7 (N-CH3)。以上数据与文献[19]报道一致,故鉴定为血根碱。
化合物9 黄色粉末,溶于甲醇、DMSO等溶剂。ESI-MS m/z: 356 [M + H]+,分子式为C21H25NO4。1H NMR (DMSO-d6, 600 MHz): δH 6.88 (1H, d, J = 10.2 Hz, H-11), 6.68 (1H, s, H-1), 6.63 (1H, d, J = 10.2 Hz, H-12), 6.60 (1H, s, H-4), 4.25 (1H, t, J = 10.2 Hz, H-13a), 3.77 (3H, s, 2-OCH3), 3.74 (3H, s, 3-OCH3), 3.73 (3H, s, 9-OCH3), 3.72 (3H, s, 10-OCH3), 3.57 (2H, m, H-8), 3.14 (2H, m, H-6), 2.83 (2H, m, H-13), 2.68 (2H, m, H-5); 13C NMR (DMSO-d6, 150MHz): δC 149.9 (C-9), 147.2 (C-2), 147.2 (C-3), 144.4 (C-10), 129.7 (C-12a), 128.4 (C-13b), 127.7 (C-8a), 126.4 (C-4a), 123.8 (C-12), 111.7 (C-11), 111.2 (C-4), 109.4 (C-1), 59.6 (9-OCH3), 58.9 (C-13a), 55.8 (3-OCH3), 55.7 (2-OCH3), 55.5 (10-OCH3), 53.5 (C-8), 51.0 (C-6), 36.7 (C-13), 28.6 (C-5)。以上数据与文献[20]报道一致,故鉴定为四氢巴马汀。
化合物10 黄色粉末,溶于甲醇、丙酮、DMSO等溶剂。ESI-MS m/z: 342 [M + H]+,分子式为C20H23NO4。1H NMR (DMSO-d6, 600 MHz): δH 8.54 (1H, s, 11-OH), 6.89 (1H, d, J = 8.4 Hz, H-8), 6.82 (1H, d, J = 8.4 Hz, H-9), 6.84 (1H, s, H-3), 3.83 (3H, s, 2-OCH3), 3.77 (3H, s, 1-OCH3), 3.59 (3H, s, 10-OCH3), 2.41 (3H, s, N-CH3); 13C NMR (DMSO-d6, 150 MHz): δC 151.1 (C-2), 148.6 (C-10), 143.7 (C-11), 142.4 (C-1), 130.0 (C-7a), 129.5 (C-1b), 128.7 (C-3a), 125.0 (C-1a), 119.8 (C-11a), 118.8 (C-8), 111.5 (C-3), 110.5 (C-9), 62.9 (C-6a), 61.4 (1-OCH3), 55.8 (2-OCH3), 55.8 (10-OCH3), 52.3 (C-5), 43.6 (N-CH3), 35.2 (C-7), 28.7 (C-4)。以上数据与文献[21]报道一致,故鉴定为异紫堇定。
1.4 抗菌活性菌悬液的制备 将保存的测试菌株划线接种于营养琼脂培养基平板,待菌落长出后挑取单菌落于液体培养基中震荡培养至对数期。除去上清液,下层的细菌沉淀用生理盐水清洗2~3次,吹散。在紫外分光光度计下测定菌液在OD600处的吸光度值,并调整菌液的光密度在0.10 (0.5麦氏法兰标准), 最后将菌液稀释到106 CFU/mL。
最小抑菌浓度(MIC)的测定 取无菌96孔板, 第2列的孔中加入180 μL无菌培养基和20 μL配置好的样品溶液,充分混匀后,从第2列中取出100 μL加入第3列,以此类推至第11列,成分混匀后第11列中取出100 μL丢弃,测试样品的最终浓度为0.049~100 μg/mL。每个板设置阳性对照(阳性对照药为小檗碱)、阴性对照(加入培养基、DMSO和菌液)和空白对照(加入培养基、DMSO和生理盐水)。处理好的96孔板放入恒温振荡器中37 ℃下恒温培养24 h,取出观察微孔中细菌生长情况,并用酶标仪测定OD600处的吸光值,按照检测不到细菌生长的孔的样品浓度作为待测样品的MIC值,如果待测样品的MIC值大于100 μg/mL视为该样品没有抗菌活性,每个实验平行3次。
体外抗菌活性实验结果 以金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌为测试菌,按同上方法检测各单体化合物的体外抗菌活性。结果表明(表 1),化合物4对大肠杆菌表现出了潜在的抑制活性,MIC值为6.25 μg/mL,抗菌活性优于临床抗菌药物小檗碱(25.0 μg/mL)。
| 表 1 化合物1~10的最小抑菌浓度(μg/mL) Table 1 Minimal inhibitory concentration (MIC, μg/mL) of compound 1-10 |
本研究主要对紫金龙根部化学成分进行了系统研究,共从其乙酸乙酯部位分离得到10个异喹啉类生物碱,包括3个普罗托品类(化合物1、3、4)、4个小檗碱类(化合物2、5、7、9)、1个苯啡啶类(化合物8)和2个吗啡烷类(化合物6、10),分别鉴定为普罗托品(1)、1-甲氧基小檗碱(2)、别隐品碱(3)、伪普鲁托品(4)、巴马汀(5)、青藤碱(6)、药根碱(7)、血根碱(8)、四氢巴马汀(9)和异紫堇定(10)。其中化合物2、3、4、8是首次从该植物中分离得到。
细菌耐药性已经成为21世纪国际关注的热点问题之一,急需开发新的抗菌药物应对耐药菌引发的临床感染。从天然来源药物资源中寻找活性成分是新型抗菌药物分子或先导分子发现的重要途径[22]。异喹啉类生物碱结构骨架多样,抗菌活性显著,已经成为抗菌药物开发的重点关注结构类群。紫金龙植物中富含异喹啉类生物碱,一些已知异喹啉结构具有显著的抗真菌活性,如普罗托品、别隐品碱和巴马汀对多种植物真菌表现出显著的抑制作用,血根碱对白色念珠菌感染模型小鼠具有保护性[23]。尽管本研究中这些化合物的抗真菌实验为阴性,但这些结构却对临床常见治病细菌表现出了显著的抑制活性。分析化合物的抗菌活性表明,化合物4的活性明显优于化合物1,两者主要的区别在于含氧五元环的位置不同,提示取代基的位置对该类化合物的抗菌活性具有重要的贡献。同时,化合物5的活性明显优于化合物9,两者主要不同在于化合物5中含有氮正离子,推测氮正离子可能是该类化合物发挥抗菌作用的关键基团。结合化合物的结构特征,推测这类化合物可能直接与细菌外膜上的带有负电荷的类脂部分发生静电相互作用,导致细菌外膜结构发生膨胀,最后解体,其可能的作用靶点在细胞膜上。同时天然产物结构复杂,可通过破坏细菌结构完整性、改变细胞渗透压、抑制细菌生命活动代谢等复杂作用方式抑制细菌生长,这些活性分子的抗菌机制及可能的结合靶点还有待于后续深入研究。本研究不仅丰富了紫金龙植物的化学成分,也为抗菌药物先导分子的发现及修饰提供了物质基础和理论依据。
| [1] |
YAN T Q, AI T M. Study on the chemical constituents from Dactylicapnos scandens[J]. Chin Trad Herb Drugs, 2004, 35(8): 25-26. 严田青, 艾铁民. 紫金龙化学成分的研究[J]. 中草药, 2004, 35(8): 25-26. DOI:10.3321/j.issn:0253-2670.2004.08.009 |
| [2] |
HE S M, SONG W L, CONG K, et al. Identification of candidate genes involved in isoquinoline alkaloids biosynthesis in Dactylicapnos scandens by transcriptome analysis[J]. Sci Rep, 2017, 7(1): 9119. DOI:10.1038/s41598-017-08672-w |
| [3] |
MA C Y, YANG H J. Research progress on the traditional Bai medicine: Zixjieillut (Dactylicapnos scandens)[J]. Chin J Ethnomed Ethnopharm, 2011, 20(23): 5-8. 马春云, 杨怀镜. 白族药滋坚伦(紫金龙)的研究进展[J]. 中国民族民间医药, 2011, 20(23): 5-8. DOI:10.3969/j.issn.1007-8517.2011.23.004 |
| [4] |
GUO C C, JIANG Y, LI L, et al. Application of a liquid chromatography-tandem mass spectrometry method to the pharmacokinetics, tissue distribution and excretion studies of Dactylicapnos scandens in rats[J]. J Pharm Biomed Anal, 2013, 74: 92-100. DOI:10.1016/j.jpba.2012.10.011 |
| [5] |
WU Y R, ZHAO Y X, LIU Y Q, et al. Alkaloids from Dactylicapnos scandens[J]. Nat Prod Res Dev, 2008, 20(4): 622-626. 吴颖瑞, 赵友兴, 刘玉清, 等. 紫金龙的生物碱成分研究[J]. 天然产物研究与开发, 2008, 20(4): 622-626. DOI:10.3969/j.issn.1001-6880.2008.04.013 |
| [6] |
WANG B, YANG Z F, ZHAO Y L, et al. Anti-inflammatory isoquinoline with bis-seco-aporphine skeleton from Dactylicapnos scandens[J]. Org Lett, 2018, 20(6): 1647-1650. DOI:10.1021/acs.orglett.8b00400 |
| [7] |
CAO Y, GAO J, GAO X L, et al. Research progress on alkaloids from genus Dactylicapnos Wall. and their pharmacological activities[J]. Chin Trad Herb Drugs, 2014, 45(17): 2556-2563. 曹愿, 高晶, 高小力, 等. 紫金龙属生物碱及其药理活性研究进展[J]. 中草药, 2014, 45(17): 2556-2563. |
| [8] |
WANG B, ZHAO Y J, ZHAO Y L, et al. Exploring aporphine as anti-inflammatory and analgesic lead from Dactylicapnos scandens[J]. Org Lett, 2020, 22(1): 257-260. DOI:10.1021/acs.orglett.9b04252 |
| [9] |
LIU X F, XIAO J Y, WANG S M, et al. Research progress on bacterial membrane vesicles and antibiotic resistance[J]. Int J Mol Sci, 2022, 23(19): 11553. DOI:10.3390/ijms231911553 |
| [10] |
ÁLVAREZ-MARTÍNEZ F J, BARRAJÓN-CATALÁN E, MICOL V. Tackling antibiotic resistance with compounds of natural origin: A comprehensive review[J]. Biomedicines, 2020, 8(10): 405. DOI:10.3390/biomedicines8100405 |
| [11] |
LIU R Y, YUAN S, SUN W W, et al. Synthesis and antifungal activity of the derivatives of protopine[J]. Chem Res Appl, 2018, 30(5): 736-744. 刘睿媛, 袁帅, 孙文文, 等. 普罗托品衍生物的合成及其抗菌活性研究[J]. 化学研究与应用, 2018, 30(5): 736-744. DOI:10.3969/j.issn.1004-1656.2018.05.013 |
| [12] |
CHANG Y, WANG X L, TANG X Y, et al. A new alkaloid from Meconopsis horridula[J]. Nat Prod Res Dev, 2017, 29(5): 731-734. 常颜, 王晓玲, 唐晓莹, 等. 多刺绿绒蒿中的一个新生物碱类化合物[J]. 天然产物研究与开发, 2017, 29(5): 731-734. DOI:10.16333/j.1001-6880.2017.5.002 |
| [13] |
IWASA K, NANBA H, LEE D U, et al. Structure-activity relationships of protoberberines having antimicrobial activity[J]. Planta Med, 1998, 64(8): 748-751. DOI:10.1055/s-2006-957572 |
| [14] |
REINHARDT J K, ZIMMERMANN-KLEMD A M, DANTON O, et al. Compounds from Toddalia asiatica: Immunosuppressant activity and absolute configurations[J]. J Nat Prod, 2020, 83(10): 3012-3020. DOI:10.1021/acs.jnatprod.0c00564 |
| [15] |
LI M, CHEN X, TANG Q M, et al. Isoquinoline alkaloids from Thalictrum delavayi[J]. Planta Med, 2001, 67(2): 189-190. DOI:10.1055/s-2001-11518 |
| [16] |
WAFO P, NYASSE B, FONTAINE C. A 7, 8-dihydro-8-hydroxypalmatine from Enantia chlorantha[J]. Phytochemistry, 1999, 50(2): 279-281. DOI:10.1016/S0031-9422(98)00382-3 |
| [17] |
LIU R, MA Y M, ZHANG H C. Chemical constituents of the leaves and stems from Menispermum dauricum[J]. J NW For Univ, 2010, 25(5): 176-178. 刘瑞, 马养民, 张弘弛. 蝙蝠葛茎叶化学成分的初步研究[J]. 西北林学院学报, 2010, 25(5): 176-178. |
| [18] |
SUN Y T, WANG A L, LI D H, et al. Nitrogeous chemical constituents from Tinosporae radix[J]. Chin Trad Herb Drugs, 2015, 46(9): 1287-1291. 孙雅婷, 王傲莉, 李达翃, 等. 青牛胆含氮类成分研究[J]. 中草药, 2015, 46(9): 1287-1291. DOI:10.7501/j.issn.0253-2670.2015.09.006 |
| [19] |
MIAO F, YANG X J, ZHOU L, et al. Structural modification of sanguinarine and chelerythrine and their antibacterial activity[J]. Nat Prod Res, 2011, 25(9): 863-875. DOI:10.1080/14786419.2010.482055 |
| [20] |
FU J L, LIU J, WU C Q, et al. Separation and purification of the chemical composition of Fibraurea recisa Pierre[J]. Acta Agric Shanghai, 2014, 30(6): 116-119. 扶教龙, 刘佳, 吴晨奇, 等. 天仙藤化学成分分离纯化研究[J]. 上海农业学报, 2014, 30(6): 116-119. |
| [21] |
LIAN J J, LIU F F, FAN D L, et al. Study of chemical constituents from Stephania hainanensis[J]. J Shenyang Pharm Univ, 2019, 36(3): 202-206. 连敬杰, 刘凡凡, 范冬立, 等. 海南地不容的化学成分[J]. 沈阳药科大学学报, 2019, 36(3): 202-206. DOI:10.14066/j.cnki.cn21-1349/r.2019.03.003 |
| [22] |
JIA L Y, DENG D, SUN L H, et al. Mechanism of traditional Chinese medicine in treating drug-resistant bacterial infection[J]. Chin J Exp Trad Med Form, 2020, 26(16): 228-234. 贾丽阳, 邓冬, 孙丽华, 等. 中药治疗耐药菌感染作用机制研究进展[J]. 中国实验方剂学杂志, 2020, 26(16): 228-234. DOI:10.13422/j.cnki.syfjx.20201624 |
| [23] |
EOM S H, LEE D S, JUNG Y J, et al. The mechanism of antibacterial activity of phlorofucofuroeckol-A against methicillin-resistant Staphylococcus aureus[J]. Appl Microbiol Biotechnol, 2014, 98(23): 9795-9804. DOI:10.1007/s00253-014-6041-8 |
 2024, Vol. 32
2024, Vol. 32


