1b. 江西农业大学国土资源与环境学院, 南昌 330045;
2. 福建农林大学资源与环境学院, 福州 350002
1b. College of Land Resources and Environment, Jiangxi Agricultural University, Nanchang 330045, China;
2. College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China
由于化石燃料的燃烧和化肥的过量使用等人类活动,各地区氮沉降量日益增多[1],我国已是全球三大高氮沉降区域之一。目前,我国亚热带地区氮沉降量已达到40 kg N/(hm2·a)[2],高于我国平均氮沉降水平[20.4 kg N/(hm2·a)][3]。在氮素缺乏的森林,氮添加能够提高植物光合速率,促进植物生长,有利于森林碳储存[4];而在氮饱和森林,氮添加可能造成植物营养失衡、光合速率下降,从而导致森林生产力降低[5–6]。不同树种对氮沉降的响应也有所不同,在低氮添加时,固氮豆科植物生长比非固氮植物更具优势;而在高氮添加时,则与非固氮物种差异不大[7]。另外,针叶树种和阔叶树种对氮沉降的响应也有所差异,Vanguelova等[8]的研究表明氮沉降对阔叶树种影响更大。
同时,我国亚热带地区也遭受着不同程度干旱,且发生频率在未来有上升趋势[9]。在轻度干旱下,植物可以通过调控渗透调节物质含量和叶绿素含量等生理过程来适应干旱;而在重度干旱下,植物自身调节能力降低,光合速率下降,生长受到限制[10]。一般认为,豆科植物由于和固氮真菌的共生,养分限制较小,植物生长受干旱的影响比非固氮植物小[11];也有研究认为,固氮植物的生产力比非固氮植物更易受干旱影响[12]。我国亚热带森林具有重要的碳汇潜力[13],探究不同树种对干旱的响应对于了解气候变化背景下亚热带森林碳库的动态变化十分重要。
高氮沉降和干旱均会影响森林不同植物生长进而影响森林群落结构和生态系统服务功能[14]。一般认为,低氮沉降会减缓干旱对植物的不利影响[15],但高氮沉降则可能加重干旱对植物生长的抑制作用[16]。亚热带森林是我国重要的碳库[17],豆科植物种类较多[18],同时受到高氮沉降和干旱的影响[19]。目前对于在高氮沉降和干旱交互作用下,森林不同树种会如何响应尚了解不足。因此,探究氮沉降和干旱对不同植物生长的影响,有助于预测未来高氮沉降和干旱交互背景下亚热带森林生态功能的变化。
本试验设置了施氮和不施氮2个处理,每个氮处理下设置3个干旱程度(对照、轻度干旱、重度干旱),探讨氮处理、干旱及其交互作用对马尾松(Pinus massoniana)、杉木(Cunninghamia lanceolata)、海南红豆(Ormosia pinnata)和木荷(Schima superba)幼树生长的影响,为未来氮沉降和干旱背景下亚热带森林生态系统管理提供理论支撑。
1 材料和方法 1.1 试验设计试验地点位于福州市福建农林大学的实验温室(26°08′ N,119°24′ E),温室四面通风。在温室内建设18个生长池,每个生长池外径长1.4 m,宽1.4 m, 深0.6 m。每个生长池底部设计1个2 cm出水口, 用于收集土壤淋滤液。池内土壤为采自城郊亚热带人工林的红壤,土壤去除杂物后混匀填入池中,填土深0.5 m,所填土壤pH值为6.09±0.08, 全碳含量为(3.99±0.04) g/kg,全氮含量为(0.37±0.01) g/kg, 全磷含量为(0.36±0.02) g/kg,硝态氮含量为(5.62±0.77) mg/kg, 氨态氮含量为(2.20±0.51) mg/kg。土壤静置1个月后,将1 a生长势一致的马尾松(Pinus massoniana)、杉木(Cunninghamia lanceolata)、海南红豆(Ormosia pinnata)和木荷(Schima superba)幼苗各1株随机移入池中。
缓苗4个月后,2018年4月开始试验处理。试验设置施氮和不施氮2个处理,每个氮处理又分别设置3个干旱处理,共6个处理,每处理3个重复。2个氮处理分别是对照(CK,不施氮)和施氮[NA, 施氮量80 kg N/(hm2·a)]。3个干旱处理分别是对照(HW, 土壤体积含水率为28.31%, 下同)、轻度干旱(MW, 22.38%)和重度干旱(LW, 15.37%),即分别相当于约80%、55%和40%的田间最大持水量。试验添加的氮为NH4NO3,将1.905 g NH4NO3溶于5 L蒸馏水中,每月1次浇于施氮组生长池,对照浇5 L蒸馏水。土壤湿度通过土壤湿度计监测,每3 d监测1次,依据土壤湿度、土壤持水量和生长池体积等补充水分,以保持土壤含水量。
1.2 样品测定土壤在填入生长池前混匀,随机取3份用于基本理化性质背景值的测定。土壤pH用电极法测定(土: 水=1:2.5);全氮和全碳用元素分析仪测定(EA3000, Euro Vector,Italy);全磷用高氯酸-硫酸消煮法测定;氨态氮和硝态氮用KCl溶液浸提[20], 用紫外分光光度比色法测定。在2018年4月和2020年8月分别测量每棵幼树的基径和株高。于2020年8月采用全收割法对4种幼树进行破坏性取样, 将植物根、茎、叶分别在65 ℃烘箱烘至恒重, 分别称量干物质量作为根、茎、叶生物量,同时计算每株植物的总生物量和根冠比。
1.3 数据分析所有数据均用SPSS 20.0进行分析,对基径、株高以及生物量进行氮添加量、干旱程度和物种多因素方差分析。采用单因素方差分析同一氮处理下对照组、轻度干旱和重度干旱处理间差异,用Duncan法进行多重比较;采用t检验分析同一干旱程度下不同氮处理间的差异。采用Excel 2013作图。
2 结果和分析 2.1 氮添加和干旱对4种幼树株高和基径的影响4种幼树的株高和基径在不同氮添加处理、干旱程度和树种间差异显著(图 1)。氮添加对轻度干旱处理的木荷和干旱对照的杉木株高有显著促进作用,对3种干旱处理的马尾松和杉木幼树株高均无显著影响。在不施氮处理下,干旱对马尾松株高没有显著影响;但在2种氮处理下,干旱对木荷、杉木和海南红豆幼树株高均有抑制作用(P < 0.05),且随干旱程度的加重,抑制作用更明显。在干旱对照组和轻度干旱处理下,氮添加促进了木荷和杉木的基径生长(P < 0.05);在轻度干旱处理下,氮添加抑制了马尾松的基径生长(P < 0.01)。在3种干旱处理下,氮添加均对海南红豆的基径生长无显著影响。在不施氮处理下,干旱对木荷幼树生长没有明显影响;在2种氮处理下,干旱对马尾松、杉木和海南红豆幼树的基径生长均有抑制作用。另外,氮添加、干旱和物种3因素之间的交互作用显著,并总体上显著影响4种幼树的株高和基径(表 1)。
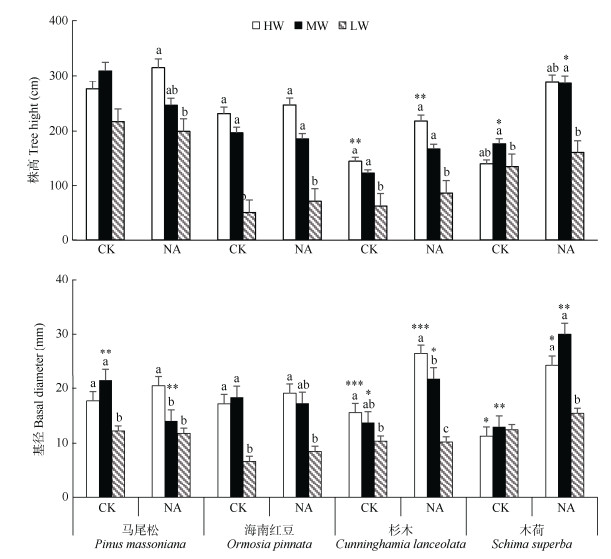
|
图 1 氮添加和干旱对4种幼树株高和基径的影响。CK: 不施氮; NA: 施氮; HW: 对照; MW: 轻度干旱; LW: 重度干旱;柱上不同小写字母表示同一氮处理下不同干旱程度间差异显著(P < 0.05); *: 同一干旱下不同氮处理间差异显著(*: P < 0.05; **: P < 0.01; ***: P < 0.001)。下同 Fig. 1 Effects of nitrogen addition and drought stress on the basal diameter and tree height of four saplings. CK: No nitrogen addition; NA: Nitrogen addition; HW: Control; MW: Moderate drought; LW: Severe drought. Different small letters upon column indicate significant differences among different drought degree under the same nitrogen treatment at 0.05 level, and * indicated significant differences among different nitrogen treatments under the same drought stress (*: P < 0.05; **: P < 0.01; ***: P < 0.001). The same below |
| 表 1 氮添加和干旱对4种幼树生长的影响 Table 1 Effects of nitrogen addition and drought stress on the growth of four sapling |
在干旱对照和轻度干旱处理下,氮添加促进了木荷和杉木总生物量的增加(P < 0.01),但对马尾松和杉木的幼树总生物量没有明显影响;在重度干旱处理下,氮添加对4种树苗的总生物量均无显著影响。氮添加对非豆科植物(木荷)生物量增加的促进作用要高于豆科植物(海南红豆)。干旱对幼树的总生物量有抑制作用,且随干旱程度的加剧抑制作用逐渐加强,但干旱对不施氮处理下的木荷生物量没有明显影响(图 2)。在不同氮添加和干旱处理下,阔叶植物(木荷、海南红豆)和针叶植物(马尾松、杉木)之间的总生物量均没有太大差异(表 2)。
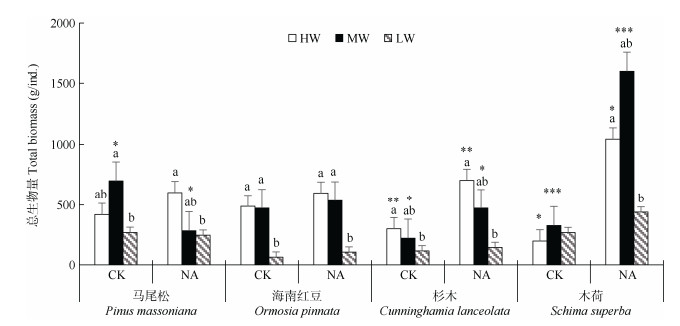
|
图 2 氮添加和干旱对4种幼树总生物量的影响 Fig. 2 Effects of nitrogen addition and drought stress on the total biomass of four saplings |
| 表 2 4种幼树生长对氮添加和干旱的响应差异 Table 2 Differential response of four sapling species to the nitrogen addition and drought stress treatments |
在不同氮处理和干旱处理下,各树种的生物量分配也存在差异(图 3)。在干旱对照和轻度干旱处理下,氮添加显著促进了木荷的根、茎、叶生物量和杉木的根、叶生物量增加(P < 0.05);在轻度干旱处理下,氮添加抑制了马尾松的根、茎生物量增长。氮添加显著降低了重度干旱处理下杉木的根冠比(P < 0.01),对其他幼树根冠比没有显著影响。在不施氮处理下,干旱对海南红豆的根、茎、叶生物量和杉木的茎、叶生物量均有抑制作用,对杉木的根生物量和木荷的根、茎生物量没有显著影响;在施氮处理下,干旱对海南红豆的叶、根生物量及杉木和木荷的根、茎、叶生物量有显著抑制作用,对马尾松的根、叶生物量和海南红豆的茎生物量没有显著影响。干旱显著增加了杉木的根冠比(P < 0.05), 对其他幼树的根冠比没有显著影响。

|
图 3 氮添加和干旱对4种幼树叶、茎和根生物量及根冠比的影响 Fig. 3 Effects of nitrogen addition and drought stress on the biomass of leaves, stems, roots and root-shoot ratio of four saplings |
氮是植物生长所需的重要元素,氮添加可以增加植物叶绿素含量,提高光合酶活性,从而提高光合速率,促进植物生长[4]。一般来讲,氮添加能显著提高植物全株生物量和各器官生物量[21]。本研究干旱对照组中,氮添加显著促进了木荷和杉木幼树基径、总生物量和不同器官生物量的增加,这表明氮添加能够有效提高植物各器官生物量。夏建阳等[22]对陆生植物对氮添加的全球响应模式也表明, 氮添加能显著增加植物的生物量。
但本研究中,氮添加对干旱对照组海南红豆和马尾松幼树的生长没有显著影响。马尾松是典型的先锋树种,可能由于对土壤养分要求不高,因而其生长对氮添加没有明显响应。豆科植物由于和固氮菌的共生,可以通过固氮作用满足自身对氮元素的需求[23],因此本研究中海南红豆在未施氮条件下可能也不缺氮,从而导致氮添加对海南红豆生长影响不大。
3.2 干旱对4种幼树生长的影响在2种氮处理下,干旱均显著降低海南红豆和杉木的基径、株高和总生物量,且随干旱程度的加重抑制作用更明显,这表明干旱会抑制植物生长。干旱通过影响植物体形态、气孔导度和光合作用等生理代谢过程抑制植物生长[10]。在Pardos[24]等对地中海4种幼树应对轻度干旱响应策略的研究中,干旱降低了幼树的水势和光合效率,抑制了生物量增加。本试验中,重度干旱降低了马尾松的光合速率和气孔导度[25],从而可能抑制了施氮处理下马尾松的基径和生物量增加,这也表明干旱会通过抑制植物光合作用从而抑制植物生长。但重度干旱对木荷的基径和生物量影响不大,这可能是由于木荷的养分吸收和利用效率受干旱影响不大[26],因此木荷生长在不同干旱处理下没有明显差异。在干旱条件下,植物会调节不同器官的生长和资源分配,比如,增加根系的生长以获取水分和养分[27]。本研究中干旱增加了杉木的根冠比,这表明杉木分配了更多的资源给根系以适应干旱。
豆科植物和非豆科植物对干旱的响应不同。在不施氮处理下,干旱对照组的海南红豆基径、株高和生物量要高于木荷,而重度干旱下的海南红豆基径、株高和生物量要低于木荷,这表明干旱对豆科植物生长的抑制作用比非豆科植物明显。这可能是由于干旱破坏了豆科植物(海南红豆)原有的固氮途径,固氮菌和植物的联系减弱,固氮菌的活性下降,从而导致豆科植物对氮元素的获取受限[7],生长受到抑制。Minucci等[12]研究固氮树种对干旱的敏感性也表明,固氮树种比非固氮树种更易受干旱影响,干旱导致固氮树种生产力降低,生物量下降。针叶树和阔叶树种之间生长没有明显差异,可能是叶片形态以外的其他特征,比如内部的组织结构差异[28]、树种间的相互影响[29]等影响了植物对干旱的响应。
3.3 氮添加和干旱交互作用对不同树种生长的影响一般认为氮添加能在一定程度上抵消干旱对植物生长的抑制,促进植物生长[30];但是在重度干旱下,氮添加对植物生长没有明显的促进效果,甚至可能抑制植物生长[31]。本研究中,在轻度干旱下,氮添加显著促进了木荷和杉木幼树的基径和生物量增加;在重度干旱下,氮添加对各幼树的生长没有显著影响。这可能是由于在轻度干旱下添加氮提高了植物的水分利用效率和光合速率[16],从而促进了幼树的生长。在重度干旱下,植物水分利用效率和养分利用效率较低,施加的氮元素由于水分限制不能被植物所吸收利用[26],因而氮添加对重度干旱下4种植物的生长没有明显促进作用。另外,高氮沉降和干旱同时发生也可能导致与植物共生的真菌发生变化进而影响植物生长[32]。
氮添加对轻度干旱处理下非豆科植物生物量的促进作用要大于海南红豆。这可能是由于豆科植物通过固氮菌获取氮元素,在未施氮条件下亦不缺氮[12],因而施氮对豆科植物影响不大;而非豆科植物在不施氮条件下氮元素获取不足,因此在氮添加后,由于氮元素对生长的促进作用[21],生长反而比豆科植物好。
未来,干旱可能在一定程度上抑制亚热带地区森林不同植物的生长,但是在氮沉降和干旱双重背景下,氮沉降可能加剧极端干旱对部分森林植物生长的抑制作用,从而改变森林的群落组成。氮沉降和干旱交互作用对不同树种生长的影响还与氮输入形式、干旱发生频度、植物生长生境和树种生长特性等因素有关,在长期高氮沉降和干旱频发的环境下,亚热带森林植物会如何响应,尚有待进一步研究。
| [1] |
RICHTER A, BURROWS J P, NÜß H, et al. Increase in tropospheric nitrogen dioxide over China observed from space[J]. Nature, 2005, 437(7055): 129-132. DOI:10.1038/nature04092 |
| [2] |
WEN Z, XU W, LI Q, et al. Changes of nitrogen deposition in China from 1980 to 2018[J]. Environ Int, 2020, 144: 106022. DOI:10.1016/j.envint.2020.106022 |
| [3] |
YU G R, JIA Y L, HE N P, et al. Stabilization of atmospheric nitrogen deposition in China over the past decade[J]. Nat Geosci, 2019, 12(6): 424-429. DOI:10.1038/s41561-019-0352-4 |
| [4] |
DEZI S, MEDLYN B E, TONON G, et al. The effect of nitrogen deposition on forest carbon sequestration: A model-based analysis[J]. Glob Chang Biol, 2010, 16(5): 1470-1486. DOI:10.1111/j.1365-2486.2009.02102.x |
| [5] |
YU Q, DUAN L, YU L F, et al. Threshold and multiple indicators for nitrogen saturation in subtropical forests[J]. Environ Pollut, 2018, 241: 664-673. DOI:10.1016/j.envpol.2018.06.001 |
| [6] |
TIAN D S, WANG H, SUN J, et al. Global evidence on nitrogen saturation of terrestrial ecosystem net primary productivity[J]. Environ Res Lett, 2016, 11(2): 024012. DOI:10.1088/1748-9326/11/2/024012 |
| [7] |
WANG X. Response of nitrogen fixation of several legumes to different environmental factors[D]. Ji'nan: Shandong University, 2018. 王骁. 几种豆科植物固氮作用对不同环境因子的响应研究[D]. 济南: 山东大学, 2018. |
| [8] |
VANGUELOVA E I, PITMAN R M. Nutrient and carbon cycling along nitrogen deposition gradients in broadleaf and conifer forest stands in the east of England[J]. For Ecol Manag, 2019, 447: 180-194. DOI:10.1016/j.foreco.2019.05.040 |
| [9] |
WANG Y J, YAN F. Spatial and temporal variations of regional drought events in southern China[J]. Meteor Appl, 2017, 24(3): 481-490. DOI:10.1002/met.1647 |
| [10] |
GUPTA A, RICO-MEDINA A, CAÑO-DELGADO A I. The physiology of plant responses to drought[J]. Science, 2020, 368(6488): 266-269. DOI:10.1126/science.aaz7614 |
| [11] |
EPRON D, BAHN M, DERRIEN D, et al. Pulse-labelling trees to study carbon allocation dynamics: A review of methods, current knowledge and future prospects[J]. Tree Physiol, 2012, 32(6): 776-798. DOI:10.1093/treephys/tps057 |
| [12] |
MINUCCI J M, MINIAT C F, WURZBURGER N. Drought sensitivity of an N2-fixing tree may slow temperate deciduous forest recovery from disturbance[J]. Ecology, 2019, 100(12): e02862. DOI:10.1002/ecy.2862 |
| [13] |
YU G R, CHEN Z, PIAO S L, et al. High carbon dioxide uptake by subtropical forest ecosystems in the East Asian monsoon region[J]. Proc Natl Acad Sci USA, 2014, 111(13): 4910-4915. DOI:10.1073/pnas.1317065111 |
| [14] |
MAES S L, PERRING M P, VANHELLEMONT M, et al. Environmental drivers interactively affect individual tree growth across temperate European forests[J]. Glob Chang Biol, 2019, 25(1): 201-217. DOI:10.1111/gcb.14493 |
| [15] |
IBÁÑEZ I, ZAK D R, BURTON A J, et al. Anthropogenic nitrogen deposition ameliorates the decline in tree growth caused by a drier climate[J]. Ecology, 2018, 99(2): 411-420. DOI:10.1002/ecy.2095 |
| [16] |
CHEN X N, ZHAO N Q, DUAN N, et al. Plant response to water and nitrogen addition: A review[J]. J Temp For Res, 2022, 5(1): 7-11. 陈晓娜, 赵纳祺, 段娜, 等. 植物响应水分和氮添加的研究进展[J]. 温带林业研究, 2022, 5(1): 7-11. DOI:10.3969/j.issn.2096-4900.2022.01.002 |
| [17] |
HUANG L, LIU J Y, SHAO Q Q, et al. Temporal and spatial patterns of carbon sequestration services for primary terrestrial ecosystems in China between 1990 and 2030[J]. Acta Ecol Sin, 2016, 36(13): 3891-3902. 黄麟, 刘纪远, 邵全琴, 等. 1990—2030年中国主要陆地生态系统碳固定服务时空变化[J]. 生态学报, 2016, 36(13): 3891-3902. DOI:10.5846/stxb201411012141 |
| [18] |
YANG A H, CHEN Z F, TAN G, et al. Species and distribution pattern of the state key protected wild plants (2021 edition) in Guangdong Province, China[J]. Subtrop Plant Sci, 2022, 51(6): 474-480. 杨安华, 陈祝锋, 谭淦, 等. 广东省国家重点保护野生植物评估及其分布格局——基于国家重点保护野生植物名录(2021版)[J]. 亚热带植物科学, 2022, 51(6): 474-480. DOI:10.3969/j.issn.1009-7791.2022.06.007 |
| [19] |
YIN S Y, MAO F J, ZHOU G M, et al. Multi-scalar spatiotemporal pattern and evolution trend of drought in subtropical China[J]. Res Soil Water Conserv, 2022, 29(6): 242-253. 尹世燕, 毛方杰, 周国模, 等. 中国亚热带干旱多尺度时空格局及演变趋势[J]. 水土保持研究, 2022, 29(6): 242-253. DOI:10.13869/j.cnki.rswc.2022.06.001 |
| [20] |
Institute of Soil Sciences, Chinese Academy of Sciences. Soil Physical and Chemical Analysis[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1978. 中国科学院南京土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978. |
| [21] |
YUE K, FORNARA D A, LI W, et al. Nitrogen addition affects plant biomass allocation but not allometric relationships among different organs across the globe[J]. J Plant Ecol, 2021, 14(3): 361-371. DOI:10.1093/jpe/rtaa100 |
| [22] |
XIA J Y, WAN S Q. Global response patterns of terrestrial plant species to nitrogen addition[J]. New Phytol, 2008, 179(2): 428-439. DOI:10.1111/j.1469-8137.2008.02488.x |
| [23] |
FENG J G, ZHU B. A review on the effects of nitrogen and phosphorus addition on tree growth and productivity in forest ecosystems[J]. Chin J Plant Ecol, 2020, 44(6): 583-597. 冯继广, 朱彪. 氮磷添加对树木生长和森林生产力影响的研究进展[J]. 植物生态学报, 2020, 44(6): 583-597. DOI:10.17521/cjpe.2019.0176 |
| [24] |
PARDOS M, CALAMA R. Adaptive strategies of seedlings of four Mediterranean co-occurring tree species in response to light and moderate drought: A nursery approach[J]. Forests, 2022, 13(2): 154. DOI:10.3390/f13020154 |
| [25] |
LIU Y F, ZHANG Y, LAI J M, et al. Effects of soil nitrogen and water interaction on COS and CO2 fluxes of Pinus massoniana and Cunninghamia lanceolata[J]. Acta Ecol Sin, 2020, 40(16): 5729-5738. 刘燕飞, 张羽, 赖金美, 等. 土壤氮水交互对马尾松和杉木COS和CO2通量的影响[J]. 生态学报, 2020, 40(16): 5729-5738. DOI:10.5846/stxb201910172178 |
| [26] |
XU X N, XIA J Y, ZHOU X H, et al. Experimental evidence for weakened tree nutrient use and resorption efficiencies under severe drought in a subtropical monsoon forest[J]. J Plant Ecol, 2020, 13(5): 649-656. DOI:10.1093/jpe/rtaa053 |
| [27] |
VERBRAEKEN L, WUYTS N, MERTENS S, et al. Drought affects the rate and duration of organ growth but not inter-organ growth coordination[J]. Plant Physiol, 2021, 186(2): 1336-1353. DOI:10.1093/plphys/kiab155 |
| [28] |
VASTAG E, COCOZZA C, ORLOVIĆ S, et al. Half-Sib lines of pedunculate Oak (Quercus robur L.) respond differently to drought through biometrical, anatomical and physiological traits[J]. Forests, 2020, 11(11): 153. DOI:10.3390/f11020153 |
| [29] |
HABERSTROH S, WERNER C. The role of species interactions for forest resilience to drought[J]. Plant Biol, 2022, 24(7): 1098-1107. DOI:10.1111/plb.13415 |
| [30] |
SONG J Y, WANG Y, PAN Y H, et al. The influence of nitrogen availability on anatomical and physiological responses of Populus alba×P. glandulosa to drought stress[J]. BMC Plant Biol, 2019, 19(1): 63. DOI:10.1186/s12870-019-1667-4 |
| [31] |
BAYAR E. Influence of drought stress and N addition on the gas exchange, biochemical and growth traits in Quercus ithaburensis[J]. Dendrobiology, 2022, 88: 94-104. DOI:10.12657/denbio.088.007 |
| [32] |
LI N J, ZENG Q P, JIANG S H, et al. Response of soil microbial community and hydrothermal environment to nitrogen deposition in Pinus massoniana forest in Central Asia[J]. Therm Sci, 2019, 23: 2551-2559. DOI:10.2298/TSCI181120143L |
 2024, Vol. 32
2024, Vol. 32


