光是植物生存和生长的重要影响因素,包括光的质量、强度和方向等[1],是影响植物成花的重要因素[2]。根是植物的营养器官,具有固定植物体、吸收水分、运输和贮存营养等功能,其形态结构受营养、水分、光等生存环境以及激素、转录因子等内源因素共同调控[3]。根的生长发育包括主根伸长、侧根伸长、侧根分枝、根系向地性以及根毛形成等不同方面。光促进根系生长和主根伸长[4],有利于植物更加固定和吸收更远、更多的养分。
拟南芥CONSTANS (CO, At5G15840)基因是参与光周期的重要基因,整合光信号和生物钟信号, 并将其转化为开花信号,激活下游开花基因FLOWE-RING LOCUS T (FT)等的表达进而调控植物开花, 在光周期途径中发挥着核心作用[5]。CO基因家族有CO和16个CONSTANS-LIKE (COL)基因,其中CO是第1个在拟南芥中鉴定的B-box蛋白, 在其N端含有2个非常保守的锌指结构域(B-box1和B-box2)[6]。2001年Robson等[7]报道锌指结构域突变会导致该蛋白的功能丧失,如CO中B-box结构域突变导致拟南芥在长日照下延迟开花。前人通过构建CO基因突变体来研究CO的功能,如co-1由X-射线诱变,co-2~co-7均由EMS诱变[8],co-8由γ-射线诱变[7],co-9~co-11由T-DNA插入诱变[9–10]。CO突变后在长日照下开花延迟,莲座叶数增加[11]。Mayfield等[12]报道,co-1的主根长度在持续强光下较野生型短,而在持续弱光和黑暗下与野生型相近。
作为一种第二信使,Ca2+在植物细胞对体内、外刺激的反应中扮演着至关重要的角色,参与多种细胞生理活动和生长发育调控[13–14]。钙调素(calmo-dulin, CaM)是最为重要的一类Ca2+传感器蛋白,通过与下游钙调素结合蛋白(calmodulin-binding protein, CaMBP)互作而发挥作用[15–16]。此外,CaM信号通路成员AtCML24和AtCML23既参与光周期也参与自主途径成花调控,通过影响CO和FLC的表达以及NO的积累来调控植株成花[17]。可见,研究CaBMP对解析CaM的功能至关重要。拟南芥IQM家族共有6个成员,均是只含有1个IQ基序的CaBMP; 各成员在植物不同器官及不同环境条件下的表达不同,提示其在不同生长发育阶段和对不同环境的响应中可能起着不同的作用[18]。其中,IQM1突变导致主根长度变短[19];IQM3突变引起主根长度增长[20]。
可见,CO和IQM3都参与拟南芥主根的长度调控。因此,本研究构建二者的双突变体,并分析其在调控主根长度方面的遗传学关系。
1 材料和方法 1.1 植物材料野生型拟南芥(Arabidopsis thaliana)为Columbia (Col)生态型,突变体iqm3-1 (SALK-152927)和iqm3-2 (SALK-203569)由本实验室保存。co突变体种子由广州大学赵晓辉老师赠送,原标记为co-9; 后经本实验室鉴定不是co-9,也不是已报道过的其他10个co突变体中的任何1个,因此,定名为co-12。
1.2 植物培养将种子浸泡于无菌水,置于4 ℃冰箱中48 h。取一部分种子播种到已灭菌的营养土(营养土: 珍珠岩=3:1)中,盖上盖子以保湿,然后转移到培养室内培养,3 d后去掉盖子;1周后,处理多余幼苗,1盆中只留1棵长势一致的幼苗,常规管理。
将另一部分种子用75%乙醇冲洗10 s,再用0.1%氯化汞消毒5 min,无菌水洗涤10次左右后播种在固体1/2MS培养基上,置于培养箱或培养室培养。培养条件:光照16 h/d、黑暗8 h/d,温度(22± 1) ℃,湿度60%~80%。
1.3 表型观测成花表型 以抽薹1 cm作为成花标准,每天固定时间记录单株的开花天数及其莲座叶数。
莲座叶表型 采集成花时的莲座叶图像,使用Image J软件进行长度和宽度测量。
主根长度 对培养6 d的幼苗进行垂直平板扫描,用Image J软件进行主根长度测量, 并用SPSS软件对数据进行Student’s t-检验。每个株系测量数n≥15,3次生物学重复。
1.4 双突变体的构建参照姜泊等[21]的方法进行拟南芥总DNA的提取并进行PCR扩增,PCR反应所用引物见表 1。将PCR扩增产物送至上海生工生物公司(广州)进行测序。然后对PCR产物进行酶切,酶切体系为:BfaI 1 μL,10×K Buffer 2 μL,PCR产物5 μL,无菌水12 μL;37 ℃反应1 h。
| 表 1 用于PCR鉴定的引物序列 Table 1 Sequences of primers for PCR identification |
以co-12为母本、iqm3-2为父本进行杂交,并对获得的F1植株进行单株iqm3-2分子标记鉴定[22],收获确认杂交成功的F1自交所得的F2种子备用。对F2植株进行单株co-12分子标记和iqm3-2分子标记[22]鉴定,筛选双突变体纯合子备用。
2 结果和分析 2.1 新突变体co-12的发现与分子鉴定赵晓晖老师提供的种子标明为co-9,是T-DNA插在CO基因第1个外显子中的突变体(https://www.arabidopsis.org/),由此设计扩增产物跨T-DNA插入位点的特异性引物co-F和co-R对该突变体进行分子鉴定。在分子鉴定中,以野生型Col的基因组DNA为模板,用引物co-F和co-R进行PCR,能扩增出大小为2 241 bp的目的条带;用T-DNA特异性引物SAIL-LB分别与co-F和co-R配对进行扩增,未扩增出条带(图 1: A)。以突变体co-9基因组DNA为模板,用co-F和co-R进行PCR,扩增出1条与野生型大小相似的条带;而用T-DNA特异性引物SAIL-LB分别与co-F和co-R配对进行扩增,均未能扩增出条带(图 1: A)。可见,检测结果与预期不相符,即该突变体不是co-9。因此,将从该突变体用co-F和co-R引物扩增的PCR产物外送测序。测序结果表明,在CO基因序列的第1个外显子的285~ 293 bp处缺失了ACTTGCTAG共9个碱基,造成所编码蛋白的第96~98位的3个氨基酸,即亮氨酸、丙氨酸和精氨酸(L、A和R)缺失(图 1: C, D),并且缺失的亮氨酸、丙氨酸为CO的B-box2上高度保守的氨基酸残基,缺失的精氨酸为部分保守的氨基酸残基,即co-12的突变为关键的保守氨基酸突变。突变体co-1、co-3、co-4就是因为其B-box2中关键氨基酸突变而导致该蛋白功能丧失[7]。经与已发表的11个co突变体[7–10]序列比较,这个突变体是CO基因的新突变体。因此,按惯例将其命名为co-12。
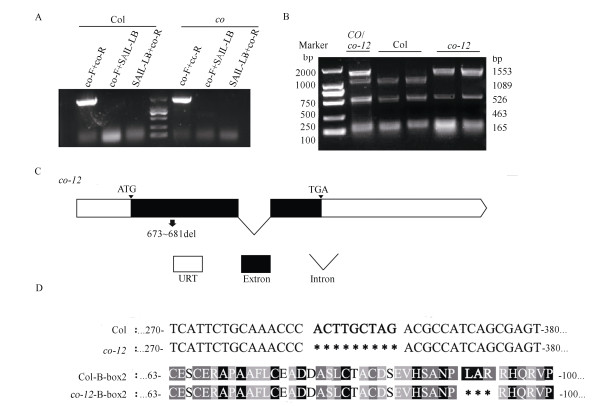
|
图 1 co-12的分子鉴定。A: 野生型与co-9的PCR检测; B: 跨编码区的PCR产物酶切鉴定co-12; C: co-12碱基缺失位点; D: 野生型与co-12中CO部分序列及B-box2氨基酸序列的对比; M: 2 000 bp Marker。 Fig. 1 Molecular identification of co-12. A: PCR detection of wild type and co-9; B: Enzyme digestion of PCR products across coding region of co-12; C: Deletion sites of co-12; D: Comparison of CO sequences and amino acid sequences of B-box2 in wild type and co-12; M: 2 000 bp Marker. |
因为co-12所缺失的9个碱基中存在1个BfaI的酶切位点CTAG,所以可用该酶对PCR产物进行酶切来鉴定。野生型进行跨基因组序列PCR扩增产物中含有3个CTAG位点,用BafI进行酶切可得到1 090、526、463和165 bp 4个片段;而co-12的PCR扩增产物中含有2个CTAG位点,用BafI进行酶切可得1 553、526和165 bp 3个片段;若是CO/co-12杂合子则会得到1 553、1 090、526、463和165 bp 5个目的条带。此方法可有效而便捷地鉴别野生型、co-12纯合突变体和CO/co-12杂合突变体(图 1: B)。由于条带526 bp和463 bp十分接近, 在本实验条件下未能分开。
2.2 co-12突变体的表型分析已有CO基因突变体主要呈现为长日照下晚花[10]、生长后期的莲座叶长宽比增大[11]和短根[12]的表型。co-12是1个新的CO基因突变体,故有必要进行相关表型观察,以确定其与其他CO基因突变体的差异。
成花表型 在长日照下,与野生型相比,突变体co-12大约推迟10 d开花(图 2: A, B),开花时莲座叶约多6片(图 2: C)。这与已报道的CO突变体成花表型[11]一致。
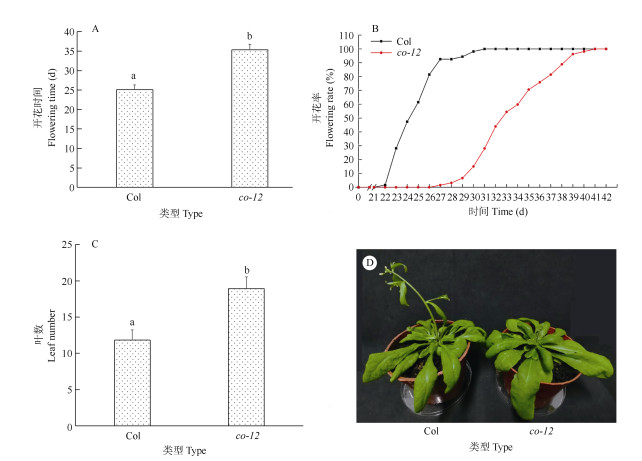
|
图 2 野生型Col与co-12的成花表型。A: 开花时间; B: 开花进程; C: 开花时莲座叶数目; D: 开花植株; 柱上不同字母表示差异显著(P < 0.05, Student’s t检验)。下同 Fig. 2 Floral phenotype of wild type Col and co-12. A: Flowering time; B: Flowering process; C: Number of rosette leaf; D: Flowering plants; different letters upon column indicate significant differences at 0.05 level by Student's t test. The same below |
叶表型 由图 3: A可见,野生型和co-12突变体从生长早期到中期莲座叶的面积逐渐增大,从生长中期到生长后期逐渐下降。叶形也随发育过程而发生变化,野生型Col的第1、2片莲座叶长宽比约为1,形状接近圆形,从第3片莲座叶开始长宽比不断增大,叶形逐渐由圆形至椭圆形至呈匙形;co-12突变体的第1、2片莲座叶也几乎为圆形, 从第3片莲座叶开始长宽比逐渐升高,叶形也由圆形至卵圆形至披针形,叶片越来越长,且从第7片莲座叶开始,突变体的叶片比野生型的长。这与冯延娇等[11]的研究结果一致。

|
图 3 野生型Col与co-12的叶表型。A: 叶形; B: 莲座叶长宽比。 Fig. 3 Leaf phenotype of wild type Col and co-12. A: Leaf shape; B: Ratio of length to width in rosette leaves. |
前期研究表明,IQM3基因突变减少幼苗的侧根数量和增加主根长度[20];Mayfield等[12]报道,CO基因突变缩短主根长度。通过杂交构建了双突变体co-12 iqm3-2,以分析二者在主根长度调控中的遗传学关系。在筛选双突变体的纯合子时,采用对co-12 (图 4: A)和iqm3-2 (图 4: B)[22]的分子鉴定方法。
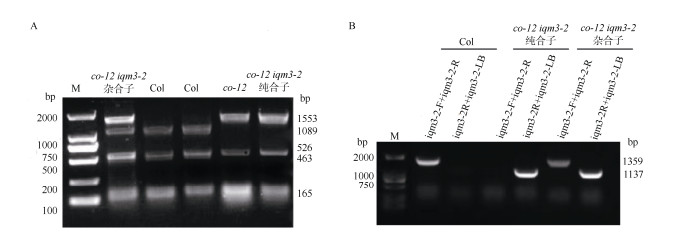
|
图 4 co-12 iqm3-2双突变体的分子鉴定。A: co-12; B: iqm3-2; M: 2 000 bp Marker。 Fig. 4 Molecular identification of co-12 iqm3-2 double mutants. A: co-12; B: iqm3-2; M: 2 000 bp Marker. |
获得双突变体的纯合子后,观测单突变体co-12、iqm3-1、iqm3-2和双突变体co-12 iqm3-2的主根长度(图 5),iqm3-1、iqm3-2的主根长度比野生型Col长,而co-12的根长较野生型短;双突变体co-12 iqm3-2的根长与iqm3-2的没有显著差异。说明co-12的短根表型要求IQM3,而iqm3-2的长根表型不要求CO,即在调控长日照下主根长度方面,IQM3活动在CO的下游。
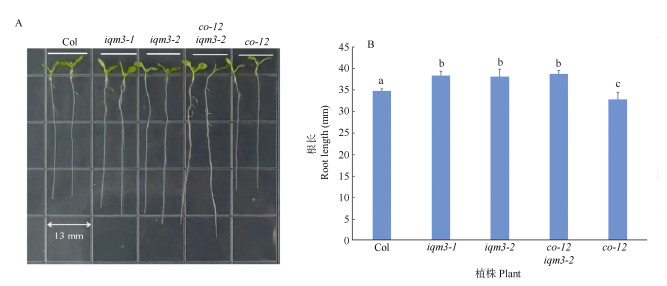
|
图 5 根表型。A: 野生型和突变体植株; B: 主根长度。 Fig. 5 Root phenotype. A: Wide type and mutant plants; B: Main root length. |
Ca2+是调节植物细胞生理及生长发育的至关重要的第二信使,钙调素作为一类最重要的Ca2+受体在钙信号转导中发挥着重要的作用,而研究钙调素结合蛋白的功能是解析钙调素信号通路的重要途径[18]。拟南芥IQM家族是含有1个IQ基序的钙调素结合蛋白家族,IQM3是其中一员。本课题组前期研究表明IQM3突变后,在长日照下与Col相比侧根数减少,主根长度增加,推测IQM3参与赤霉素激素调控的根的生长发育[20];最近,本研究组未发表资料表明iqm3突变体在短日照下早花,可能涉及光周期途径成花调控。CO是光周期途径成花调控的极为关键的因子,同时该基因突变致使主根长度减少[12]。因此,分析二者在主根长度调控方面的遗传关系具有十分重要的意义。
本研究首先建立了用于鉴定1个不同于已经发表的11个CO基因突变体的co-12的分子标记;并对突变体的成花、叶和主根长度等表型进行观测, 结果表明,co-12与已发表的CO基因突变体的主要表型[10–12]一致,证实该突变体确实是CO基因的突变体。此外,Khanna等[23]研究表明,由AT5G15840编码的CO含有2个B-Box结构域,其B-Box1结构域位置为第20~57位氨基酸残基,B-Box2结构域位置为第63~100位氨基酸残基。而co-12是在CO氨基酸序列的第96~98位上缺失了3个氨基酸L、A和R,即此缺失位点位于B-Box2结构域上, 且缺失的L、A为高度保守的氨基酸残基, 故co-12的缺失突变位点是CO的关键位点,从而导致出现长日照晚花等其他co突变体的表型。最后, 通过杂交并利用所建立的分子标记筛选得到iqm3-2 co-12的双突变体,表型分析表明,在长日照下, 双突变体co-12 iqm3-2的主根长度比co-12长,且与iqm3-2的相似,说明co-12主根变短的表型要求IQM3,而iqm3-2主根变长的表型不要求CO,即在长日照下调控主根长度方面IQM3活动在CO的下游。徐浩等[20]认为,IQM3突变增加主根长度可能与突变体赤霉素含量增加有关[17],这个推论也可用来解释双突变co-12 iqm3-2呈现出与iqm3-2主根长度一致的结果。
目前,关于Ca2+/CaM参与植物成花调控的报道不多,研究亦不够深入。Dodd等[24]的研究表明植物细胞质中Ca2+水平以24 h节律振荡,其振荡可能作为细胞内信号,整合生物钟输出和环境刺激, 并调节开花过渡。此外,CaM信号通路成员CML24及其同源基因CML23通过影响CO和FLC的表达以及NO的积累进而调控植物成花[17]。在本课题组未发表的资料显示,IQM3突变后在短日照下提前开花,是研究Ca2+/CaM信号参与光周期途径成花调控的新切入点,而CO是光周期的关键调控因子,本文构建的双突变体iqm3-2 co-12是一个十分有用的材料,除了分析二者在调控主根长度方面的遗传学关系外,还可以用于分析二者在成花等多个涉及生长发育和对外界刺激反应调控方面的遗传学关系,相关研究结果将有助于拓展对钙调素信号、成花信号以及二者涉及的其他信号转导网络和分子机理的认识。
| [1] |
KELLY J W G, LANDHÄUSSER S M, CHOW P S. The impact of light quality and quantity on root-to-shoot ratio and root carbon reserves in aspen seedling stock[J]. New For, 2015, 46(4): 527-545. DOI:10.1007/s11056-015-9473-9 |
| [2] |
LI L, LI X, LIU Y W, et al. Flowering responses to light and temperature[J]. Sci China Life Sci, 2016, 46(3): 253-259. 李莉, 李旭, 刘亚文, 等. 光和温度调控开花时间的研究进展[J]. 中国科学: 生命科学, 2016, 46(3): 253-259. DOI:10.1360/05SCLS-2015-0122.R2 |
| [3] |
FILLEUR S, WALCH-LIU P, GAN Y, et al. Nitrate and glutamate sensing by plant roots[J]. Biochem Soc Trans, 2005, 33(1): 283-286. DOI:10.1042/BST0330283 |
| [4] |
KUMARI S, YADAV S, PATRA D, et al. Uncovering the molecular signature underlying the light intensity-dependent root development in Arabidopsis thaliana[J]. BMC Genom, 2019, 20(1): 596. DOI:10.1186/s12864-019-5933-5 |
| [5] |
SHIM J S, KUBOTA A, IMAIZUMI T. Circadian clock and photo-periodic flowering in Arabidopsis: CONSTANS is a hub for signal integration[J]. Plant Physiol, 2017, 173(1): 5-15. DOI:10.1104/pp.16.01327 |
| [6] |
PUTTERILL J, ROBSON F, LEE K, et al. The CONSTANS gene of Arabidopsis promotes flowering and encodes a protein showing similarities to zinc finger transcription factors[J]. Cell, 1995, 80(6): 847-857. DOI:10.1016/0092-8674(95)90288-0 |
| [7] |
ROBSON F C, COSTA M M, HEPWORTH S R, et al. Functional importance of conserved domains in the flowering-time gene CONSTANS demonstrated by analysis of mutant alleles and transgenic plants[J]. Plant J, 2001, 28(6): 619-631. DOI:10.1046/j.1365-313x.2001.01163.x |
| [8] |
KOORNNEEF M, HANHART C J, VAN DER VEEN J H. A genetic and physiological analysis of late flowering mutants in Arabidopsis thaliana[J]. Mol Gen Genet, 1991, 229(1): 57-66. DOI:10.1007/BF00264213 |
| [9] |
YOO S K, WU X L, LEE J S, et al. AGAMOUS-LIKE 6 is a floral promoter that negatively regulates the FLC/MAF clade genes and positively regulates FT in Arabidopsis[J]. Plant J, 2011, 65(1): 62-76. DOI:10.1111/J.1365-313X.2010.04402.X |
| [10] |
NING Y Q, CHEN Q, LIN R N, et al. The HDA19 histone deacetylase complex is involved in the regulation of flowering time in a photoperiod-dependent manner[J]. Plant J, 2019, 98(3): 448-464. DOI:10.1111/tpj.14229 |
| [11] |
FENG Y J, LONG H. Vegetative phase change delayed in late-flowering mutants co-2 and ft-1 in Arabidopsis thaliana[J]. Chin J Biol, 2013, 30(4): 46-49. 冯延娇, 龙鸿. 拟南芥晚花突变co-2和ft-1延迟营养生长时相转变[J]. 生物学杂志, 2013, 30(4): 46-49. DOI:10.3969/j.issn.2095-1736.2013.04.046 |
| [12] |
MAYFIELD J D, PAUL A L, FERL R J. The 14–3-3 proteins of Arabidopsis regulate root growth and chloroplast development as components of the photosensory system[J]. J Exp Bot, 2012, 63(8): 3061-3070. DOI:10.1093/jxb/ers022 |
| [13] |
DEFALCO T A, BENDER K W, SNEDDEN W A. Breaking the code: Ca2+ sensors in plant signalling[J]. Biochem J, 2010, 425(1): 27-40. DOI:10.1042/BJ20091147 |
| [14] |
YANG T B, POOVAIAH B W. Calcium/calmodulin-mediated signal network in plants[J]. Trends Plant Sci, 2003, 8(10): 505-512. DOI:10.1016/j.tplants.2003.09.004 |
| [15] |
TIAN C E, ZHOU Y P. Research progress in plant IQ motif-containing calmodulin-binding proteins[J]. Chin Bull Bot, 2013, 48(4): 447-460. 田长恩, 周玉萍. 植物具IQ基序的钙调素结合蛋白的研究进展[J]. 植物学报, 2013, 48(4): 447-460. DOI:10.3724/SP.J.1259.2013.00447 |
| [16] |
CARAFOLI E, KREBS J. Why Calcium? How calcium became the best communicator[J]. J Biol Chem, 2016, 291(40): 20849-20857. DOI:10.1074/jbc.R116.735894 |
| [17] |
TSAI Y C, DELK N A, CHOWDHURY N I, et al. Arabidopsis potential calcium sensors regulate nitric oxide levels and the transition to flowering[J]. Plant Sign Behav, 2007, 2(6): 446-454. DOI:10.4161/psb.2.6.4695 |
| [18] |
ZHOU Y P, CHEN Y Z, YAMAMOTO K T, et al. Sequence and expression analysis of the Arabidopsis IQM family[J]. Acta Physiol Plant, 2010, 32(1): 191-198. DOI:10.1007/s11738-009-0398-9 |
| [19] |
MO Z Z, HUANG Z K, ZHOU Y P, et al. IQM1 is involved in response of primary root growth to methyl jasmonate in Arabidopsis[J]. Lett Biotechnol, 2015, 26(3): 399-402. 莫忠蓁, 黄章科, 周玉萍, 等. 拟南芥IQM1涉及主根生长对茉莉酸甲酯的反应[J]. 生物技术通讯, 2015, 26(3): 399-402. DOI:10.3969/j.issn.1009-0002.2015.03.022 |
| [20] |
XU H, FENG Y J, FAN T, et al. Disruption of IQM3 reduces the number of lateral roots and increases the length of primary root in Arabidopsis seedlings[J]. Plant Physiol J, 2019, 55(5): 629-634. 徐浩, 冯奕嘉, 范甜, 等. 拟南芥IQM3基因突变减少幼苗的侧根数量和增加主根长度[J]. 植物生理学报, 2019, 55(5): 629-634. DOI:10.13592/j.cnki.ppj.2019.1001 |
| [21] |
JIANG B, ZHANG Y L, ZHOU D Y. Common Experiment Methods of Molecular Biology[M]. Beijing: People's Military Medical Press, 1996. 姜泊, 张亚历, 周殿元. 分子生物学常用实验方法[M]. 北京: 人民军医出版社, 1996. |
| [22] |
ZHOU Y P, ZHAO J, HE T, et al. Expression analysis of Arabidopsis thaliana IQM3 gene and identification of iqm3 mutants[J]. J Trop Subtrop Bot, 2009, 17(4): 365-370. 周玉萍, 赵军, 何滔, 等. 拟南芥IQM3基因的表达分析及其突变体的鉴定[J]. 热带亚热带植物学报, 2009, 17(4): 365-370. DOI:10.3969/j.issn.1005-3395.2009.04.009 |
| [23] |
KHANNA R, KRONMILLER B, MASZLE D R, et al. The Arabi-dopsis B-box zinc finger family[J]. Plant Cell, 2009, 21(11): 3416-3420. DOI:10.1105/tpc.109.069088 |
| [24] |
DODD A N, LOVE J, WEBB A A R. The plant clock shows its metal: Circadian regulation of cytosolic free Ca2+[J]. Trends Plant Sci, 2005, 10(1): 15-21. DOI:10.1016/j.tplants.2004.12.001 |
 2024, Vol. 32
2024, Vol. 32



