2. 中交第四航务工程局有限公司, 广州 510220;
3. 中国交通建设集团有限公司四航工程研究院有限公司, 中国交通建设集团有限公司交通基础工程环保与安全重点实验室, 广州 510230;
4. 中国科学院华南植物园, 南海岛礁植被生态系统定位研究站, 广州 510650
2. CCCC Fourth Harbor Engineering Co., Ltd, Guangzhou 510220, China;
3. Key Laboratory of Environment and Safety Technology of Transportation Infrastructure Engineering, China Communications Construction Company Limited (CCCC), Fourth Harbor Engineering Institute Co., Ltd., CCCC, Guangzhou 510230, China;
4. South China Sea Island Research Station of Reef Vegetation and Ecosystem Positioning, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China
2020年国家发展改革委和自然资源部联合印发《全国重要生态系统保护和修复重大工程总体规划(2021—2035年)》,《海岸带生态保护和修复重大工程建设规划》是其部署的九大专项规划之一。其中包括珊瑚礁生态系统保护和修复、海岛生态系统保护和修复、海岸植被保护和修复等内容。二十大报告将“人与自然和谐共生的现代化”上升到“中国式现代化”的内涵之一,再次明确了新时代中国生态文明建设的战略任务,总基调是推动绿色发展,促进人与自然和谐共生。党的二十大报告指出,“要推进美丽中国建设,坚持山水林田湖草沙一体化保护和系统治理,统筹产业结构调整、污染治理、生态保护、应对气候变化,协同推进降碳、减污、扩绿、增长,推进生态优先、节约集约、绿色低碳发展。”
坡柳(Dodonaea viscosa)为无患子科(Sapindaceae)的灌木或小乔木,高1~3 m或更高;花序顶生或在小枝上部腋生,比叶短,密花;蒴果倒心形或扁球形,2或3翅;花期秋末,果期冬末春初;分布于我国西南部、南部至东南部,常生于干旱山坡、旷地或海边的沙土上;其根系发达,萌生力强,耐干旱和贫瘠,是良好的固沙保土树种[1]。热带珊瑚岛日照时间长、终年高温、季节性干旱严重,开展植被修复难度很大[2–3]。坡柳在海岛生态系统维持、海岸植被保护和修复以及珊瑚砂环境海岛植被修复具有较好的适应性。坡柳作为海岸、海岛植被修复的重要树种,可以先培育小苗后移栽种植,但采用在海岸、海岛上做适当处理后直接撒播坡柳种子的措施可以大大地节省成本,营造近自然的植被群落。2018年10月在南海某岛礁,在对珊瑚砂进行适当改良后,撒播坡柳种子,前期给予适当的养护后,至2022年10月调查,坡柳在珊瑚砂环境边坡植被恢复效果良好,与海刀豆(Canavalia rosea)、厚藤(Ipomoea pes-caprae)、假茉莉(Volkameria inermis)等构成植物群落。
幼苗是植物生长周期最脆弱、敏感的阶段,不同光照和水分处理对幼苗的生理影响反映了植株幼苗对环境的适应能力[4]。丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、可溶性蛋白(SP)和脯氨酸(Pro)是衡量植物适应能力强弱的重要生理指标[5]。MDA是膜脂过氧化产物之一,膜脂过氧化损伤的程度与MDA含量成正比[6];SOD、POD、CAT是3种重要的抗氧化酶,SOD催化超氧阴离子发生歧化反应生成H2O2, POD、CAT再将H2O2转化为H2O,从而减缓膜系统的损伤[7];SP、Pro是细胞重要的渗透调节物质,植物通过提高SP、Pro含量可以降低细胞渗透势,使细胞膨压稳定,从而保证细胞结构与功能正常,以维持正常的生理反应[8]。光照和水分是影响坡柳在热带珊瑚岛生长的重要生态因子,为了探究坡柳幼苗期对光照、水分的生理响应,本研究在广州华南植物园内的试验大棚开展了光照和水分双因素处理下对坡柳生理指标的影响试验,试验结论对指导坡柳应用于珊瑚砂环境生态修复具有重要意义,可为坡柳应用于海岸、海岛、干旱贫瘠裸地如矿山、公路边坡等特殊生境生态修复提供科技支撑。
1 材料和方法 1.1 材料坡柳(Dodonaea viscosa)种子采摘于广州中国科学院华南植物园物种保存园。2022年2月成熟时将果枝剪下,置于阴凉通风处晾晒,至其种子掉出后收集种子备用。
1.2 试验设计2022年6月8日,用清水冲洗浸泡坡柳种子,挑选自然下沉的颗粒饱满、大小相似的种子,播种于10 cm×8 cm×8 cm花盆中,20粒/盆,基质配比为: 珊瑚砂70%、客土10%、椰糠10%、谷壳5%、有机肥5%。光照设置:(1) 全光:不遮盖滤网;(2) 遮阴: 遮盖2层黑色滤网;(3) 黑暗:遮盖2层黑色不透光麻袋。水分设置(体积含水量):(1) 正常控水:40%~50%;(2) 中度胁迫:30%~40%;(3) 重度胁迫:10%~20%。共9个处理,每处理3个重复。将花盆放入RCQ-360人工气候培养箱,设置温度25 ℃、光照强度224 μmol/(m2·s)、光暗周期12 h/12 h。利用Model MQ-100 Serial#2070 (USA)测量光照强度,全光、遮阴、黑暗处理的光强分别为224、140、0 μmol/(m2·s); 采用称量法控制水分,将土壤体积含水量保持在设定范围内。每天随机改变花盆的摆放位置,以确保受光条件基本一致。2022年7月13日,株高10~ 15 cm,有处理组植株已出现萎蔫、枯黄现象,采集坡柳幼苗植株测定相关抗逆性生理指标。
1.3 方法MDA含量采用硫代巴比妥酸(TBA)法[9]测定, SOD活性采用氮蓝四唑(NBT)光化还原法[10]测定, POD活性采用愈创木酚显色法[12]测定,CAT活性采用紫外吸收法[11]测定,SP含量采用二喹啉甲酸(BCA)法[13]测定,Pro含量采用酸性茚三酮染色法[12]测定。
1.4 数据的统计分析用Excel 2016对数据进行整理,用SPSS Stati-stics 26软件对数据进行统计分析。采用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)分析水分胁迫对生理指标的影响,光照处理和水分胁迫对生理指标的影响采用双因素方差分析,同时用重复测量方差分析进行检验,采用Duncan’s法在P < 0.05水平上进行多重比较。
2 结果和分析 2.1 光照和水分对坡柳种子成苗率的影响全光下,正常控水的坡柳种子成苗率最高,为45%;遮阴下,水分中度胁迫的成苗率最高,为40%;黑暗条件下,水分重度胁迫的成苗率最高,为45%。可见,光照越强,坡柳种子萌发所需水分越高。
2.2 MDA含量变化由图 1可见,全光下,坡柳幼苗的MDA含量显著高于遮阴和黑暗处理,且水分中度和重度胁迫的差异不显著,分别为61.83、53.40 nmol/g,均高于正常控水(42.04 nmol/g)。遮阴下,水分中度和重度胁迫的差异不显著,分别为12.94、17.35 nmol/g, 均低于正常控水(23.58 nmol/g);黑暗下,水分中度和重度胁迫的MDA含量分别为17.09、7.94 nmol/g, 差异显著, 但二者与正常控水(10.13 nmol/g)的差异均不显著。
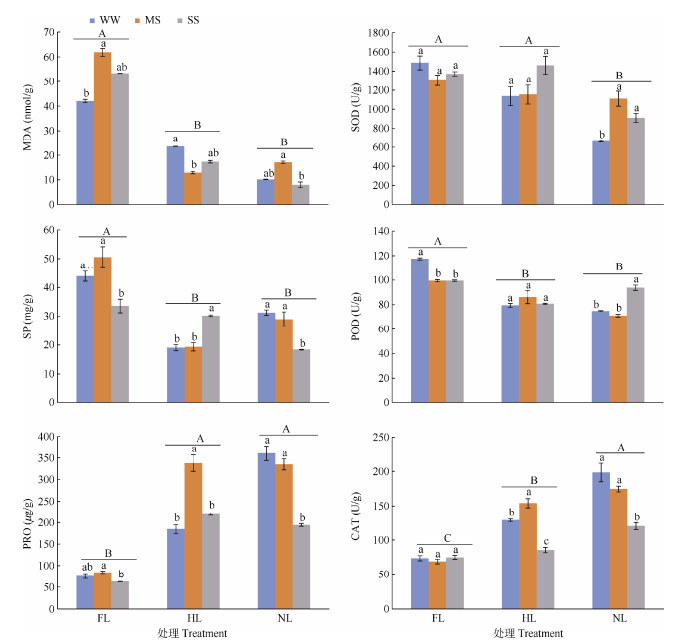
|
图 1 光照和水分胁迫下坡柳植株的MDA、SP、Pro含量和SOD、POD、CAT活性变化。WW: 正常控水; MS: 水分中度胁迫; SS: 水分重度胁迫; FL: 全光; HL: 遮阴; NL: 黑暗; 柱上不同字母表示差异显著(P < 0.05)。 Fig. 1 Changes in contents of MDA, SP, Pro, and activities of SOD, POD, CAT in Dodonaea viscosa under water stress and light treatment. WW: Normal water control; MS: Moderate water stress; SS: Severe water stress; FL: Full light; HL: Shade; NL: Dark. Different letters upon column indicate significant differences at 0.05 level. |
全光、遮阴和黑暗下,坡柳幼苗的SOD活性分别为1 388.05、1 250.71和895.19 U/g,黑暗处理显著低于全光和遮阴处理,表明黑暗抑制了植株机体内的SOD活性(图 1)。全光和遮阴条件下,不同水分胁迫的SOD活性差异不显著;黑暗条件下,水分中度和重度胁迫下的SOD活性分别为1 110.09、910.45 U/g, 均高于正常控水(665.04 U/g),且差异显著。
全光、遮阴和黑暗下,坡柳幼苗的POD活性分别为105.48、82.10和79.90 U/g,全光处理均显著高于遮阴和黑暗处理,且遮阴和黑暗处理的差异不显著(图 1)。全光下,水分中度和重度胁迫的POD活性分别为99.51、99.44 U/g,均显著低于正常控水(117.49 U/g);遮阴条件下,不同程度水分胁迫POD活性不受影响;黑暗条件下,水分重度、中度胁迫和正常控水POD活性分别为93.86、71.05和74.80 U/g, 重度胁迫显著高于中度胁迫和正常控水。
全光、遮阴和黑暗下,坡柳幼苗的CAT活性分别为72.31、122.78和164.44 U/g,说明光照强度越弱,CAT活性越高,且不同光照处理间差异显著(图 1)。全光下,正常控水、水分中度和重度胁迫的CAT活性分别为73.44、68.69和74.79 U/g,说明CAT活性不受水分胁迫影响;遮阴条件下,水分重度胁迫的CAT活性最低,为85.32 U/g;黑暗下,正常控水、水分中度和重度胁迫CAT活性分别为198.47、174.52和120.31 U/g,CAT活性随水分胁迫程度增加逐渐降低,水分胁迫与正常控水间的差异显著。
2.4 渗透调节物质的变化全光、遮阴和黑暗下,坡柳幼苗的SP含量分别为42.66、22.85和26.20 mg/g,遮阴和黑暗处理显著低于全光处理(图 1)。全光条件下,正常控水、水分中度和重度胁迫SP含量分别为43.89、50.54和33.56 mg/g,重度胁迫显著低于中度胁迫和正常控水;遮阴条件下,正常控水、水分中度和重度胁迫的SP含量分别为19.02、19.33和30.20 mg/g,重度胁迫显著高于中度胁迫和正常控水;黑暗下,正常控水、水分中度和重度胁迫SP含量分别为31.27、28.96和18.39 mg/g,重度胁迫显著低于中度胁迫和正常控水。
全光、遮阴和黑暗下,坡柳幼苗的Pro含量分别为74.11、247.40和296.71 μg/g,遮阴和黑暗处理显著高于全光处理(图 1)。全光下,正常控水、水分中度和重度胁迫的Pro含量分别为75.45、84.07和62.82 μg/g,水分胁迫与正常控水间差异不显著,而重度胁迫与中度胁迫的差异显著;遮阴下,水分中度胁迫的Pro含量最高,为338.07 μg/g,与正常控水和重度胁迫间差异显著,但正常控水和重度胁迫的差异不显著;黑暗下,正常控水、水分中度和重度胁迫的Pro含量分别为360.87、335.04和194.22 μg/g, 正常控水与中度胁迫差异不显著,但重度胁迫显著低于正常控水和中度胁迫。
2.5 方差分析从表 1可见,光照和水分胁迫分别对坡柳幼苗的MDA、Pro和SP含量,SOD、POD和CAT活性有显著影响(P < 0.05),且光照和水分对这些指标产生显著的交互作用(P < 0.05)。
| 表 1 光照和水分胁迫对生理指标影响的方差分析 Table 1 Variance analysis of effects of light and water stress on physiological indexes |
光照和水分是影响植物生长发育的重要因素[14]。有研究者认为光照和水分是独立因子,对植物不会产生交互作用[15];也有研究表明光照和水分相互作用,适度遮阴可缓解土壤水分缺乏给植物带来的负面影响,而强光和重度遮阴则会加重负面影响[16]。本研究中,光照、水分处理均对坡柳幼苗的MDA、Pro和SP含量及SOD、POD和CAT活性有显著影响,二者对这些指标产生显著的交互作用。
植物体内活性氧的积累会引起膜脂过氧化作用,从而造成MDA含量积累[17]。植物MDA含量随着光照强度的降低而降低,且强光照和低水分对植物的影响较大,不利于其生长。本研究中,遮阴和黑暗条件下,胁迫程度增加未造成坡柳细胞膜脂过氧化,MDA含量保持较低水平;且全光下,中度和重度胁迫MDA含量均显著高于正常控水,这与杨虎彪[18]等对吊罗山薹草(Carex diaoluoshanica)的研究结果一致。SOD、POD和CAT活性增强有利于清除细胞内的活性氧,从而减缓膜脂过氧化损伤[19]。本研究中,不同光照和水分处理下SOD、POD、CAT活性变化趋势不一致,SOD活性在全光和遮阴下不受影响,黑暗下随胁迫程度增加而升高;POD活性在遮阴下没有变化,全光下正常控水的POD活性最高,黑暗条件下重度胁迫POD活性最高;CAT活性随光照强度减弱而升高,且全光下CAT活性不随胁迫程度变化而变化。这与披针叶茴香(Illicium lanceolatum)幼苗[20]、耐冬山茶(Camellia japonica)[21]不一致,可能不同植物对不同光照和水分处理抗氧化酶活性变化不一样。植物通过提高SP、Pro含量以增加细胞渗透势,从而保持细胞水分不流失,将细胞内外水分保持动态平衡[22]。本研究中,SP含量随光照强度减弱而减弱,Pro含量随光照强度减弱而增加,说明减少光照有利于积累Pro,但不利于积累SP,这与孔维鹏等[23]的研究结果类似。遮阴下,水分重度胁迫的SP含量最高,中度胁迫的Pro含量最高;黑暗下,SP、Pro含量均随胁迫程度提高而降低,说明遮阴和低水分有利于提高SP含量,遮阴和中度水分有利于提高Pro含量。
综上,遮阴和黑暗处理均有利于将MDA含量维持在较低水平;遮阴和低水分处理有利于提高SP含量,遮阴和中度水分处理有利于提高CAT活性和Pro含量,黑暗和低水分处理有利于提高SOD、POD活性,全光和水分充足有利于提高POD活性。坡柳分布于全世界的热带和亚热带地区,在我国分布于南部至东南部、西南部,原生于干旱山坡、旷地或海边的沙土上。这种植物耐干旱,萌生力强,根系发达,又有丛生习性,是一种良好的固沙保土树种。因此,在坡柳作为工具种进行特殊生境生态修复实践中,直播种子后无遮光条件时应充分浇水,从而保证种子有充足的水分进行萌发,保证幼苗正常生长;遮光条件下部分光照透过时应适当浇水,使幼苗在维持机体水分的同时还可以进行光合作用;特殊情况如高温、缺水,覆盖遮光网有利于坡柳幼苗维持正常水分生长。
| [1] |
XING F W, ZENG Q W, CHEN H F, et al. Landscape plants of China[M]. Wuhan: Huazhong University of Science and Technology Press, 2009: 929. 邢福武, 曾庆文, 陈红锋, 等. 中国景观植物[M]. 武汉: 华中科技大学出版社, 2009: 929. |
| [2] |
HUANG Z G, ZHANG W Q. A discussion on the quaternary climate record from the coral reef in tropical China[J]. Trop Geogr, 2008, 28(1): 11-15. 黄镇国, 张伟强. 中国热带珊瑚礁的第四纪气候记录[J]. 热带地理, 2008, 28(1): 11-15. DOI:10.3969/j.issn.1001-5221.2008.01.003 |
| [3] |
XING F W, DENG S W. Flora of the South China Sea Island[M]. Beijing: China Forestry Press, 2019. 邢福武, 邓双文. 中国南海诸岛植物志[M]. 北京: 中国林业出版社, 2019. |
| [4] |
LÜ C Y. Responses of Acer catalpifolium seedling to light intensity and soil moisture[D]. Beijing: Beijing Forestry University, 2019 吕程瑜. 梓叶槭幼苗对光照强度和土壤水分的响应[D]. 北京: 北京林业大学, 2019. doi: 10.26949/d.cnki.gblyu.2019.001114. |
| [5] |
LIANG F, TAN X H, DENG X, et al. Growth and physiological responses of semi-mangrove plant Barringtonia racemosa to water-logging and salinity stress[J]. Guihaia, 2021, 41(6): 872-882. 梁芳, 檀小辉, 邓旭, 等. 半红树植物玉蕊对淹水-盐度胁迫的生长及生理响应[J]. 广西植物, 2021, 41(6): 872-882. DOI:10.11931/guihaia.gxzw202007036 |
| [6] |
TSIKAS D. Assessment of lipid peroxidation by measuring malondia-ldehyde (MDA) and relatives in biological samples: Analytical and biological challenges[J]. Anal Biochem, 2017, 524: 13-30. DOI:10.1016/j.ab.2016.10.021 |
| [7] |
INGRAM J, BARTELS D. The molecular basis of dehydration tolerance in plants[J]. Ann Rev Plant Physiol Plant Mol Biol, 1996, 47: 377-403. DOI:10.1146/annurev.arplant.47.1.377 |
| [8] |
ASHRAF M, AKRAM N A, AI-QURAINY F, et al. Drought tolerance: Roles of organic osmolytes, growth regulators, and mineral nutrients[J]. Adv Agronomy, 2011, 111: 249-296. DOI:10.1016/B978-0-12-387689-8.00002-3 |
| [9] |
ZHANG X Z. Method of Crop Physiology Research[M]. Beijing: China Agriculture Press, 1992: 131-207. 张宪政. 作物生理研究法[M]. 北京: 农业出版社, 1992: 131-207. |
| [10] |
LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 261-263. 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 261-263. |
| [11] |
AMAKO K, CHEN G X, ASADA K. Separate assays specific for ascorbate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase in plants[J]. Plant Cell Physiol, 1994, 35(3): 497-504. |
| [12] |
LU W J, LI Y S. Experimental Course of Plant Physiology[M]. Beijing: China Forestry Publishing House, 2012: 106-109. 路文静, 李奕松. 植物生理学实验教程[M]. 北京: 中国林业出版社, 2012: 106-109. |
| [13] |
ZOU Q. Guideline of Experiments in Plant Physiology[M]. Beijing: China Agriculture Press, 2000: 111-114. 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000: 111-114. |
| [14] |
ZHANG X Z. Method of Crop Physiology Research[M]. Beijing: Agricultural Press, 1992: 148-149. 张宪政. 作物生理研究法[M]. 北京: 农业出版社, 1992: 148-149. |
| [15] |
HOLMGREN M. Combined effects of shade and drought on tulip poplar seedlings: Trade-off in tolerance or facilitation?[J]. Oikos, 2000, 90(1): 67-78. DOI:10.1034/j.1600-0706.2000.900107.x |
| [16] |
HOLMGREN M, SCHEFFER M, HUSTON M A. The interplay of facilitation and competition in plant communities[J]. Ecology, 1997, 78(7): 1966-1975. DOI:10.1890/0012-9658(1997)078[1966:TIOFAC]2.0.CO;2 |
| [17] |
CHEN J. Response of activated oxygen metabolism to drought stress of four ornamental species[D]. Hangzhou: Zhejiang A & F University, 2013. 陈珺. 四种观赏植物的活性氧代谢对干旱胁迫的响应[D]. 杭州: 浙江农林大学, 2013. |
| [18] |
YANG H B, LIN P, LIU G D. Effect of light intensity and water content on the seedling growth and physiological characteristics of Carex diaoluoshanica[J]. Chin J Trop Crops, 2021, 42(9): 2623-2630. 杨虎彪, 林鹏, 刘国道. 不同光照和水分对吊罗山薹草生长的影响[J]. 热带作物学报, 2021, 42(9): 2623-2630. DOI:10.3969/j.issn.1000-2561.2021.09.025 |
| [19] |
LIU W Y, HE B, YANG F R, et al. Physiological response to drought and rewatering of different quinoa varieties[J]. Pratacult Sci, 2019, 36(10): 2656-2666. 刘文瑜, 何斌, 杨发荣, 等. 不同品种藜麦幼苗对干旱胁迫和复水的生理响应[J]. 草业科学, 2019, 36(10): 2656-2666. DOI:10.11829/j.issn.1001-0629.2018-0698 |
| [20] |
CAO Y H, ZHOU B Z, CHEN S L. Effects of water stress on physiological characteristics of different Illicium lanceolatum ecotypes under low light intensity[J]. Acta Ecol Sin, 2014, 34(4): 814-822. 曹永慧, 周本智, 陈双林. 弱光下水分胁迫对不同产地披针叶茴香幼苗生理特性的影响[J]. 生态学报, 2014, 34(4): 814-822. DOI:10.5846/stxb201209241351 |
| [21] |
LIU C J, GUO X, WANG K L, et al. Ecophysiological responses of Camellia japonica (Naidong) to different light and water conditions[J]. Chin J Appl Ecol, 2018, 29(4): 1125-1132. 刘翠菊, 郭霄, 王奎玲, 等. 耐冬山茶对不同光照和水分的生理生态学响应[J]. 应用生态学报, 2018, 29(4): 1125-1132. DOI:10.13287/j.1001-9332.201804.005 |
| [22] |
ZHANG L P, LIU Y, WANG Y, et al. The effects of NaCl stress on growth and accumulation of penetration adjustment substances in Glycyrrhiza[J]. J Inner Mongolia Agric Univ (Nat Sci), 2020, 41(3): 10-15. 张林平, 刘艳, 王洋, 等. NaCl胁迫对甘草生长和渗透调节物质积累的影响[J]. 内蒙古农业大学学报(自然科学版), 2020, 41(3): 10-15. DOI:10.16853/j.cnki.1009-3575.2020.03.003 |
| [23] |
KONG W P, ZHANG X A. Physiological response and drought resistance evaluation of four fig varieties to drought stress[J]. Acta Agric Boreali Sin, 2019, 34(S1): 105-113. 孔维鹏, 张小艾. 四个无花果品种对干旱胁迫的生理响应及抗旱性评价[J]. 华北农学报, 2019, 34(S1): 105-113. DOI:10.7668/hbnxb.20190269 |
 2024, Vol. 32
2024, Vol. 32


