2. 中国科学院华南植物园, 广东省应用植物学重点实验室, 中国科学院华南农业植物分子分析与遗传改良重点实验室, 广州 510650;
3. 青海师范大学教育学院, 西宁 810016
2. Guangdong Provincial Key Laboratory of Applied Botany, Key Laboratory of South China Agricultural Plant Molecular Analysis and Gene Improvement, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China;
3. School of Education, Qinghai Normal University, Xining 810016, China
黑果枸杞(Lycium ruthenicum)是茄科(Solanaceae)枸杞属多年生棘刺灌木,主要分布于青海东部、新疆北部等高海拔、盐碱地、干旱地区[1]。黑果枸杞富含花青素、黄酮、酚酸、生物碱等多种活性成分[2–3], 具有较高的营养保健功效。宁夏枸杞(L. barbarum)为茄科枸杞属落叶灌木[1],其干燥成熟果实、根皮、叶均可入药,富含多糖、黄酮、酚酸、生物碱等活性成分[4–5]。相较于宁夏枸杞,大量花青素的积累促成黑果枸杞黑色果实性状,黑果枸杞中的花青素组成由矮牵牛素、飞燕草素、芍药素和锦葵素等衍生而来[6]。
花青素是植物界普遍存在的一类水溶性的类黄酮次生代谢产物[7],基于苯丙烷代谢途径[8],由PAL、CHS、CHI、F3H、ANS等结构基因调控[9–10]。而转录因子MYB、bHLH和WD40形成的复合物MBW能够激活结构基因的表达,从而促进花青素的生物合成。MYB转录因子是调控植物花青素合成代谢的重要转录因子,如拟南芥(Arabidopsis thaliana)的AtMYB75[11]、AtPAP1[12]、矮牵牛(Petunia hybrida)的PhAN2[13]、西伯利亚白刺(Nitraria sibirica)的NsMYB1[14]等基因可正向调控花青素的合成。前期研究表明,黑果枸杞(Lycium ruthenicum)与红果枸杞(L. barbarum)中分离出的R2R3-MYB转录因子LrAN2和LbAN2等位基因均正向调控花青素的生物合成[15]。过表达LrAN2紫色烟草(Nicotiana tabacum)中花青素生物合成代谢通路中的结构基因和多个MYB转录因子被激活[16]。但AN2基因在红果枸杞和黑果枸杞中产生等位变异的原因还不清楚。
启动子作为基因的上游调控因子,能够识别并结合其转录因子,是基因表达调控的重要作用位点[17]。虽然现在红果枸杞基因组已发表,但尚未公开组装结果。因此对AN2基因启动子功能分析尚且无法直接进行克隆,本研究通过Tail-PCR方式克隆红果枸杞和黑果枸杞中花青素合成关键基因LbAN2和LrAN2上游启动子序列,并构建植物表达载体,利用农杆菌介导的遗传转化体系验证其功能,以期为进一步揭示枸杞果色形成及AN2基因的表达调控机制奠定理论基础。
1 材料和方法 1.1 试验材料本实验选用的红果枸杞(Lycium barbarum)‘宁杞7号’和黑果枸杞(L. ruthenicum) ‘青黑杞1号’,采摘于青海省都兰县诺木洪农场(96°27.2856′ N,36° 26.9625′ E),Samsun烟草(Nicotiana tabacum)保存于中国科学院西北高原生物研究所作物分子育种重点实验室,LrAN2和LbAN2基因序列由本课题组前期克隆和分离获得[15]。新鲜果实采摘后液氮冷冻, 保存于-80 ℃冰箱备用。DNA、RNA提取试剂盒、胶回收试剂盒由天根生化科技(北京)有限公司提供,反转录试剂盒PrimeScript™ II 1st Strand cDNA Synthesis Kit (TaKaRa Code No. 6210A)、高保真酶及限制性内切酶等由TaKaRa (大连)公司提供,农杆菌GV3101购自上海生工生物工程技术公司。
1.2 基因组DNA提取采用天根多糖多酚植物基因组DNA提取试剂盒(离心柱型)对红枸杞和黑果枸杞果实进行基因组DNA提取。用Nanodro浓度测定仪测定浓度,1.0%琼脂糖凝胶电泳检测条带质量。
1.3 PCR和Tail-PCRPCR扩增以DNA为模板,使用高保真酶Prime STAR Max Premix (2×)扩增,PCR反应体系为:25 μL PrimeSTAR Max Premix(2×)、正反向引物各0.5 μL、23 μL ddH2O和1 μL cDNA。PCR反应程序为:98 ℃ 10 s,55 ℃ 5 s或15 s,72 ℃ 1 min,共30个循环。Tail-PCR根据已知的LrAN2序列,在其5′端设计3个向外的巢式引物AN2-R9、AN2-R8和AN2-R4,使用Genome Walking Ki试剂盒(TaKaRa, Code No. 6108)进行Tail-PCR扩增,反应体系与反应条件参考Liu等[18]的方法。PCR和Tail-PCR产物在1%琼脂糖凝胶电泳上进行检测,回收目的条带,将目的基因连接至载体pEASY®-Blunt Cloning Kit,转化大肠杆菌DH5α,菌落PCR鉴定的阳性单克隆送至生工(上海)测序。设计差异引物,对采自8个地点的红果枸杞和7个地点的黑果枸杞的基因组DNA进行扩增,并用聚丙烯酰胺凝胶电泳进行条带检测。本试验中用到的引物见表 1。
| 表 1 引物 Table 1 Primers |
使用AlignX软件进行序列比对和拼接。为解析LbAN2p和LrAN2p启动子区域顺式作用元件差异,对LbAN2p和LrAN2p序列进行分离克隆,用Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/htmL/)软件进行启动子顺式作用元件分析[19]。
1.5 启动子表达载体构建及烟草遗传转化使用Gateway载体构建技术,通过BP反应体系将启动子序列连接在中间载体pDONR207中, 测序后提取质粒,继续进行LR反应完成构建表达载体pKGWFS7:LbAN2p和pKGWFS7:LrAN2p。将表达载体转化DH5α大肠杆菌感受态细胞,选择阳性单克隆,测序正确后提取质粒备用。利用液氮冻融法将重组质粒转化GV3101农杆菌感受态细胞,在含有抗性(100 mg/L卡那霉素、100 mg/L利福平)的LB固体培养基上于28 ℃培养48 h后进行菌落PCR鉴定,挑取阳性单克隆在LB液体培养基(100 mg/L卡那霉素、100 mg/L利福平)中于28 ℃、200 r/min下摇菌48 h,OD值为0.8时,采用叶盘法进行烟草遗传转化[20],经共培养、分化培养、生根培养后炼苗、移栽获得转基因植株。使用GUS染色试剂盒浸泡F1代烟草叶片[21], 37 ℃避光浸泡过夜,无水乙醇洗脱叶绿素后观察并拍照。
1.6 qRT-PCR采用天根RNAprep Pure多糖多酚植物总RNA提取试剂盒(离心柱型),提取野生型烟草和转基因烟草叶片总RNA。使用反转录试剂盒(TaKaRa),将cDNA稀释100倍备用。以NtActin为内参基因,荧光引物RT-GUSF、RT-GUSR由Primer Premier 5设计(表 1),反应条件及反应体系参考文献[22]。烟草叶片中GUS基因的相对表达量采用2–∆ΔCT法计算,3次生物学重复,计算结果通过Graphpad prims 8.3作图。
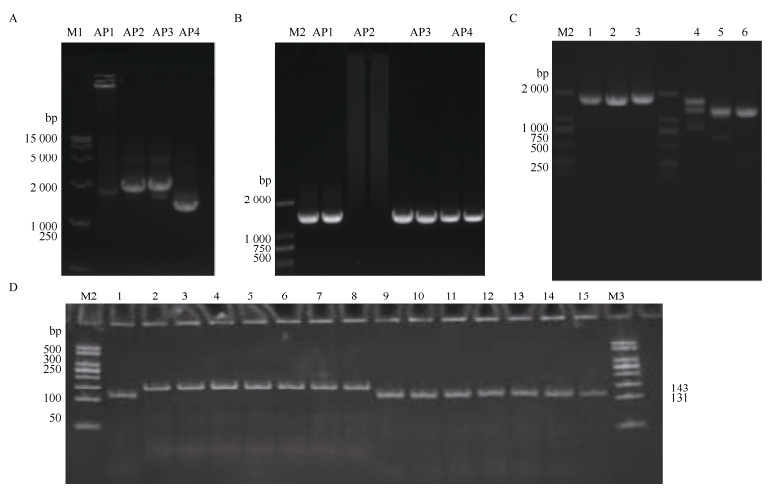
2 结果和分析 2.1 枸杞AN2基因启动子的分离利用Tail-PCR方法,根据枸杞AN2基因的cDNA及gDNA序列设计F端引物,以红果枸杞和黑果枸杞基因组DNA为模板进行扩增,根据获得的核心序列,设计Tail-PCR的特异性引物,分离到黑果枸杞和红果枸杞AN2基因起始密码子上游约1 686和1 495 bp的序列,命名为LrAN2p和LbAN2p (图 1)。序列比对结果表明,黑果枸杞在573~584 bp处有12 bp的“CATGAAGAGGAC”插入,设计差异引物对不同采样点的红果枸杞和黑果枸杞基因组DNA进行扩增(图 1: D),结果表明红果枸杞和黑果枸杞的PCR产物差异明显,条带清晰,可有效区分红果枸杞和黑果枸杞。
|
图 1 AN2基因启动子的Tail-PCR (A, B)、PCR产物(C)及不同产地枸杞的PCR产物(D)电泳图谱。A: 红果枸杞; B: 黑果枸杞; M1: DL15000 DNA Marker; M2: DL2000 DNA Marker; M3: 50 bp DNA Ladder Marker; AP1、AP2、AP3和AP4为兼并引物; 图C中1~3为红果枸杞; 4~6为黑果枸杞; 图D中1、9~15为红果枸杞; 2~8为黑果枸杞。 Fig. 1 Electrophoretic map of Tail-PCR (A, B), PCR products (C) of the promoter of AN2 gene and PCR products (D) from different places of Lycium. A: L. barbarum; B: L. ruthenicum A: 红果枸杞; B: 黑果枸杞; M1: DL15000 DNA Marker; M2: DL2000 DNA Marker; M3: 50 bp DNA Ladder Marker; AP1, AP2, AP3 and AP4 were primers; 1-3: L. barbarum; 4-6: L. ruthenicum in C; 1, 9-15: L. barbarum; 2-8: L. ruthenicum in Figure D. |
利用Plant CARE在线软件对LbAN2p和LrAN2p进行顺式作用元件分析(图 2)。结果表明,从LbAN2p和LrAN2p氨基酸序列中分别检测到133和137个的顺式作用元件,除启动子所具备的43和47个TATA-box、20和22个CAAT-box之外,尚有70和68个参与AN2基因表达调控的顺式作用元件,其中LbAN2p中有24个可预测功能的顺式作用元件,LrAN2p中有30个,如参与光调控的分别有11和15个,包括G-box、G-Box、GT1-motif、GATA-motif、MRE等;与激素响应相关的分别有13和16个,如赤霉素响应元件ABRE、生长素响应元件AuxRR-core和水杨酸响应元件CGTCA-motif。此外,与LbAN2p相比,LrAN2p在第573~584位插入了12 bp的“CATGAAGAGGAC”,使其具有更多的CAAT-box。

|
图 2 LbAN2p、LrAN2p的顺式作用元件 Fig. 2 Number of cis-acting elements in LbAN2p and LrAN2p |
为研究LbAN2和LrAN2基因启动子活性,将构建好的表达载体pKGWFS7:LbAN2p和pKGWFS7: LrAN2p转化农杆菌GV3101后,利用农杆菌介导的遗传转化体系侵染烟草。对阳性转基因烟草进行GUS染色,以野生型Samsun烟草叶片为阴性对照。结果表明,pKGWFS7:LrAN2p载体表达后, GUS蛋白进入烟草表皮细胞,整个叶片呈现蓝色, pKGWFS7:LbAN2p转基因烟草叶片染色后未观察到蓝色,肉眼观测GUS蛋白几乎没有表达(图 3)。

|
图 3 烟草叶片的GUS染色 Fig. 3 GUS staining of tobacco leaves |
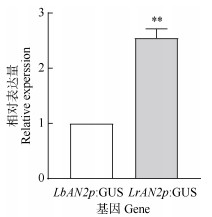
以NtActin为内参基因,采用qRT-PCR对转基因烟草叶片中GUS基因的表达模式进行分析(图 4)。结果表明,以LbAN2p: GUS烟草中GUS基因的相对表达量为对照,LrAN2p: GUS转基因烟草叶片中GUS基因转录水平是LbAN2p: GUS烟草叶片的2.55倍,差异显著(P < 0.01)。
|
图 4 转基因烟草中GUS基因的相对表达量 Fig. 4 Relative expression of GUS gene in leaves of transgenic tobacco |
黑果枸杞作为西北特色植物资源,因其药食同源、高经济价值和高营养价值而越来越被重视,人们通过口服、泡茶等方式摄入大量花青素,从而提高机体免疫力,而黑果枸杞高花青素积累的分子机制研究在近2年才开展,研究人员通过转录组测序技术在黑果枸杞中筛选出LrAN2,证实LrAN2在果实中的特异表达激活了花青素的合成,表达谱分析也证实黑色果实的形成伴随着花青素的逐步积累以及LrAN2转录水平的提高,而转基因烟草分析结果表明,LrAN2和LbAN2两个等位基因诱导烟草合成花青素积累的能力不一,LrAN2功能更强[15–16], 初步推测黑果枸杞和红果枸杞中AN2基因上游启动子区域存在活性差异,从而导致LbAN2功能性远弱于LrAN2。
基因启动子区域含有的顺式作用元件能够控制该基因表达的起始时间和程度[23]。本研究采用Tail-PCR法获得了LbAN2和LrAN2基因起始密码子上游约1 686和1 495 bp的序列,与LrAN2p相比, LbAN2p序列含有更多的顺式作用元件。LrAN2p中12 bp “CATGAAGAGGAC”的插入,使得LrAN2p具有更多的CAAT-box,这可作为有效区分红果枸杞和黑果枸杞的分子标记,在今后枸杞新品系育种工作中提供可靠的标记方式之一。此外,光环境也是影响花青素生物合成的重要环境因素[24],黑果枸杞中更多的光响应元件更有利于激活LrAN2基因的表达,促进花青素的合成。前期研究表明,花青素的合成积累可以使植物在干旱、紫外辐射、缺水、低温、缺氧等多种环境胁迫下,增加植株抗逆性[25–26]。而LrAN2p中ABRE元件显著多于LbAN2p, ABRE是脱落酸特异结合响应元件,脱落酸在植物中抗逆研究较多[27],这也从侧面推测LrAN2与黑果枸杞抗旱、耐盐碱息息相关[25, 28]。LrAN2p中有6个G-box元件,远多于LbAN2p,G-box已证实参与茉莉酸、脱落酸、乙烯响应[29],最终诱导植株的抗病及花青素和生物碱的合成积累。由此可以推测LrAN2基因不仅能够产生MBW蛋白,也有可能和茉莉酸或脱落酸响应基因互作产生植物抗逆的蛋白,从而提高黑果枸杞在西北荒漠地区的抗逆性。
将启动子序列构建到含有GUS报告基因的载体上,利用烟草进行遗传转化,可确定启动子区域的活性差异。薛惠敏等[30]构建了pBI121-LsANSpro: GUS融合表达载体,瞬时转化拟南芥(Arabidopsis thaliana),其根、叶片和花显示蓝色,可知启动子LsANSPro具有启动下游基因的作用。罗香怡等[31]构建了紫粒小麦(Triticum aestivum)的TaMYC1启动子植物表达载体TaMYC1p: GUS和TaMYC1w: GUS并转入本氏烟草,结果表明TaMYC1p启动子的活性要远高于TaMYC1w,推测其与紫粒小麦中TaMYC1转录水平较高和花青素含量较高有关。甘蓝型油菜(Brassica napus)的BnaFIL启动子在早花材料和晚花材料表达存在差异,说明启动子的驱动效果对油菜开花早晚进行了调控,导致BnaFIL在不同材料中的表达效果不一致[32]。在本研究中,GUS染色结果表明,LrAN2p能够启动下游GUS报告基因在烟草叶片中的表达,说明该启动子具有明显的启动激活基因转录的能力,而LbAN2p转基因烟草染色后,叶片不呈现蓝色,说明LbAN2p启动激活基因转录的能力远弱于LrAN2p,qRT-PCR结果也在表达量水平上证实了这一推论。AN2基因的启动子在红果枸杞和黑果枸杞中的表达效果差异显著,由此推断,AN2在不同材料中的差异表达可能是由启动子驱动决定的,也是黑果枸杞花青素合成代谢通路被激活的原因之一。这为后续黑果枸杞花青素生物合成代谢研究奠定了可靠的理论依据。
| [1] |
GUO B Z. Economic Flora of Qinghai[M]. Xining: Qinghai People's Press, 1987. 郭本兆. 青海经济植物志[M]. 西宁: 青海人民出版社, 1987. |
| [2] |
LIU Z G, DONG B M C L, LIU C, et al. Variation of anthocyanin content in fruits of wild and cultivated Lycium ruthenicum[J]. Ind Crops Prod, 2020, 146: 112208. DOI:10.1016/j.indcrop.2020.112208-16 |
| [3] |
ZHENG J, DING C X, WANG L S, et al. Anthocyanins composition and antioxidant activity of wild Lycium ruthenicum Murr. from Qinghai-Tibet Plateau[J]. Food Chem, 2011, 126(3): 859-865. DOI:10.1016/j.foodchem.2010.11.052 |
| [4] |
RUKEYA JIAPAER, SUN Y J, ZHONG L Z, et al. A review of phytochemical composition and bio-active of Lycium barbarum fruit (Goji)[J]. J Chin Inst Food Sci Technol, 2013, 13(8): 161-172. 如克亚·加帕尔, 孙玉敬, 钟烈州, 等. 枸杞植物化学成分及其生物活性的研究进展[J]. 中国食品学报, 2013, 13(8): 161-172. DOI:10.16429/j.1009-7848.2013.08.001 |
| [5] |
JIANG X F. Overview on chemical constituents and pharmacological research of medlar[J]. J Jiangxi Univ TCM, 2013, 25(3): 98-100. 江旭锋. 枸杞子化学成分及其药理学研究概况[J]. 江西中医学院学报, 2013, 25(3): 98-100. DOI:10.3969/j.issn.1005-9431.2013.03.032 |
| [6] |
LI J, YANG F, LUAN G X, et al. Research progress on ingredient and pharmacological activities of anthocyanins from Lycium ruthenicum[J]. W China J Pharm Sci, 2022, 37(3): 331-336. 李婧, 杨芳, 栾广祥, 等. 黑果枸杞的花青素类成分及其药理作用的研究进展[J]. 华西药学杂志, 2022, 37(3): 331-336. DOI:10.13375/j.cnki.wcjps.2022.03.022 |
| [7] |
TANAKA Y, SASAKI N, OHMIYA A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids[J]. Plant J, 2008, 54(4): 733-749. DOI:10.1111/j.1365-313X.2008.03447.x |
| [8] |
AMRHEIN N. Novel inhibitors of phenylpropanoid metabolism in higher plants [M]// LUCKNER M, SCHREIBER K. Regulation of Secondary Product and Plant Hormone Metabolism. Oxford: Pergamon Press, 1979: 173–182. doi: 10.1016/B978-0-08-023179-2.50020-4.
|
| [9] |
BOSS P K, DAVIES C, ROBINSON S P. Analysis of the expression of anthocyanin pathway genes in developing Vitis vinifera L. cv Shiraz grape berries and the implications for pathway regulation[J]. Plant Physiol, 1996, 111(4): 1059-1066. DOI:10.1104/pp.111.4.1059 |
| [10] |
DONG Y H, BEUNING L, DAVIES K, et al. Expression of pigmentation genes and photo-regulation of anthocyanin biosynthesis in developing Royal Gala apple flowers[J]. Funct Plant Biol, 1998, 25(2): 245-252. DOI:10.1071/PP97108 |
| [11] |
KREYNES A E, YONG Z H, ELLIS B E. Developmental phenotypes of Arabidopsis plants expressing phosphovariants of AtMYB75[J]. Plant Signal Behav, 2021, 16(1): 1836454-68. DOI:10.1080/15592324.2020.1836454 |
| [12] |
CHHON S, JEON J, KIM J, et al. Accumulation of anthocyanins through overexpression of AtPAP1 in Solanum nigrum Lin. (black nightshade)[J]. Biomolecules, 2020, 10(2): 277-293. DOI:10.3390/biom10020277 |
| [13] |
GERATS A G, FARCY E, WALLROTH M, et al. Control of anthocyanin synthesis in Petunia hybrida by multiple allelic series of the genes An1 and An2[J]. Genetics, 1984, 106(3): 501-508. DOI:10.1093/genetics/106.3.501 |
| [14] |
BAO X M, ZONG Y, HU N, et al. Functional R2R3-MYB transcription factor NsMYB1, regulating anthocyanin biosynthesis, was relative to the fruit color differentiation in Nitraria sibirica Pall.[J]. BMC Plant Biol, 2022, 22(1): 186-198. DOI:10.1186/s12870-022-03561-5 |
| [15] |
ZONG Y, ZHU X B, LIU Z G, et al. Functional MYB transcription factor encoding gene AN2 is associated with anthocyanin biosynthesis in Lycium ruthenicum Murray[J]. BMC Plant Biol, 2019, 19(1): 169-178. DOI:10.1186/s12870-019-1752-8 |
| [16] |
ZONG Y, LI S M, XI X Y, et al. Comprehensive influences of overexpression of a MYB transcriptor regulating anthocyanin biosynthesis on transcriptome and metabolome of tobacco leaves[J]. Int J Mol Sci, 2019, 20(20): 5123-5136. DOI:10.3390/ijms20205123 |
| [17] |
SHEN Z Y, ZHANG C, DONG B, et al. Cloning and expression analysis of the promoters of OfLCYB and OfLCYE in Osmanthus fragrans[J]. Biotechnol Bull, 2018, 34(1): 137-143. 沈子又, 张超, 董彬, 等. 桂花OfLCYB和OfLCYE启动子的克隆和活性分析[J]. 生物技术通报, 2018, 34(1): 137-143. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0706 |
| [18] |
LIU Y G, WHITTIER R F. Thermal asymmetric interlaced PCR: Auto-matable amplification and sequencing of insert end fragments from P1 and YAC clones for chromosome walking[J]. Genomics, 1995, 25(3): 674-681. DOI:10.1016/0888-7543(95)80010-J |
| [19] |
GAO L, TIAN Y, CHEN M C, et al. Cloning and functional characterrization of epidermis-specific promoter MtML1 from Medicago truncatula[J]. J Biotechnol, 2019, 300: 32-39. DOI:10.1016/j.jbiotec.201 |
| [20] |
HORSCH R B, FRY J E, HOFFMANN N L, et al. A simple and general method for transferring genes into plants[J]. Science, 1985, 227(4691): 1229-1231. DOI:10.1126/science.227.4691.1229 |
| [21] |
Fernández-Piñán S, López J, Armendariz I, et al. Agrobacterium tumefaciens and Agrobacterium rhizogenes-mediated transformation of potato and the promoter activity of a suberin gene by GUS staining[J]. JoVE, 2019(145): e59119-e59128. DOI:10.3791/59119 |
| [22] |
LAI Y S, SHIMOYAMADA Y, NAKAYAMA M, et al. Pigment accumulation and transcription of LhMYB12 and anthocyanin biosynthesis genes during flower development in the Asiatic hybrid lily (Lilium spp.)[J]. Plant Sci, 2012, 193–194: 136-147. DOI:10.1016/j.plantsci.2012.05.013 |
| [23] |
LU J, ZHAO H Y, HE Y K, et al. Advances in promoters in higher plants and their applications[J]. Prog Nat Sci, 2004, 14(8): 856-862. 路静, 赵华燕, 何奕昆, 等. 高等植物启动子及其应用研究进展[J]. 自然科学进展, 2004, 14(8): 856-862. DOI:10.3321/j.issn:1002-008X.2004.08.003 |
| [24] |
WANG F, WANG X J, ZHAO S N, et al. Light regulation of anthocyanin biosynthesis in horticultural crops[J]. Sci Agric Sin, 2020, 53(23): 4904-4917. 王峰, 王秀杰, 赵胜男, 等. 光对园艺植物花青素生物合成的调控作用[J]. 中国农业科学, 2020, 53(23): 4904-4917. DOI:10.3864/j.issn.0578-1752.2020.23.015 |
| [25] |
WANG H X, LIU T Y, ZHUANG W B, et al. Research advances in the function of anthocyanin in plant stress response[J]. J Agric Biotechnol, 2020, 28(1): 174-183. 王鸿雪, 刘天宇, 庄维兵, 等. 花青素苷在植物逆境响应中的功能研究进展[J]. 农业生物技术学报, 2020, 28(1): 174-183. DOI:10.3969/j.issn.1674-7968.2020.01.018 |
| [26] |
LIU L, DU H, TANG X F, et al. The roles of MYB transcription factors on plant defense responses and its molecular mechanism[J]. Hereditas, 2008, 30(10): 1265-1271. 刘蕾, 杜海, 唐晓凤, 等. MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J]. 遗传, 2008, 30(10): 1265-1271. DOI:10.3724/SP.J.1005.2008.01265 |
| [27] |
LIU H J, LIU Y, LIU L. Progress of research on the influence of abscisic acid in plant resistance[J]. Biotechnol Bull, 2008(6): 7-9. 刘红娟, 刘洋, 刘琳. 脱落酸对植物抗逆性影响的研究进展[J]. 生物技术通报, 2008(6): 7-9. |
| [28] |
SHI X W. Identification and analysis of MicroRNA related to adversity stress and anthocyanin biosynthesis in sweet potato[D]. Jinzhong: Shanxi Agricultural University, 2018. 石晓雯. 甘薯逆境胁迫和花青素合成相关microRNA及其靶基因的鉴定和分析[D]. 晋中: 山西农业大学, 2018. |
| [29] |
SA Q L, LI W B, SUN Y R. Transcriptional regulation of the G-box and G-box-binding proteins in plant gene expression[J]. Plant Physiol Commun, 2003, 39(1): 89-92. 萨其拉, 李文彬, 孙勇如. G-box和G-box结合蛋白在植物基因诱导表达中的转录调控作用[J]. 植物生理学通讯, 2003, 39(1): 89-92. DOI:10.13592/j.cnki.ppj.2003.01.028 |
| [30] |
XUE H M, ZHOU Y L, GAO Y H. Cloning and promoter function analysis of the anthocyanins synthase gene (LsANS) in Lycoris sprengeri[J]. Chin J Agric Biotechol, 2022, 30(8): 1468-1479. 薛惠敏, 周洋丽, 高燕会. 换锦花花青素合成酶基因(LsANS)的克隆及启动子功能分析[J]. 农业生物技术学报, 2022, 30(8): 1468-1479. DOI:10.3969/j.issn.1674-7968.2022.08.003 |
| [31] |
LUO X Y, ZONG Y, CAO D, et al. Cloning and functional analysis of promoter of TaMYC1 gene in common wheat[J]. Mol Plant Breed, 2022, 20(8): 2456-2462. 罗香怡, 宗渊, 曹东, 等. 普通小麦中TaMYC1基因启动子的克隆和功能分析[J]. 分子植物育种, 2022, 20(8): 2456-2462. DOI:10.13271/j.mpb.020.002456 |
| [32] |
CHEN J, HU R, LIU Y, et al. Cloning and expression analysis of BnaFIL gene promoter in Brassica napus L.[J]. Acta Agric Boreali-Sin, 2022, 37(3): 53-59. 陈静, 胡蓉, 刘勇, 等. 甘蓝型油菜BnaFIL基因启动子的克隆与表达分析[J]. 华北农学报, 2022, 37(3): 53-59. DOI:10.7668/hbnxb.20192788 |
 2024, Vol. 32
2024, Vol. 32



