苔藓植物种类丰富,分布广泛,是最低级的高等植物,苔藓植物是环境监测和水土保持的常用植物,并且还具有不可忽视的造景和药用价值。然而苔藓植物生长缓慢,人工种植产业不发达、种植技术不完善,苔藓植物栽培研究较少[1],涉及苔藓植物施肥的研究更少。前人有关苔藓植物的施肥研究,大多仅涉及施肥下的植物群落结构与丰富度的变化,多数研究结果为长期施肥会降低苔藓植物生物量和苔藓植物物种丰富度[2–3]。这种变化主要与高度较高的维管植物在施肥下有更强的竞争力有关[3–4],施肥促进了较高的维管植物生长,限制了体型相对较低的维管植物和苔藓植物的生长。另外,苔藓植物缺乏角质层,也可能会受到施肥带来的盐胁迫[5]。苔藓植物丰富度降低的原因还可能与施肥形式有关,固体施肥对苔藓植物的影响可能小于模拟大气沉降的肥料喷施。
大灰藓(Hypnum plumaeforme)广泛分布于东亚,能生长在腐木、树干、岩面薄土、草地、砂土、黏土上[6]。土生的大灰藓适合生长在湿度高(85%)、降雨充沛、遮阴度较高、温度10 ℃~25 ℃的环境中[7–9]。目前,大灰藓的栽培研究大多与基质、光照和营养液有关[10–12],有关大灰藓施肥的研究较少,少数研究仅关注其N肥溶液喷施效果[13],缺少N、P、K平衡施肥对大灰藓生长的影响研究。
苔藓植物体型低矮,植株分布紧凑,以往研究多以发枝率、枝条长度、覆盖度和生物量来衡量苔藓植物长势的好坏,缺少对苔藓植物个体形态的细致研究以及苔藓植物个体生长与苔藓植物群体变化的关联性探究。苔藓植物个体的分枝发育决定着苔藓植物群体的覆盖度大小和植株颜色,植株颜色也与植株长势有一定的关联性,尤其在常绿植物中,颜色越绿往往长势越好。另外,苔藓植物也容易受到环境刺激产生枝叶蜷缩和颜色变化,其植株颜色非常适合作为衡量苔藓植物健康程度的指标[14],植株颜色也可以直观反映苔藓植物的生长状况,但苔藓植株颜色与苔藓植物长势的研究较少。植物和土壤的C、N、P、K含量反映着植物养分的积累程度和吸收状况。苔藓植物对元素的固定、对养分的需求和利用效率不同于其他植物,通过分析不同施肥处理下苔藓植物、土壤的元素含量变化可以探讨苔藓植物与土壤间的相互作用来研究生态问题,为苔藓植物-土壤的生态系统研究提供一定的数据参考[15]。
因此,本研究将不同施肥量的单一肥料作为基肥使用,研究大灰藓的生长生理、养分含量、土壤养分状况及pH对施肥处理的响应,比较隶属函数综合得分筛选出适合大灰藓的施肥方法,探讨施肥下苔藓植物与土壤C、N、P、K含量的相关性。本研究探讨不同施肥处理对大灰藓分枝发育的影响, 分析分枝与覆盖度、植株颜色的相互关系,并且综合考虑覆盖度、植株颜色等指标筛选出最适合大灰藓的施肥方法;同时,探讨施肥对大灰藓光合色素、可溶性蛋白、可溶性糖含量、养分含量的影响,分析大灰藓生长生理、养分含量与土壤养分及土壤pH的关系,为大灰藓人工培育提供施肥指导依据,也为苔藓植物-养分元素-土壤的栽培系统研究提供一条新思路。
1 材料和方法 1.1 试验地概况试验地位于贵州省贵阳市花溪区贵州大学林学院实验基地(106°65′~107°17′ E, 26°45′~27°22′ N), 海拔1137.76 m,属于亚热带湿润温和型气候,兼有高原性和季风性气候特点。年平均气温为15.3 ℃, 年均相对湿度为77%,年均降水量为1129.5 mm, 年均日照时数为1148.3 h。根据研究地的气候特点和苔藓植物正常生长对光的需求,采用两层6针遮阳网的大棚进行试验,结合大灰藓需水量和天气变化进行浇水,控制各个施肥处理的浇水量一致,并定期清除杂草。
1.2 试验材料试验用大灰藓(Hypnum plumaeforme)于网上购买。基质采用草木发酵过的混合土。种植盆为长宽高为42 cm×42 cm×5 cm的塑料种植盆,在盆底铺塑料膜以防止肥料流失,造成营养损失。
1.3 试验设计将硫酸钾(K)、过磷酸钙(P)和磷酸二氢钾(PK)做底肥,单独使用,参考Virtanen等[3]的方法并略加改进(增加施肥量),设置5个施肥量(每盆6、12、18、24、30 g, 下同),以不施肥为对照(CK),其中硫酸钾K2O≥50%、过磷酸钙P2O5≥12%、磷酸二氢钾的P、K养分比例为52~34。种植土深度约为4 cm,并将盆中土壤等分成4块,将相同质量的4份肥料混合在每个方块正中心10 cm×10 cm的土中。浇透水之后将盆随机摆放,并于第5天种植大灰藓。
种植试验分为群体种植和单体(单株)种植两部分。苔藓植物干燥处理后,选取长势和植株颜色一致的植株,用剪刀将大灰藓剪碎成0.5~0.8 cm断茎,然后将配子体碎片铺成10 cm×10 cm的种植面积, 每个处理3个重复,此为群体种植试验。单体种植试验(主要目的为探究施肥对植株个体发育的影响以及植株分枝发育规律,排除群体种植下个体交错纵横带来的测量误差)取长度0.5~0.8 cm的大灰藓断茎,去除分枝,只保留主茎,每盆等间距种植, 每个处理3个重复,每个重复都有6株断茎。试验周期为2021年7月20日至2022年1月20日。
1.4 方法生长指标 苔藓植物单体种植时,将植株茎等分成尖端、中部、基部3部分,每20 d测量1次不同部位各级(1~3级)分枝的数量和长度(分枝长度≥0.5 cm时开始记录),并计算每个处理总的分枝数和分析生长状况。种植20 d后,每40 d用Redmi Note 8 Pro手机的相机64M模式对大灰藓进行拍照, 通过CAD2018软件勾出大灰藓整体轮廓,轮廓面积与盆面积的1/4比值为覆盖度。将大灰藓轮廓的图片导入Photoshop 2020软件中删除非大灰藓部分, 再通过ColorImpact软件提取大灰藓植株不同颜色的占比。
生理生化指标 用浸提法测量光合色素含量,并按照Arnon法[16]计算总叶绿素a+b、类胡萝卜素含量。可溶性糖含量用蒽酮比色法测定,可溶性蛋白含量则用考马斯亮蓝G-250 (Bradford)法测定。植株C含量采用重铬酸钾-硫酸氧化法测定; 植物样品用过氧化氢+硫酸消煮后,半微量凯氏定氮法测定N含量(LYT 1269—1999);钼锑抗分光光度法测定P含量;火焰光度法测定K含量[17]。
土壤养分及pH值的测定 土壤有机碳(SOC)含量测定采用重铬酸钾氧化法,土壤养分测定用硫酸+高氯酸消煮后,土壤全N (TN)、全P (TP)、全K (TK)含量测定分别采用凯氏定氮法、钼锑抗比色法、火焰光度法[18]。土壤pH采用FieldScout土壤原位pH计-PH400、PH600 (美国Spectrum)仪,称取风干土样10 g (过0.25 mm筛)于烧杯中,加入25 mL蒸馏水,搅拌混匀2 min,静止20 min后用pH计探针插入上层悬浊液,待数值稳定后读取pH值, 读取3次,取平均值。
1.5 大灰藓生长状况综合评价用模糊隶属函数方法对大灰藓长势与植株颜色进行综合评价[16],通过Pearson相关性分析,与覆盖度(或绿色占比)呈正相关用公式:F(Xi)=(Xi–Xmin)/(Xmax–Xmin),若呈负相关用公式:F(Xi)=1–(Xi –Xmin)/(Xmax–Xmin)。式中X表示第i个指标数值,Xmin和Xmax表示第i个指标的最小数值和最大数值。将不同施肥处理下的大灰藓生长生理及营养元素指标的隶属函数值进行累加后求平均值,得到植株生长状况综合评价指数,指数值越大说明该施肥处理下的植株生长越好[16]。
1.6 数据处理试验数据采用Excel和SPSS 19.0软件进行处理和分析。
2 结果和分析 2.1 施肥对植株生长发育的影响 2.1.1 植株分枝发育特征总体上,茎不同部位的分枝以尖端分枝数量和长度最大,中部分枝数量和长度最小(表 1)。不同级别的分枝数量以二级分枝最多,分枝长度以一级分枝最长。分枝总数最大和总长最长的前3个处理均为PK6、P12、K18。PK6与其它处理不同,其中部分枝的数量和长度数值最大,尖端分枝的数量和长度数值最小,这可能导致该处理的大灰藓覆盖度增速低于其他处理。
| 表 1 施肥对分枝发育的影响 Table 1 Effect of fertilization on branch development |
各级分枝发育呈现明显的时间变化特征(图 1),一级分枝主要在60 d前萌发,其长度增长主要在20~80 d;二级分枝数量的主要增长期在40~80和100~180 d,80~100 d出现增长略微减缓的状况,这可能是因为分枝长势过旺导致大灰藓营养供给不足而导致的;二级分枝长度的主要增长期在80~180 d;三级分枝的主要萌发期在120 d之后,并且三级分枝长度仅少量处理出现略微增长。
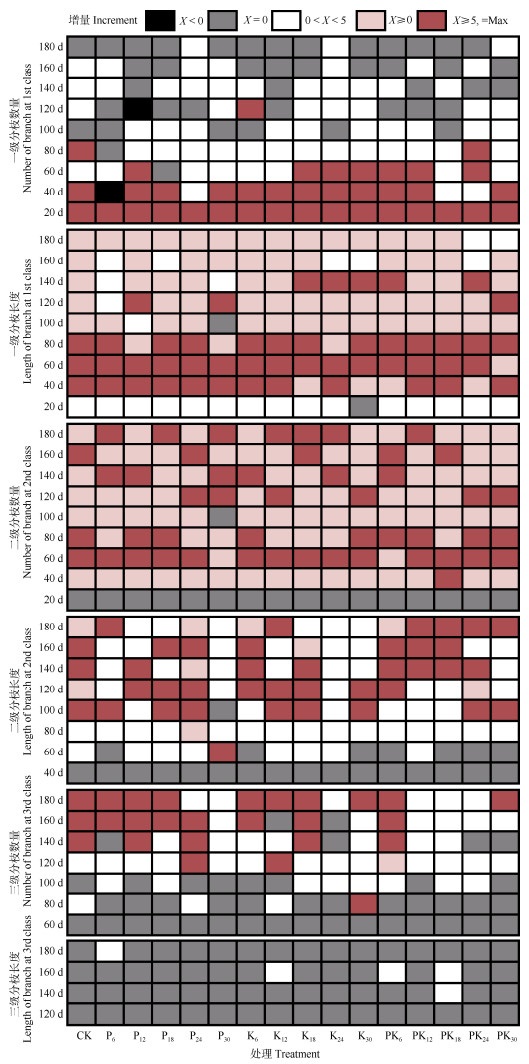
|
图 1 不同施肥处理下大灰藓分枝数量和长度的增量。P、K、PK分别为P肥、K肥、PK肥, 下标数字为施肥量; CK: 对照。下同 Fig. 1 Increment of number and length of branch of Hypnum plumaeforme under different fertilization treatments. P, K and PK represent P, K and PK fertilizers, respectively, and the subscript number represent the fertilizing amount; CK: Control. The same below |
一级分枝长度和二级分枝数量的增长是大灰藓分枝发育的重点,均在20~180 d的增量较大。大灰藓分枝发育的重要基础是一级分枝数量的增长, 其在80 d前基本发育完毕;三级分枝的发育尤其是长度的增长对大灰藓分枝发育的影响最小。80~100 d是大灰藓一二级分枝的生长过渡期,此阶段的一级分枝主要发育期基本结束,二级分枝数量增长减缓,二级分枝长度增量开始上升,在该阶段添加适量外源营养物可能会更进一步的促进分枝发育。
2.1.2 对覆盖度的影响由图 2可见,所有施肥处理的大灰藓覆盖度都大于CK,且仅P6、PK6、PK24与CK差异不显著,表明3种肥料都可显著增加植株覆盖度。覆盖度较大的前5个处理为K18、K24、K6、PK12和P12,分别为CK的1.54、1.47、1.44、1.43和1.39倍,且所有施K肥的覆盖度均显著大于CK,说明K肥对大灰藓覆盖度增长的促进作用最好。
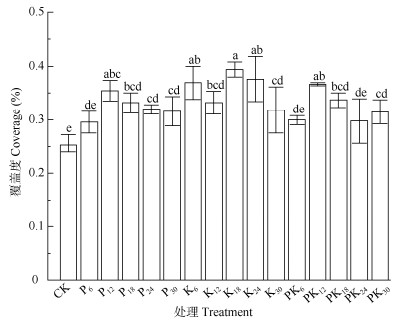
|
图 2 不同施肥处理的大灰藓覆盖度。柱上不同字母表示差异显著(P < 0.05)。下同 Fig. 2 Coverage of Hypnum plumaeforme under different fertilization treatments. Different letters upon column indicate significant differences at 0.05 level. The same below |
由图 3可见,20~60 d时PK24、P30的大灰藓覆盖度增量最大,其余较大增量都分布在60~180 d, 证明此时期为大灰藓覆盖度的主要增长期。CK的增量在140~180 d最大,除K24、K30的增量排序跟CK一样外,其余处理的最大增量均比CK提前出现, 证明多数施肥处理可使大灰藓提前进入覆盖度的主要增长期。

|
图 3 不同施肥处理的覆盖度增量 Fig. 3 Coverage increment under different fertilization treatments |
通过ColorImpact软件提取生长期内大灰藓植株颜色,统计深褐、褐、浅褐、褐绿、浅褐绿、深绿、绿、浅黄绿色共8种颜色。将代表植株褐色程度的深褐、褐、浅褐、褐绿色占比之和记为褐值,代表植株绿色程度的浅褐绿、深绿、绿、浅黄绿色占比之和记为绿值,以此衡量植株整体的褐色和绿色程度。由图 4可见,CK的褐值最大、绿值最小,且与3种肥料处理的差异显著,说明3种肥料都能显著增加大灰藓植株的总体绿度。P肥处理的褐值最小、绿值最高,表明P肥处理的大灰藓植株颜色最绿,褐色最少。K和PK肥处理的浅褐、浅黄绿、浅褐绿色占比都高于CK和P肥处理,表明K和PK肥会使大灰藓的植株颜色变淡(褐色变为浅褐色、绿色变成浅黄绿和浅褐绿)。施肥能显著增加大灰藓植株的绿色程度,其中P肥的促进效果最好, 而K和PK肥在增加植株绿度的同时会减少深色色系的占比。
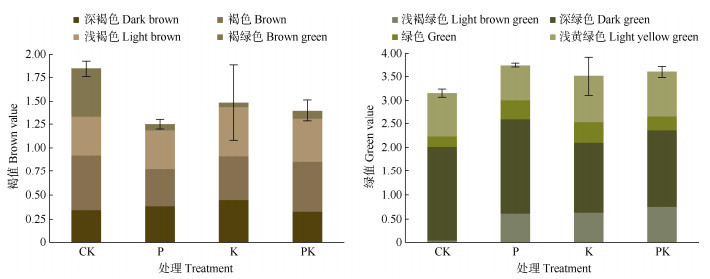
|
图 4 肥料对植株颜色的影响 Fig. 4 Effect of fertilization on plant color |
叶绿素和类胡萝卜素含量是衡量植物光合作用强弱的重要指标。可溶性糖和可溶性蛋白是植物营养贮藏物质,同时也参与了细胞渗透压的调节。这些物质的含量常被用于衡量苔藓植物的长势状况。由图 5可见,施肥总体上增加了大灰藓类胡萝卜素、叶绿素(K12处理以外)、可溶性蛋白含量(P24、PK12、PK30除外),降低了可溶性糖含量(除P24、PK6以外)。
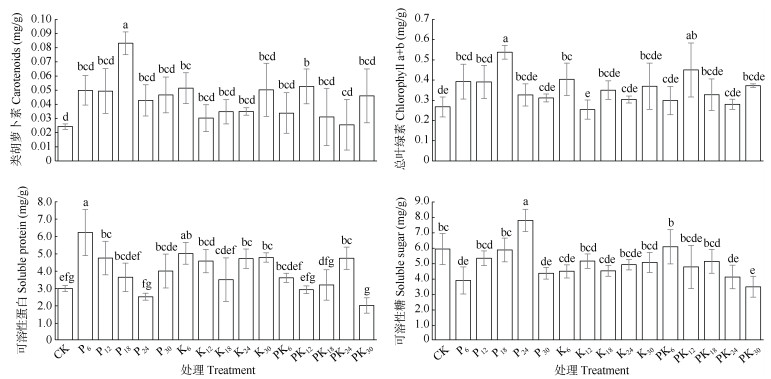
|
图 5 施肥对植株生理指标的影响 Fig. 5 Effect of fertilization on physiological indexes of plants |
C元素是生命组成的根本,而N、P、K是植物生长最基本的营养元素。从图 6可见,大多数施肥处理间的植物N含量差异不显著。施肥对大灰藓P含量的影响为P肥 > K肥 > CK > PK肥,P肥可显著提高植株P含量,高肥量K肥(K24、K30)也可提高植株P含量。植株K含量以K肥的促进作用最好,其次是PK肥、P肥。较高施肥量(每盆24、30 g)的植株C含量都低于CK (仅K24略大于CK),表明高施肥量会降低大灰藓C含量。

|
图 6 施肥对植株营养元素含量的影响 Fig. 6 Effect of fertilization on nutrient contents of plants |
P30、PK6、P24的肥料含P量相近,分别为3.6、3.12、2.88 mg/g,但是植株P含量P30 > P24 > CK > PK6,证明大灰藓对PK肥的耐受性比P肥差,并且大灰藓适合的PK肥量低于每盆6 g,PK肥还可能对大灰藓P元素的吸收存在抑制作用。K和PK肥处理在肥料含K量为每盆6 g时(K12、PK18)的植株K含量都有所降低,并且总体上随着施肥量的增加均出现先减后增的趋势,证明K和PK肥对大灰藓K含量的影响类似。
总体来说,施肥对大灰藓N含量的影响不显著,中低施肥量(每盆6、12、18 g)的施肥处理可增加植株C含量(K18除外),施肥对植株P、K含量的影响较大,并且P肥和K肥分别对植株P、K含量积累的促进作用最好。
2.4 相关性分析相关性分析表明(表 2), 覆盖度与植物K、土壤全N含量呈极显著正相关,与植物N、土壤全K含量呈正相关,证明N、K元素是大灰藓覆盖度增长的主要影响因素。绿(植株绿色占比)和绿值均与植物N、P、土壤全P含量呈显著正相关,证明N、P元素是影响大灰藓绿度的主要元素。土壤全P含量与各项植株颜色指标均呈显著相关,证明土壤P含量是影响大灰藓绿度的关键因子。绿和绿值都与土壤pH呈显著负相关,证明土壤pH也是影响植株绿度的主要因素。
| 表 2 不同指标间的相关性 Table 2 Index membership and comprehensive index of treatments with higher coverage or green proportion than CK |
类胡萝卜素含量主要受P元素的影响, 与土壤全P含量呈显著正相关;可溶性蛋白含量主要与K元素有关, 与土壤全K含量呈显著正相关;可溶性糖含量与植物N含量呈极显著正相关,与土壤全N含量呈极显著负相关,证明大灰藓可溶性糖含量主要受N元素的影响。
2.5 综合评价计算大灰藓的覆盖度、植株颜色指标(绿和浅黄绿色占比、绿值、褐值)、植株生理(叶绿素、类胡萝卜素、可溶性蛋白、可溶性糖)与养分含量(植物C、N、P、K含量)指标的隶属函数值,最终计算出每个处理植株的生长状况综合评价指数(表 3)。只以覆盖度为主要评判时,覆盖度优于CK的隶属度, 依次为K18 > K6 > P18 > K24。因为绿值包括浅黄绿色占比,绿色占比比绿值更能代表大灰藓植株绿色程度,所以当植株绿色占比为主要评判时,绿色占比优于CK的隶属度, 依次为P18 > P12 > K24 > K6。覆盖度和绿色占比同时考虑时,两者的综合指数都优于CK的隶属度, 依次为P18 > K6 > K24, 剔除了可溶性糖、植物P、浅黄绿指标,因为这些指标与覆盖度和绿色占比分别呈负相关和正相关。
| 表 3 生理指标的隶属函数值 Table 3 Index membership and comprehensive index of treatments with higher coverage or green proportion than CK |
施肥能促进苔藓植物枝条萌发和长度增长[19], 施肥对泥炭藓(Sphagnum)长度增长的促进作用比施肥对发枝数的促进作用更显著[20]。大灰藓分枝发育主要位于尖端区域,而施肥对尖端分枝发育的促进作用弱,但施肥对中部和基部分枝发育促进作用好。不同施肥处理对大灰藓的促进作用不同,PK6处理对植株中部和基部分枝发育的促进作用最好, 但会抑制尖端分枝发育;P12处理对大灰藓所有部位的分枝发育都有较好促进作用。PK6处理抑制了尖端分枝的发育,导致该处理在群体种植下的覆盖度与CK差异不显著,P12的覆盖度则显著大于CK。植株的分枝发育对群体覆盖度的增长有重要影响, 群体种植下的所有施肥处理的覆盖度均大于CK, 而单体种植下的施肥处理的植株分枝发育并非如此,这说明紧凑排列下的大灰藓能更高效地利用土壤中的肥料,这可能与个体间形成的小缝隙以及植株的毛细管系统有很大关系,从而使得土壤能借助水分,将更多营养输入到大灰藓内部[21]。
施肥能改变土壤的养分状况,进而影响苔藓植物的生长和养分积累[22]。有研究表明施用PK肥对泥炭地里的苔藓植物N含量影响不显著[23],本研究中PK6和PK30处理的大灰藓N含量与CK差异显著,这可能与苔藓植物种类有关,也与施肥量的多少有关。大灰藓多分布在氮浓度较高的区域[13],并且N肥与PK肥合理的搭配使用能显著增加苔藓植物的N含量[23]。本研究结果表明,大灰藓的覆盖度、绿色占比、绿值都与N元素呈显著或极显著正相关, 证明N的添加可能会更好的促进大灰藓生长。大灰藓利用NO3–-N的能力较强,并且施加NH4NO3比KNO3更有利于大灰藓对N的吸收[24],N、P、K肥的合理搭配对于后续大灰藓的施肥研究来说是值得关注的问题。有研究表明,喀斯特土生苔藓植物N含量与土壤全N含量无关,与土壤有机碳呈显著正相关[25]。本研究中的大灰藓N含量与土壤全N含量呈极显著负相关,与土壤C含量呈正相关,这种差异可能是由施肥和环境的不同而导致的。此外,有研究发现基质pH低有利于植物对磷酸盐的吸收[26],本研究表明,土壤pH与植物P和土壤全P含量分别呈显著、极显著负相关,证明土壤pH低有利于大灰藓对P的吸收。大多数苔藓植物适合的基质pH为4.2~7.2[26], 本研究表明苔藓植物覆盖度与土壤pH呈负相关,证明低pH的环境适宜大灰藓生长。
植物生长离不开光合作用,叶绿素含量可衡量光合作用的强弱、类胡萝卜素可吸收剩余光能,并且保护叶绿素和光合机能[27]。可溶性糖和可溶性蛋白是重要的光合产物[28],可为植物生长提供能量, 同时又与K+和其他无机离子一起参与渗透调节来保护细胞[29]。本研究中的大灰藓覆盖度与可溶性蛋白含量呈显著正相关,还与类胡萝卜素、叶绿素含量呈正相关,而与可溶性糖呈负相关,证明施肥是通过提高植株光合性能(类胡萝卜素和总叶绿素), 增强植物代谢(可溶性蛋白),增加能量消耗(可溶性糖)来促进大灰藓覆盖度的增长。除此之外,植株覆盖度与土壤全K含量呈极显著正相关,并与植株K含量呈正相关,这解释了为什么施K肥的植株覆盖度最大。绿色占比与可溶性蛋白、土壤全N、全P呈显著正相关,并且可溶性蛋白和叶绿素含量均与土壤全N、全P呈正相关,证明大灰藓可通过吸收土壤N、P元素来增加可溶性蛋白和叶绿素的合成,以此影响自身植株颜色。绿色占比还与植物C含量呈正相关,与土壤全C呈负相关,证明大灰藓对土壤C含量的吸收能力越强,植株颜色越绿。这些现象解释了为什么颜色的综合得分以P18处理最高。郝占庆[30]在长白山北坡森林中发现被苔藓植物覆盖的土壤P含量随苔藓植物盖度的增加而变少,而本研究表明大灰藓覆盖度与土壤和植物P含量均呈负相关, 与其研究结果相似。但是本研究表明绿色占比与植物P含量呈正相关,与土壤全P和覆盖度呈极显著正相关,并且植株绿值与土壤全P含量呈显著正相关,证明P元素对大灰藓的绿色程度有较大影响。
综上,一级分枝长度增长和二级分枝的发育是大灰藓覆盖度增加和植株绿度提高的关键。施肥对大灰藓中部和基部的分枝发育的促进作用最好,施肥能显著增加大灰藓覆盖度和植株绿度。施肥通过显著增加大灰藓光合色素和可溶性蛋白含量,显著降低植株可溶性糖含量和土壤pH来增加大灰藓覆盖度增量和植株绿度。N元素对大灰藓覆盖度和植株绿度的影响较大,施肥下的K、P元素分别对大灰藓覆盖度增长和植株绿度维持的影响最大。过磷酸钙(P肥)最有利于提高大灰藓植株绿度,硫酸钾(K肥)对大灰藓覆盖度增长的促进作用最好。综合评分下,以覆盖度为主要评判标准时,K18处理最好, 以绿色占比为主要评判标准时,P18处理最好,综合考虑覆盖度和绿色占比时,以P18处理最好。
| [1] |
CHIWA M, SHEPPARD L J, LEITH I D, et al. Long-term interactive effects of N addition with P and K availability on N status of Sphagnum[J]. Environ Pollut, 2018, 237: 468-472. DOI:10.1016/j.envpol.2018.02.076 |
| [2] |
JÄGERBRAND A K, LINDBLAD K E M, BJÖRK R G, et al. Bryophyte and lichen diversity under simulated environmental change compared with observed variation in unmanipulated alpine tundra[J]. Biodiv Conserv, 2006, 15(14): 4453-4475. DOI:10.1007/s10531-005-5098-1 |
| [3] |
VIRTANEN R, ESKELINEN A, HARRISON S. Comparing the responses of bryophytes and short-statured vascular plants to climate shifts and eutrophication[J]. Funct Ecol, 2017, 31(4): 946-954. DOI:10.1111/1365-2435.12788 |
| [4] |
OULEHLE F, ROWE E C, MYŠKA O, et al. Plant functional type affects nitrogen use efficiency in high-Arctic tundra[J]. Soil Biol Biochem, 2016, 94: 19-28. DOI:10.1016/j.soilbio.2015.11.008 |
| [5] |
OSTERTAG R, VERVILLE J H. Fertilization with nitrogen and phosphorus increases abundance of non-native species in Hawaiian montane forests[J]. Plant Ecol, 2002, 162(1): 77-90. DOI:10.1023/A:1020332824836 |
| [6] |
XIONG Y X. The Second Volume of Bryophytes in Guizhou[M]. Guiyang: Guizhou Science and Technology Press, 2014. 熊源新. 贵州苔藓植物志第二卷[M]. 贵阳: 贵州科技出版社, 2014: 320. |
| [7] |
JIANG H, HE B, LUO Q. A study of the relationship between the distribution of bryophytes and the environmental factors in Baili Azalea National Forest Park[J]. Ecol Sci, 2015, 34(4): 31-36. 江洪, 何斌, 骆强. 百里杜鹃国家森林公园苔藓植物分布及对环境因子关系研究[J]. 生态科学, 2015, 34(4): 31-36. DOI:10.14108/j.cnki.1008-8873.2015.04.006 |
| [8] |
WU Q, LU Z H, LI C N, et al. Research on the bryophytes' diversity and microhabitat in Wenjiang Park of Sichuan Province[J]. J Yunnan Agric Univ (Nat Sci), 2019, 34(3): 458-465. 伍青, 卢子豪, 李春浓, 等. 四川温江公园苔藓植物多样性及微生境调查研究[J]. 云南农业大学学报(自然科学), 2019, 34(3): 458-465. DOI:10.12101/j.issn.1004-390X(n).201712041 |
| [9] |
MA H P. Diversity and distribution of the mosses and their relationship with the environment in Sygera Mountain [D]. Xizang: Xizang University, 2019. [ 马和平. 色季拉山藓类植物多样性及其分布与环境关系的研究[D]. 拉萨: 西藏大学, 2019. |
| [10] |
LIU W C. Study on the gametophyte cultivate of medicinal bryophytes [D]. Guizhou: Guizhou University, 2009. 刘伟才. 药用苔藓植物配子体培育研究[D]. 贵州: 贵州大学, 2009. |
| [11] |
DU B M. The study on cultivation and drought resistance of Hypnum plumaeforme [D]. Hangzhou: Zhejiang A & F University, 2011. 杜宝明. 大灰藓(Hypnum plumaeforme)的栽培和抗旱性研究[D]. 杭州: 浙江农林大学, 2011. |
| [12] |
HONG C T. Study on salt tolerance of Hypnum plumaeforme [D]. Hangzhou: Zhejiang A & F University, 2015. 洪春桃. 大灰藓(Hypnum plumaeforme)的耐盐性研究[D]. 杭州: 浙江农林大学, 2015. |
| [13] |
LIU B Y, LIU W Q, LEI C Y, et al. Physiological responses of three bryophyte species of south China to simulated nitrogen deposition[J]. J Plant Ecol, 2009, 33(1): 141-149. 刘滨扬, 刘蔚秋, 雷纯义, 等. 三种苔藓植物对模拟N沉降的生理响应[J]. 植物生态学报, 2009, 33(1): 141-149. DOI:10.3773/j.issn.1005-264x.2009.01.016 |
| [14] |
QIN X C, ZHU Y, YU J J, et al. Chemical sensing in real time with plants using a Webcam[J]. Anal Chem, 2018, 90(21): 13030-13035. DOI:10.1021/acs.analchem.8b03863 |
| [15] |
LI Y G, ZHOU X B, ZHANG Y M. Moss patch size and microhabitats influence stoichiometry of moss crusts in a temperate desert, Central Asia[J]. Plant Soil, 2019, 443(1): 55-72. DOI:10.1007/s11104-019-04191-x |
| [16] |
SHI B Y, WANG X R, CHEN H M, et al. Growth and physiological responses of Plagiomnium acutum to different cultivation substrates[J]. Acta Bot Boreali-Occid Sin, 2022, 42(7): 1208-1218. 史秉洋, 王秀荣, 陈洪梅, 等. 尖叶匐灯藓对不同栽培基质的生长和生理响应[J]. 西北植物学报, 2022, 42(7): 1208-1218. DOI:10.7606/j.issn.1000-4025.2022.07.1208 |
| [17] |
LIU S Q, YANG R, PENG X D, et al. Contributions of plant litter decomposition to soil nutrients in ecological tea gardens[J]. Agriculture, 2022, 12(7): 957. DOI:10.3390/AGRICULTURE12070957 |
| [18] |
BAO Q, YANG R, NIE C J, et al. Soil nutrient characteristics of different restoration patterns in Huajiang Gorge of Guizhou karst plateau[J]. Chin J Ecol, 2017, 36(8): 2094-2102. 鲍乾, 杨瑞, 聂朝俊, 等. 贵州喀斯特高原花江峡谷区不同恢复模式的土壤养分特征[J]. 生态学杂志, 2017, 36(8): 2094-2102. DOI:10.13292/j.1000-4890.201708.032 |
| [19] |
SORENSEN P L, LETT S, MICHELSEN A. Moss-specific changes in nitrogen fixation following two decades of warming, shading, and fertilizer addition[J]. Plant Ecol, 2012, 213(4): 695-706. DOI:10.1007/s11258-012-0034-4 |
| [20] |
LEÓN C A, NEILA-PIVET M, BENÍTEZ-MORA A, et al. Effect of phosphorus and nitrogen on Sphagnum regeneration and growth: An experience from Patagonia[J]. Wetlands Ecol Manage, 2019, 27(2/3): 257-266. DOI:10.1007/s11273-019-09657-4 |
| [21] |
CHEN Q, CHE L P, LOU Y X. Study on water retention capacities of six moss species[J]. J Shanghai Norm Univ (Nat Sci), 2019, 48(5): 521-525. 陈倩, 车丽萍, 娄玉霞. 6种藓类植物保水性能的研究[J]. 上海师范大学学报(自然科学版), 2019, 48(5): 521-525. DOI:10.3969/J.ISSN.1000-5137.2019.05.009 |
| [22] |
POULIOT R, ROCHEFORT L, GAUTHIER G, et al. Moss carpets constrain the fertilizing effects of herbivores on graminoid plants in arctic polygon fens[J]. Botany, 2009, 87(12): 1209-1222. DOI:10.1139/B09-069 |
| [23] |
XING Y P, BUBIER J, MOORE T, et al. The fate of 15N-nitrate in a northern peatland impacted by long term experimental nitrogen, phosphorus and potassium fertilization[J]. Biogeochemistry, 2011, 103(1/2/3): 281-296. DOI:10.1007/s10533-010-9463-0 |
| [24] |
TAN Y, SHU T, ZHAO Y J, et al. Physiological responses of Hypnum plumaeforme to different inorganic nitrogen forms[J]. Chin J Ecol, 2012, 31(11): 2823-2827. 谭鹰, 舒婷, 赵艳君, 等. 大灰藓对硝态氮及混合态氮的生理响应[J]. 生态学杂志, 2012, 31(11): 2823-2827. DOI:10.13292/j.1000-4890.2012.0453 |
| [25] |
MENG W P, DAI Q H, REN Q Q, et al. Ecological stoichiometric characteristics of soil-moss C, N, and P in restoration stages of karst rocky desertification[J]. PLoS One, 2021, 16(6): e0252838. DOI:10.1371/JOURNAL.PONE.0252838 |
| [26] |
TYLER T, OLSSON P A. Substrate pH ranges of south Swedish bryophytes: Identifying critical pH values and richness patterns[J]. Flora, 2016, 223: 74-82. DOI:10.1016/j.flora.2016.05.006 |
| [27] |
GONG S J, MA T W, JIANG Y F, et al. Leaf cell damage and change of photosynthetic pigment contents induced by lead stress in three species of mosses[J]. Acta Bot Boreali-Occid Sin, 2009, 29(8): 1630-1636. 龚双姣, 马陶武, 姜业芳, 等. 铅胁迫对3种藓类植物细胞伤害及光合色素含量的影响[J]. 西北植物学报, 2009, 29(8): 1630-1636. DOI:10.3321/j.issn:1000-4025.2009.08.021 |
| [28] |
WU J J, TIAN Q L, TAN X, et al. Effects of combined application of N, P and K fertilizer on growth and leaf color of Cotinus coggygria[J]. Sci Silv Sin, 2021, 57(11): 179-189. 吴焦焦, 田秋玲, 谭星, 等. 氮磷钾肥配施对黄栌生长和叶片呈色的影响[J]. 林业科学, 2021, 57(11): 179-189. DOI:10.11707/j.1001-7488.20211118 |
| [29] |
YAN H K, LIU X, WANG H G, et al. Changes and relation of soluble protein, soluble sugar and potassium in low-potassium tolerant maize under low-potassium condition[J]. J Maize Sci, 2012, 20(6): 81-84. 闫洪奎, 刘祥, 王会广, 等. 低钾胁迫下耐低钾玉米可溶性蛋白、可溶性糖和钾含量的变化及其关系[J]. 玉米科学, 2012, 20(6): 81-84. DOI:10.13597/j.cnki.maize.science.2012.06.018 |
| [30] |
HAO Z Q, YE J, JIANG P, et al. Roles of bryophyte in nutrient cycling in dark coniferous forest of Changbai Mountains[J]. Chin J Appl Ecol, 2005, 16(12): 2263-2266. 郝占庆, 叶吉, 姜萍, 等. 长白山暗针叶林苔藓植物在养分循环中的作用[J]. 应用生态学报, 2005, 16(12): 2263-2266. DOI:10.13287/j.1001-9332.2005.0332 |
 2024, Vol. 32
2024, Vol. 32


