2. 中国热带农业科学院热带生物技术研究所海南省黎药资源天然产物研究与利用重点实验室, 海南热带农业资源研究院, 海南省热带农业生物资源保护与利用重点实验室, 海口 571101
2. Key Laboratory of Natural Products Research and Development of Li Folk Medicine of Hainan Province Institute of Tropical Bioscience and Biotechnology Chinese Academy of Tropical Agricultural Sciences & Key Laboratory for Biology and Genetic Resources of Tropical Crops of Hainan Province, Hainan Institute for Tropical Agricultural Resources, Haikou 571101, China
重唇石斛(Dendrobium hercoglossum)是兰科(Orchidaceae)石斛属多年生草本植物。性喜温暖潮湿环境,多生长于海拔590~1 260 m的树干上和潮湿的岩石上,在我国主要分布于海南、安徽、江西、湖南、广东、广西和云南等地[1]。石斛属植物如金钗石斛(D. nobile)、铁皮石斛(D. officinale)是重要的药用植物,具有益胃生津,滋阴清热等功效,药用价值突出。现代药理学研究表明,石斛属植物具有多种药理活性,如抗炎、抗肿瘤、抗氧化和延缓衰老,以及增强免疫力、缓解糖尿病及其并发症等[2–3]。石斛属植物次级代谢产物含有多种类型的化合物,包括生物碱类、倍半萜类、联苄类和香豆素类等[4–5]。重唇石斛作为石斛属的重要植物资源,对其次级代谢产物的研究较少,仅见报道重唇石斛含有联苄类、酚酸类和黄酮类等类型化合物[6–8]。为进一步探究石斛属植物的化学成分和活性成分, 本研究对重唇石斛地上部分乙醇提取物的乙酸乙酯萃取物进行分离纯化,并对分离得到的单体化合物进行酪氨酸酶抑制活性测试,为重唇石斛的开发利用提供理论依据,为石斛资源的保护、利用奠定基础。
1 材料和方法 1.1 材料重唇石斛于2021年3月购买于云南保山,由中国热带农业科学院热带生物技术研究所黄圣卓博士鉴定为兰科石斛属植物重唇石斛(Dendrobium hercoglossum),凭证标本(No. 20210315)保存于中国热带农业科学院热带生物技术研究所。
1.2 仪器和试剂安捷伦1260分析型高效液相色谱仪和安捷伦1260半制备型高效液相色谱仪(美国Agilent公司); Bruker AV-500型超导核磁共振仪(德国Bruker公司); 质谱仪(Bruker amazon SL公司);旋转蒸发仪(德国Heidolph Laborota公司);ELX-800酶标仪(美国Bio-Tek公司);薄层色谱硅胶板G和柱层析硅胶G (H, 200~300目, 60~80目)(青岛海洋化工厂); 凝胶Sepha-dex LH-20 (德国Merck公司), 酪氨酸、酪氨酸酶(德国Sigma-Aldrich公司)和曲酸(上海阿拉丁生化科技股份有限公司)。常规试剂均为国产AR级试剂(天津大茂、天津福晨和广州化工等),高效液相分析纯试剂(天津市康科德科技有限公司)。
1.3 提取和分离取新鲜的重唇石斛地上部分28.5 kg,粉碎后在室温下用95%的乙醇提取3次,得到711.0 g提取物, 将提取物依次经石油醚、乙酸乙酯和正丁醇萃取,分别得到石油醚萃取物37.3 g,乙酸乙酯萃取物69.6 g, 正丁醇萃取物168.5 g。取乙酸乙酯萃取物经硅胶柱色谱, 以石油醚׃乙酸乙酯[100׃1→1׃1, V/V (下同)]为洗脱剂进行洗脱,得到10个流份(Fr.1~ Fr.10)。
Fr.3 (3.8 g)经十八烷基硅烷键合硅胶柱(ODS)色谱以甲醇: 水(2:8→1:0)梯度洗脱得到9个流份(Fr.3.1~Fr.3.9),Fr.3.2 (54.3 mg)经硅胶柱色谱以石油醚: 乙酸乙酯(65:35)为洗脱剂,分离得到化合物5 (2.0 mg);Fr.3.6 (126.3 mg)经半制备高效液相色谱(C18柱,甲醇: 水=36:65洗脱;流速4 mL/min;检测波长254 nm),得到化合物4 (4.0 mg, tR=42 min);Fr.3.7 (83.6 mg)经半制备高效液相色谱(C18柱,甲醇: 水=36:65洗脱;流速4 mL/min; 检测波长254 nm),得到化合物6 (5.0 mg, tR=52 min), 剩余流份Fr.3.7.1 (32.3 mg)经硅胶柱色谱以氯仿: 甲醇(150:1)为洗脱剂,分离得到化合物7 (2.1 mg);Fr.3.8 (137.4 mg)经硅胶柱色谱以氯仿: 甲醇(150:1)为洗脱剂,分离得到化合物10 (6.7 mg)。Fr.4 (3.3 g)经ODS反相柱色谱以甲醇: 水(2:8→1:0)梯度洗脱得到14个流份(Fr.4.1~Fr.4.14),Fr.4.4 (161.7 mg)经硅胶柱色谱以氯仿׃甲醇(90:1)为洗脱剂,分离得到化合物2 (3.5 mg); Fr.4.12 (104.6 mg)经硅胶柱色谱以氯仿: 甲醇(70:1)为洗脱剂,分离得到化合物14 (2.4 mg)。Fr.5 (6.2 g)经ODS柱色谱以甲醇: 水(2:8→1:0)梯度洗脱得到15个流份(Fr.5.1~Fr.5.15),Fr.5.10 (95.3 mg)经硅胶柱色谱以氯仿: 甲醇(120:1)为洗脱剂,分离得到化合物8 (8.6 mg);Fr.5.11 (26.3 mg)经Sephadex LH-20色谱柱以甲醇为洗脱剂,分离得到化合物11 (1.0 mg)。Fr.8 (4.2 g)经ODS反相柱色谱以甲醇: 水(2:8→1:0)梯度洗脱得到13个流份(Fr.8.1~Fr.8.13),Fr.8.3 (139.1 mg)经硅胶柱色谱以氯仿: 乙酸乙酯(20:1)为洗脱剂,分离得到化合物3 (20.8 mg); Fr.8.3.1 (68.3 mg)经硅胶柱色谱以氯仿: 甲醇(300:1)为洗脱剂,分离得到化合物12 (1.7 mg)和13 (5.2 mg); Fr.8.5 (171.6 mg)使用硅胶柱色谱以氯仿: 甲醇(300:1)为洗脱剂,分离得到化合物1 (8.0 mg);Fr.8.13 (146.6 mg)经硅胶柱色谱以氯仿: 甲醇(300:1)为洗脱剂,分离得到化合物9 (18.7 mg) (图 1)。
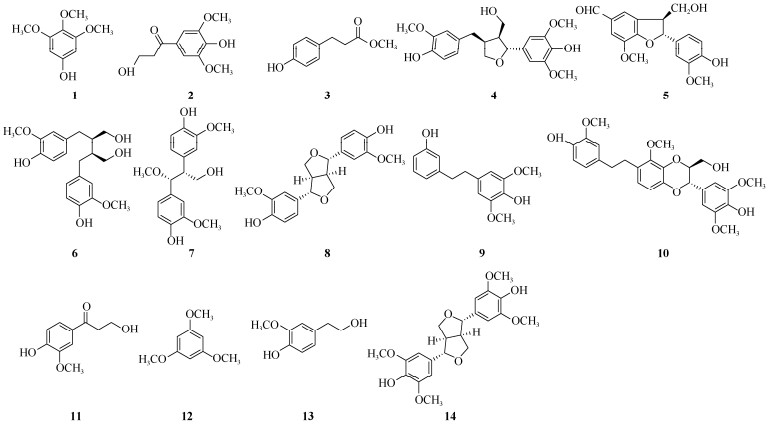
|
图 1 化合物1~14的化学结构 Fig. 1 Chemical structures of compounds 1-14 |
取130 μL溶于50 mmol/L磷酸盐缓冲液(PBS, pH=6.8)的酪氨酸酶与20 μL溶于DMSO的样品(0.031 25~1.0 mmol/L)混合后转移到96孔板中, 在37 ℃恒温培养箱中放置5 min后,待测组每孔再加50 μL 2 mmol/L酪氨酸溶液,37 ℃再次放置20 min。DMSO作为阴性对照,而PBS代替底物作为空白对照, 阳性对照为曲酸,每处理4次重复。在475 nm下用酶标仪测定每个孔的吸光度值。抑制率=[OD阴性– (OD样品–OD本底)]/(OD阴性–OD空白)×100%。
1.5 结构鉴定化合物1 黄色油状(甲醇),ESI-MS: m/z 207.06 [M + Na]+,分子式为C9H12O4。1H NMR (500 MHz, CD3OD): δH 6.08 (2H, s, H-2, 6), 3.76 (6H, s, 3, 5-OMe), 3.66 (3H, s, 4-OMe); 13C NMR (125 MHz, CD3OD): δC 155.42 (C-1), 93.9 (C-2, 6), 154.9 (C-3, 5), 132.2 (C-4), 61.3 (4-OCH3), 56.4(3, 5-OCH3)。以上数据与文献[9]报道一致,故鉴定为3, 4, 5-三甲氧基苯酚。
化合物2 无色油状(甲醇),ESI-MS: m/z 249.07 [M + Na]+,分子式为C11H14O5。1H NMR (500 MHz, CD3OD): δH 7.31 (2H, d, J = 1.7 Hz, H-2, 6), 3.94 (2H, t, J = 6.2 Hz, H-9), 3.89 (6H, s, 3, 5-OMe), 3.17 (2H, t, J = 6.2 Hz, H-8); 13C NMR (125 MHz, CD3OD): δC 129.3 (C-1), 107.3 (C-2, 6), 149.0 (C-3, 5), 142.6 (C-4), 199.7 (C-7), 41.7 (C-8), 58.9 (C-9), 56.9 (3, 5-OMe)。以上数据与文献[10]报道一致,故鉴定为3-hydroxy-1-(4-hydroxy-3, 5-di-methoxyphenyl)-propan-1-one。
化合物3 黄色油状(甲醇),ESI-MS: m/z 203.07 [M + Na]+,分子式为C10H12O3。1H NMR (500 MHz, CD3OD): δH 7.01 (2H, d, J = 8.5 Hz, H-5, 9), 6.70 (2H, d, J = 8.5 Hz, H-6, 8), 3.63 (3H, s, 9-OMe), 2.81 (2H, t, J = 7.6 Hz, H-3), 2.57 (2H, t, J = 7.6 Hz, H-2); 13C NMR (125 MHz, CD3OD): δC 175.3 (C-1), 37.0 (C-2), 31.2 (C-3), 132.7 (C-4), 130.2 (C-5, 9), 116.2 (C-6, 8), 156.8 (C-7), 51.9 (9-OMe)。以上数据与文献[11]报道一致,故鉴定为methyl 3-(p-hydro-xyphenyl) propionate。
化合物4 黄色油状(甲醇),ESI-MS: m/z 391.18 [M + H]+,分子式为C21H26O7。1H NMR (500 MHz, CD3OD): δH 6.79 (1H, d, J = 2.0 Hz, H-2), 6.71 (1H, d, J = 8.0 Hz, H-5), 6.64 (1H, dd, J = 8.0, 2.0 Hz, H-6), 6.61 (2H, s, H-2′, 6′), 4.77 (1H, d, J = 6.6 Hz, H-7′), 3.99 (1H, dd, J = 8.4, 6.4 Hz, H-9b), 3.83 (9H, s, 3, 3′, 5′-OMe), 3.73 (1H, dd, J = 8.4, 6.1 Hz, H-9a), 3.65~3.85 (2H, m, H-9′), 2.92 (1H, dd, J = 13.5, 5.0 Hz, H-7b), 2.72 (1H, m, H-8), 2.50 (1H, dd, J = 13.5, 11.1 Hz, H-7a), 2.37 (1H, m, H-8′); 13C NMR (125 MHz, CD3OD): δC 133.5 (C-1), 113.4 (C-2), 149.0 (C-3), 145.8 (C-4), 116.2 (C-5), 122.2 (C-6), 33.7 (C-7), 43.8 (C-8), 73.6 (C-9), 56.4 (3-OMe), 135.1 (C-1′), 104.2 (C-2′), 149.2 (C-3′), 135.0 (C-4′), 149.2 (C-5′), 104.2 (C-6′), 84.2 (C-7′), 54.1 (C-8′), 60.5 (C-9′), 56.8 (3′, 5′-OMe)。以上数据与文献[12]报道一致,故鉴定为justiciresinol。
化合物5 黄色油状(甲醇),ESI-MS: m/z 353.10 [M + Na]+,分子式为C18H18O6。1H NMR (500 MHz, CD3OD): δH 9.78 (1H, s, H-7′), 7.53 (1H, s, H-6′), 7.47 (1H, d, J = 1.1 Hz, H-2′), 6.95 (1H, d, J = 1.8 Hz, H-2), 6.84 (1H, dd, J = 8.5, 1.8 Hz, H-6), 6.79 (1H, d, J = 8.3 Hz, H-5), 5.67 (1H, d, J = 6.5 Hz, H-7), 3.92 (3H, s, 3′-OMe), 3.87 (2H, m, H-9), 3.83 (3H, s, 3-OMe), 3.62 (H, q, J = 6.2 Hz, H-8); 13C NMR (125 MHz, CD3OD): δC 133.6 (C-1), 110.7 (C-2), 149.0 (C-3), 147.9 (C-4), 116.3 (C-5), 119.9 (C-6), 90.6 (C-7), 54.3 (C-8), 64.5 (C-9), 56.7 (3-OMe), 132.7 (C-1′), 113.8 (C-2′), 146.3 (C-3′), 155.6 (C-4′), 131.2 (C-5′), 122.3 (C-6′), 192.7 (C-7′), 56.4 (3′-OMe)。以上数据与文献[13]报道一致,故鉴定为榕醛。
化合物6 黄色油状(甲醇),ESI-MS: m/z 385.16 [M + Na]+,分子式为C20H26O6。1H NMR (500 MHz, CD3OD): δH 6.58 (2H, d, J = 1.9 Hz, H-2, 2′), 6.54 (2H, dd, J = 7.9, 1.9 Hz, H-4, 4′), 6.65 (2H, d, J = 7.9 Hz, H-5, 5′), 3.73 (6H, s, 3, 3′-OMe), 3.58 (4H, m, H-9, 9′), 2.55 (4H, d, J = 6.9 Hz, H-7, 7′), 1.90 (2H, m, H-8, 8′); 13C NMR (125 MHz, CD3OD): δC 133.9 (C-1, 1′), 113.3 (C-2, , 2′), 148.8 (C-3, 3′), 145.5 (C-4, 4′), 115.8 (C-5, 5′), 122.7 (C-6, 6′), 36.0 (C-7, 7′), 44.1 (C-8, 8′), 62.1 (C-9, 9′), 56.2 (3, 3′-OMe)。以上数据与文献[14]报道一致,故鉴定为异落叶松脂素。
化合物7 白色油状(甲醇),ESI-MS: m/z 357.13 [M + Na]+,分子式为C18H22O6。1H NMR (500 MHz, CD3OD): δH 6.65 (1H, d, J = 8.0 Hz, H-5′), 6.61 (H, d, J = 8.0 Hz, H-5), 6.52 (1H, d, J = 1.9 Hz, H-2), 6.56 (1H, dd, J = 8.0, 1.9 Hz, H-6), 6.50 (1H, dd, J = 8.0, 1.9 Hz, H-6′), 6.48 (1H, d, J = 1.9 Hz, H-2′), 4.32 (H, d, J = 8.5 Hz, H-7), 4.06 (1H, m, H-9b), 3.91 (1H, m, H-9a), 3.72 (3H, s, 7-OMe), 3.70 (6H, d, J = 5.5 Hz, 3, 3′-OMe), 3.01 (1H, m, H-8); 13C NMR (125 MHz, CD3OD): δC 132.7 (C-1), 115.7 (C-2), 148.5 (C-3), 146.8 (C-4), 114.3 (C-5), 122.6 (C-6), 87.4 (C-7), 56.0 (C-8), 65.0 (C-9), 56.8 (3, 3′-OMe), 56.3 (7-OMe), 132.6 (C-1′), 115.5 (C-2′), 148.3 (C-3′), 146.0 (C-4′), 112.3 (C-5′), 121.5 (C-6′)。以上数据与文献[15]报道一致,故鉴定为threo-2, 3-bis-(4-hydroxy-3-methoxyphenyl)-3-methoxypropanol。
化合物8 黄色粉末(甲醇),ESI-MS: m/z 381.13 [M + Na]+,分子式为C20H22O6。1H NMR (500 MHz, CD3OD): δH 6.96 (2H, d, J = 2.0 Hz, H-2, 2′), 6.83 (2H, dd, J = 2.0, 8.0 Hz, H-6, 6′), 6.78 (2H, d, J = 8.0 Hz, H-5, 5′), 4.72 (2H, d, J = 4.0 Hz, H-7, 7′), 4.22 (2H, dd, J = 6.3, 8.9 Hz, H-9, 9′), 3.87 (6H, s, 3, 3′-OMe), 3.15 (2H, d, J = 4.1 Hz, H-8, 8′); 13C NMR (125 MHz, CD3OD): δC 133.8 (C-1, 1′), 111.0 (C-2, 2′), 149.1 (C-3, 3′), 147.3 (C-4, 4′), 116.1 (C-5, 5′), 120.0 (C-6, 6′), 87.5 (C-7, 7′), 55.4 (C-8, 8′), 72.6 (C-9, 9′), 56.4 (3, 3′-OMe)。以上数据与文献[16]报道一致,故鉴定为(+)-松脂素。
化合物9 黄色油状(甲醇),ESI-MS:m/z 297.11 [M + Na]+,分子式为C16H18O4。1H NMR (500 MHz, CD3OD): δH 7.04 (1H, t, J = 8.1 Hz, H-5′), 6.62 (1H, t, J = 7.6 Hz, H-6′), 6.57 (2H, d, J = 6.3 Hz, H-2′, 4′), 6.36 (2H, s, H-2, 6), 3.75 (6H, s, 3, 5-OMe), 2.77 (4H, s, H-a, b); 13C NMR (125 MHz, CD3OD): δC 133.9 (C-1), 106.8 (C-2, 6), 148.9 (C-3, 5), 134.6 (C-4), 56.7 (3, 5-OMe), 144.7 (C-1′), 116.6 (C-2′), 158.3 (C-3′), 113.7 (C-4′), 130.2 (C-5′), 120.9 (C-6′), 39.3 (C-b), 39.0 (C-a)。以上数据与文献[17]报道一致,故鉴定为aloifol Ⅰ。
化合物10 黄色油状(甲醇), ESI-MS: m/z 521.17 [M + Na]+,分子式为C27H30O9。1H NMR (500 MHz, CD3OD): δH 6.72 (1H, d, J = 1.8 Hz, H-2′′, 6′′), 6.70 (1H, d, J = 4.6 Hz, H-5′), 6.69 (1H, d, J = 6.6 Hz, H-2′), 6.60 (1H, dd, J = 8.1, 1.9 Hz, H-6′), 6.41 (1H, d, J = 1.8 Hz, H-2), 6.36 (1H, d, J = 1.8 Hz, H-6), 4.85 (1H, d, J = 8.2 Hz, H-7′′), 3.98~4.01 (1H, m, H-8′′), 3.92~3.95 (1H, m, H-9′′b), 3.86 (6H, s, 3′′, 5′′-OMe), 3.80 (6H, s, 5, 3′-OMe), 3.50 (1H, dd, J = 12.4, 4.5 Hz, H-9′′a), 2.77~2.80 (4H, m, H-α, α′); 13C NMR (125 MHz, CD3OD): δC 134.4 (C-1), 109.4 (C-2), 144.0 (C-3), 131.1 (C-4), 148.4 (C-5), 104.5 (C-6), 55.0 (5-OMe), 133.3 (C-1′), 109.4 (C-2′), 147.3 (C-3′), 144.2 (C-4′), 114.6 (C-5′), 120.6 (C-6′), 37.7 (C-α), 37.3 (C-α′), 127.3 (C-1′′), 104.5 (C-2′′, 6′′), 147.3 (C-3′′), 135.8 (C-4′′), 147.3 (C-5′′), 76.4 (C-7′′), 78.5 (C-8′′), 60.8 (C-9′′), 55.2 (3′-OMe), 55.4 (3′′, 5′′-OMe)。以上数据与文献[18]报道一致,故鉴定为dendrocandins T。
化合物11 无色油状(甲醇), ESI-MS: m/z 197.08 [M + H]+, 分子式为C10H12O4。1H NMR (500 MHz, CD3OD): δH 7.58 (1H, dd, J = 8.3, 2.0 Hz, H-6), 7.55 (1H, d, J = 2.0 Hz, H-2), 6.87 (1H, d, J = 8.3 Hz, H-5), 3.94 (2H, t, J = 6.2 Hz, H-9), 3.91 (3H, s, 3-OMe), 3.71 (2H, t, J = 6.2 Hz, H-8); 13C NMR (125 MHz, CD3OD): δC 130.7 (C-1), 115.8 (C-2), 149.1 (C-3), 153.4 (C-4), 112.0 (C-5), 124.7 (C-6), 199.8 (C-7), 41.7 (C-8), 59.0 (C-9), 56.4 (3-OMe)。以上数据与文献[10]报道基本一致,故鉴定为3-甲氧基-4-羟基苯丙酮。
化合物12 黄色粉末(氯仿), ESI-MS: m/z 169.09 [M + H]+,分子式为C9H12O3。1H NMR (500 MHz, CD3OD): δH 5.85 (3H, s, H-2, 4, 6), 3.82 (9H, s, 1, 3, 5-OMe); 13C NMR (125 MHz, CD3OD): δC 157.5 (C-1, 3, 5), 107.5 (C-2, 4, 6), 56.6 (1, 3, 5-OMe)。以上数据与文献[19]报道基本一致,故鉴定为1, 3, 5-三甲氧基苯。
化合物13 黄色油状(甲醇),ESI-MS: m/z 169.69 [M + H]+,分子式为C9H12O3。1H NMR (500 MHz, CD3OD): δH 6.78 (1H, d, J = 1.7 Hz, H-2), 6.70 (1H, dd, J = 8.0, 1.3 Hz, H-5), 6.64 (1H, dd, J = 8.0, 1.7 Hz, H-6), 3.82 (3H, s, 3-OMe), 3.78 (2H, t, H-8), 3.72 (2H, t, H-7); 13C NMR (125 MHz, CD3OD): δC 131.8 (C-1), 113.7 (C-2), 148.8 (C-3), 145.9 (C-4), 116.1 (C-5), 122.4 (C-6), 39.8 (C-7), 64.5 (C-8), 56.4 (3-OMe)。以上数据与文献[20]报道一致,故鉴定为香草醇。
化合物14 黄色晶体(甲醇),ESI-MS:m/z 441.15 [M + Na]+,分子式为C22H26O8。1H NMR (500 MHz, CD3OD): δH 6.66 (4H, s, H-2′, 6′, 2′′, 6′′), 4.72 (2H, dd, J = 2.5 Hz, H-2, 6), 4.27 (4H, dd, J = 8.6, 5.6 Hz, H-4, 8), 3.84 (12H, s, 2′, 5′, 2′′, 5′′-OMe), 3.15 (2H, m, H-1, 5); 13C NMR (125 MHz, CD3OD): δC 54.3 (C-1, 5), 86.1 (C-2, 6), 71.8 (C-4, 8), 132.1 (C-1′, 1′′), 102.6 (C-2′, 2′′, 6′, 6′′), 147.2 (C-3′, 5′′, 3′′, 5′′), 134.4 (C-4′, 4′′), 56.4 (3′, 5′, 3′′, 5′′-OMe)。以上数据与文献[21]报道基本一致,故鉴定为丁香脂素。
2 结果和讨论从重唇石斛地上部分的乙酸乙酯萃取物中分离鉴定了14个化合物,分别是3, 4, 5-三甲氧基苯酚(1)、3-hydroxy-1-(4-hydroxy-3, 5-dimethoxyphenyl)-propan-1-one (2)、methyl 3-(p-hydroxyphenyl) propio-nate (3)、justiciresinol (4)、榕醛(5)、异落叶松脂素(6)、threo-2, 3-bis-(4-hydroxy-3-methoxyphenyl)-3-methoxypropanol (7)、(+)-松脂素(8)、aloifol Ⅰ (9)、dendrocandin T (10)、3-甲氧基-4-羟基苯丙酮(11)、1, 3, 5-三甲氧基苯酚(12)、香草醇(13)和丁香脂素(14),其中化合物1~12、14均为首次从重唇石斛中分离得到,化合物7、10和14为首次从石斛属植物中分离得到。
对重唇石斛中的14个化合物进行酪氨酸酶抑制活性筛选,结果表明,化合物4、8和10的活性显著,IC50值均低于阳性对照曲酸[(37.22± 1.64) μmol/L],分别为(10.40±0.36)、(12.16±0.18)和(9.46±0.78) μmol/L,化合物8的酪氨酸酶抑制活性曾有报道[22],而化合物4和10的酪氨酸酶抑制活性为首次报道。
海南自然分布的石斛属植物有22种[23],石斛属植物的化学成分研究多集中于金钗石斛和铁皮石斛。本课题组已对华石斛(D. sinense)[24–25]、海南石斛(D. hainanense)[26–27]和金钗石斛[28]进行过化学成分研究。本研究分离得到的木脂素、酚酸类化合物和联苄类化合物在这3种石斛中均有发现。除以上化合物外,前人还报道菲类化合物和芴酮类化合物[24–28],但是在重唇石斛中尚未见报道。对于金钗石斛的特征性成分生物碱类,也尚未在重唇石斛中分离得到,金钗石斛味苦,重唇石斛味淡无苦味, 推测重唇石斛无苦味原因可能为生物碱类含量较少所致。这说明重唇石斛和其他石斛具有相似的化学成分,但也有差异,本研究在化学成分上为区别重唇石斛与其他石斛及其开发利用提供了理论依据。
构效关系分析表明,化合物8和14结构相似,区别仅为化合物14在C-3′和3′′比化合物8各多了1个甲氧基,推测C-3′和3′′的甲氧基取代会减弱酪氨酸酶的抑制活性。酪氨酸酶抑制剂在化妆品美白产品研发中具有重要作用,本研究从重唇石斛中发现多个具有显著活性的酪氨酸抑制剂将为重唇石斛作为美白产品的开发提供理论基础。
| [1] |
Delectis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Editta. Florae Reipublicae Popularis Sinicae[M]. Beijing: Science Press, 1999, Tomus 18: 122. 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1999, 第18卷: 122. |
| [2] |
ZHAO J R, WANG Y H, JIN Y, et al. Research advances in chemical constituents and pharmacological activities of Dendrobium plants[J]. China J Chin Mat Med, 2022, 47(9): 2358-2372. 赵菊润, 王艺涵, 金艳, 等. 石斛属植物化学成分及药理活性研究进展[J]. 中国中药杂志, 2022, 47(9): 2358-2372. DOI:10.19540/j.cnki.cjcmm.20220216.601 |
| [3] |
LINGHU C, GU R H, QIN L K. Research progress on chemical constituents and pharmacological effects of Dendrobium nobile[J]. Chin Trad Herb Drug, 2021, 52(24): 7693-7708. 令狐楚, 谷荣辉, 秦礼康. 金钗石斛的化学成分及药理作用研究进展[J]. 中草药, 2021, 52(24): 7693-7708. DOI:10.7501/j.issn.0253-2670.2021.24.032 |
| [4] |
ZHANG X Q, ZHAO T M, LIU J, et al. Advances in chemical compounds and pharmacological effects of Dendrobii caulis[J]. Chin Trad Herb Drug, 2018, 49(13): 3174-3182. 张雪琴, 赵庭梅, 刘静, 等. 石斛化学成分及药理作用研究进展[J]. 中草药, 2018, 49(13): 3174-3182. DOI:10.7501/j.issn.0253-2670.2018.13.033 |
| [5] |
WANG Z D, DAI Y F, LUO S J, et al. Research progress on chemical constituents and pharmacological effects of Dendrobium officinale[J]. W China J Pharm Sci, 2022, 37(4): 472-476. 王治丹, 代云飞, 罗尚娟, 等. 铁皮石斛化学成分及药理作用的研究进展[J]. 华西药学杂志, 2022, 37(4): 472-476. DOI:10.13375/j.cnki.wcjps.2022.04.025 |
| [6] |
CHENG L, CHEN Z Y, SHANG Z M, et al. Chemical constituents of Dendrobium hercoglossum[J]. Chin Trad Herb Drug, 2020, 51(12): 3126-3130. 成蕾, 陈志有, 尚志梅, 等. 重唇石斛化学成分研究[J]. 中草药, 2020, 51(12): 3126-3130. DOI:10.7501/j.issn.0253-2670.2020.12.002 |
| [7] |
CHENG L, FANG Y K, HE H L, et al. Two new bibenzyls from Dendrobium hercoglossum[J]. Rec Nat Prod, 2022, 16(4): 353-357. DOI:10.25135/rnp.291.2109.2198 |
| [8] |
HU L, ZHOU C J, HUANG Y C, et al. HPLC coupled with electrospray ionization multistage MS/MS and TLC analysis of flavones-C-glycosides and bibenzyl of Dendrobium hercoglossum[J]. J Sep Sci, 2020, 43(20): 3885-3901. DOI:10.1002/jssc.202000647 |
| [9] |
DE OLIVEIRA L Z, FARIAS I L G, RIGO M L, et al. Effect of Uncaria tomentosa extract on apoptosis triggered by oxaliplatin exposure on HT29 cells[J]. Evid Based Complement Alternat Med, 2014, 2014: 274786. DOI:10.1155/2014/274786 |
| [10] |
JONES L, BARTHOLOMEW B, LATIF Z, et al. Constituents of Cassia laevigata[J]. Fitoterapia, 2000, 71(5): 580-583. DOI:10.1016/S0367-326X(00)00155-6 |
| [11] |
PCOLINSKI M J, O'MATHÚNA D P, DOSKOTCH R W. Modified labdane diterpenes from Amphiachyris amoena[J]. J Nat Prod, 1995, 58(2): 209-216. DOI:10.1021/np50116a008 |
| [12] |
SUBBARAJU G V, KUMAR K K K, RAJU B L, et al. Justiciresinol, a new furanoid lignan from Justicia glauca[J]. J Nat Prod, 1991, 54(6): 1639-1641. DOI:10.1021/np50078a023 |
| [13] |
LI Y C, KUO Y H. Four new compounds, ficusal, ficusesquilignan A, B, and ficusolide diacetate from the heartwood of Ficus microcarpa[J]. Chem Pharm Bull, 2000, 48(12): 1862-1865. DOI:10.1248/cpb.48.1862 |
| [14] |
AGRAWAL P K, RASTOGI R P. Two lignans from Cedrus deodara[J]. Phytochemistry, 1982, 21(6): 1459-1461. DOI:10.1016/0031-9422(82)80172-6 |
| [15] |
ZHOU C C, HUANG X X, GAO P Y, et al. Two new compounds from Crataegus pinnatifida and their antithrombotic activities[J]. J Asian Nat Prod Res, 2014, 16(2): 169-174. DOI:10.1080/10286020.2013.848429 |
| [16] |
XU F, ZHOU C X, MO J X, et al. A new phenylethanol glycoside from Baphicacanthis cusiae Rhizoma et Radix[J]. China J Chin Mat Med, 2021, 46(18): 4749-4756. 许范, 周长新, 莫建霞, 等. 南板蓝根中1个新的苯乙醇苷类化合物[J]. 中国中药杂志, 2021, 46(18): 4749-4756. DOI:10.19540/j.cnki.cjcmm.20210429.201 |
| [17] |
JUNEJA R K, SHARMA S C, TANDON J S. Two substituted bibenzyls and a dihydrophenanthrene from Cymbidium aloifolium[J]. Phytochemistry, 1987, 26(4): 1123-1125. DOI:10.1016/S0031-9422(00)82362-6 |
| [18] |
YANG L, LIU S J, LUO H R, et al. Two new dendrocandins with neurite outgrowth-promoting activity from Dendrobium officinale[J]. J Asian Nat Prod Res, 2015, 17(2): 125-131. DOI:10.1080/10286020.2014.942294 |
| [19] |
NIU X M, LI S H, PENG L Y, et al. Constituents from Limonia crenulata[J]. J Asian Nat Prod Res, 2001, 3(4): 299-311. DOI:10.1080/10286020108040370 |
| [20] |
XU Z P, WANG Y Z, GUO Y, et al. Isolation and identification of chemical constituents in the above-ground part of the plant Achyranthes bidentata BI[J]. J Int Pharm Res, 2020, 47(6): 450-455. 徐志贫, 王彦志, 郭燕, 等. 牛膝地上部位化学成分的分离鉴定[J]. 国际药学研究杂志, 2020, 47(6): 450-455. DOI:10.13220/j.cnki.jipr.2020.06.008 |
| [21] |
CHEN C Y, WU T Y, CHANG F R, et al. Lignans and kauranes from the stems of Annona cherimola[J]. J Chin Chem Soc, 1998, 45(5): 629-634. DOI:10.1002/jccs.199800095 |
| [22] |
AZHAR-UL-HAQ, MALIK A, KHAN M T H, et al. Tyrosinase inhibitory lignans from the methanol extract of the roots of Vitex negundo Linn. and their structure-activity relationship[J]. Phytomedicine, 2006, 13(4): 255-260. DOI:10.1016/j.phymed.2004.09.001 |
| [23] |
LI D C, SONG X Q, ZHANG Z, et al. Strategies for conservation and priority monitoring of key orchid plants in Hainan Tropical Rainforest National Park[J]. J Trop Biol, 2022, 13(2): 136-148. 李大程, 宋希强, 张哲, 等. 海南热带雨林国家公园兰科植物重点保护与优先监测策略[J]. 热带生物学报, 2022, 13(2): 136-148. DOI:10.15886/j.cnki.rdswxb.2022.02.005 |
| [24] |
TAN C Y, MEI W L, ZHAO Y X, et al. Chemical constituents from Dendrobium sinense[J]. J Trop Subtrop Bot, 2017, 25(2): 189-194. 谭彩银, 梅文莉, 赵友兴, 等. 华石斛化学成分研究[J]. 热带亚热带植物学报, 2017, 25(2): 189-194. DOI:10.11926/jtsb.3668 |
| [25] |
TAN C Y. The nematicide components from Dendrobium sinense (Orchidaceae)[D]. Haikou: Hainan University, 2017. 谭彩银. 华石斛杀线虫活性成分研究[D]. 海口: 海南大学, 2017. |
| [26] |
ZHANG Y Y, SONG X Q, MEI W L, et al. Chemical constituents from Dendrobium hainanense (Orchidaceae) in Hainan[J]. J Trop Subtrop Bot, 2015, 23(3): 317-322. 张友源, 宋希强, 梅文莉, 等. 海南石斛化学成分研究[J]. 热带亚热带植物学报, 2015, 23(3): 317-322. DOI:10.11926/j.issn.1005-3395.2015.03.013 |
| [27] |
ZHANG Y Y. Chemical components and bioactivities of Dendrobium hainanense (Orchidaceae)[D]. Haikou: Hainan University, 2015. 张友源. 海南石斛化学成分及生物活性研究[D]. 海口: 海南大学, 2015. |
| [28] |
CAO X. Study on the constituents with α-glucosidase inhibitory and anti-inflammatory activities from Dendrobium nobile Lindl. [D]. Nanjing: Nanjing Agricultural University, 2020. 曹雪. 金钗石斛中α-葡萄糖苷酶抑制剂和抗炎活性成分研究[D]. 南京: 南京农业大学, 2020. |
 2024, Vol. 32
2024, Vol. 32


