2. 中国林业科学研究院林木遗传育种全国重点实验室, 北京 100091;
3. 中国林业科学研究院热带林业研究所, 国家林业和草原局热带林木培育重点实验室, 广州 510520
2. State Key Laboratory of Tree Genetics Breeding, Chinese Academy of Forestry, Beijing 100091, China;
3. Key Laboratory of State Forestry Administration on Tropical Forestry, Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China
G-box元件(CACGTG, G盒)是基因转录起始位点上游常见的顺式作用元件,能够识别G-box并与之特异性相互作用的G-box结合蛋白称为G-box结合因子(G-box-binding factor, GBF),大多数响应冷、盐、脱水、低氧等胁迫的基因启动子中都存在1个或多个G-box。GBF作为bZIP转录因子家族中的G亚族成员,在高等植物中普遍存在,通常与启动子中存在的G-box元件特异性结合,调控下游基因的表达。研究表明,当拟南芥(Arabidopsis thaliana)的GBF1富含脯氨酸的N末端结构域与异源DNA结合结构域融合时,会刺激植物原生质体中的转录[1],证实了GBF1作为转录因子的功能。bZIP转录因子广泛参与植物生长发育进程及逆境胁迫响应途径, 例如病原菌防御、种子贮藏基因表达、光形态发生和器官建成等[2]。
在拟南芥和部分单子叶植物中发现GBF1基因能够促进细胞的伸长和膨胀,同时对光诱导基因的表达有不同的调节作用[3]。在拟南芥中,GBF1能够抑制蓝光介导的下胚轴伸长,促进光形态发生过程中的子叶扩张,表明其在蓝光的光形态建成中发挥着独特的调控作用[4]。叶绿素和花青素等色素的合成与光照相关,它们通常被用作衡量光形态发生程度的指标。在拟南芥中,与野生型相比gbf1突变体积累的叶绿素水平降低[5], 验证了GBF1在光形态发生中的功能。同时,GBF1能够通过控制病原菌诱导的CAT2基因的表达影响衰老相关的过氧化氢积累,且能够正向调节PAD4基因在拟南芥中的表达和防御反应,增强植物体对细菌病原体的抗病性[6]。此外,GBF1基因还与低氧应激相关基因表达有关。研究表明,玉米(Zea mays)细胞在缺氧时, GBF1 mRNA在ADH-1 (alcohol dehydrogenase, 乙醇脱氢酶) mRNA水平增加之前迅速积累,证明GBF1能够与玉米ADH-1的低氧反应启动子结合,激活ADH-1的表达[7]。这些结论表明GBF1在植物生长发育和胁迫响应中具有重要作用,尽管如此,目前尚未有报道探究GBF1基因在木本植物中的功能。
桉树是桃金娘科(Myrtaceae)桉属(Eucalyptus)、伞房属(Corymbia)和杯果木属(Angophora)植物的统称[8],是我国南方最重要的造林树种之一,是主要的纸浆材和工业用材原料林,在我国的林业生产中具有重要地位。巨桉(Eucalyptus grandis)具有生长迅速、抗性强等优良特性,常作为杂种桉的亲本材料。前期通过对桉树初生生长到次生生长的转录组测序分析筛选出差异表达的基因EgrGBF1。为进一步验证EgrGBF1的基因功能,本研究克隆了EgrGBF1的cDNA全长,对其基本特征进行了分析,并通过实时荧光定量PCR检测EgrGBF1在不同组织和处理条件下的表达,同时构建了过表达载体,以期为后续深入探究EgrGBF1基因的功能奠定基础。
1 材料和方法 1.1 材料组织表达分析材料为巨桉(Eucalyptus grandis)无性系GL01。将组培苗移栽到温室培养6个月后,苗高约为1 m,分别采集幼苗的木质部、韧皮部+形成层、幼嫩叶片、成熟叶片、根。
选取30~40 cm高,生长状况良好且相对均一的幼苗,用0.1 mmol/L茉莉酸甲酯、0.1 mmol/L水杨酸喷洒叶片,分别在0、1、6、24和168 h后收集叶片。盐胁迫参考刘倩煜[9]的方法,配制100 mmol/L NaCl溶液,对幼苗进行灌根,在处理0、1、6、24、168 h后收集叶片。配制缺磷、缺硼的霍格兰营养液,分别培养幼苗0、6、24、48、96、504 h后收集叶片。统一采集顶端向下4~6片幼嫩全展叶片,立即放于液氮中速冻,用于RNA提取。每处理5株,所有处理均3次重复。
大肠杆菌Trans1-T1感受态细胞、pEASY-T1克隆载体购于北京全式金生物技术有限公司,KOD-Plus-NEO高保真DNA聚合酶购于上海东洋纺生物科技有限公司,限制性内切酶KpnⅠ、XbaⅠ购于大连宝生物技术有限公司,胶回收试剂盒、质粒提取试剂盒购于美国Omega Bio-Tek公司,DNase Ⅰ试剂盒购自德国凯捷(Qiagen)公司,引物合成、DNA测序由擎科生物技术有限公司(哈尔滨)完成。
1.2 总RNA的提取及cDNA第一链合成使用艾德莱德(Aidlab)植物RNA快速提取试剂盒进行总RNA提取,然后经DNase I消化基因组DNA,获得巨桉的总RNA。利用NanoDrop-one检测所提取的RNA的质量和浓度,取1 μg检测合格的总RNA,采用Invitrogen Superscript Ⅲ反转录试剂盒合成cDNA,产物置于-20 ℃冰箱保存备用。
1.3 EgrGBF1基因克隆从Phytozome13 (https://phytozome-next.jgi.doe.gov/)数据库下载巨桉EgrGBF1基因序列。以cDNA为模板,利用Primer Premier 5.0和NCBI中的Prime-BLAST在线工具设计引物(表 1),通过KOD-Plus-NEO高保真DNA聚合酶进行PCR扩增。PCR反应体系:10×KOD-Plus-NEO Buffer 5.0 μL,dNTP (10 mmol/L) 5.0 μL,MgCl2 2.0 μL,正、反向引物(10 μmol/L)各1.5 μL,cDNA模板(稀释20倍) 1.0 μL, KOD-Plus-NEO酶(5 U/μL) 1.0 μL,ddH2O补齐50.0 μL。反应程序为:95 ℃预变性5 min;然后95 ℃ 30 s→60 ℃ 30 s→72 ℃ 10 s,共35个循环;最后72 ℃延伸7 min;于16 ℃下保存。
| 表 1 所用引物 Table 1 Primers in this study |
利用Expasy Protparam tool (http://web.expasy.org/protparam/)分析并预测EgrGBF1蛋白的理化性质,利用TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0/)对EgrGBF1蛋白的跨膜结构进行预测分析,利用SignalP (http://www.cbs.dtu.dk/services/SignalP/index.php)进行信号肽预测,利用在线软件Plant-Ploc (http://www.csbio.sjtu.edu.cn/bioinf/plant/)进行亚细胞定位预测,利用SOPMA (http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对EgrGBF1蛋白的二级结构进行预测,利用InterPro (http://www.ebi.ac.uk/interpro/)对EgrGBF1蛋白的结构域进行分析,利用Phyre2 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对EgrGBF1蛋白的三级结构进行预测。在NCBI的BLASTX (http://blast.ncbi.nlm.nih.gov/)中查找不同植物的同源序列,选择相似度较高的物种,与EgrGBF1的氨基酸序列进行多序列比对,通过DNAMAN 9.0软件进行绘图, 并在MEGA 7.0软件中通过邻接法(neighbour-joining, NJ)构建系统进化树。
1.5 过表达载体构建将回收的目的片段与克隆载体pEASY-T1连接, 转化大肠杆菌。通过M13F/M13R引物进行菌液PCR检测,将菌液送测并保存于-80 ℃备用。采用限制性内切酶XbaⅠ和KpnⅠ对载体进行双酶切,之后使用T4-DNA连接酶将测序正确的目的基因连接到pROK Ⅱ过表达载体上,连接产物转化大肠杆菌,并利用PCR进行检测,对检测结果正确的菌株测序,最终使用电击转化法将重组载体转化到根癌农杆菌感受态细胞中。
1.6 EgrGBF1基因的差异表达分析选取EgrEF2为内参基因,以稀释10倍的cDNA样品为模板,利用SYBR Premix Ex Taq Ⅱ试剂盒(TaKaRa)在Light Cycler96荧光定量分析仪(Roche)中进行荧光定量分析。实时荧光定量PCR体系为: cDNA 1 μL,SYBR Premix 7.5 μL,上下游引物(表 1)各0.8 μL,加ddH2O水补至20 μL。反应程序为95 ℃预变性30 s,然后95 ℃ 5 s,60 ℃ 34 s, 共40个循环,溶解曲线程序为95 ℃ 15 s→60 ℃ 1 min→95 ℃ 15 s。采用2−∆∆CT方法计算基因相对表达量, 试验3次重复。最后利用GraphPad Prism 8和SPSS 22软件进行绘图和数据统计学分析。
2 结果和分析 2.1 EgrGBF1基因克隆和序列分析根据巨桉基因组信息,利用巨桉cDNA模板和基因特异性引物(表 1),对EgrGBF1基因进行PCR扩增。PCR产物经琼脂糖凝胶电泳检测后,切取目的DNA条带进行胶回收,并将回收产物连接于克隆载体pEASY-T1,转化大肠杆菌,对经PCR验证后的阳性菌落进行测序分析,获得EgrGBF1基因CDS序列(图 1)。经比对分析,EgrGBF1具有11个外显子(图 2: A),CDS全长984 bp,编码327个氨基酸。编码的EgrGBF1蛋白分子量约为8.23 kD, 理论等电点为5.07,不稳定系数为47.94,脂肪系数29.47,属于疏水性蛋白,不存在信号肽,蛋白质二级结构分析表明主要含有α螺旋和无规则卷曲, 其中α螺旋占26.61%,无规则卷曲占67.58% (图 2: B),且EgrGBF1蛋白主要定位于细胞核中,没有跨膜结构域区(图 2: C)。利用Phyre2在线工具对蛋白质序列进行建模,推测EgrGBF1蛋白的三维结构模型(图 2: D)。
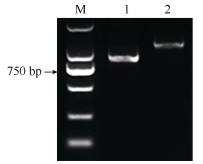
|
图 1 EgrGBF1基因的克隆。M: DL2000; 1, 2: EgrGBF1。 Fig. 1 Clone of EgrGBF1 gene. M: DL2000; 1, 2: EgrGBF1. |

|
图 2 EgrGBF1的结构(A)和EgrGBF1的二级结构(B)、跨膜结构(C)和三级结构(D)预测 Fig. 2 Gene structure (A) of EgrGBF1, and prediction of secondary structure (B), transmembrane structure (C) and tertiary structure (D) of EgrGBF1 |
在进行EgrGBF1的CDS序列扩增时,存在1条长度约为1 300 bp的扩增条带,进一步测序验证为EgrGBF1基因的新转录本,其保留了第7个内含子部分序列和完整的第10个内含子(图 2: A),并且在第10个内含子中存在1个提前终止密码子(premature termination codon, PTC)。因此将具有内含子保留的转录本命名为EgrGBF1β,其可能的CDS序列全长为1 248 bp,且在保留的第10个内含子中出现了提前终止现象,推测其不能翻译成完整的蛋白质,但也可能翻译成部分缺失的蛋白质,原有的转录本命名为EgrGBF1α。
2.2 同源性分析和系统进化树构建利用DNAMAN软件,将EgrGBF1的氨基酸序列与拟南芥、玉米、水稻(Oryza sativa)、毛果杨(Populus trichocarpa)、桃(Prunus persica)、可可(Theobroma cacao)等物种的同源序列进行比对(图 3),结果表明EgrGBF1含有高度保守的bZIP结构域,且与桃、美国山核桃(Carya illinoinensis)的GBF1蛋白的相似度分别达84.9%和84.7%。使用MEGA 7.0软件对巨桉EgrGBF1蛋白与其他植物中GBF1s蛋白的遗传进化关系进行分析,在拟南芥、毛果杨等9种植物中,巨桉的EgrGBF1和美国山核桃的GBF1亲缘关系较近(图 4)。

|
图 3 桉树与其他物种的GBF1氨基酸序列多重比对。Egr: 巨桉; At: 拟南芥; Sp: 红皮柳; Pt: 毛果杨; Ci: 美国山核桃; Cp: 番木瓜; Tc: 可可; Cs: 甜橙; Cc: 木豆; Pp: 桃树; Os: 水稻; Zm: 玉米。下同 Fig. 3 Multiple alignment of amino acid sequences of GBF1 in Eucalyptus grandis and other plants. Egr: Eucalyptus grandis; At: Arabidopsis thaliana; Sp: Sarracenia purpurea; Pt: Populus trichocarpa; Ci: Carya illinoinensis; Cp: Carica papaya; Tc: Theobroma cacao; Cs: Citrus sinensis; Cc: Cajanus cajan; Pp: Prunus persica; Os: Oryza sativa; Zm: Zea mays. The same below |

|
图 4 EgrGBF1的系统进化树 Fig. 4 Phylogenetic tree of EgrGBF1 |
以测序正确的克隆载体为模板,使用带酶切位点的正反向引物进行PCR扩增,将产物进行凝胶回收。采用酶切连接方法,用限制性内切酶XbaⅠ和KpnⅠ对pROK Ⅱ载体进行双酶切,使用T4-DNA连接酶对纯化的DNA片段和pROK Ⅱ载体进行粘性末端连接,产物转化大肠杆菌。用PCR筛选鉴定阳性单克隆并测序。将重组质粒转化农杆菌GV3101, 菌液PCR检测证实EgrGBF1α和EgrGBF1β的过表达载体已转化到农杆菌菌株中(图 5)。
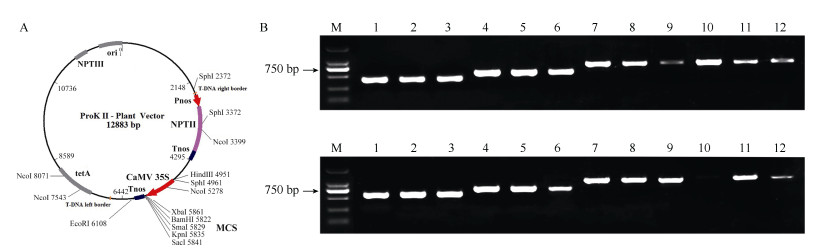
|
图 5 EgrGBF1α和EgrGBF1β过表达载体的构建。A: 过表达载体示意图; B: 过表达载体元件检测。M: DL2000; 1~3: LB; 4~6: RB; 7~9: NPT Ⅱ; 10~12: 35S。 Fig. 5 Construction of EgrGBF1α and EgrGBF1 overexpression vector. A: Schematic diagram of overexpression vectors; B: Detection of overexpression vector elements. M: DL2000; 1-3: LB; 4-6: RB; 7-9: NPT Ⅱ; 10-12: 35S. |
EgrGBF1α和EgrGBF1β在不同组织中的表达存在明显不同。EgrGBF1α主要在茎尖和成熟叶片中表达,而EgrGBF1β在韧皮部和幼叶中的表达量较高。EgrGBF1α和EgrGBF1β在根中的表达量显著低于其他部位(图 6)。
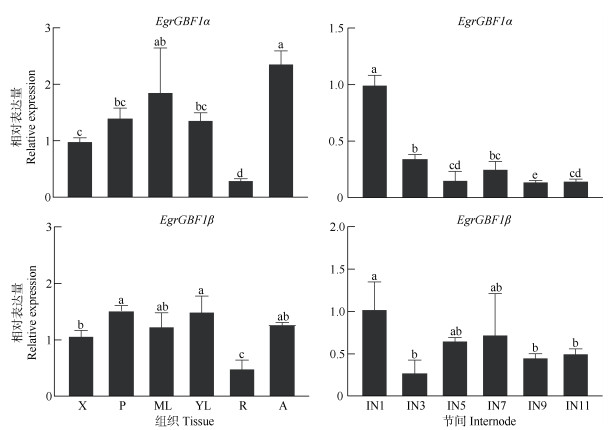
|
图 6 EgrGBF1α和EgrGBF1β在不同组织中的相对表达量。X: 木质部; P: 韧皮部; ML: 成熟叶; YL: 幼叶; R: 根; IN1~IN11: 节间1~11。柱上不同字母表示差异显著(P < 0.05)。下同 Fig. 6 Relative expression of EgrGBF1αand EgrGBF1β in different tissues. X: Xylem; P: Phloem; ML: Mature leaf; YL: Young leaf; R: Root; IN1-IN11: Internode 1-11. Different letters upon column indicate significant difference at 0.05 level. The same below |
桉树自顶端向下的不同节间代表了从初生生长到次生生长的过程,对EgrGBF1α和EgrGBF1β在不同节间的表达模式进行了分析。结果表明, EgrGBF1α和EgrGBF1β在不同节间的表达模式略有不同,EgrGBF1α在第1节间具有较高的表达,然后逐渐降低,而EgrGBF1β在第1、5和7节间的表达略高,这说明EgrGBF1α主要在桉树初生生长过程起作用或者负调控巨桉的次生生长,反映了EgrGBF1α和EgrGBF1β作用于巨桉生长发育的方式不同。
2.5 EgrGBF1α和EgrGBF1β的应激表达巨桉经NaCl处理24 h,EgrGBF1α和EgrGBF1β的表达呈现相似的变化趋势,表达量均显著降低, 说明盐胁迫抑制了EgrGBF1的表达,但盐胁迫168 h后,EgrGBF1α表达量开始上升,而EgrGBF1β表达量仍保持较低水平(图 7),说明不同的转录本响应盐胁迫的方式不同。经茉莉酸甲酯处理后,EgrGBF1α和EgrGBF1β的表达模式不同, EgrGBF1α能够快速响应,呈上升趋势,但24 h后又降低;而EgrGBF1β的表达未发生显著变化,处理168 h后,EgrGBF1α和EgrGBF1β的表达量均最高,分别为对照的4.97和1.76倍,表明EgrGBF1α和EgrGBF1β能够长时间响应茉莉酸甲酯处理。经水杨酸处理1 h,EgrGBF1α和EgrGBF1β的表达呈相反的趋势,EgrGBF1α的表达量升高,而EgrGBF1β显著降低,说明EgrGBF1β可能竞争性地参与调控EgrGBF1α响应水杨酸处理。
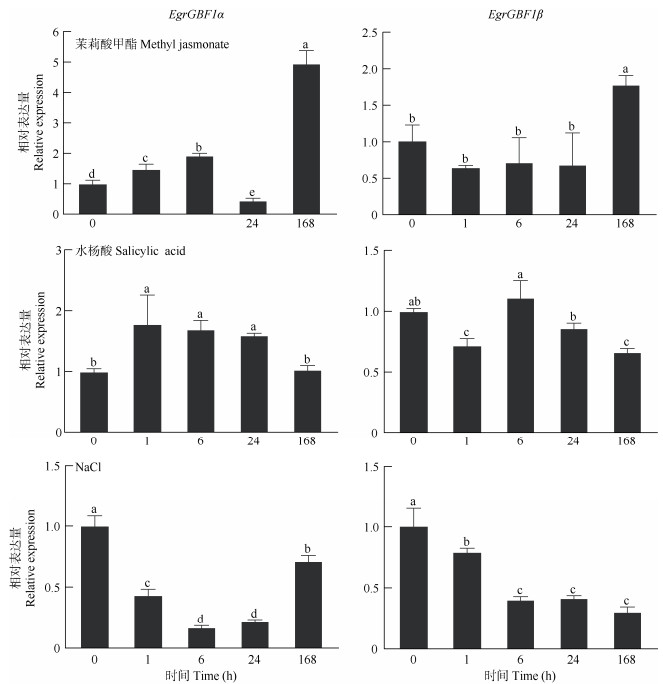
|
图 7 茉莉酸甲酯、水杨酸、NaCl处理后巨桉叶片中EgrGBF1α和EgrGBF1β的相对表达量 Fig. 7 Relative expression of EgrGBF1α and EgrGBF1β in leaves of Eucalyptus grandis treated with methyl jasmonate, salicylic acid, and NaCl |
巨桉幼苗进行缺磷、缺硼处理,以检测EgrGBF1α和EgrGBF1β对营养胁迫的响应。EgrGBF1α的表达在磷胁迫96 h后达到顶峰,长期缺磷(504 h)其表达量也稳定在较高水平,分别为对照的615.60和100.17倍;而EgrGBF1β的表达量只在磷胁迫24 h后上升为对照的4.41倍,长期胁迫与对照无显著差异(图 8),说明EgrGBF1α和EgrGBF1β在响应磷胁迫时存在完全不同的作用机制,表明EgrGBF1α在磷胁迫中发挥重要的作用,可以作为候选的转录本进行磷响应研究。EgrGBF1α和EgrGBF1β的表达模式对缺硼明显不同,处理24 h后EgrGBF1α的表达量最高,为对照的2.13倍;而EgrGBF1β在长期缺硼后(504 h)达到峰值(图 8)。这表明EgrGBF1α和EgrGBF1β分别在应对短时间和长时间的磷胁迫中发挥着重要的作用。可见,EgrGBF1的不同转录本在应对逆境胁迫时的响应方式不同,其调控途径以及调控机制存在差异。
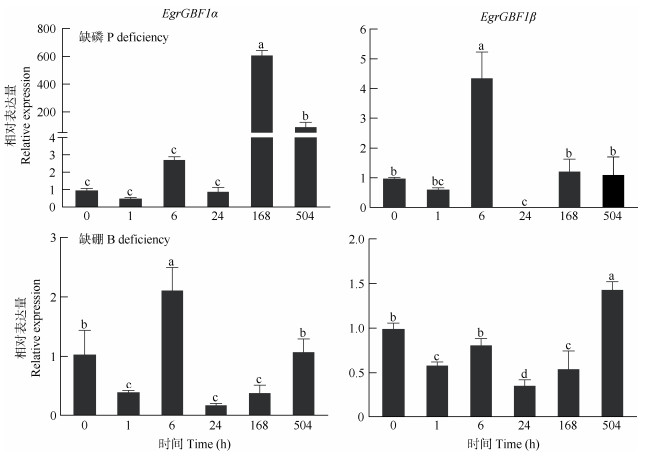
|
图 8 缺磷和缺硼对巨桉EgrGBF1α和EgrGBF1β相对表达量的影响 Fig. 8 Effects of phosphorus (P) and boron (B) deficiency on relative expression of EgrGBF1α and EgrGBF1β in leaves of Eucalyptus grandis |
本研究克隆了巨桉EgrGBF1基因, 并对其基因结构和特性进行了分析,其编码的蛋白具有典型的bZIP结构域,属于典型的bZIP转录因子,且具有高度的结构保守性。同时EgrGBF1具有2个转录本EgrGBF1α和EgrGBF1β,其中EgrGBF1β保留了第7个内含子部分序列和第10个内含子,并且出现了提前终止现象,RT-qPCR分析表明EgrGBF1α和EgrGBF1β的表达模式明显不同,说明这2个转录本可能具有不同的功能。通过构建EgrGBF1α和EgrGBF1β的过表达载体可为深入研究巨桉GBF1基因功能提供基础。
GBF1已被证明参与植物的光响应、侧根形成、病原菌防御、低氧胁迫等相关基因的表达调控等, 桉树中EgrGBF1α和EgrGBF1β在茎尖具有较高的表达水平,而bZIP转录因子参与植物的器官和组织分化[10],这表明EgrGBF1可能在桉树中有相似的功能。
水杨酸、茉莉酸甲酯等生长调节剂是植物应对生物胁迫及非生物胁迫反应的重要信号分子,外源施加水杨酸和茉莉酸甲酯能诱导多种植物对生物和非生物胁迫产生持续抗性,减缓植物对包括病原菌侵染等多种逆境胁迫的伤害[11–13]。AtGBF1能够提高植株对病原菌的防御能力。丁香假单胞菌是好氧、腐生性强的革兰氏阴性菌,所引起的植物病害发生率位居十大细菌性植物病害之首[14]。Mrunmay等[6]将菌株接种到拟南芥gbf1突变体和GBF1过表达株系中,证实GBF1能够正向调节对细菌病原体的防御,同时水杨酸在病原体感染时以较高水平累积, 茉莉酸甲酯也在植物-病原体相互作用时有较高水平的积累,在赋予对病原体的抗性方面发挥重要作用。本研究中水杨酸和茉莉酸甲酯均能促进EgrGBF1α的表达,预示桉树可以通过EgrGBF1α的表达调控水杨酸和茉莉酸甲酯途径,从而参与病原菌的防御。而EgrGBF1β的表达模式与EgrGBF1α不同,可能其以不同的方式或者通过影响EgrGBF1α的表达参与到响应水杨酸和茉莉酸甲酯途径的病原菌防御。
EgrGBF1对盐胁迫的响应说明其在非生物胁迫中也起到重要的调控作用,这与水稻受盐胁迫时调控OsGBF1表达的结果一致[15]。值得注意的是, EgrGBF1响应磷和硼胁迫,分别在处理96和504 h后达到表达高峰。缺磷时,EgrGBF1α表达量大幅度提高,推测EgrGBF1α是一个关键的响应磷缺乏的基因,可能通过调控巨桉的生长发育来应对长期缺磷的环境,这还需要进一步的研究证实。这些都证明EgrGBF1可能在非生物胁迫中起到重要的调控作用。
可变剪切能够使得同一基因在转录后产生多个转录本,进而翻译成结构和功能不同的蛋白,在植物生长过程及某些非生物胁迫响应中发挥调控作用[16]。植物次生壁合成关键的基因SND1是已知的能够激活杨树次生细胞壁生物合成的转录因子, SND1转录活性升高会导致木质化异常和生长受阻。Quanz等[17]报道毛果杨中PtrSND1存在1个内含子保留的剪接变体PtrSND1-A2IR,PtrSND1-A2IR能够与PtrSND1形成二聚体,抑制PtrMYB021基因表达,进而调控次生壁合成相关下游基因的表达,保证杨树正常的生长发育。值得注意的是,在不同胁迫处理下EgrGBF1的2个转录本EgrGBF1α和EgrGBF1β的表达模式明显不同,尤其在磷缺乏和水杨酸处理时。EgrGBF1α能够翻译成完整的蛋白,而EgrGBF1β由于内含子的保留出现提前终止密码子形成C端转录激活域缺失的蛋白质。有研究证实,GBF蛋白之间能够形成同源或异源二聚体调控不同基因的表达[18]。与PtrSND1类似,我们推测EgrGBF1β编码的功能缺失蛋白与EgrGBF1α形成异源二聚体,影响EgrGBF1α行使正常的功能,从而抑制下游基因的表达,响应磷胁迫或者水杨酸的处理。如果EgrGBF1β不能形成蛋白,则可能通过与EgrGBF1α的竞争性转录来应对不同的胁迫。
综上,本试验结果初步揭示了EgrGBF1基因在巨桉苗期的生长发育和逆境胁迫中可能发挥的作用,后续我们将构建的过表达载体对桉树进行遗传转化,以期获得相应的转基因植株,进一步明确EgrGBF1基因的功能以及不同剪接变体发挥作用的机制,同时也为探究GBF1基因在其他木本植物中的作用提供参考依据。
| [1] |
SCHINDLER U, TERZAGHI W, BECKMANN H, et al. DNA binding site preferences and transcriptional activation properties of the Arabidopsis transcription factor GBF1[J]. EMBO J, 1992, 11(4): 1275-1289. DOI:10.1002/j.1460-2075.1992.tb05171.x |
| [2] |
JAKOBY M, WEISSHAAR B, DRÖGE-LASER W, et al. bZIP transcription factors in Arabidopsis[J]. Trends Plant Sci, 2002, 7(3): 106-111. DOI:10.1016/S1360-1385(01)02223-3 |
| [3] |
GANGAPPA S N, SRIVASTAVA A K, MAURYA J P, et al. Z-box binding transcription factors (ZBFs): A new class of transcription factors in Arabidopsis seedling development[J]. Mol Plant, 2013, 6(6): 1758-1768. DOI:10.1093/mp/sst140 |
| [4] |
MALLAPPA C, YADAV V, NEGI P, et al. A basic leucine zipper transcription factor, G-box-binding factor 1, regulates blue light-mediated photomorphogenic growth in Arabidopsis[J]. J Biol Chem, 2006, 281(31): 22190-22199. DOI:10.1074/jbc.M601172200 |
| [5] |
YADAV V, MALLAPPA C, GANGAPPA S N, et al. A basic helix-loop-helix transcription factor in Arabidopsis, MYC2, acts as a repressor of blue light-mediated photomorphogenic growth[J]. Plant Cell, 2005, 17(7): 1953-1966. DOI:10.1105/tpc.105.032060 |
| [6] |
GIRI M K, SINGH N, BANDAY Z Z, et al. GBF1 differentially regulates CAT2 and PAD4 transcription to promote pathogen defense in Arabidopsis thaliana[J]. Plant J, 2017, 91(5): 802-815. DOI:10.1111/tpj.13608 |
| [7] |
DE VETTEN N C, FERL R J. Characterization of a maize G-box binding factor that is induced by hypoxia[J]. Plant J, 1995, 7(4): 589-601. DOI:10.1046/j.1365-313x.1995.7040589.x |
| [8] |
CHEN S X, ZHENG J Q, LIU X F. Hundred year histories and prospect of Eucalyptus cultivation technology development in China[J]. World For Res, 2018, 31(2): 7-12. 陈少雄, 郑嘉琪, 刘学锋. 中国桉树培育技术百年发展史与展望[J]. 世界林业研究, 2018, 31(2): 7-12. DOI:10.13348/j.cnki.sjlyyj.2018.0001.y |
| [9] |
LIU Q Y. Functional analysis of EgrBZR1 in xylem of Eucalyptus grandis[D]. Beijing: Chinese Academy of Forestry, 2018. 刘倩煜. 巨桉EgrBZR1在木质部发育中的功能分析[D]. 北京: 中国林业科学研究院, 2018. |
| [10] |
SILVEIRA A B, GAUER L, TOMAZ J P, et al. The Arabidopsis AtbZIP9 protein fused to the VP16 transcriptional activation domain alters leaf and vascular development[J]. Plant Sci, 2007, 172(6): 1148-1156. DOI:10.1016/j.plantsci.2007.03.003 |
| [11] |
BAJGUZ A, HAYAT S. Effects of brassinosteroids on the plant responses to environmental stresses[J]. Plant Physiol Biochem, 2009, 47(1): 1-8. DOI:10.1016/j.plaphy.2008.10.002 |
| [12] |
DREHER K, CALLIS J. Ubiquitin, hormones and biotic stress in plants[J]. Ann Bot, 2007, 99(5): 787-822. DOI:10.1093/aob/mcl255 |
| [13] |
SU Y F, ZHENG Q X, WU B D, et al. Effects of exogenous hormones on physiological changes of black pepper leaves after inoculation with Phytophthora capsici[J]. Mol Plant Breed, 2022, 20(1): 294-302. 苏岳峰, 郑其向, 伍宝朵, 等. 喷施外源激素对接种辣椒疫霉菌后胡椒叶片生理变化的影响[J]. 分子植物育种, 2022, 20(1): 294-302. DOI:10.13271/j.mpb.020.000294 |
| [14] |
WANG D D, WANG Q M. Research advancement of molecular biology in Pseudomonas syringae[J]. Acta Agric Boreali-Occid Sin, 2017, 26(4): 487-496. 王丹丹, 王清明. 丁香假单胞菌的分子生物学研究进展[J]. 西北农业学报, 2017, 26(4): 487-496. DOI:10.7606/j.issn.1004-1389.2017.04.001 |
| [15] |
ASHWINI N, SAJEEVAN R S, UDAYAKUMAR M, et al. Identification of splice variant of OsGBF1 in Oryza sativa ssp. indica genotypes under salinity stress[J]. 3 Biotech, 2018, 8(8): 345. DOI:10.1007/s13205-018-1370-4 |
| [16] |
LALOUM T, MARTÍN G, DUQUE P. Alternative splicing control of abiotic stress responses[J]. Trends Plant Sci, 2018, 23(2): 140-150. DOI:10.1016/j.tplants.2017.09.019 |
| [17] |
LI Q Z, LIN Y C, SUN Y H, et al. Splice variant of the SND1 transcription factor is a dominant negative of SND1 members and their regulation in Populus trichocarpa[J]. Proc Natl Acad Sci USA, 2012, 109(36): 14699-14704. DOI:10.1073/pnas.1212977109 |
| [18] |
SA Q L, LI W B, SUN Y R. Transcriptional regulation of the G-box and G-box-binding proteins in plant gene expression[J]. Plant Physiol Commun, 2003, 39(1): 89-92. 萨其拉, 李文彬, 孙勇如. G-box和G-box结合蛋白在植物基因诱导表达中的转录调控作用[J]. 植物生理学通讯, 2003, 39(1): 89-92. DOI:10.13592/j.cnki.ppj.2003.01.028 |
 2024, Vol. 32
2024, Vol. 32


