可逆的蛋白质磷酸化/去磷酸化共价修饰调节作为蛋白质的翻译后修饰方式,在参与植物生长发育、细胞周期、新陈代谢及逆境响应等方面发挥核心作用[1]。该过程由蛋白激酶与蛋白磷酸酶负责完成[1-2]。蛋白激酶催化目标蛋白的羟基基团共价修饰结合磷酸基团,根据磷酸化的氨基酸残基的不同,蛋白激酶分为Ser/Thr蛋白激酶、Tyr蛋白激酶及双特异性蛋白激酶[3]。酪蛋白激酶(casein kinase, CK)是一类在真核生物中高度保守的Ser/Thr类蛋白激酶。根据其理化性质、蛋白结构及在DEAE-纤维素柱的分离洗脱顺序分为1型和2型,即CK1和CK2[4]。CK1以单体形式存在,仅以ATP作为磷酸供体,属多基因家族。最初关于CK1的研究主要来自于酵母和动物,目前,酿酒酵母(Saccharomyces cerevisiae)鉴定并克隆到YCK1、YCK2、YCK3、HRR25等4个CK1基因,裂殖酵母(Schizosaccharomyces pombe)则包含Cki1、Cki2、Hhp1、Hhp2等4个CK1基因,参与酵母形态建成、出芽等主要代谢过程[5],而哺乳动物至少鉴定到7个CK1同工酶(α、β、γ1、γ2、γ3、δ、ε),其氨基酸长度为300~500 aa,都包含1个高度保守的激酶结构域,参与哺乳动物生物节律、细胞凋亡等重要生理过程[6]。目前对于植物CK1基因家族的鉴定与功能机制研究还较少,但已经明确植物CK1基因家族较动物多,且存在功能的冗余[7],如拟南芥(Arabidopsis thaliana)包含13个成员[8]、水稻(Oryza sativa)包含15个成员[9]。另外, 在植物中还鉴定到一类植物特有的CK1 (PS-CK1),氨基酸长度约为700 aa。第1个被报道的PS-CK1来自绿藻(Chlamydomonas reinhardtii)的MUT9p[10], 而拟南芥中鉴定到4个同源PS-CK1蛋白MLK1~MLK4 (MUT9 like kinase, MLK)[11]。有研究表明,这些PS-CK1参与植物开花节律、脂肪酸代谢、下胚轴伸长、蛋白质泛素化降解等重要生理生化过程。CK2全酶是由2个催化亚基α和2个调节亚基β构成的异源四聚体(α2β2),以ATP和GTP作为磷酸供体[12]。在酵母和哺乳动物中,催化亚基有2种异形体α、α′,分别由不同的基因编码,而植物CK2与动物存在较大差异,且α、β亚基序列相似性较小,分别属于不同的多基因家族[13]。拟南芥中鉴定到4个α亚基基因(CK2-α,包含1个叶绿体定位α亚基)、4个β亚基基因(CK2-β)[14],玉米中也鉴定到4个α亚基基因(包含2个叶绿体定位α亚基)、4个β亚基基因[15]。CK2的磷酸化底物多达300余种,参与植物细胞周期调控、光信号转导、生物钟、逆境适应等大部分生理过程。
能源植物小桐子(Jatropha curcas)为大戟科(Euphorbiaceae)麻疯树属多年生落叶灌木或小乔木。作为木本油料植物,小桐子种子含油量高达35%~60%,是加工生物柴油的优质原料[16]。小桐子是原产于热带及亚热带地区的喜温植物,低温冷害是影响小桐子地域分布、限制小桐子产业发展的主要环境因素。研究表明,脱落酸(abscisic acid, ABA)信号转导途径与蛋白激酶组成代谢网络广泛参与植物多种抗逆性如抗冷性等过程,而CK基因家族在小桐子中的鉴定及其与ABA共同参与小桐子抗冷性功能研究还未见报道。本研究基于同源序列比对的方法,在小桐子全基因组中共鉴定到CK1基因7个、PS-CK1基因5个、CK2-α基因3个、CK2-β基因2个,在此基础上,克隆了PS-CK1-5基因的全长cDNA序列,并对其进行了ABA处理下的qRT-PCR低温差异表达分析及原核细胞蛋白表达分析,为研究小桐子酪蛋白激酶的功能及参与的代谢途径奠定了基础。
1 材料和方法 1.1 材料供试小桐子(Jatropha curcas)种子采自云南省楚雄州元谋县。选取饱满的种子,用1.5% CuSO4消毒20 min,无菌水漂洗5次,于26 ℃的恒温培养箱中吸涨24 h。将吸涨的种子在无菌水中漂洗3次, 置于垫有5层无菌水湿润滤纸的白磁盘中,于26 ℃/ 20 ℃ (昼/夜)、相对湿度75%、16 h/8 h光周期的恒温培养箱中萌发5 d。将发芽的种子播种于1/2Hogland营养液的砂培白磁盘中, 在同上条件的恒温培养箱中生长14 d,每天添加1/2Hogland营养液,得到第2片真叶展开且长势一致的小桐子幼苗[17]。取幼苗(对照)叶片、根材料0.1 g置于1.5 mL离心管中, 液氮速冻后置于-80 ℃超低温冰箱中保存。将长势一致的小桐子幼苗,移栽至添加100 μmol/L ABA的1/2Hogland营养液中,对照材料继续添加1/2Hogland营养液,同时置于温度12 ℃、相对湿度75%、16 h/ 8 h光周期的低温培养箱中进行低温胁迫处理,分别于0.5、3、12、24、48 h后取叶片、根0.1 g置于1.5 mL离心管中,液氮速冻后保存于-80 ℃冰箱中用于RNA的提取。
1.2 CK基因家族的鉴定及序列分析从GenBank下载小桐子注释蛋白质数据库(v101)。基于拟南芥已经鉴定的13个CK1基因、4个PS-CK1基因、4个CK2催化亚基α基因(CK2-α)和4个CK2调节亚基β基因(CK2-β),从拟南芥TAIR数据库(https://www.arabidopsis.org/)下载对应蛋白质的氨基酸序列。通过ClustalX进行多重序列比对,利用Hmmer 3.0软件的Hmmbuild程序将比对结果生成酪蛋白激酶结构域的隐马可夫HMM模型,基于模型,利用Hmmer 3.0软件的Hmmsearch程序对小桐子蛋白质数据库进行检索(阈值E < 1e-10),经过去除重复序列,得到非冗余的小桐子酪蛋白激酶CK1、PS-CK1、CK2-α、CK2-β的氨基酸序列,同时,下载其对应的基因序列、mRNA序列。利用ProtParam工具(http://web.expasy.org/protparam/)分析蛋白的氨基酸长度、等电点(isoelectric point, pI)等参数。将鉴定到的小桐子酪蛋白激酶氨基酸序列利用ClustalX进行序列相似性比对,然后用MEGA6.0软件通过邻接法(NJ)构建系统进化树,同时,利用GenDOC软件对ClustalX比对结果进行蛋白保守结构域分析。利用在线软件GSDS (http://gsds.cbi.pku.edu.cn/)进行编码框CDS与基因序列比对以确定基因内含子与外显子的结构并绘制基因结构图。染色体定位以吴平治等[18]构建的小桐子遗传连锁图谱进行锚定。
1.3 PS-CK1-5基因的荧光定量表达分析利用TriZol试剂盒(Invitrogen公司)提取小桐子叶片、根的总RNA,并利用DNase I (TaKaRa公司)消化RNA中的残余基因组DNA, 得到纯化的总RNA。分别取3 μg总RNA,以Random primer为逆转录引物,利用PrimeScript RT Reagent Kit with gDNA Eraser (TaKaRa公司)合成第一链cDNA。以GAPDH为内参基因[19],利用Power SYBR Green PCR Master Mix (ABI公司)进行小桐子PS-CK1-5基因的实时荧光定量PCR (qPCR)表达分析,引物分别为PS-CK1-5_F1: 5′-CGATAGTGGTGGTTTGAGCG-3′,PS-CK1-5_R1: 5′-CCACCCTTACCCAACTTCCT-3′;GAPDH_F: 5′-TGAAGGACTGGAGAGGTGGA-3′,GAPDH_R: 5′-ATCAACAGTTGGAACACGGAA-3′。反应体系总体积20 μL,每样品重复3次。扩增程序为:95 ℃预变性3 min;然后95 ℃变性10 s,55 ℃退火20 s,72 ℃延伸20 s,共40个循环;之后增加溶解曲线程序:0.5 ℃增量5 s,65 ℃~95 ℃连续检测信号。以对照(CK)的表达量为基准,采用2-ΔΔCT方法计算基因相对表达量。
1.4 PS-CK1-5蛋白的诱导表达分析根据PS-CK1-5基因的mRNA序列,设计带酶切位点的全长编码框(CDS)扩增引物,引物分别为PS-CK1-5_F2: 5′-catggctgatatcggatccgaattcATGCCTGAGCTTCGCAGAGGT-3′ (下划线为EcoR I酶切位点),PS-CK1-5_R2: 5′-agtggtggtggtggtggtgctcgagGGAGACTGTCCGTCCATAGCA-3′ (下划线为Xho I酶切位点)。以叶片cDNA为模板,使用高保真DNA聚合酶KOD FX Neo DNA Polymerase (TOYOBO公司)进行PCR扩增,扩增程序为:98 ℃预变性5 min; 然后98 ℃变性10 s,60 ℃退火30 s,68 ℃延伸2 min,共30个循环;最后68 ℃延伸5 min。电泳检测PCR产物质量,扩增产物与原核表达载体pET-32a经EcoR I和Xho I双酶切,切胶回收后利用T4 DNA连接酶16 ℃过夜连接,获得重组质粒,将其转化大肠杆菌DH5α感受态细胞,涂布LB抗性(含50 mg/L的Amp)平板,37 ℃过夜培养。挑选阳性克隆经EcoR I和Xho I双酶切鉴定,送华大基因公司进行测序, 经酶切和测序验证正确的重组质粒命名为pET-32a-JcPS-CK1-5。
将构建的小桐子PS-CK1-5基因原核表达载体通过热激法转化大肠杆菌BL21 (DE3)菌株,同时转化pET-32a空质粒作为对照,挑选阳性单克隆接种至5 mL LB液体培养基中(含50 mg/L的Amp),37 ℃ 200 r/min过夜振荡培养。之后按体积比1׃100接种至100 mL LB液体培养基中(含50 mg/L的Amp), 37 ℃ 200 r/min振荡培养至OD600为0.6,取1 mL菌液至1.5 mL EP管中,4 ℃保存。之后,加入异丙基-β-d-硫代半乳糖苷(IPTG)至终浓度为1 mmol/L, 16 ℃诱导表达,分别取诱导1、3、6、12 h的菌液1 mL于4 ℃保存备用。将未诱导与诱导不同时间的菌液14 463×g离心5 min,弃上清,将菌体沉淀利用200 μL PBS缓冲液(pH值7.4)重悬浮,加入50 μL 5×SDS上样缓冲液,100 ℃煮沸10 min,冷却至室温,14 463×g离心5 min,取20 μL上清蛋白样品上样,进行SDS-PAGE电泳(5%浓缩胶,12%分离胶),考马斯亮蓝G250染色,检测蛋白质的表达情况。
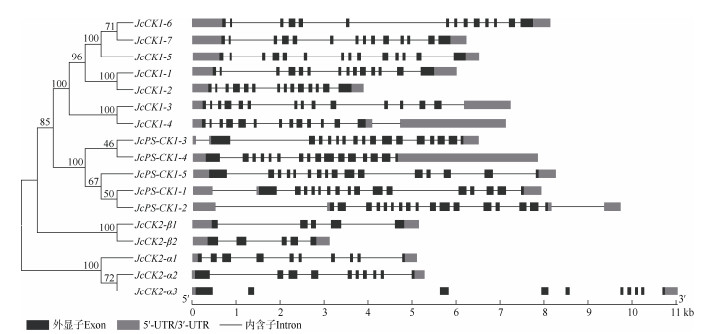
2 结果和分析 2.1 酪蛋白激酶CK基因家族的鉴定根据同源序列比对,在小桐子基因组中共鉴定到CK1基因7个、PS-CK1基因5个、CK2-α基因3个、CK2-β基因2个(表 1)。除CK2-β蛋白的等电点显酸性外,其他家族成员的蛋白等电点都显碱性。基因结构显示,各基因家族的外显子与内含子分布都有家族特异性且较为保守(图 1)。小桐子酪蛋白激酶家族基因不均匀分布于9条染色体上,其中,11号染色体最多,有5个基因。
| 表 1 小桐子酪蛋白激酶家族基因信息 Table 1 Information of casein kinase gene family from Jatropha curcas |
|
图 1 小桐子酪蛋白激酶CK家族的基因结构 Fig. 1 Gene structure of casein kinase family from Jatropha curcas |
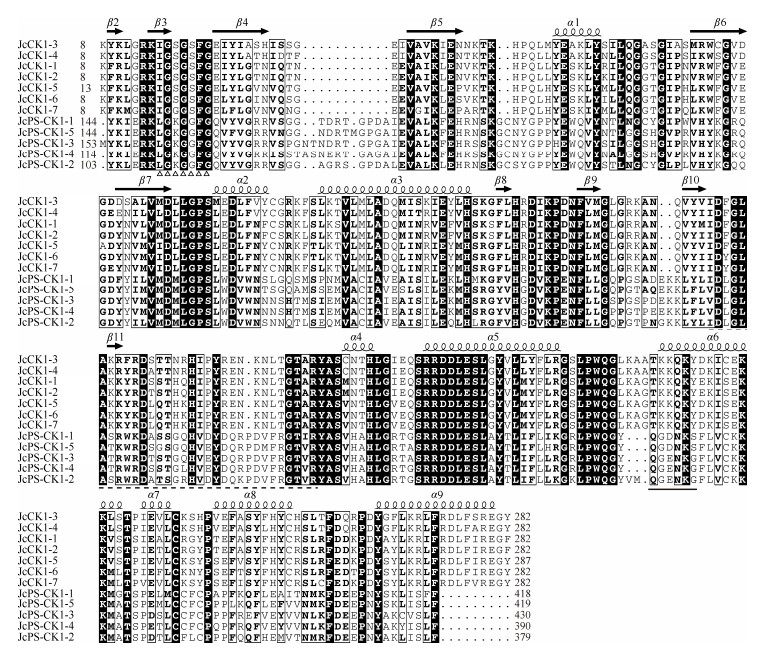
序列比对表明,小桐子酪蛋白激酶1都由1个高度保守的激酶结构域和不保守的N端、C端非催化区域组成。核心激酶结构域(Ser/Thr kinase domain) 包含约280个氨基酸残基,序列相似性为63%~92%, 多肽二级结构都包含9个α-螺旋和10个β-折叠。同时,在激酶结构域中都鉴定到典型的激酶活性环基序(A-loop)、ATP结合基序和核定位信号肽(NLS), 但小桐子CK1与PS-CK1都有自己的亚家族序列特异性。其中,ATP结合核心基序CK1亚家族都为-IGSGSFG-,而PS-CK1亚家族都为-LGKGGFG-; 核定位信号肽序列CK1亚家族都为-TKKQKY-,而PS-CK1亚家族都为-QGD/ENKS/G-。另外,小桐子植物特异性PS-CK1较CK1蛋白具有更长的N端和C端序列,同时,激酶结构域的11个保守基序之间间隔的氨基酸残基数目也更多(图 2)。
|
图 2 小桐子酪蛋白激酶1激酶结构域的多序列比对。α1~α9: α-螺旋; β2~β11: β-折叠; 下划虚线: 活性环基序(A-loop); △: ATP结合核心基序; 下划直线: 核定位信号肽。 Fig. 2 Multiple sequence alignment of casein kinase 1 domain from Jatropha curcas. α1-α9: α-helix; β2-β11: β-sheet; dash line: Kinase activation loop (A-loop); △: ATP-binding core motif; underline: Nuclear localization signal peptide. |
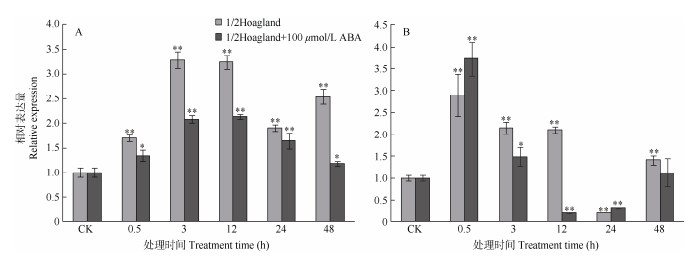
通过实时荧光定量表达分析PS-CK1-5的低温表达特性。结果表明(图 3),PS-CK1-5基因在叶片与根中都属于低温诱导基因且表现出相似的诱导表达特性,可能参与小桐子抗冷性过程。随着低温胁迫时间的持续,PS-CK1-5基因在叶片和根中的表达量都逐渐增加,分别在低温胁迫3、0.5 h时达到最大,较对照(CK)分别提高3.29和2.89倍(P < 0.01),说明PS-CK1-5基因在根中较叶片响应低温更加快速,之后表达量逐渐下降。另外,100 μmol/L ABA处理对低温胁迫下小桐子幼苗叶片和根中PS-CK1-5基因的表达存在一定的抑制作用,仅在根中低温胁迫0.5、24 h时,其表达量较未经100 μmol/L ABA处理的稍有上调。
|
图 3 小桐子PS-CK1-5基因的低温差异表达。A: 叶片; B: 根; CK: 对照; **: P < 0.01; *: P < 0.05。 Fig. 3 Differential expression of Jatropha curcas PS-CK1-5 gene under cold stress. A: Leaf; B: Root; CK: Control; **: P < 0.01; *: P < 0.05. |
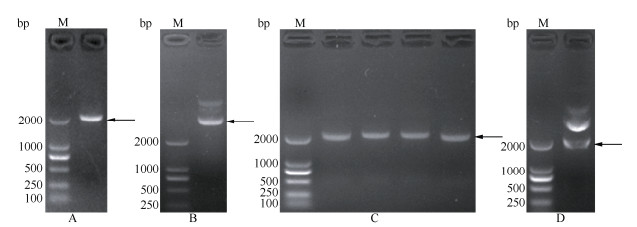
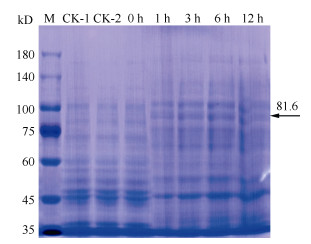
通过EcoR I与Xho I双酶切,将小桐子PS-CK1-5基因的编码框序列连接至pET-32a表达载体,构建了原核表达载体pET-32a-JcPS-CK1-5 (图 4),经过酶切与测序验证正确,未出现突变。将大肠杆菌BL21 (DE3)菌株、转pET-32a空质粒与pET-32a-JcPS-CK1-5重组载体的菌液裂解后进行SDS-PAGE表达蛋白的电泳分析(图 5)。经IPTG诱导后都出现1条约81.6 kD的蛋白条带,与理论融合蛋白的分子量一致,表明小桐子PS-CK1-5基因已经在大肠杆菌中成功表达。另外, 目的蛋白在诱导1 h后即开始表达,且其表达量在诱导6 h时达到最大。而大肠杆菌BL21(DE3)菌株(CK-1)、转pET-32a空质粒(CK-2)及转pET-32a-JcPS-CK1-5重组载体未诱导(0 h)的菌株都未出现相应条带。
|
图 4 小桐子PS-CK1-5基因的克隆及原核表达载体构建。A: 基因扩增; B: 重组质粒pET-32a-JcPS-CK1-5; C: 菌落PCR验证; D: 酶切验证; M: DNA Marker。 Fig. 4 Cloning and prokaryotic expression vector construction of PS-CK1-5 from Jatropha curcas. A: Gene amplification; B: Recombinant vector of pET-32a-JcPS-CK1-5; C: Colony PCR verification; D: Restriction enzyme digestion verification by EcoR I and Xho I; M: DNA Marker. |
|
图 5 小桐子PS-CK1-5基因大肠杆菌表达蛋白的SDS-PAGE电泳。CK-1: 大肠杆菌BL21(DE3)菌株;CK-2: 转空pET-32a表达载体;0 h、1 h、3 h、6 h、12 h表示转重组表达载体经IPTG分别诱导0、1、3、6、12 h; M: Marker。 Fig. 5 SDS-PAGE electrophoresis of Escherichia coli expression protein of Jatropha curcas PS-CK1-5 gene. CK-1: E. coil BL21(DE3) strain; CK-2: E. coil BL21(DE3) strain containing pET-32a; 0 h, 1 h, 3 h, 6 h, and 12 h indicate that E. coil BL21(DE3) strain with recombinant vector was induced by IPTG for 0, 1, 3, 6, and 12 h, respectively; M: Marker. |
由于植物CK1基因家族成员较多,且相互之间存在功能冗余,导致植物CK1的功能及磷酸化作用机制研究起步较晚。早期研究主要集中在CK1蛋白的分离纯化[20-21],Klimczak等[22]与Liu等[23]将拟南芥与水稻CK1蛋白功能的研究推进到分子与机理水平,体外表达研究表明,拟南芥AtCKI1与水稻OsCKI1都能够磷酸化酪蛋白,同时OsCKI1基因受ABA诱导上调表达[23]。研究表明,植物低温信号转导途径也主要依赖ABA诱导基因的表达,此类低温诱导基因含有ABA应答元件(ABRE),ABA通过亮氨酸拉链蛋白(bZIP)与该元件结合而调控基因的表达,另外,也可通过特异的转录因子如MYB、MYC、bZIP等,这些转录因子存在典型的DNA结合蛋白基序如bHLH、AP2等,可以与低温诱导基因的上游调控区域结合而调控其表达[24],Kim等[25]报道芝麻(Sesamum indicum)的SePS-CK1表达能够被ABA诱导,并通过磷酸化bHLH转录因子,调控油酸去饱和酶(SeFAD2)的表达,从而影响种子中脂肪酸的代谢。本研究在小桐子PS-CK1-5基因启动子中鉴定到低温响应元件,但未见ABA响应元件,同时,还鉴定到大量MYB、MYC等转录因子结合区域, 推测为小桐子PS-CK1-5基因表达的主要调控位点。小桐子属于低温敏感植物,CK1基因家族参与小桐子抗冷性及其与ABA的响应关系研究还未见报道, 根据我们课题组前期的小桐子低温转录组与数字基因表达谱数据表明,PS-CK1-5属低温诱导表达基因[26], 本研究通过qRT-PCR进行验证,也表明PS-CK1-5基因受到低温胁迫的诱导表达,与小桐子的抗冷性直接相关,但ABA对其低温胁迫下的表达却存在负调控作用,暗示PS-CK1-5基因的低温诱导表达还受到其他转录因子或信号途径如不依赖ABA信号转导途径的调节。
鉴定CK下游靶标蛋白的种类及磷酸化位点对于该激酶家族功能的分子机制研究至关重要。目前,植物CK磷酸化位点的识别主要依赖生物信息学预测,且都是基于微生物和动物CK的研究,而对于植物特异性酪蛋白激酶PS-CK1的靶标蛋白研究还鲜有报道。最早报道的绿藻PS-CK1蛋白MUT9能够磷酸化组蛋白H2A和H3,从而调控多个基因的表达[10],对应拟南芥MLKs主要通过磷酸化组蛋白H2A的Ser95促进开花生理过程[27],利用生物信息学预测小桐子PS-CK1-5的磷酸化靶标蛋白也包括组蛋白家族,与上述绿藻、拟南芥的报道一致。另外,水稻PS-CK1蛋白EL1通过磷酸化赤霉素信号途径中的负调控因子SLR1的Ser196和Ser510来调节水稻的开花时间[28],而拟南芥的AEL蛋白通过磷酸化ABA受体PYL1的Ser136和Ser182,加速其泛素化降解,从而调节种子的休眠与萌发过程[29]。这些说明PS-CK1可以磷酸化多种下游靶标转录因子,广泛参与植物整个生命周期中的代谢过程。通过STRING蛋白互作网络和NetPhos磷酸化位点分析工具鉴定小桐子PS-CK1家族的靶向目标蛋白显示,除包含模式植物拟南芥已经报道的途径外,还涉及植物形态建成、光合作用、ABA信号转导、抗逆性如抗冷性ICE-CBF途径等生理生化过程。
在小桐子全基因组中鉴定到酪蛋白激酶基因家族7个CK1基因、5个PS-CK1基因、3个CK2-α基因、2个CK2-β基因。克隆到小桐子植物特异性酪蛋白激酶PS-CK1-5基因,其在小桐子叶片与根中都受低温诱导表达,在小桐子抗冷性中发挥重要作用。构建了该基因的原核表达载体pET-32a-JcPS-CK1-5,并成功在大肠杆菌BL21(DE3)中诱导表达。
| [1] |
LUAN S. Protein phosphatases in plants[J]. Annu Rev Plant Biol, 2003, 54: 63-92. DOI:10.1146/annurev.arplant.54.031902.134743 |
| [2] |
HANKS S K, QUINN A M, HUNTER T. The protein kinase family: Conserved features and deduced phylogeny of the catalytic domains[J]. Science, 1988, 241(4861): 42-52. DOI:10.1126/science.3291115 |
| [3] |
CHUANG H C, WANG X H, TAN T H. MAP4K family kinases in immunity and inflammation[J]. Adv Immunol, 2016, 129: 277-314. DOI:10.1016/bs.ai.2015.09.006 |
| [4] |
TUAZON P T, TRAUGH J A. Casein kinase Ⅰ and Ⅱ-multipotential serine protein kinases: Structure, function, and regulation[J]. Adv Second Messenger Phosphoprotein Res, 1991, 23: 123-164. |
| [5] |
ROBINSON L C, HUBBARD E J, GRAVES P R, et al. Yeast casein kinase I homologues: An essential gene pair[J]. Proc Natl Acad Sci USA, 1992, 89(1): 28-32. DOI:10.1073/pnas.89.1.28 |
| [6] |
GROSS S D, ANDERSON R A. Casein kinase I: Spatial organization and positioning of a multifunctional protein kinase family[J]. Cell Sign, 1998, 10(10): 699-711. DOI:10.1016/s0898-6568(98)00042-4 |
| [7] |
CHEN H H, XUE H W. Casein kinase 1 in plants[J]. Chin Bull Life Sci, 2018, 30(11): 1184-1192. 陈虎辉, 薛红卫. 植物1型酪蛋白激酶的研究进展及展望[J]. 生命科学, 2018, 30(11): 1184-1192. DOI:10.13376/j.cbls/2018143 |
| [8] |
UEHARA T N, MIZUTANI Y, KUWATA K, et al. Casein kinase 1 family regulates PRR5 and TOC1 in the Arabidopsis circadian clock[J]. Proc Natl Acad Sci USA, 2019, 116(23): 11528-11536. DOI:10.1073/pnas.1903357116 |
| [9] |
KANG J M, WANG Z. Mut9p-LIKE KINASE family members: New roles of the plant-specific casein kinase I in plant growth and development[J]. Int J Mol Sci, 2020, 21(5): 1562. DOI:10.3390/ijms21051562 |
| [10] |
CASAS-MOLLANO J A, JEONG B R, XU J P, et al. The MUT9p kinase phosphorylates histone H3 threonine 3 and is necessary for heritable epigenetic silencing in Chlamydomonas[J]. Proc Natl Acad Sci USA, 2008, 105(17): 6486-6491. DOI:10.1073/pnas.0711310105 |
| [11] |
WANG Z, CASAS-MOLLANO J A, XU J P, et al. Osmotic stress induces phosphorylation of histone H3 at threonine 3 in pericentromeric regions of Arabidopsis thaliana[J]. Proc Natl Acad Sci USA, 2015, 112(27): 8487-8492. DOI:10.1073/pnas.1423325112 |
| [12] |
RIERA M, VÉLEZ-BERMÚDEZ I C, LEGNAIOLI T, et al. Specific features of plant CK2[M]// PINNA L A. Protein Kinase CK2. Ames: John Wiley & Sons, Inc., 2013. doi: 10.1002/9781118482490.ch9.
|
| [13] |
VELEZ-BERMUDEZ I C, IRAR S, CARRETERO-PAULET L, et al. Specific characteristics of CK2β regulatory subunits in plants[J]. Mol Cell Biochem, 2011, 356(1/2): 255-260. DOI:10.1007/s11010-011-0971-6 |
| [14] |
SALINAS P, FUENTES D, VIDAL E, et al. An extensive survey of CK2 α and β subunits in Arabidopsis: Multiple isoforms exhibit differential subcellular localization[J]. Plant Cell Physiol, 2006, 47(9): 1295-1308. DOI:10.1093/pcp/pcj100 |
| [15] |
PERACCHIA G, JENSEN A B, CULIÁÑEZ-MACIÀ F A, et al. Characterization, subcellular localization and nuclear targeting of casein kinase 2 from Zea mays[J]. Plant Mol Biol, 1999, 40(2): 199-211. DOI:10.1023/A:1006196530079 |
| [16] |
MAKKAR H P S, BECKER K. Jatropha curcas, a promising crop for the generation of biodiesel and value-added coproducts[J]. Eur J Lipid Sci Technol, 2009, 111(8): 773-787. DOI:10.1002/ejlt.200800244 |
| [17] |
AO P X, LI Z G, FAN D M, et al. Involvement of antioxidant defense system in chill hardening-induced chilling tolerance in Jatropha curcas seedlings[J]. Acta Physiol Plant, 2013, 35(1): 153-160. DOI:10.1007/s11738-012-1058-z |
| [18] |
WU P Z, ZHOU C P, CHENG S F, et al. Integrated genome sequence and linkage map of physic nut (Jatropha curcas L.), a biodiesel plant[J]. Plant J, 2015, 81(5): 810-821. DOI:10.1111/tpj.12761 |
| [19] |
ZHANG L, HE L L, FU Q T, et al. Selection of reliable reference genes for gene expression studies in the biofuel plant Jatropha curcas using real-time quantitative PCR[J]. Int J Mol Sci, 2013, 14(12): 24338-24354. DOI:10.3390/ijms141224338 |
| [20] |
MURRAY M G, GUILFOYLE T J, KEY J L. Isolation and preliminary characterization of a casein kinase from cauliflower nuclei[J]. Plant Physiol, 1978, 62(3): 434-437. DOI:10.1104/pp.62.3.434 |
| [21] |
KLIMCZAK L J, CASHMORE A R. Purification and characterization of casein kinase I from broccoli[J]. Biochem J, 1993, 293(1): 283-288. DOI:10.1042/bj2930283 |
| [22] |
KLIMCZAK L J, FARINI D, LIN C, et al. Multiple isoforms of Arabidopsis casein kinase I combine conserved catalytic domains with variable carboxyl-terminal extensions[J]. Plant Physiol, 1995, 109(2): 687-696. DOI:10.1104/pp.109.2.687 |
| [23] |
LIU W, XU Z H, LUO D, et al. Roles of OsCKI1, a rice casein kinase I, in root development and plant hormone sensitivity[J]. Plant J, 2003, 36(2): 189-202. DOI:10.1046/j.1365-313X.2003.01866.x |
| [24] |
KAPLAN F, KOPKA J, SUNG D Y, et al. Transcript and metabolite profiling during cold acclimation of Arabidopsis reveals an intricate relationship of cold-regulated gene expression with modifications in metabolite content[J]. Plant J, 2007, 50(6): 967-981. DOI:10.1111/j.1365-313X.2007.03100.x |
| [25] |
KIM M J, GO Y S, LEE S B, et al. Seed-expressed casein kinase I acts as a positive regulator of the SeFAD2 promoter via phosphorylation of the SebHLH transcription factor[J]. Plant Mol Biol, 2010, 73(4/5): 425-437. DOI:10.1007/s11103-010-9630-7 |
| [26] |
WANG H B, ZOU Z R, WANG S S, et al. Global analysis of transcriptome responses and gene expression profiles to cold stress of Jatropha curcas L.[J]. PLoS One, 2013, 8(12): e82817. DOI:10.1371/journal.pone.0082817 |
| [27] |
SU Y H, WANG S L, ZHANG F, et al. Phosphorylation of histone H2A at serine 95: A plant-specific mark involved in flowering time regulation and H2A.Z deposition[J]. Plant Cell, 2017, 29(9): 2197-2213. DOI:10.1105/tpc.17.00266 |
| [28] |
DAI C, XUE H W. Rice early flowering1, a CKI, phosphorylates DELLA protein SLR1 to negatively regulate gibberellin signalling[J]. EMBO J, 2010, 29(11): 1916-1927. DOI:10.1038/emboj.2010.75 |
| [29] |
CHEN H H, QU L, XU Z H, et al. EL1-like casein kinases suppress ABA signaling and responses by phosphorylating and destabilizing the ABA receptors PYR/PYLs in Arabidopsis[J]. Mol Plant, 2018, 11(5): 706-719. DOI:10.1016/j.molp.2018.02.012 |
 2024, Vol. 32
2024, Vol. 32


