2. 内江市东兴区林木野生动物保护站, 四川 内江 641199
2. Forest Wildlife Conservation Station, Dongxing District, Neijiang City, Neijiang 641199, Sichuan, China
生物量作为衡量生态系统生产力、物质循环和能量流动的重要指标[1],能够反映植物物质积累状况及其对环境资源的利用能力[2],生物量分配一直是植物生长和繁殖过程研究的热点问题[3–4]。同种植物在不同生境下的生物量分配模式常存在差异, 在胁迫生境中,如果水分、无机盐获取受限,植物倾向于将生物量分配给根系[5–6];如果光照受限, 植物倾向于将生物量分配给叶和茎[7]。对植物在不同胁迫下生物量分配模式变化的一种有效解释是最优分配理论,即植物个体生物量分配模式具有一定的灵活性,会不断调整生物量在各器官的分配以适应环境变化[8],将生物量优先分配给获取资源受限的器官[9–11]。
然而,另一种生物量分配理论——异速分配理论也在诸多研究中得到了验证[12–15]。该理论认为所有植物的生物量分配都遵循一定的异速比例规则[12, 15–16],个体大小会限制各器官生物量分配,可用幂函数Y=bXα表示(Y和X为各器官的生物量,α为异速生长指数)。Enquist等[12]通过对全球种子植物根、茎和叶生物量数据进行meta分析,提出了一个种子植物成熟个体各器官生物量的普遍分配规则:叶与茎、叶与根间的异速生长指数为3/4,根与茎间为1,而对于幼龄个体,其根系生物量与冠(非根系部分)生物量间也为1。在解释植物生物量分配方面,最优分配理论和异速分配理论并非互相排斥,而是互补的,即植物生物量分配模式是在资源和个体大小限制下共同作用的结果[11, 17–18]。目前, 对于植物生物量分配和异速生长的研究主要聚焦在非寄生植物上[5, 15, 18],一些涉及半寄生植物生物量分配的研究也多限于根寄生植物(吸器着生于寄主的根部)[19–20],而对茎寄生植物(吸器着生于寄主的茎干)生物量分配的研究相对较少[21]。
相比自养植物,半寄生植物有着独特的资源获取策略[22],它们兼具寄生生物的寄生能力和自养生物的光合能力,既能通过吸器从寄主获取水分、无机盐等营养物质,也能通过光合作用合成部分或全部有机物质[23–24]。寄生植物在营寄生生活时会降低吸器生物量的分配,从而增加个体总生物量的积累[20]。对比自养植物的根生物量分配比例,一年生根寄生植物的吸器生物量分配更低,而一些多年生草本或木本半寄生植物吸器生物量分配比例与自养植物相当[25]。同时,半寄生植物生物量的增加会显著降低寄主生物量的积累[19],严重时会造成寄主死亡[26],改变群落中寄主与非寄主的竞争平衡[27–28]。此外,寄生植物会向林下生境输入丰富的凋落物, 提升土壤肥力,增加林下草本植物生物量[29]。但目前对半寄生植物生物量的研究大多聚焦于寄生植物吸器生物量特征以及与寄主[30–31]或群落[32–33]生物量关系等方面,对于半寄生植物本身生物量分配模式以及不同生长阶段分配差异和各器官间的异速生长关系的研究相对较少。
毛叶钝果寄生(Taxillus nigrans)是西南地区典型半寄生植物,属于多年生半寄生常绿灌木,嫩枝、叶、花序和花均被毛,叶革质,中果皮具粘胶质, 植株高度达1.5 m,其寄主种类和分布范围广泛,主要通过鸟类取食传播种子完成寄生生长和繁殖,常见于城市人工林和行道树上[34]。本文对毛叶钝果寄生生物量分配模式及其异速生长特征进行研究,以期明确以下问题:1. 生物量分配模式在不同生长阶段是否一致?2. 异速生长关系是否符合异速分配理论?以进一步了解其生长发育规律和寄生特性,为其资源分配策略、寄生机制研究及防治提供理论基础。
1 材料和方法 1.1 研究区概况研究区域为成都市四川大学望江校区,地理坐标为104°4′59.5″~104°5′54.3″ E,30°37′63.2″~30°37′ 66.7″ N,海拔约480 m,属亚热带湿润气候,地形平坦,年降水量约为980 mm。年均温16.2 ℃,最热月(8月)平均温度为25.0 ℃,最冷月(1月)平均温度为5.6 ℃。乔木二球悬铃木(Platanus acerifolia)、刺槐(Robinia pseudoacacia)、水杉(Metasequoia glyptostroboides)和构树(Broussonetia papyrifera)等是毛叶钝果常见寄主[34]。
1.2 样本采集和处理鉴于寄主种类和大小会一定程度上影响寄生植物生物量分配[25],故所有毛叶钝果寄生样本均采集于成熟二球悬铃木上(胸径≥30 cm)。2018年1月, 从成熟二球悬铃木上采集80株全株个体,测量整株长度(length, L)和基径(距吸器5 cm处的寄生植物茎干直径,basal diameter, BD)。将每株寄生植物从寄主中小心剥离,对每株样本进行标号。根据生物学特性并结合植株长度将寄生植物划分为3个阶段:幼龄阶段(< 50 cm)、中龄阶段(50~100 cm)和成熟阶段(> 100 cm),样本量分别为29、30和21株)。将样本的叶、茎、吸器、果实(如果有果实)等部位分离,在烘箱中75 ℃恒温烘干,称取各器官干重计算其生物量。
1.3 生物量指标计算叶生物量(leaf biomass, LB)、茎生物量(stem biomass, SB)、吸器生物量(haustorium biomass, HB)、果实生物量(fruit biomass, FB)之和为总生物量(total biomass, TB)。叶生物量分配比例(allocation ratio of leaf biomass, ALB)=LB/TB;茎生物量分配比例(allocation ratio of stem biomass, ASB)=SB/TB;吸器生物量分配比例(allocation ratio of haustorium biomass, AHB)=HB/TB。由于毛叶钝果寄生属于半寄生灌木, 由吸器行使吸收水分、无机盐和固着等功能,故根冠比由吸器和植冠的比值(吸冠比, H/LSF)表示, H/LSF=HB/(LB+SB+FB)],作为其在“根”生物量和“植冠”生物量(shoot biomass, SHB)分配特征的反映。
1.4 数据的统计分析计算各器官生物量分配比例,对同一生长阶段各器官间以及同一器官在不同生长阶段间生物量分配比例进行单因素方差分析(One-Way ANOVA)并使用LSD法进行多重比较(显著性水平为0.05)。对总生物量和个体大小指标——长度和基径进行皮尔森相关分析,并建立线性回归方程。为明确毛叶钝果寄生各器官间及各器官与个体大小间的异速生长关系,使用幂函数方程y=bxa对其异速生长关系进行描述,a为异速生长指数,并将其对数转换为线性方程,即,lg(y)=alg(x)+lgb,其中x和y分别表示各器官生物量或总生物量,lgb表示截距,a表示斜率(生长指数)。采用标准主轴回归分析法,利用软件SMATR 2.0 (Standardized Major Axis Tests & Routines Version 2.0)计算回归斜率,比较斜率值与1的差异显著性(显著性水平α=0.05),用以判断器官间是等速生长(a=1)还是异速生长(a≠1);对叶和茎、叶和吸器以及吸器和茎之间的异速生长指数和异速分配理论的假设值进行比较,以判断其是否符合异速生长理论假设。单因素方差分析、多重比较、相关性分析和线性回归均使用SPSS 26.0完成,使用Origin 2018软件作图。
2 结果和分析 2.1 毛叶钝果寄生的生物量模型毛叶钝果寄生植株的平均长度为(77±7.1) cm, 叶、茎、吸器和果实的平均生物量分别为(42.0±8.3)、(104.0±28.1)、(12.7±20.9)和(1.2±0.4) g。分别以长度和基径为自变量,总生物量为因变量进行拟合(表 1),各拟合结果中幂回归方程模型的拟合效果最佳。
| 表 1 毛叶钝果寄生生物量回归模型 Table 1 Regression models of biomass of Taxillus nigrans |
毛叶钝果寄生不同生长阶段的平均H/LSF为0.18,叶、茎和吸器平均生物量分配比例分别为41%、45%和14%。其中,叶和茎平均生物量分配比例显著高于吸器(P=0.03),两者之和达86%。各器官生物量分配比例变异系数为34.14%~57.14%,吸器生物量分配比例的变异系数最大(57.14%),而叶生物量分配比例的变异系数最小(34.14%) (表 2)。
| 表 2 不同生长阶段的器官生物量分配比及吸冠比 Table 2 Biomass allocation ratio in leaf, stem, and haustorium and H/LSF at different growth stages |
不同生长阶段毛叶钝果寄生各器官间的生物量分配比存在显著差异(P < 0.05),生物量分配模式主要有2种:一种在幼龄阶段,生物量分配比为叶 > 茎 > 吸器(P < 0.05),即叶的生物量分配比(58%)显著高于茎和吸器,吸器生物量分配比最低(18%);另一种在中龄和成熟阶段,生物量分配比为茎 > 叶 > 吸器(P < 0.05),即茎和叶生物量分配比最高(分别为46%和65%),吸器生物量分配比最低(分别是20%和9%)(表 2, 图 1)。
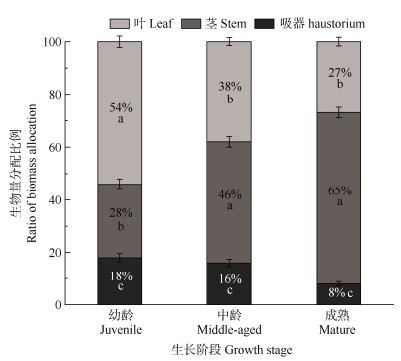
|
图 1 毛叶钝果寄生茎、叶和吸器生物量分配比例。同一柱上不同字母表示差异显著(P < 0.05)。 Fig. 1 Biomass allocation ratio of different organs of Taxillus nigrans. Different letters upon the same column indicate significant differences at 0.05 level. |
毛叶钝果寄生器官生物量分配比随植株长度增加表现出不同的变化趋势(表 2, 图 1),各器官生物量分配比在不同生长阶段间差异显著,其中叶生物量分配比(27%~54%)在幼龄阶段占比最大,随着植株长度的增加呈显著降低趋势(P < 0.05),茎生物量分配比(28%~65%)在成熟个体占比最高,随着个体的生长呈显著增加趋势(P < 0.05)。吸器生物量分配比(8%~18%)在幼龄阶段和中龄阶段间无显著差异,但均显著高于成熟阶段,整体上呈下降趋势。成熟阶段的H/LSF值(0.09)显著低于幼龄阶段(0.23) 和中龄阶段(0.20) (P < 0.05)。
2.3 毛叶钝果寄生的异速生长分析为探明毛叶钝果寄生幼龄阶段与非幼龄阶段(中龄和成熟阶段)各器官间的异速生长关系,我们对各器官生物量进行了标准主轴回归分析。在整体生长阶段,各器官生物量与总生物量间均呈显著的异速生长关系(表 3),其中,茎-总生物量异速生长指数(回归斜率)为1.169,显著大于1 (P < 0.01),且显著高于叶-总生物量、吸器-总生物量间的生长指数(P < 0.01)。叶-总生物量、吸器-总生物量拥有共同的斜率a=0.89 (P=0.363),都显著小于1 (P < 0.01)。吸器沿共同斜率呈显著的负向移动趋势(P < 0.001), 表明其吸器生物量显著低于叶生物量。
| 表 3 毛叶钝果寄生的异速生长指数及等速检验 Table 3 Allometric exponent and isometric test of Taxillus nigrans |
在非幼龄阶段(中龄和成熟阶段),不同器官间既存在异速生长关系,也存在等速生长关系(表 3, 图 2)。叶-茎异速生长(图 2: A)的斜率为0.738 (95%置信区间0.672~0.810),显著小于1 (P < 0.001),该斜率与异速分配理论中叶-茎的异速生长指数预测值0.75无显著差异(F=0.118, P=0.733)。这说明了两点:(1) 叶和茎呈现显著异速生长关系,且茎生物量增长速率大于叶的增长速率;(2) 叶与茎之间的异速生长指数,与异速分配理论对叶和茎异速生长指数预测值一致。叶-吸器(图 2: B)回归斜率为1.01 (95%置信区间0.868~1.184),与1无显著差异(P= 0.862),说明其叶和吸器生物量分配速率在生长过程中保持一致,两者间呈现等速生长关系。茎-吸器异速生长(图 2: C)斜率为0.728 (95%置信区间0.611~ 0.868), 显著小于1 (P < 0.01),吸器生物量增长速率小于茎的增长速率。
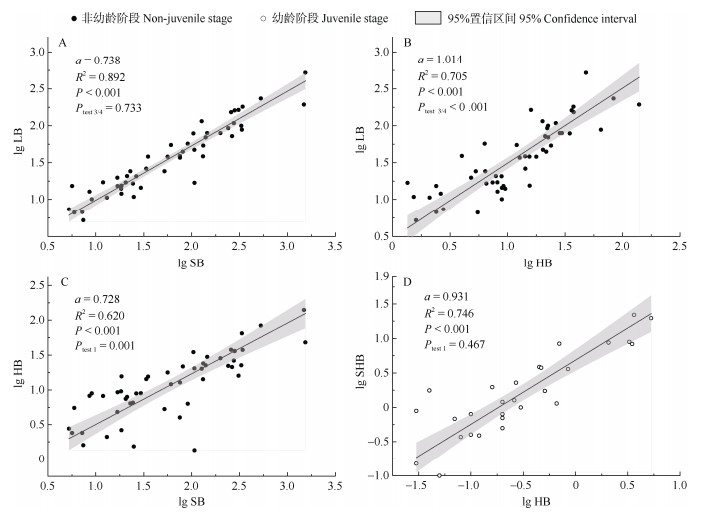
|
图 2 非幼龄阶段(A、B和C)和幼龄阶段(D)的异速生长关系。α: 斜率; Ptest 3/4, Ptest 1: 斜率分别与0.75和1的差异显著性。 Fig. 2 Allometric growth relationships at non-juvenile stage (A, B, and C) and juvenile stage (D). a: Slope; Ptest 3/4, Ptest 1: Significant difference of slope with 0.75 and 1, respectively. |
在幼龄阶段,吸器与植冠(叶、茎、果实)生物量间(图 2: D)回归斜率为0.931,与1无显著差异(P= 0.467),表明吸器与植冠之间呈等速增长,符合异速分配理论中根与冠的等速生长关系。
3 讨论和结论 3.1 不同生长阶段半寄生植物生物量分配模式毛叶钝果寄生在幼龄阶段的分配模式与中龄阶段和成熟阶段存在显著差异,而作为半寄生植物,毛叶钝果寄生兼具自养生物和寄生生物的特性,其生物量分配同样既有与自养生物的相似之处,又具寄生植物的独特性。在幼龄阶段中,叶生物量分配比例显著高于茎和吸器,其生物量分配模式为叶 > 茎 > 吸器,这种分配模式与Tanaecium tetragonolobum和Dioclea violacea等非寄生性的藤本植物在幼龄阶段生物量的分配模式一致[15],可能是生长初期的植物倾向于更多的将生物量分配到叶,以便维持较高的光合固碳能力以促进其生长[35–36]。
在中龄和成熟阶段茎生物量分配比例显著高于同阶段叶和吸器,这与灌木[37]、藤本植物[15]和乔木[15, 38]等非寄生性植物茎生物量分配特征具有一致性。一方面,对于半寄生植物而言,寄主既是它们水分、无机盐等营养物质的主要来源,同时也是它们获取光照的潜在竞争对手[22],较高的茎生物量分配比例有利于植株保持较高的光利用能力[39]。另一方面,对于植物而言,植物茎相比于叶和根有着更低的更替率[40]和更高的年增长率[41],这也可能导致了毛叶钝果寄生有着高于叶和根的茎生物量分配比例。
而半寄生植物毛叶钝果寄生在根(吸器)生物量分配方面展现了其独特性,本研究结果表明,所有生长阶段中叶生物量分配比例均高于根(吸器),这与半寄生植物Odontites vulgaris和Euphrasia minima生物量分配中叶生物量分配比高于吸器的结果一致[20],且吸器生物量在整体阶段中平均占比仅14%。同时,毛叶钝果寄生吸冠比随个体增大而显著降低,且在整体阶段均值为0.18,远低于夹竹桃(Nerium oleander)等13种非寄生性灌木的根冠比(0.46)[37],反映了半寄生植物比非寄生植物具有更低的吸器生物量分配特征[35, 37, 42]。
3.2 半寄生植物不同器官间生物量的异速生长关系本研究中,在幼龄阶段毛叶钝果寄生吸器与植冠之间呈等速生长关系,意味着吸器(根)与植冠(叶、茎和果实)同步生长和发育,符合异速分配理论对幼龄阶段的假设。这与前人[12, 16]对种子植物在幼龄阶段根冠间呈等速生长关系的研究结论一致。在非幼龄阶段,叶与茎异速生长指数与异速分配理论的预测值无显著差异,意味着该阶段茎干生物量的积累显著高于叶生物量的积累,符合异速分配理论中关于非幼龄叶和茎异速生长关系的假设。然而,在非幼龄阶段,叶与吸器间异速生长指数显著高于预测值,吸器和茎间的异速生长指数显著低于预测值,说明在此阶段茎的生长速率高于吸器,该结果不符合异速分配理论在非幼龄阶段所假设的这两个器官间呈等速生长的关系[12]。有研究表明植物在适应环境变化中器官间异速生长指数值与异速分配理论假设值不符合的结论。Poorter等[43]通过对全球1 200余种植物的分析,叶与根异速生长指数显著高于异速分配理论的预测值,茎与根异速生长指数显著高于其预测值。此外,陈国鹏等[44]对7种高寒杜鹃(Rhododendron spp.)的异速生长进行研究亦发现,高寒杜鹃叶与茎、叶与根以及茎与根之间既呈异速生长关系,也有等速生长关系,各器官间的异速生长指数与理论值也并不完全符合。
对于半寄生植物而言,这种各器官间的异速生长指数与理论值不完全符合的现象可能源自寄生植物利用吸器营寄生生活的生存策略。本研究中, 在非幼龄阶段的毛叶钝果寄生吸器生物量分配比例显著低于叶与茎,导致了其叶与吸器间的异速生长指数高于理论值,而吸器与茎之间的异速生长指数低于理论值。具体来说,可能有以下3方面原因:第一、吸器作为半寄生植物特殊的水盐获取器官, 与寄主维管系统直接连接,寄生植物利用叶片较高的蒸腾速率通过吸器从寄主获取水分和无机盐等营养物质[45],无需像非寄生植物通过增加根系来寻觅营养物质,因此不必在吸器上分配更多生物量。Matthies[19]对兼性半寄生植物Rhinanthus serotinus的研究也表明,在营寄生生活时其吸器生物量分配比例显著低于营非寄生生活时根生物量分配比例。第二、半寄生植物一定程度上会受到寄主枝条和叶片的遮蔽,Ma等[34]报道在侧枝外侧的半寄生植物其枝条更长,且基径更粗,为了获得充足光照,可能会增加对茎叶生物量的分配。第三、寄主能感知寄生植物的入侵而建立防御机制,会一定程度上抑制寄生植物吸器在其体内的发育[46–47]。
综上,寄生于同种寄主的半寄生植物毛叶钝果寄生在幼龄和非幼龄阶段生物量分配模式不同,在幼龄阶段,其生物量分配比例为叶(54%) > 茎(28%) > 吸器(18%),非幼龄阶段(中龄和成熟阶段)为茎 > 叶 > 吸器。幼龄阶段分配更多资源至叶以应对营养供应限制;在中龄和成熟阶段,更多的生物量分配到茎有利于竞争获取更多光资源,符合最优分配理论。随个体生长,毛叶钝果寄生叶和吸器生物量的分配比例趋于降低,茎生物量分配比例趋于升高。幼龄阶段毛叶钝果寄生吸器和植冠(叶、茎和果实)间呈等速生长关系,非幼龄阶段叶和茎之间异速生长指数与异速分配理论的预测值无显著差异。叶与吸器间、吸器与茎间的异速生长关系由于受到半寄生植物吸器生物量分配比例较低的特性影响,其异速生长指数并不符合异速分配理论。本研究有助于进一步理解半寄生植物的生长发育特征和生存策略,但对于半寄生植物在繁殖器官(花和果实)上的生物量分配规律还有待更进一步深入研究。
| [1] |
LI L, LI Y B, MA Q H, et al. Aboveground biomass modeling and allometric growth characteristics of Artemisia capillaris Thunb. under different water availabilities[J]. Chin J Ecol, 2020, 39(1): 337-348. 李浪, 李义博, 马全会, 等. 水分驱动下茵陈蒿(Artemisia capillaris Thunb.)地上生物量模型与异速生长特征[J]. 生态学杂志, 2020, 39(1): 337-348. DOI:10.13292/j.1000-4890.202001.001 |
| [2] |
HOVENDEN M J, NEWTON P C, WILLS K E. Seasonal not annual rainfall determines grassland biomass response to carbon dioxide[J]. Nature, 2014, 511(7511): 583-586. DOI:10.1038/nature13281 |
| [3] |
MÜLLER I, SCHMID B, WEINER J. The effect of nutrient availability on biomass allocation patterns in 27 species of herbaceous plants[J]. Persp Plant Ecol Evol Syst, 2000, 3(2): 115-127. DOI:10.1078/1433-8319-00007 |
| [4] |
MCCARTHY M C, ENQUIST B J, KERKHOFF A J. Organ partitioning and distribution across the seed plants: Assessing the relative importance of phylogeny and function[J]. Int J Plant Sci, 2007, 168(5): 751-761. DOI:10.1086/513491 |
| [5] |
ROA-FUENTES L L, CAMPO J, PARRA-TABLA V. Plant biomass allocation across a precipitation gradient: An approach to seasonally dry tropical forest at Yucatan, Mexico[J]. Ecosystems, 2012, 15(8): 1234-1244. DOI:10.1007/s10021-012-9578-3 |
| [6] |
WANG X M, YAN B G, SHI L T, et al. Different responses of biomass allocation and leaf traits of Dodonaea viscosa to concentrations of nitrogen and phosphorus[J]. Chin J Plant Ecol, 2020, 44(12): 1247-1261. 王雪梅, 闫帮国, 史亮涛, 等. 车桑子幼苗生物量分配与叶性状对氮磷浓度的响应差异[J]. 植物生态学报, 2020, 44(12): 1247-1261. DOI:10.17521/cjpe.2020.0199 |
| [7] |
XUE Q, CHEN B, YANG X M, et al. Biomass allocation, water use characteristics, and photosynthetic light response of four Commelinaceae plants under different light intensities[J]. Acta Pratacul Sin, 2022, 31(1): 69-80. 薛晴, 陈斌, 杨小梅, 等. 不同光强下4种鸭跖草科植物的生物量分配、水分生理及光响应特征[J]. 草业学报, 2022, 31(1): 69-80. DOI:10.11686/cyxb2021250 |
| [8] |
LI Y Q, SUN J W, LI J F, et al. Biomass allocation and its allometric growth of Pinus yunnanensis seedlings of different families[J]. J Beijing For Univ, 2021, 43(8): 18-28. 李亚麒, 孙继伟, 李江飞, 等. 云南松不同家系苗木生物量分配及其异速生长[J]. 北京林业大学学报, 2021, 43(8): 18-28. DOI:10.12171/j.1000-1522.20200142 |
| [9] |
THORNLEY J H. Balanced quantitative model for root-shoot ratios in vegetative plants[J]. Ann Bot, 1972, 36(145): 431-441. DOI:10.1093/oxfordjournals.aob.a084602 |
| [10] |
BLOOM A J, CHAPIN F S, MOONEY H A. Resource limitation in plants: An economic analogy[J]. Ann Rev Ecol System, 1985, 16(1): 363-392. DOI:10.1146/annurev.es.16.110185.002051 |
| [11] |
MCCARTHY M C, ENQUIST B J. Consistency between an allometric approach and optimal partitioning theory in global patterns of plant biomass allocation[J]. Funct Ecol, 2007, 21(4): 713-720. DOI:10.1111/j.1365-2435.2007.01276.x |
| [12] |
ENQUIST B J, NIKLAS K J. Global allocation rules for patterns of biomass partitioning in seed plants[J]. Science, 2002, 295(5559): 1517-1520. DOI:10.1126/science.1066360 |
| [13] |
CHENG D L, NIKLAS K J. Above- and below-ground biomass relationships across 1534 forested communities[J]. Ann Bot, 2007, 99(1): 95-102. DOI:10.1093/aob/mcl206 |
| [14] |
LIU R, YANG X J, GAO R R, et al. Allometry rather than abiotic drivers explains biomass allocation among leaves, stems and roots of Artemisia across a large environmental gradient in China[J]. J Ecol, 2021, 109(2): 1026-1040. DOI:10.1111/1365-2745.13532 |
| [15] |
SMITH-MARTIN C M, XU X T, MEDVIGY D, et al. Allometric scaling laws linking biomass and rooting depth vary across ontogeny and functional groups in tropical dry forest lianas and trees[J]. New Phytol, 2020, 226(3): 714-726. DOI:10.1111/nph.16275 |
| [16] |
NIKLAS K J, ENQUIST B J. Canonical rules for plant organ biomass partitioning and annual allocation[J]. Am J Bot, 2002, 89(5): 812-819. DOI:10.3732/ajb.89.5.812 |
| [17] |
GEDROC J J, MCCONNAUGHAY K D M, COLEMAN J S. Plasticity in root shoot partitioning: Optimal, ontogenetic, or both?[J]. Funct Ecol, 1996, 10(1): 44-50. DOI:10.2307/2390260 |
| [18] |
SKARPAAS O, MEINERI E, BARGMANN T, et al. Biomass partitioning in grassland plants along independent gradients in temperature and precipitation[J]. Persp Plant Ecol Evol Syst, 2016, 19(19): 1-11. DOI:10.1016/j.ppees.2016.01.006 |
| [19] |
MATTHIES D. Parasitic and competitive interactions between the hemiparasites Rhinanthus serotinus and Odontites rubra and their host Medicago sativa[J]. J Ecol, 1995, 83(2): 245-251. DOI:10.2307/2261563 |
| [20] |
MATTHIES D. Influence of the host on growth and biomass allocation in the two facultative root hemiparasites Odontites vulgaris and Euphrasia minima[J]. Flora, 1998, 193(2): 187-193. DOI:10.1016/s0367-2530(17)30838-1 |
| [21] |
NDAGURWA H G T, MUTIRWARA W, NCUBE S F, et al. Estimating mistletoe biomass in a semi-arid savanna woodland, southwest Zimbabwe[J]. Acta Oecol, 2022, 117: 103849. DOI:10.1016/j.actao.2022.103849 |
| [22] |
TĚŠITEL J, PLAVCOVA L, CAMERON D D. Interactions between hemiparasitic plants and their hosts: The importance of organic carbon transfer[J]. Plant Signal Behav, 2010, 5(9): 1072-1076. DOI:10.4161/psb.5.9.12563 |
| [23] |
PRESS M C, PHOENIX G K. Impacts of parasitic plants on natural communities[J]. New Phytol, 2005, 166(3): 737-751. DOI:10.1111/j.1469-8137.2005.01358.x |
| [24] |
TĚŠITEL J. Functional biology of parasitic plants: A review[J]. Plant Ecol Evol, 2016, 149(1): 5-20. DOI:10.5091/plecevo.2016.1097 |
| [25] |
MATTHIES D. Interactions between a root hemiparasite and 27 different hosts: Growth, biomass allocation and plant architecture[J]. Perspect Plant Ecol Evol Syst, 2017, 24: 118-137. DOI:10.1016/j.ppees.2016.12.006 |
| [26] |
GODFREE R C, TINNIN R O, FORBES R B. Relationships between Arceuthobium americanum and the structure of Pinus contorta var. murrayana stands in central Oregon[J]. Plant Ecol, 2003, 165(1): 69-84. DOI:10.1023/a:1021598712920 |
| [27] |
GIBSON C C, WATKINSON A R. Host selectivity and the mediation of competition by the root hemiparasite Rhinanthus minor[J]. Oecologia, 1991, 86(1): 81-87. DOI:10.1007/bf00317393 |
| [28] |
CALLAWAY R M, PENNINGS S C. Impact of a parasitic plant on the zonation of two salt marsh perennials[J]. Oecologia, 1998, 114(1): 100-105. DOI:10.1007/s004420050425 |
| [29] |
NDAGURWA H G T, NDAREVANI P, MUVENGWI J, et al. Mistletoes via input of nutrient-rich litter increases nutrient supply and enhance plant species composition and growth in a semi-arid savanna, southwest Zimbabwe[J]. Plant Ecol, 2016, 217(9): 1095-1104. DOI:10.1007/s11258-016-0635-4 |
| [30] |
WU Y, ZHEN L, CUI X S, et al. Influence on biomass and carbohydrate in Nitraria tangutorum Bobr. when it parasitized by Cynomorium songaricum[J]. J China Agric Univ, 2012, 17(4): 53-57. 吴艳, 郑雷, 崔旭盛, 等. 锁阳寄生对白刺生物量及碳水化合物影响研究[J]. 中国农业大学学报, 2012, 17(4): 53-57. DOI:10.11841/j.issn.1007-4333.2012.04.009 |
| [31] |
FERNANDEZ-APARICIO M, FLORES F, RUBIALES D. The Effect of Orobanche crenata infection severity in faba bean, field pea, and grass pea productivity[J]. Front Plant Sci, 2016, 7: 1409. DOI:10.3389/fpls.2016.01409 |
| [32] |
MARVIER M A. Parasite impacts on host communities: Plant parasitism in a California coastal prairie[J]. Ecology, 1998, 79(8): 2616-2623. DOI:10.2307/176505 |
| [33] |
AMELOOT E, VERHEYEN K, HERMY M. Meta-analysis of standing crop reduction by Rhinanthus spp. and its effect on vegetation structure[J]. Folia Geobot, 2005, 40(2): 289-310. DOI:10.1007/bf02803241 |
| [34] |
MA R, MIAO N, ZHANG H X, et al. Generalist mistletoes and their hosts and potential hosts in an urban area in southwest China[J]. Urban For Urban Gree, 2020, 53: 126717. DOI:10.1016/j.ufug.2020.126717 |
| [35] |
POORTER H, NIKLAS K J, REICH P B, et al. Biomass allocation to leaves, stems and roots: Meta-analyses of interspecific variation and environmental control[J]. New Phytol, 2012, 193(1): 30-50. DOI:10.1111/j.1469-8137.2011.03952.x |
| [36] |
ROBAKOWSKI P, BIELINIS E, SENDALL K. Light energy partitioning, photosynthetic efficiency and biomass allocation in invasive Prunus serotina and native Quercus petraea in relation to light environment, competition and allelopathy[J]. J Plant Res, 2018, 131(3): 505-523. DOI:10.1007/s10265-018-1009-x |
| [37] |
SONG S S, LENG H B, FENG S C, et al. Biomass allocation pattern of urban shrubs in the Yangtze River Delta region, China: A field observation of 13 shrub species[J]. Urban For Urban Gree, 2021, 63: 127228. DOI:10.1016/j.ufug.2021.127228 |
| [38] |
GUO S, ZHAO H B, ZHOU G Y, et al. Biomass and its distribution pattern of four tree species plantation in south subtropical China[J]. For Res, 2022, 35(1): 182-189. 郭耆, 赵厚本, 周光益, 等. 南亚热带4个树种人工林生物量及其分配格局[J]. 林业科学研究, 2022, 35(1): 182-189. DOI:10.13275/j.cnki.lykxyj.2022.01.021 |
| [39] |
YAN B G, FAN B, HE G X, et al. Biomass allocations and their response to environmental factors for grass species in an aridhot valley[J]. Chin J Appl Ecol, 2016, 27(10): 3173-3181. 闫帮国, 樊博, 何光熊, 等. 干热河谷草本植物生物量分配及其对环境因子的响应[J]. 应用生态学报, 2016, 27(10): 3173-3181. DOI:10.13287/j.1001-9332.201610.005 |
| [40] |
REICH P B, LUO Y, BRADFORD J B, et al. Temperature drives global patterns in forest biomass distribution in leaves, stems, and roots[J]. Proc Natl Acad Sci USA, 2014, 111(38): 13721-13726. DOI:10.1073/pnas.1216053111 |
| [41] |
NIKLAS K J, ENQUIST B J. On the vegetative biomass partitioning of seed plant leaves, stems, and roots[J]. Am Nat, 2002, 159(5): 482-497. DOI:10.1086/339459 |
| [42] |
LIE G W, XUE L. Biomass allocation patterns in forests growing different climatic zones of China[J]. Trees, 2016, 30(3): 639-646. DOI:10.1007/s00468-015-1306-0 |
| [43] |
POORTER H, JAGODZINSKI A M, RUIZ-PEINADO R, et al. How does biomass distribution change with size and differ among species? An analysis for 1200 plant species from five continents[J]. New Phytol, 2015, 208(3): 736-749. DOI:10.1111/nph.13571 |
| [44] |
CHEN G P, YANG K T, WANG L, et al. Allometric relations for biomass partitioning of seven alpine Rhododendron species in south of Gansu[J]. Chin J Plant Ecol, 2020, 44(10): 1040-1049. 陈国鹏, 杨克彤, 王立, 等. 甘肃南部7种高寒杜鹃生物量分配的异速生长关系[J]. 植物生态学报, 2020, 44(10): 1040-1049. DOI:10.17521/cjpe.2020.0119 |
| [45] |
PRESS M C, GRAVES J D, STEWART G R. Transpiration and carbon acquisition in root hemiparasitic angiosperms[J]. J Exp Bot, 1988, 39(8): 1009-1014. DOI:10.1093/jxb/39.8.1009 |
| [46] |
SAUCET S B, SHIRASU K. Molecular parasitic plant-host interactions[J]. Plos Pathog, 2016, 12(12): e1005978. DOI:10.1371/journal.ppat.1005978 |
| [47] |
JHU M Y, SINHA N R. Parasitic plants: An overview of mechanisms by which plants perceive and respond to parasites[J]. Ann Rev Plant Biol, 2022, 73: 433-455. DOI:10.1146/annurev-arplant-102820-100635 |
 2024, Vol. 32
2024, Vol. 32


