1b. 福建师范大学, 地理科学学院, 福州 350007;
2. 福建三明森林生态系统国家野外科学观测研究站, 福建 三明 365002
1b. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China;
2. Fujian Sanming Forest Ecosystem National Observation and Research Station, Sanming 365002, Fujian, China
据IPCC报告,全球降水格局可能会在未来20年内发生显著改变,部分陆地干旱发生的频率、强度将有所增加[1]。干旱环境会干扰植物体内许多生理生化过程,如导致植物细胞活性氧(reactive oxygen species, ROS)代谢失衡并积累大量丙二醛(malondialdehyde, MDA),从而影响细胞膜的稳定、离子平衡和蛋白质的变性等,极端干旱条件下植物还可能减产甚至死亡[2–3]。一些抗旱相关的生理指标如抗氧化酶和非酶促物质(渗透调节物质、内源激素等)都对维持ROS代谢平衡起着重要作用。其可形成抗氧化系统以清除ROS自由基,积累溶质增强渗透调节, 以及通过激素抑制生长从而减少能量消耗等[4–5]。从植物器官来看,干旱将使叶片数量减少并且大幅降低气孔导度和光合速率,地下根系的生理特征也将受到影响[6]。而细根(直径≤2 mm)作为根系中活跃度和敏感度最高的部分,是植物吸收水分、养分和适应干旱环境的重要器官,其感受土壤水分含量的变化后可向上传递化学信号进行适应调节[5, 7]。因此,有必要对林木在降水减少下细根生理特征指标的变化进行试验与研究。
近年来土壤水分状况与植物细根关系的研究已引起重视,但关于细根对降水减少的生理响应机制还有待深入研究。隔离降水试验中细根酶促系统的响应仍存在争议。有研究表明干旱时细根过氧化氢酶和过氧化物酶活性显著增强,一定程度上减轻了细根细胞膜的干旱损伤[5, 8];而吴永波等[9]认为抗氧化酶对减轻干旱带来的细根膜脂过氧化的伤害作用有限。有研究表明,随着干旱强度增加,细根可溶性糖和淀粉总量下降,ROS含量显著增加,其中过氧化氢水平上升尤为显著,细根功能受损,水分利用效率下降[10–11];并且,细根能利用抗坏血酸-谷胱甘肽循环维持细胞氧化还原以应对干旱[12–13]; 钟波元等[14]认为隔离降水使细根养分失衡但淀粉含量增加,总体影响并不显著等。关于干旱对细根生理特征的影响研究主要集中在ROS代谢和抗氧化酶活性、碳汇/源[15–16]、非结构性碳水化合物[17]、渗透调节物质积累[18]等方面,缺乏细根对干旱响应重要生理指标的研究,在抗旱指标的选取上也不够全面。故综合考虑细根ROS代谢、植物酶活性和非酶促物质含量等指标与植物抗旱性的关系尤为重要。
有研究表明,1980年以来亚热带地区土壤干旱程度加剧[19–20],目前国内外对于森林土壤干旱响应的研究主要集中在北半球干旱、半干旱区等,试验对象也多为耐旱作物[5],对湿润亚热带地区森林干旱响应的研究还较为缺乏。杉木(Cunninghamia lanceolata)作为湿润亚热带地区的优势造林树种, 占世界人工林面积的6.5%、我国人工林面积的19%, 对我国林业生产意义重大[21]。基于此,本文提出以下2个科学问题:(1) 50%的降水隔离是否显著改变了亚热带杉木幼树细根的生理特性?(2) 杉木幼树细根如何在生理方面(酶促与非酶促抗氧化系统)进行干旱响应,各生理指标间有何关联?本研究选取杉木幼树为研究对象,利用隔离降水试验(0,–50%)对细根的ROS代谢与抗氧化酶活性、渗透调节物质和内源激素等生理特征指标进行研究,为我国亚热带人工林的生产力提升以及全球变化背景下地下生态系统的适应机制等研究提供科学依据。
1 材料和方法 1.1 研究地概况试验地位于福建三明森林生态系统国家野外科学观测研究站陈大观测点(26°19′ N,117°36′ E)。该区属中亚热带季风气候,年平均气温19.1 ℃,年平均降水量1 688 mm,降水集中在3月—8月。区域地形多为山地丘陵,平均海拔300 m。土壤以黑云母花岗岩发育的红壤为主。
1.2 试验设计试验设置2个处理:隔离降水50% (PR)和对照(CK),每处理5个重复,共计10个小区,小区随机排列。每个小区面积为2 m×2 m,小区周围用4块PVC板(70 cm×200 cm)隔开以防止区间干扰, PVC板埋入地下70 cm (图 1)。试验所用土壤取自观测站附近的杉木人工林,为了消除土壤的异质性(同一土壤类型上不同空间位置取样所测定的土壤养分和水分等因子的差异性)[22],按0~10、10~20、20~70 cm分层取回并去除杂物(根系、沙石等),充分混拌均匀后分层填至各小区内,调整土壤容重使其接近原杉木林地。于2013年11月在每个小区内均匀种植4棵1 a生短侧枝杉木幼苗并用号码牌标记,各杉木幼苗的苗高与地径均相近,苗高(25.7± 2.5) cm,地径(3.4±0.4) mm。同时在小区1.5 m高处每隔5 cm放置一根透明瓦浪板(0.05 m×5 m),将其固定于支架上均匀铺满隔离降水试验样区(图 1), 以达到50%的降水隔离,瓦浪板装置高度随试验地杉木幼苗的生长进行定期升高。于各试验小区地表下10 cm处布设土壤温湿度传感器,用以监测土壤温度和水分变化,空气温度和降雨量采用气象站进行监测。从2018年4月的监测数据来看,PR与CK处理的土壤温度无显著差异,但土壤湿度显著下降(P < 0.05),初步判断试验达到预期降水隔离效果。
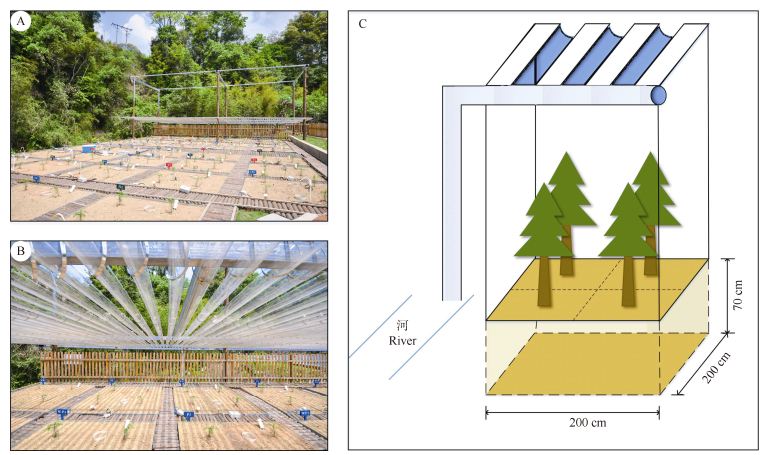
|
图 1 试验样地及隔离降水装置示意图。A: 试验样地全景;B: 隔离降水试验样地;C: 隔离降水装置示意图。 Fig. 1 Schematic diagram of sample plot and precipitation exclusion device. A: Perspective of sample plot; B: Precipitation exclusion sample plot; C: Schematic diagram of precipitation exclusion device. |
2018年4月(隔离降水4 a后),采用土芯法, 于每个试验小区随机(中心和边缘等地均有取样以保证其随机性)取6个土钻,土钻内径3.5 cm,取样深度为10 cm。将每个样地各土钻的细根挑出并混合均匀,随后将根系装入分根盘,对杉木细根进一步分选。采用径级法将根系样品分为0~1和1~2 mm细根(本研究选取0~1 mm根系为研究对象),并根据表皮的颜色、脱落及褶皱情况挑出活细根,挑选好的细根用干冰进行保存。取样的同时对树高和胸径生长进行同步测定。
1.4 方法ROS与MDA含量测定 超氧阴离子自由基(superoxide radical, O2·-)采用羟氨氧化法测定[23],过氧化氢(hydrogen peroxide, H2O2)含量采用Prochazkova等[24]的方法测定,MDA含量采用硫代巴比妥酸法(TBA)测定[25]。
渗透调节物质浓度测定 可溶性蛋白(soluble protein, SP)浓度采用考马斯亮蓝比色法测定[26],脯氨酸(proline, Pro)含量采用酸性茚三酮比色法测定[27], 谷胱甘肽(glutathione, GSH)含量参考Kampfenkel等[28]的方法测定。
保护酶活性测定 超氧化物歧化酶(superoxide dismutase, SOD)活性采用黄嘌呤氧化酶法测定[29];过氧化氢酶(catalase, CAT)活性采用紫外线吸收法,参照Trevor等[30]的方法测定;过氧化物酶(peroxidase, POD)活性采用愈创木酚比色法测定[31]; 谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)活性采用Khatuna等[32]的方法测定;总抗氧化能力(total antioxidant capacity, T-AOC)参照Dinis等[33]的方法测定。
内源激素含量测定 脱落酸(abscisic acid, ABA)、吲哚乙酸(indoleacetic acid, IAA)和细胞分裂素(cytokinin, CTK)均参考Voesenek等[34]的方法测定。
1.5 数据处理利用SPSS 25.0软件对数据进行处理分析,采用独立样本t检验对两种处理间土壤温湿度、杉木树高、胸径生长及细根各指标的差异进行分析,同时采用Pearson相关性分析对丙二醛、过氧化氢、超氧阴离子自由基与渗透调节物质、保护酶活性及内源激素间的关系进行分析。显著性水平设定为P= 0.05。利用Origin 10.5软件完成作图。
2 结果和分析 2.1 杉木幼树生长特征变化从表 1可见,2018年4月监测的土壤温度,PR处理与CK间无显著差异,但土壤湿度显著下降(P < 0.05);PR处理的树高、胸径较CK分别显著提高21.6%和18.5% (P < 0.05)。
| 表 1 隔离降水对土壤温湿度及杉木生长的影响 Table 1 Effect of precipitation exclusion on soil temperature, humidity and growth of Cunninghamia lanceolata |
由图 2可知,与CK相比,隔离50%降水使杉木幼树细根的H2O2含量显著增加(P < 0.05),约为CK的1.5倍;O2·-和MDA含量无显著变化(P > 0.05)。

|
图 2 隔离降水对杉木幼树细根活性氧和丙二醛含量的影响。H2O2: 过氧化氢; O2·-: 超氧阴离子自由基; MDA: 丙二醛。下同 Fig. 2 Effects of precipitation exclusion on reactive oxygen species and malondialdehyde contents in fine roots of Cunninghamia lanceolata saplings. H2O2: Hydrogen peroxide; O2·-: Superoxide radical; MDA: Malondialdehyde. The same below |
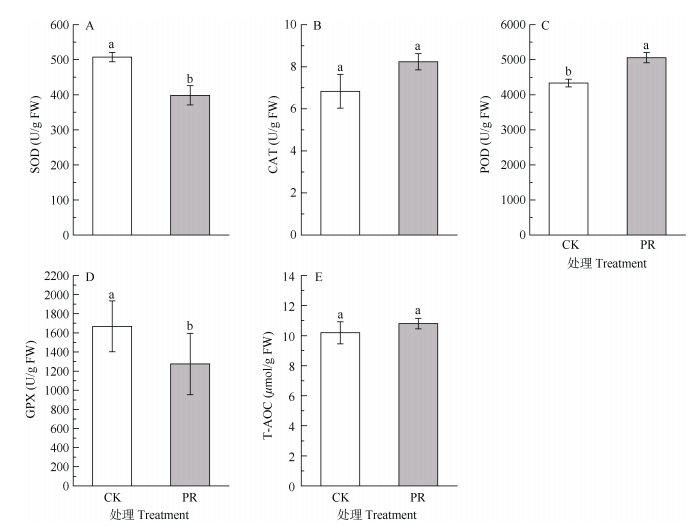
与CK相比,PR处理的细根SP含量变化不显著(P > 0.05),Pro和GSH含量显著增加(P < 0.05),约为CK的1.4倍(图 3)。从图 4可见,隔离降水对细根不同保护酶活性的影响不同,PR处理后细根SOD活性显著降低了21.5%,POD活性显著增加16.7% (P < 0.05),而CAT、GPX活性和T-AOC无显著变化(P > 0.05)。

|
图 3 隔离降水对杉木幼树细根渗透调节物质的影响。SP: 可溶性蛋白; Pro: 脯氨酸; GSH: 谷胱甘肽。下同 Fig. 3 Effect of precipitation exclusion on osmoregulation substances in fine roots of Cunninghamia lanceolata saplings. SP: Soluble protein; Pro: Proline; GSH: Glutathione. The same below |
|
图 4 隔离降水对杉木幼树细根保护酶活性的影响。SOD: 超氧化物歧化酶; CAT: 过氧化氢酶; POD: 过氧化物酶; GPX: 谷胱甘肽过氧化物酶; T-AOC: 总抗氧化能力。下同 Fig. 4 Effect of precipitation exclusion on antioxidant enzyme activities in fine roots of Cunninghamia lanceolata saplings. SOD: Superoxide dismutase; CAT: Catalase; POD: Peroxidase; GPX: Glutathione peroxidase; T-AOC: Total antioxidant capacity. The same below |
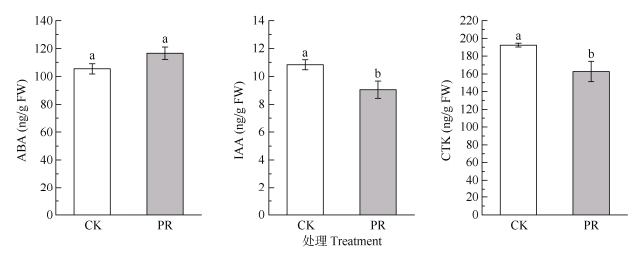
由图 5可知,与CK相比,PR处理的细根ABA含量无显著变化(P > 0.05),而IAA和CTK含量分别显著下降16.5%和15.4% (P < 0.05)。
|
图 5 隔离降水对杉木幼树细根内源激素的影响。ABA: 脱落酸; IAA: 吲哚乙酸; CTK: 细胞分裂素。下同 Fig. 5 Effect of precipitation exclusion on endogenous hormones in fine roots of Cunninghamia lanceolata saplings. ABA: Abscisic acid; IAA: Indoleacetic acid; CTK: Cytokinin. The same below |
对11个与抗旱相关的生理指标和ROS、MDA含量进行相关性分析(表 2),结果表明,杉木细根的T-AOC与MDA、O2·-含量分别呈显著(P < 0.05)和极显著(P < 0.01)正相关关系;GSH含量与MDA含量呈显著正相关关系(P < 0.05),与H2O2含量呈极显著正相关关系(P < 0.01);其余指标间的相关性不显著。
| 表 2 丙二醛、过氧化氢、超氧阴离子自由基与渗透调节物质、保护酶活性及内源激素间的相关性分析 Table 2 Correlation analysis between malondialdehyde, hydrogen peroxide, superoxide radical and osmotic adjustment substances, antioxidant enzyme activities, endogenous hormones |
ROS是性质极为活泼且氧化能力强的含氧物的总称,包括O2·-、H2O2等,对细胞膜脂质氧化作用强,且氧化过程将产生MDA,因此可以通过MDA的含量来判断植物细胞膜脂过氧化程度[9]。在正常降水背景下,植物体能维持ROS产生与清除的动态平衡[9]。隔离降水试验结果表明,土壤湿度显著下降,并且杉木幼树细根的O2·-和MDA含量变化不显著,而H2O2含量显著增加。这表明干旱导致了杉木细根膜脂过氧化概率的增加但受损程度较低。其中H2O2的显著增加可能是由于4 a降水隔离后,ROS的增加一定程度上诱导了活性氧清除酶系统的活性,如H2O2的清除酶POD和CAT活性的提高,但长期的水分缺失可能已导致H2O2积累超过一定阈值,酶促系统的防御不足以控制其增长,保护酶活性与活性氧物质含量没有显著相关性可作为佐证。此外,虽然O2·-的主要清除酶SOD活性显著下降,但O2·-浓度无显著变化。可能是细根抗氧化系统中GSH含量的显著增加,使得自由基分解速率加快,这也是其分解物之一H2O2含量显著增加的可能原因。而土壤湿度较对照显著下降12.9%,MDA含量却并未出现明显变化,表明杉木细根对于干旱造成的膜脂氧化适应性较强,能进行一定程度的自我修护,这与种培芳等[6]对红砂(Reaumuria soongorica)的研究结果相似。
3.2 细根抗氧化系统对隔离降水的响应渗透调节是植物抗氧化系统的重要组成部分, 细胞通过渗透调节维持正常膨压,保持各种生理过程的正常运行,植物根系的渗透调节能力与抗旱性正相关[6]。SP能提高细胞的保水性,Pro能保护蛋白质在水分胁迫下不变性,在调节细胞氧化还原方面起重要作用,正常情况下其含量不高,而GSH是一种重要的非酶抗氧化剂[35–37]。本研究结果表明,与对照相比,杉木细根的Pro和GSH含量显著增加,这可能是杉木细根对生存环境水分缺失的一种信号, 也表明杉木的抗旱能力较强,在土壤水分显著减少的情况下能通过积累渗透物质进行有效调节。H2O2可以诱导GSH含量的增加[37],本试验中GSH与H2O2含量呈极显著正相关,证实了这一观点。而在水分缺失环境下,可将GSH分解为氧化型谷胱甘肽(GSSG)的GPX活性并未有显著变化, 这也是GSH含量增加的可能原因之一。Pro浓度显著提高的可能原因在于长期干旱造成的碳水化合物增加,从而促进Pro的合成;此外还有研究表明PR处理下植物氮代谢将发生变化,这也会造成Pro的大量积累[15],使杉木的渗透调节能力增强。本研究还表明,虽然长期干旱会影响蛋白质的合成,也使得SP开始分解,但试验中SP含量却无显著变化,可能有Pro、GSH含量显著增加的原因存在,使其稳定性得到保护,有利于维持杉木对于水分、养分的吸收。
SOD、CAT、POD、GPX等是植物抗氧化代谢的主要酶类,可清除植物体内的ROS,整个酶促防御系统的抗氧化能力取决于这几种酶的协同作用效果[12]。本研究表明,隔离降水下杉木细根的POD、CAT活性较对照增强。其中,POD活性显著增强,表明其对水分变化较敏感,在长期隔离降水情况下能持续作出响应。SOD、GPX活性较对照降低,并且SOD活性表现为显著降低,原因可能是大量增加的H2O2对SOD活性的钝化作用[9]。总体来看, 隔离降水条件下杉木细根的总抗氧化能力较对照无显著变化,可能是因为土壤温度并未出现显著变化的原因,使得抗氧化酶系统部分酶的抗氧化过程变缓。SOD活性与O2·-含量,CAT、POD活性与H2O2含量间均未表现出明显的相关性,并且H2O2与CAT的Pearson相关系数的绝对值最小,表明杉木细根ROS的酶促抗氧化系统对水分缺失的适应调控较弱。可见若只改变杉木抗氧化酶活性,对减轻水分减少带来ROS失衡从而造成膜脂过氧化伤害的作用有限。
内源激素在植物根源信号传导中起重要作用, 植物体可通过改变激素的含量、比例来调节气孔开闭,调控植物生长,从而影响植物的抗逆性。ABA是植物感知干旱刺激的根源信号,能促进根部对水和离子的吸收,而CTK可以促进细胞分裂,延缓细胞衰老,IAA对植物生长也有促进作用,并且ABA与CTK、IAA间存在拮抗关系[38]。干旱环境对植物的ABA合成起促进作用,而对IAA、CTK合成起抑制作用[39]。本研究中,隔离降水后杉木细根的IAA、CTK分别显著降低了16.5%和15.4%,可能是因为H2O2显著增加,使得杉木细根膜结构的完整性受到威胁,但却有利于ABA的积累。杉木细根的ABA含量较对照并未出现显著提高,与前人研究结果不一致,可能是长期适度降水隔离下杉木调节能力强,使得作为根源信号的ABA响应灵敏,在完成诱导和启动杉木细根的抵抗防御后逐渐下降至正常水平。吕东[40]研究表明ABA通过诱导H2O2等物质的产生促使气孔关闭,二者间大概率存在协同效应。杉木细根生理指标的相关性分析表明, ABA与自由基含量呈负相关关系,Pearson相关系数为0.712,因此ABA在杉木的抗旱防御过程中可能有一定作用。在一定浓度范围内,CTK、IAA浓度越低,植物气孔导度也越低[39–40]。故虽然杉木在干旱环境前期主要依靠ABA浓度的增加传递关闭气孔的根源信号,但是长期降水隔离后可能选择通过降低CTK、IAA浓度来抑制气孔开放,以有效应对土壤水分的显著降低。
3.3 细根抗旱生理指标与杉木生长变化特征探究已有研究表明T-AOC与ROS代谢平衡有重要联系[12, 37]。本研究中渗透调节物质与ROS指标的相关程度为GSH > Pro > SP,其中GSH与H2O2和MDA均呈极显著正相关,因此也可以将GSH作为衡量杉木细根耐旱性的指标之一。此外,逆境时植物体内激素的平衡和比值变化也对其生长、生理特性产生影响。本研究中杉木细根IAA/ABA较对照显著降低,而由土壤温湿度及杉木生长特征数据可知, 隔离降水试验地土壤湿度较对照显著降低,杉木幼树的树高和胸径显著增加,这与一般隔离降水试验中CTK、IAA、IAA/ABA随土壤湿度降低显著下降从而使植物生长受抑制的结果相反[38–39, 41–42]。从试验地杉木生长情况来探究其可能的原因,一是隔离降水前期ABA以及渗透物质增加使其建立了适应机制,并且这种机制可能持续作用于细根生长, 使杉木根系更为发达[43],试验地杉木树高胸径与对照相比显著增加;二是CTK、IAA与杉木的生长未表现出明显相关性,长期隔离降水处理导致的低土壤湿度环境也可能使得杉木细根内部建立了新的激素平衡,促使杉木正常生长发育,杉木细根在激素调控方面呈现主动的干旱适应性。
综上,隔离降水后杉木细根H2O2含量显著增加, 一方面提高了ABA、GSH含量;另一方面也影响CTK、IAA合成,但CTK、IAA对杉木生长调控贡献小。与对照处理相比,隔离降水后土壤湿度显著下降,并且杉木细根O2·-、MDA含量变化不显著。相对干旱环境下其GSH、Pro显著增加从而提高渗透调节,清除自由基并降低膜脂损伤,而早期ABA浓度的增加也促进了杉木对土壤水分缺失的适应。综合作用下,杉木树高、胸径显著增长。抗氧化酶对于杉木细根的干旱适应调控影响弱,主要依靠非酶促抗氧化系统的保护作用,其中有关隔离降水条件下杉木细根各内源激素间协调平衡的复杂机制还需进一步研究。
| [1] |
IPCC. Summary for Policymakers. In: Climate Change 2021: The Physical Science Basis[M]. Cambridge: Cambridge University Press, 2021: 17.
|
| [2] |
ZHOU G Y, ZHOU L Y, SHAO J J, et al. Effects of extreme drought on terrestrial ecosystems: Review and prospects[J]. Chin J Plant Ecol, 2020, 44(5): 515-525. 周贵尧, 周灵燕, 邵钧炯, 等. 极端干旱对陆地生态系统的影响: 进展与展望[J]. 植物生态学报, 2020, 44(5): 515-525. DOI:10.17521/cjpe.2019.0317 |
| [3] |
LUO D D, WANG C K, JIN Y. Stomatal regulation of plants in response to drought stress[J]. Chin J Appl Ecol, 2019, 30(12): 4333-4343. 罗丹丹, 王传宽, 金鹰. 植物应对干旱胁迫的气孔调节[J]. 应用生态学报, 2019, 30(12): 4333-4343. DOI:10.13287/j.1001-9332.201912.004 |
| [4] |
TARDIEU F, SIMONNEAU T, MULLER B. The physiological basis of drought tolerance in crop plants: A scenario-dependent probabilistic approach[J]. Annu Rev Plant Biol, 2018, 69: 733-759. DOI:10.1146/annurev-arplant-042817-040218 |
| [5] |
HUANG H X, YANG Q Q, CUI P, et al. Changes in morphological and physiological characteristics of Gymnocarpos przewalskii roots in response to water stress[J]. Acta Prat Sin, 2021, 30(1): 197-207. 黄海霞, 杨琦琦, 崔鹏, 等. 裸果木幼苗根系形态和生理特征对水分胁迫的响应[J]. 草业学报, 2021, 30(1): 197-207. DOI:10.11686/cyxb2020057 |
| [6] |
CHONG P F, LI H Y, LI Y. Physiological responses of seedling roots of the desert plant Reaumuria soongorica to drought stress[J]. Acta Prat Sin, 2015, 24(1): 72-80. 种培芳, 李航逸, 李毅. 荒漠植物红砂根系对干旱胁迫的生理响应[J]. 草业学报, 2015, 24(1): 72-80. DOI:10.11686/cyxb20150110 |
| [7] |
WILLIAMS A, DE VRIES F T. Plant root exudation under drought: implications for ecosystem functioning[J]. New Phytol, 2020, 225(5): 1899-1905. DOI:10.1111/nph.16223 |
| [8] |
MILLER G, SUZUKI N, CIFTCI-YILMAZ S, et al. Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant Cell Environ, 2010, 33(4): 453-467. DOI:10.1111/j.1365-3040.2009.02041.x |
| [9] |
WU Y B, YE B. Effects of combined elevated temperature and drought stress on anti-oxidative enzyme activities and reactive oxygen species metabolism of Broussonetia papyrifera seedlings[J]. Acta Ecol Sin, 2016, 36(2): 403-410. 吴永波, 叶波. 高温干旱复合胁迫对构树幼苗抗氧化酶活性和活性氧代谢的影响[J]. 生态学报, 2016, 36(2): 403-410. DOI:10.5846/stxb201409201862 |
| [10] |
WANG X. Effects of soil water contents on carbohydrates partitioning and reactive oxygen species metabolism in different organs of Robinia pseudoacacia[D]. Yangling: Northwest Agricultural & Forest University, 2014. 王昕. 土壤含水量对刺槐不同器官中碳水化合物分配及活性氧代谢的影响[D]. 杨凌: 西北农林科技大学, 2014. |
| [11] |
MEIER I C, LEUSCHNER C. Belowground drought response of European beech: Fine root biomass and carbon partitioning in 14 mature stands across a precipitation gradient[J]. Glob Change Biol, 2008, 14(9): 2081-2095. DOI:10.1111/j.1365-2486.2008.01634.x |
| [12] |
WANG Y. Physiological characteristics and key redox couples in Ziziphus jujuba Mill. var. spinosa adapted to drought[D]. Beijing: University of Chinese Academy of Sciences, 2016. 王勇. 酸枣适应干旱的生理特征和氧化还原特征物质研究[D]. 北京: 中国科学院研究生院, 2016. |
| [13] |
SHAN C J. Metabolism of glutathione and ascorbate and the signal function of Ja in regulating glutathione and ascorbate metabolism in Agropyron cristatum under drought stress[D]. Yangling: Northwest Agricultural & Forest University, 2010. 单长卷. 干旱胁迫下冰草AsA、GSH代谢及茉莉酸的信号调控作用[D]. 杨凌: 西北农林科技大学, 2010. |
| [14] |
ZHONG B Y, XIONG D C, SHI S Z, et al. Effects of precipitation exclusion on fine-root biomass and functional traits of Cunninghamia lanceolata seedlings[J]. Chin J Appl Ecol, 2016, 27(9): 2807-2814. 钟波元, 熊德成, 史顺增, 等. 隔离降水对杉木幼苗细根生物量和功能特征的影响[J]. 应用生态学报, 2016, 27(9): 2807-2814. DOI:10.13287/j.1001-9332.201609.023 |
| [15] |
LI R X. Fine root biomass, morphology, and C and N concentration response to thinning in a Pinus massoniana plantation[D]. Nanjing: Nanjing Forestry University, 2014. 李瑞霞. 间伐对马尾松细根生物量、形态和碳氮含量的影响[D]. 南京: 南京林业大学, 2014. |
| [16] |
HASIBEDER R, FUCHSLUEGER L, RICHTER A, et al. Summer drought alters carbon allocation to roots and root respiration in mountain grassland[J]. New Phytol, 2015, 205(3): 1117-1127. DOI:10.1111/nph.13146 |
| [17] |
LI P, ZHOU H M, FANG Z Z. Ozone pollution, nitrogen addition, and drought stress interact to affect non-structural carbohydrates in the leaves and fine roots of poplar[J]. Environ Sci, 2021, 42(2): 1004-1012. 李品, 周慧敏, 冯兆忠. 臭氧污染、氮沉降和干旱胁迫交互作用对杨树叶和细根非结构性碳水化合物的影响[J]. 环境科学, 2021, 42(2): 1004-1012. DOI:10.13227/j.hjkx.202007213 |
| [18] |
QUAN W L, LIU X, WANG H Q, et al. Comparative physiological and transcriptional analyses of two contrasting drought tolerant alfalfa varieties[J]. Front Plant Sci, 2015, 6: 1256. DOI:10.3389/fpls.2015.01256 |
| [19] |
ZHAO Z C, LUO Y, HUANG J B. Global warming and abrupt climate change[J]. Climate Change Res, 2021, 17(1): 114-120. 赵宗慈, 罗勇, 黄建斌. 全球变暖与气候突变[J]. 气候变化研究进展, 2021, 17(1): 114-120. DOI:10.12006/j.issn.1673-1719.2020.180 |
| [20] |
DAI A G. Increasing drought under global warming in observations and models[J]. Nat Climate Change, 2013, 3(1): 52-58. DOI:10.1038/nclimate1633 |
| [21] |
CHEN G S, YANG Z J, GAO R, et al. Carbon storage in a chronosequence of Chinese fir plantations in southern China[J]. For Ecol Manage, 2013, 300: 68-76. DOI:10.1016/j.foreco.2012.07.046 |
| [22] |
DELAHAYE C H, ALONSO E E. Soil heterogeneity and preferential paths for gas migration[J]. Eng Geol, 2002, 64(2/3): 251-271. DOI:10.1016/S0013-7952(01)00104-1 |
| [23] |
KE D S, WANG A G, SUN G C, et al. The effect of active oxygen on the activity of ACC synthase induced by exogenous IAA[J]. Acta Bot Sin, 2002, 44(5): 551-556. |
| [24] |
PROCHAZKOVA D, SAIRAM R K, SRIVASTAVA G C, et al. Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J]. Plant Sci, 2001, 161(4): 765-771. DOI:10.1016/S0168-9452(01)00462-9 |
| [25] |
DHINDSA R S, PLUMB-DHINDSA P, THORPE T A. Leaf senescence: Correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase[J]. J Exp Bot, 1981, 32(1): 93-101. DOI:10.1093/jxb/32.1.93 |
| [26] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-90523 |
| [27] |
TROLL W, LINDSLEY J. A photometric method for the determination of proline[J]. J Biol Chem, 1955, 215(2): 655-660. DOI:10.1016/S0021-9258(18)65988-5 |
| [28] |
KAMPFENKEL K, VANMONTAGU M, INZE D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J]. Anal Biochem, 1995, 225(1): 165-167. DOI:10.1006/abio.1995.1127 |
| [29] |
GIANNOPOLITIS C N, RIES S K. Superoxide dismutases: I. Occurrence in higher plants[J]. Plant Physiol, 1977, 59(2): 309-314. DOI:10.1104/pp.59.2.309 |
| [30] |
KRAUS T E, FLETCHER R A. Paclobutrazol protects wheat seedlings from heat and paraquat injury. Is detoxification of active oxygen involved?[J]. Plant Cell Physiol, 1994, 35(1): 45-52. DOI:10.1093/oxfordjournals.pcp.a078569 |
| [31] |
KOCHHAR S, KOCHHAR V K, KHANDUJA S D. Changes in the pattern of isoperoxidases during maturation of grape berries CV Gulabi as affected by ethephon (2-chloroethyl) phosphonic acid[J]. Am J Enol Vitic, 1979, 30: 275-277. DOI:10.5344/ajev.1979.30.4.275 |
| [32] |
KHATUN S, ALI M B, HAHN E J, et al. Copper toxicity in Withania somnifera: Growth and antioxidant enzymes responses of in vitro grown plants[J]. Environ Exp Bot, 2008, 64(3): 279-285. DOI:10.1016/j.envexpbot.2008.02.004 |
| [33] |
DINIS T C P, MADEIRA V M C, ALMEIDA L M. Action of phenolic derivatives (acetaminophen, salicylate, and 5-aminosalicylate) as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers[J]. Arch Biochem Biophys, 1994, 315(1): 161-169. DOI:10.1006/abbi.1994.1485 |
| [34] |
VOESENEK L A C J, RIJNDERS J H G M, PEETERS A J M, et al. Plant hormones regulate fast shoot elongation under water: From genes to communities[J]. Ecology, 2004, 85(1): 16-27. DOI:10.1890/02-740 |
| [35] |
WANG X, HU H L, HU T X, et al. Effects of drought stress on the osmotic adjustment and active oxygen metabolism of Phoebe zhennan seedlings and its alleviation by nitrogen application[J]. Chin J Plant Ecol, 2018, 42(2): 240-251. 王曦, 胡红玲, 胡庭兴, 等. 干旱胁迫对桢楠幼树渗透调节与活性氧代谢的影响及施氮的缓解效应[J]. 植物生态学报, 2018, 42(2): 240-251. DOI:10.17521/cjpe.2017.0225 |
| [36] |
WANG X C, SAMO N, LI L M, et al. Root distribution and its impacts on the drought tolerance capacity of hybrid rice in the Sichuan Basin area of China[J]. Agronomy, 2019, 9(2): 79. DOI:10.3390/agronomy9020079 |
| [37] |
LIU Z J, GUO Y K, LIN S H, et al. Effects of exogenous hydrogen peroxide on ultrastructure of chloroplasts and activities of antioxidant enzymes in greenhouse-ecotype cucumber under drought stress[J]. Acta Hort Sin, 2009, 36(8): 1140-1146. 刘忠静, 郭延奎, 林少航, 等. 外源过氧化氢对干旱胁迫下温室黄瓜叶绿体超微结构和抗氧化酶的影响[J]. 园艺学报, 2009, 36(8): 1140-1146. DOI:10.16420/j.issn.0513-353x.2009.08.008 |
| [38] |
YU L, MA H L. The endogenous hormone level and drought adaptability of four Kentucky bluegrass species in Gansu, China[J]. J Desert Res, 2015, 35(1): 182-188. 俞玲, 马晖玲. 甘肃几种早熟禾内源激素水平及干旱适应性[J]. 中国沙漠, 2015, 35(1): 182-188. DOI:10.7522/j.issn.1000-694X.2013.00451 |
| [39] |
ZHOU Y F, WANG D Q, LU Z B, et al. Effects of drought stress on photosynthetic characteristics and endogenous hormone ABA and CTK contents in green-stayed sorghum[J]. Sci Agric Sin, 2014, 47(4): 655-663. 周宇飞, 王德权, 陆樟镳, 等. 干旱胁迫对持绿性高粱光合特性和内源激素ABA、CTK含量的影响[J]. 中国农业科学, 2014, 47(4): 655-663. DOI:10.3864/j.issn.0578-1752.2014.04.005 |
| [40] |
LÜ D. ATHK1 is involved in the signal transduction of ABA-induced stomatal closure[D]. Kaifeng: Henan University, 2012. 吕东. ATHK1参与ABA诱导气孔关闭的信号转导过程[D]. 开封: 河南大学, 2012. |
| [41] |
LI J. Response of stomatal conductance and phytohormones of leaves to vapor pressure deficit in some species of plants[D]. Ji'nan: Shandong University, 2014. 李静. 几种植物叶片气孔导度与植物激素对大气湿度的响应[D]. 济南: 山东大学, 2014. |
| [42] |
ZHANG H Y, DUAN W, XIE B T, et al. Effects of drought stress at different growth stages on endogenous hormones and its relationship with storage root yield in sweetpotato[J]. Acta Agron Sin, 2018, 44(1): 126-136. 张海燕, 段文学, 解备涛, 等. 不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系[J]. 作物学报, 2018, 44(1): 126-136. DOI:10.3724/SP.J.1006.2018.00126 |
| [43] |
HE J L, ZHAO S Q, WANG Y N, et al. Response of endogenous hormones of tobacco to drought stress[J]. Chin Agric Sci Bull, 2015, 31(30): 205-209. 何俊龙, 赵世钦, 王彦楠, 等. 烟草内源激素对干旱胁迫响应的研究进展[J]. 中国农学通报, 2015, 31(30): 205-209. |
 2023, Vol. 31
2023, Vol. 31


