2. 华南国家植物园,广州 510650;
3. 中国科学院大学,北京 1000498;
4. 南方海洋科学与工程广东省实验室(广州),广州 511458
2. South China Botanical Garden, Guangzhou 510650, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China
红树林是指生长在热带、亚热带地区沿海潮滩湿地,受周期性潮水浸淹的乔木、灌木、棕榈状或陆生蕨类植物群落[1–2]。作为热带、亚热带沿海地区的代表性植被类型,红树林主要分布在江河入海口及沿海岸线的海湾内,是全球四大湿地生态系统中最具特色的一个湿地生态系统[3–4]。红树林具有重要的生态系统服务功能,最突出的就是海岸带生态屏障功能[5–6]。红树植物适应于海岸潮间带的特殊生态环境(如高且多变的盐浓度、缺氧、长时间的强光照和高的叶表面温度),具有特有生态习性和结构[7]。然而,在过去的几十年间直至目前,全球范围内的红树林因受过度砍伐及海岸的开发等人类活动的影响正遭受大面积的破坏和退化[8–9]。我国红树林总面积历史上曾达25×104 hm2,1950年约为4.2×104 hm2,2001年仅为2.28×104 hm2[10]。因此,红树林的生态恢复与重建研究已成为国际上海岸带可持续发展方面的热点研究课题[11–15]。
近年来我国南方海岸带进行了大规模的红树林造林,特别是无瓣海桑(Sonneratia apetala)因耐水淹能力强、生长繁殖迅速而在我国红树林引种造林中栽培面积最广[16]。然而截至目前为止,仍有许多红树林生态系统处于退化状态[3],这是因为红树林生态系统十分脆弱,一旦遭到破坏便很难恢复到自然状态[7]。同时,无瓣海桑的引入可能会对本土红树林生态系统的物种多样性和生产力产生显著影响,使得本土红树林生态系统稳定性进一步降低[3]。这就需要对我国红树林群落结构进一步改造和优化。因此,我们针对外来种无瓣海桑与7种本土红树植物在不同光强条件下的生长和生物量分配[17]以及生理生态特性进行了系统研究,旨在为本土红树林的群落构建和无瓣海桑人工林的乡土化改造提供科学指导。
当环境条件变化时,植物会启动一系列生理生态响应来适应当前变化的环境,其中就包含叶绿素荧光参数的变化。叶绿素荧光参数可以指示植物受到胁迫的程度,并作为植物光能利用效率的指标[18]。作为一种阐述光反应中心和光合电子传递链状态的非破坏性方法,叶绿素荧光测定技术已被广泛地应用于测定植物光合生理状态[19]。光系统Ⅱ (PSⅡ)的最大光化学量子效率(Fv/Fm)在植物正常生长状态下通常相对稳定,当植物受到来自环境的胁迫或伤害时,Fv/Fm会表现出下降趋势[20]。ΦPSⅡ表示光系统Ⅱ的实际光化学效率,代表经光系统Ⅱ的线性电子传递的量子效率,可用于指代被光系统Ⅱ利用的光化学能量与光系统Ⅱ吸收的全部光能之比[21]。电子传递速率(ETR)代表实际光强条件下光系统Ⅱ的非循环光合电子传递效率,它的大小反映了植物同化CO2的能力以及有效耗散过剩光能从而提供光保护作用的能力大小[22]。
红树林作为生长在陆海之间潮间带的重要植被类型,在自然条件下红树幼苗的生长发育过程同时受到光照、盐度和水淹时间等环境因子的影响。目前对于红树植物在胁迫环境下叶绿素荧光参数的研究主要集中在盐胁迫的研究上[23–24],而关于光照条件变化对红树植物幼苗生理生态特征的影响研究相对较少[25–26]。光不仅是植物进行光合作用的能量之源,同时能通过促进或抑制植物生理过程而对植物生长发育产生深远影响[27–29]。为了实现人工红树林群落的优化配置和红树林林分的合理改造, 本研究选择我国珠三角地区常见的8种红树植物, 比较其幼苗叶片叶绿素荧光参数在不同生长光强下的差异,从而揭示红树植物适应光照条件变化的生理生态策略。
1 材料和方法 1.1 材料试验材料为6种真红树植物:无瓣海桑(Sonneratia apetala)、秋茄(Kandelia candel)、木榄(Bruguiera gymnorrhiza)、桐花树(Aegiceras corniculatum)、老鼠簕(Acanthus ilicifolius)和卤蕨(Acrostichum aureum),以及2种半红树植物:银叶树(Heritiera littoralis)和黄槿(Hibiscus tiliaceus)。其中,无瓣海桑为外来红树植物,原产孟加拉国,对我国南方海岸的环境表现出很强的生态适应性,在珠海淇澳岛已有成规模的造林,其他7种红树植物均为本土种。2013年8月,在珠海淇澳岛红树林自然保护区(22°23′40″~ 22°27′38″ N,113°36′40″~113°39′15″ E)附近的苗圃内选择苗龄1 a、长势均一的8种红树植物的幼苗。该保护区属南亚热带海洋性季风气候,年均温22.2 ℃,年均降雨量1 875.7 mm,4月—10月降雨量约占全年雨量的84%[30],海水盐度为3.31‰~ 7.05‰,海域潮汐属不正规半日潮[31]。
1.2 试验设计遮荫试验于2013年10月至2014年10月在广东省广州市的中国科学院华南植物园大型实验生态学综合试验场(23°10′42.79″ N, 113°21′25.28″ E)进行。气候类型为南亚热带海洋季风气候,年均温为20 ℃~22 ℃,年均降雨量为1 982.7 mm,年均相对湿度为77%。
通过不同透光度的黑色尼龙网获得不同相对光强,分别为相对自然光强的100% (T0,对照)、45% (T1)、30% (T2)和10% (T3)[32]。每个光照强度每种红树植物10~12株,将栽植好的幼苗标号并分别置于4个光强处理区中。幼苗栽种于13.4 L花盆(上口内径30 cm,盆底内径21 cm,高26 cm)中, 盆中栽培基质使用珠海淇澳岛的海泥,每盆1株。花盆放置于含有人工配置海水的塑料盆(内径27.5 cm, 高10.5 cm)中,人工海水以粗海盐和自来水调配而成,含盐量模拟淇澳岛近岸海水平均盐度,约为6‰。试验期间监测盐度,适时补充人工海水,进行遮荫处理1 a。
1.3 叶绿素荧光参数的测定每树种选取不同光强处理中长势较好的3~5棵幼苗,每棵幼苗随机选取6~10片成熟叶片,参照Jin等[33]的方法使用便携式调制叶绿素荧光仪PAM 2500 (Walz Inc., 德国)测定叶绿素荧光参数。测定工作在2014年10月27日至11月2日全晴天进行。使用仪器自带程序获取的主要叶绿素荧光参数为: Fo (初始荧光)、Fm (最大荧光)、Fv=Fm-Fo (可变荧光)、Fv/Fm (最大光化学效率)、ΦPSII (光系统Ⅱ实际光化学效率)和ETR (相对电子传递速率)等。Fv/Fm在凌晨日出前测定;ΦPSⅡ在上午10:00—11:00自然光下测定;ETR=ΦPSII×PFD×0.5×0.84[34]。
1.4 数据分析所有数据用Microsoft Excel 2013进行整理,采用SPSS 13.0 (SPSS Inc., Chicago, IL, USA)进行统计分析,当P < 0.05时表示有统计学意义。各处理光强间和全光照下植物间叶绿素荧光参数的差异使用单因素方差分析(One-way ANOVA)方法进行显著性检验,当差异显著时以Tukey post hoc comparisons法进行多重比较。
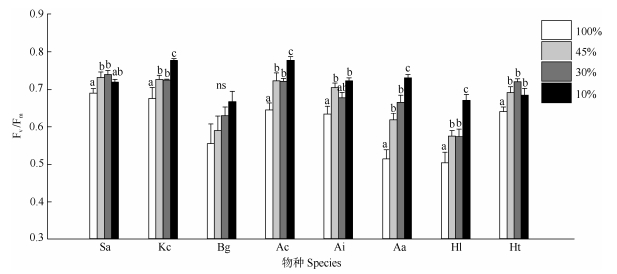
2 结果和分析单因素方差分析结果表明(表 1),光照强度对无瓣海桑、秋茄、桐花树、老鼠簕、卤蕨、银叶树和黄槿幼苗叶片Fv/Fm影响显著,对木榄幼苗叶片Fv/Fm影响不显著。无瓣海桑和黄槿叶片Fv/Fm随光照强度的下降呈现先升后降的趋势,在45%和30%遮荫处理下较高,显著高于全光照;在10%遮荫处理下有一定程度的下降。秋茄、桐花树、老鼠簕、卤蕨和银叶树叶片Fv/Fm在10%光照处理组最高,显著高于其他处理(图 1)。在全光照处理下,无瓣海桑、秋茄、桐花树、老鼠簕和黄槿的叶片Fv/Fm较高(表 2)。
| 表 1 遮荫对8种红树幼苗叶片Fv/Fm、ΦPSⅡ和ETR的影响的单因素方差分析结果(F值) Table 1 One-Way ANOVA (F value) of leaf Fv/Fm, ΦPSII and ETR of eight mangrove seedlings under shading |
|
图 1 遮荫对8种红树幼苗叶片Fv/Fm的影响。Sa、Kc、Bg、Ac、Ai、Aa、Hl、Ht见表 1。不同字母表示差异显著。下同 Fig. 1 Effect of shading on maximal photochemical efficiency (Fv/Fm) in leaves of eight mangrove seedlings. Sa, Kc, Bg, Ac, Ai, Aa, Hl, Ht see Table 1. Different letters indicate significantly differences at 0.05 level. The same below |
| 表 2 全光照下8种红树植物幼苗叶片的Fv/Fm、ΦPSII和ETR Table 2 Fv/Fm, ΦPSII and ETR in leaves of eight mangrove seedlings under natural full sunlight |
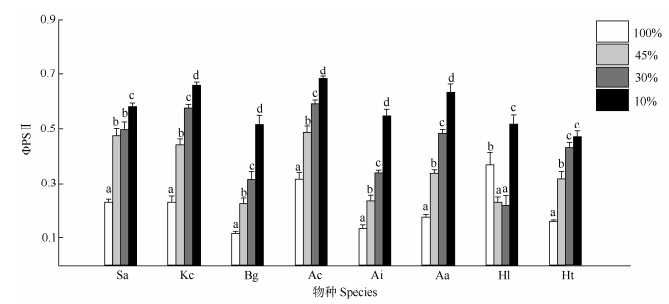
单因素方差分析结果表明(表 1),生长光强对叶片ΦPSII的影响在8种红树幼苗中均表现为显著。除银叶树外,其他7种红树植物叶片ΦPSII均随着光照强度的降低而升高。在10%光照下,8种红树幼苗的ΦPSII均较高,显著高于另外3组光照处理。除银叶树外,其他红树植物叶片的ΦPSII均在全光照下最低,显著低于其他遮荫处理(图 2)。全光照下,无瓣海桑、秋茄、桐花树和银叶树的叶片ΦPSII相对较高(表 2)。
|
图 2 遮荫对8种红树幼苗叶片ΦPSII的影响 Fig. 2 Actual photochemical efficiency (ΦPSII) in leaves of 8 mangrove seedlings under shading |
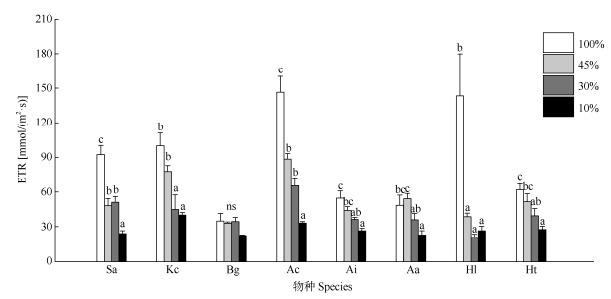
单因素方差分析表明,光照强度对叶片ETR的影响在无瓣海桑、秋茄、桐花树、老鼠簕、卤蕨、银叶树和黄槿幼苗中表现显著,在木榄幼苗中表现不显著(表 1)。在8种红树幼苗中ETR随光照强度的下降而下降(图 3)。无瓣海桑、秋茄、桐花树、老鼠簕、银叶树和黄槿ETR在全光照处理下显著高于3个遮荫处理,木榄ETR在各光照强度处理间差异不显著(图 3)。全光照条件下,无瓣海桑、秋茄、桐花树和银叶树的叶片ETR相对较高(表 2)。
|
图 3 遮荫对8种红树幼苗叶片ETR的影响 Fig. 3 Effects of shading on electron transport rate (ETR) in leaves of eight mangrove seedlings |
叶绿素荧光不但可以用来反映光系统Ⅱ的光化学效率,而且还可以用来指示植物对环境胁迫的耐受能力以及环境胁迫对植物光系统的破坏程度[28, 34]。Fv/Fm是研究植物光合生理状态的重要叶绿素荧光参数,能表征开放的PSⅡ反应中心捕获激发能的效率。由于在非胁迫环境下Fv/Fm的变化极小,多数植物的Fv/Fm稳定维持在0.8以上,因此有学者提出利用Fv/Fm作为植物受到光抑制的信号[35]。而光胁迫对植物Fv/Fm影响的研究表明,半夏(Pinellia ternate)的Fv/Fm随着光照强度的增加而降低,说明光照强度增加是光系统活性降低的主要原因[36]。耿晓东等[37]报道2种萱草属(Hemerocallis)植物在重度遮荫下Fv/Fm下降较大,说明其在重度遮荫环境中受到了严重的光抑制。Chen等[38]报道施加强光后番茄(Lycopersicon esculentum)幼苗的Fv/Fm表现出快速下降趋势,并且下降速度随着施加光强的增强而加快,Fv/Fm的值在施加强光后普遍低于0.8,呈现明显的强光抑制现象。有研究表明红树植物的Fv/Fm较低,平均约为0.75,全光照处理下更是普遍低于0.65[39–40]。Bjorkman等[39]的研究表明生长在自然光照条件下的红树植物叶片由于接收到超量的激发能,表现出叶绿素荧光被大量猝灭的现象,导致其PSII反应中心光化学反应效率降低。这可能说明红树植物生境中的自然光强对红树植物其实是过剩的。本研究中多数红树植物在不同生长光强下的Fv/Fm为0.69~0.75,并且除木榄外所有红树植物幼苗的Fv/Fm值在遮荫条件下显著高于100%光照。这说明PSII反应中心在100%光照条件下受到一定程度破坏,产生了光抑制,造成红树植物叶片光化学效率降低,并且红树植物在100%光照条件下受到的胁迫伤害要大于遮荫处理。同时,在本研究中不同红树植物的叶片Fv/Fm随着表光强度变化表现出的变化趋势不同,无瓣海桑和黄槿的叶片Fv/Fm在45%和30%光强处理下较高,表明其在该光强处理下光能转化效率最高;而秋茄、桐花树、卤蕨和银叶树的叶片Fv/Fm则均随着光照强度的下降而增加, 表明这些红树植物潜在的最大光合效率出现在10%光强处理下。也有研究指出,Fv/Fm的提高有利于光合器官把捕获的光能以更高的效率转化为化学能,有利于光合效率的提高[41]。因此本研究中遮荫条件下红树幼苗的Fv/Fm表现出的升高趋势可能表示其在遮荫条件下能有效改善叶片的光合功能。同时,在100%光照条件下,无瓣海桑、秋茄、桐花树和黄槿相比于其他红树植物表现出了较高的Fv/Fm,可能表明这些红树植物在高光强下有着较高的光合效率,表现出典型的阳生树种的特性。
ΦPSII是光系统Ⅱ电子转移中的实际光化学效率,用于表示被光系统Ⅱ利用的光化学能与被光系统Ⅱ吸收的总光能之比[38]。有研究表明,植物在低光照条件下光系统Ⅱ的实际光化学效率较高光照条件下的高[42]。这是由于在高光照条件下叶片所吸收的光能中有很大比例通过其它过程散失,而没有被用于光化学反应。也有研究指出,植物在最适光照条件下表现出最大的ΦPSII,过高或过低的光照强度都会使植物ΦPSII值下降[38]。在本研究中,除了银叶树之外的7种红树植物幼苗ΦPSII均随着遮荫强度的增加而增加,表明他们在遮荫条件下具有更高的光能利用率。在100%光照条件下,桐花树和银叶树的ΦPSII显著高于木榄、老鼠簕和卤蕨,表明这2种红树植物比木榄、老鼠簕和卤蕨更加耐高光辐射。
ETR能反映植物有效耗散过剩光能的光保护作用的大小[22]。ETR的上升,表明光合电子传递速率增加,能够将多余的光能用于CO2同化或者可能将大量的电子分配到光呼吸中;如果ETR降低,其同化CO2以及有效耗散过剩光能的光保护作用也相应降低[22]。有研究表明,长期生长在高光环境下的三七(Panax notoginseng)的非光化学猝灭能力并没有得到提升,其通过提高ETR来提高光能利用率,并以此来适应高光环境,从而避免长期的高光环境对其光合器官产生不可逆的伤害[43]。本研究表明, 除了木榄和卤蕨之外,其他6种红树植物的ETR均随着光照强度的降低而降低,表明由于光照强度的减弱,叶片过剩光能减少,因此ETR也随之下降,这与从ΦPSII揭示的结果相一致。同时,桐花树和银叶树在100%光照强度下的叶片ETR显著高于木榄、老鼠簕和卤蕨,表明这2种红树植物在高光中能够更好的保护光合器官。
综上所述,遮荫对红树植物幼苗叶片叶绿素荧光参数具有明显的影响。本研究的8种红树植物在遮荫处理后Fv/Fm和ΦPSII呈增加趋势,而ETR则显示出下降态势,表明其在遮荫条件下具有更高的光合效率和光能利用率。同时无瓣海桑、秋茄、桐花树、银叶树和黄槿则在全光照下也表现出比其它红树植物更高的叶片Fv/Fm,桐花树和银叶树在全光照条件下的叶片ΦPSII和ETR也显著高于木榄、老鼠簕和卤蕨,说明无瓣海桑、秋茄、桐花树和黄槿在强光条件下具有比其它红树植物更高的光能利用率,而桐花树和银叶树则具有比木榄、老鼠簕和卤蕨更强大的光合器官保护功能,能更好的利用强光并耗散过剩光能,以此来保护光合器官。无瓣海桑在我国红树林生态系统的大范围扩散,导致滩涂的光照条件大大减弱,极有可能会挤压本土物种的生存空间。因此,要在郁闭度极高的无瓣海桑群落进行林分改造,就要充分考虑各种红树植物在不同光照条件下的生理生态响应特征。从叶绿素荧光参数来看,8种红树植物中,秋茄、桐花树、银叶树和黄槿更适合作为本土树种代替无瓣海桑在中上层种植。而木榄、老鼠簕和卤蕨在高光辐射下ΦPSII均不足0.2,ETR也仅为阳生物种的20%~33%,因此这3种红树植物可能更适合种植在光照条件稍弱的林下。根据不同红树植物的光照适应特点对红树林群落进行林分改造,能够进一步丰富红树林生态系统的生物多样性并改善其生态系统服务功能。
| [1] |
LIN P. Mangroves[M]. Beijing: Ocean Press, 1984: 28-31. 林鹏. 红树林[M]. 北京: 海洋出版社, 1984: 28-31. |
| [2] |
LIN P. A review on the mangrove research in China[J]. J Xiamen Univ (Nat Sci), 2001, 40(2): 592-603. 林鹏. 中国红树林研究进展[J]. 厦门大学学报(自然科学版), 2001, 40(2): 592-603. DOI:10.3321/j.issn:0438-0479.2001.02.050 |
| [3] |
REN H, LU H F, SHEN W J, et al. Sonneratia apetala Buch. Ham in the mangrove ecosystems of China: An invasive species or restoration species?[J]. Ecol Eng, 2009, 35(8): 1243-1248. DOI:10.1016/j.ecoleng.2009.05.008 |
| [4] |
LI Z Q, LIN Z D, XUE C Q. The succession and distribution of mangrove community in Guangdong[J]. Guangdong For Sci Technol, 2002, 18(2): 52-55. 黎植权, 林中大, 薛春泉. 广东省红树林植物群落分布与演替分析[J]. 广东林业科技, 2002, 18(2): 52-55. DOI:10.3969/j.issn.1006-4427.2002.02.013 |
| [5] |
DASGUPTA R, SHAW R. Participatory Mangrove Management in a Changing Climate[M]. Tokyo: Springer, 2017: 2. DOI:10.1007/978-4-431-56481-2
|
| [6] |
TEMMERMAN S, MEIRE P, BOUMA T J, et al. Ecosystem-based coastal defence in the face of global change[J]. Nature, 2013, 504(7478): 79-83. DOI:10.1038/nature12859 |
| [7] |
TOMLINSON P B. The Botany of Mangroves[M]. 2nd ed. New York: Cambridge University Press, 2016: 11-14.
|
| [8] |
VALIELA I, BOWEN J L, YORK J K. Mangrove forests: One of the world's threatened major tropical environments[J]. BioScience, 2001, 51(10): 807-815. DOI:10.1641/0006-3568(2001)051[0807:Mfootw]2.0.Co;2 |
| [9] |
DUKE N C, MEYNECKE J O, DITTMANN S, et al. A world without mangroves?[J]. Science, 2007, 317(5834): 41-42. DOI:10.1126/science.317.5834.41b |
| [10] |
LIAO B W, ZHANG Q M. Area, distribution and species composition of mangroves in China[J]. Wetland Sci, 2014, 12(4): 435-440. 廖宝文, 张乔民. 中国红树林的分布、面积和树种组成[J]. 湿地科学, 2014, 12(4): 435-440. DOI:10.13248/j.cnki.wetlandsci.2014.04.005 |
| [11] |
DAY J W JR, BOESCH D F, CLAIRAIN E J, et al. Restoration of the Mississippi Delta: Lessons from Hurricanes Katrina and Rita[J]. Science, 2007, 315(5819): 1679-1684. DOI:10.1126/science.1137030 |
| [12] |
STONE R. A rescue effort for tsunami-ravaged mangrove forests[J]. Science, 2006, 314(5798): 404. DOI:10.1126/science.314.5798.404 |
| [13] |
LEWIS III R R. Ecological engineering for successful management and restoration of mangrove forests[J]. Ecol Eng, 2005, 24(4): 403-418. DOI:10.1016/j.ecoleng.2004.10.003 |
| [14] |
LIAO B W, LI M, CHEN Y J, et al. Techniques on Restoration and Reconstruction of Mangrove Ecosystem in China[M]. Beijing: Science Press, 2010: 22-23. 廖宝文, 李玫, 陈玉军, 等. 中国红树林恢复与重建技术[M]. 北京: 科学出版社, 2010: 22-23. |
| [15] |
WANG Y S. Assessment and Remediation Techniques of Mangrove Ecosystems[M]. Beijing: Science Press, 2013: 181. 王友绍. 红树林生态系统评价与修复技术[M]. 北京: 科学出版社, 2013: 181. |
| [16] |
ZHANG Q M. Status of tropical biological coasts of China: Implications on ecosystem restoration and reconstruction[J]. Oceanol Limnol Sin, 2001, 32(4): 454-464. 张乔民. 我国热带生物海岸的现状及生态系统的修复与重建[J]. 海洋与湖沼, 2001, 32(4): 454-464. DOI:10.3321/j.issn:0029-814X.2001.04.015 |
| [17] |
TAN S J, LI T, YU S R, et al. Effects of light intensity on growth and biomass allocation of seedlings of the eight mangrove species[J]. Ecol Sci, 2020, 39(3): 139-146. 谭淑娟, 李婷, 余素睿, 等. 光照强度对8种红树植物幼苗生长和生物量分配的影响[J]. 生态科学, 2020, 39(3): 139-146. DOI:10.14108/j.cnki.1008-8873.2020.03.019 |
| [18] |
KALAJI H M, CARPENTIER R, ALLAKHVERDIEV S I, et al. Fluorescence parameters as early indicators of light stress in barley[J]. J Photochem Photobiol B: Biol, 2012, 112: 1-6. DOI:10.1016/j.jphotobiol.2012.03.009 |
| [19] |
GUANTER L, ZHANG Y G, JUNG M, et al. Global and time-resolved monitoring of crop photosynthesis with chlorophyll fluorescence[J]. Proc Natl Acad Sci USA, 2014, 111(14): E1327-E1333. DOI:10.1073/pnas.1320008111 |
| [20] |
TANG M, ZHAI X M, LI J, et al. Study on chlorophyll fluorescence characteristics of tea cultivars (lines) in different phenological stages[J]. S China Agric, 2020, 14(28): 9-12. 唐敏, 翟秀明, 李解, 等. 不同物候期茶树品种(系)叶绿素荧光特性研究[J]. 南方农业, 2020, 14(28): 9-12. DOI:10.19415/j.cnki.1673-890x.2020.28.003 |
| [21] |
BILGER W, BJÖRKMAN O. Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absorbance changes, fluorescence and photosynthesis in leaves of Hedera canariensis[J]. Photosynth Res, 1990, 25(3): 173-185. DOI:10.1007/bf00033159 |
| [22] |
KOBLíŽEK M, KAFTAN D, NEDBAL L. On the relationship between the non-photochemical quenching of the chlorophyll fluorescence and the photosystem Ⅱ light harvesting efficiency. A repetitive flash fluorescence induction study[J]. Photosynth Res, 2001, 68(2): 141-152. DOI:10.1023/A:1011830015167 |
| [23] |
JIANG Y, LIU X, HUANG Z L, et al. Impact of salinity on plant growth and chlorophyll fluorescence in two semi-mangroves[J]. Chin J Trop Agric, 2012, 32(11): 7-12. 姜英, 刘秀, 黄志玲, 等. 盐度对2种半红树植物生长及叶绿素荧光特性的影响[J]. 热带农业科学, 2012, 32(11): 7-12. DOI:10.3969/j.issn.1009-2196.2012.11.003 |
| [24] |
WU M L, WANG G, CHEN L S, et al. Response of chlorophyll a fluorescence of Kandelia obovata to salinity environments in Zhangjiang Estuary[J]. J Quanzhou Norm Univ, 2013, 31(2): 84-89. 吴敏兰, 王果, 陈立松, 等. 漳江口优势红树植物秋茄叶绿素荧光特性对盐度环境的响应[J]. 泉州师范学院学报, 2013, 31(2): 84-89. DOI:10.16125/j.cnki.1009-8224.2013.02.010 |
| [25] |
LIAO B W, QIU F Y, ZHANG L E, et al. Effect of salinity on the growth and eco-physiological characteristics of Bruguira sexangula var. rhynchopetala seedlings[J]. Acta Ecol Sin, 2010, 30(23): 6363-6371. 廖宝文, 邱凤英, 张留恩, 等. 盐度对尖瓣海莲幼苗生长及其生理生态特性的影响[J]. 生态学报, 2010, 30(23): 6363-6371. |
| [26] |
LIAO B W, QIU F Y, TAM F Y, et al. Study on the adaptability of mangrove Kandelia candel seedlings to simulated tidal inundation[J]. J S China Agric Univ, 2009, 30(3): 49-54. 廖宝文, 邱凤英, 谭凤仪, 等. 红树植物秋茄幼苗对模拟潮汐淹浸时间的适应性研究[J]. 华南农业大学学报, 2009, 30(3): 49-54. DOI:10.3969/j.issn.1001-411X.2009.03.012 |
| [27] |
KELLY J, JOSE S, NICHOLS J D, et al. Growth and physiological response of six Australian rainforest tree species to a light gradient[J]. For Ecol Manag, 2009, 257(1): 287-293. DOI:10.1016/j.foreco.2008.09.008 |
| [28] |
WANG Y, TONG Y F, CHU H L, et al. Effects of different light qualities on seedling growth and chlorophyll fluorescence parameters of Dendrobium officinale[J]. Biologia, 2017, 72(7): 735-744. DOI:10.1515/biolog-2017-0081 |
| [29] |
ZHANG J J, ZHU L, ZHANG X, et al. Photosynthetic performance and growth responses of Liriope muscari (Decne.) L.H. Bailey (Asparagaceae) planted within poplar forests having different canopy densities[J]. BMC Ecol, 2020, 20(1): 25. DOI:10.1186/s12898-020-00294-7 |
| [30] |
LIAO B W, TIAN G H, YANG X B, et al. The analysis of natural regeneration and diffusion of the seedling of Sonneratia apetala in the Qi'ao Island, Zhuhai[J]. Ecol Sci, 2006, 25(6): 485-488. 廖宝文, 田广红, 杨雄邦, 等. 珠海淇澳岛无瓣海桑种苗天然更新与扩散分析[J]. 生态科学, 2006, 25(6): 485-488. DOI:10.3969/j.issn.1008-8873.2006.06.002 |
| [31] |
CAI S H, LI T, ZHOU G X, et al. Gas exchange characteristics in the mangrove associate Hibiscus tiliaceus[J]. Guihaia, 2016, 36(4): 397-404. 蔡水花, 李婷, 周光霞, 等. 半红树植物黄槿的气体交换特性[J]. 广西植物, 2016, 36(4): 397-404. DOI:10.11931/guihaia.gxzw201403011 |
| [32] |
HUANG L, ZHAN C A. Analysis on introduction and trial of mangrove Sonneratia apetala on the seashore of east Guangdong[J]. For Sci Technol, 2003(5): 7-8. 黄陵, 詹潮安. 粤东沿海引种无瓣海桑试验研究[J]. 林业实用技术, 2003(5): 7-8. DOI:10.13456/j.cnki.lykt.2003.05.002 |
| [33] |
JIN S H, HUANG J Q, LI X Q, et al. Effects of potassium supply on limitations of photosynthesis by mesophyll diffusion conductance in Carya cathayensis[J]. Tree Physiol, 2011, 31(10): 1142-1151. DOI:10.1093/treephys/tpr095 |
| [34] |
MAXWELL K, JOHNSON G N. Chlorophyll fluorescence: A practical guide[J]. J Exp Bot, 2000, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
| [35] |
HE J, CHEE C W, GOH C J. 'Photoinhibition' of Heliconia under natural tropical conditions: The importance of leaf orientation for light interception and leaf temperature[J]. Plant Cell Environ, 1996, 19(11): 1238-1248. DOI:10.1111/j.1365-3040.1996.tb00002.x |
| [36] |
DONG Y, CHEN J W, XIE S Q, et al. Adaptation of Pinellia ternate photoreaction system to diurnal changes of light and temperature[J]. Guihaia, 2021, 41(9): 1486-1496. 董益, 陈军文, 谢世清, 等. 半夏光系统对光照和温度日变化的适应[J]. 广西植物, 2021, 41(9): 1486-1496. DOI:10.11931/guihaia.gxzw201911043 |
| [37] |
GENG X D, WANG J Q, ZHOU Y, et al. Physiological characteristics and chlorophyll fluorescence parameters of three Hemerocallis species under different light intensities[J]. Mol Plant Breed, 2023, 21(4): 1322-1329. 耿晓东, 王菊秋, 周英, 等. 不同光照强度下3种萱草属植物的光合特性与叶绿素荧光特性[J]. 分子植物育种, 2023, 21(4): 1322-1329. DOI:10.13271/j.mpb.021.001322 |
| [38] |
CHEN D Y, YUAN K K, ZHANG J H, et al. Response analysis of fluorescence parameters of tomato seedlings oriented to vertical light environment adaptation[J]. Plant Sci, 2022, 314: 111118. DOI:10.1016/j.plantsci.2021.111118 |
| [39] |
BJORKMAN O, DEMMIG B, ANDREWS T J. Mangrove photosyn-thesis: Response to high-irradiance stress[J]. Aust J Plant Physiol, 1988, 15(2): 43-61. DOI:10.1071/pp9880043 |
| [40] |
SOBRADO M A, BALL M C. Light use in relation to carbon gain in the mangrove, Avicennia marina, under hypersaline conditions[J]. Aust J Plant Physiol, 1999, 26(3): 245-251. DOI:10.1071/pp98075 |
| [41] |
SHI X D, WANG W J, WANG W W, et al. Response of photosynthetic characteristics in leaves of cigar wrapper tobacco to nitrogen application under shady condition[J]. Plant Nutr Fert Sci, 2007, 13(2): 299-304. 时向东, 汪文杰, 王卫武, 等. 遮荫下氮肥用量对雪茄外包皮烟叶光合特性的调控效应[J]. 植物营养与肥料学报, 2007, 13(2): 299-304. DOI:10.11674/zwyf.2007.0219 |
| [42] |
WU F Y, YI L T, LI X P, et al. Effect of different light intensity on intensity chlorophyll content and chlorophyll fluorescence in Lithocarpus glaber[J]. J NE Agric Univ, 2012, 43(4): 88-92. 吴飞燕, 伊力塔, 李修鹏, 等. 不同光照强度对石栎幼苗叶绿素含量及叶绿素荧光参数的影响[J]. 东北农业大学学报, 2012, 43(4): 88-92. DOI:10.19720/j.cnki.issn.1005-9369.2012.04.016 |
| [43] |
XU X Z, ZHANG J Y, ZHANG G H, et al. Effects of light intensity on photosynthetic capacity and light energy allocation in Panax notoginseng[J]. Chin J Appl Ecol, 2018, 29(1): 193-204. 徐祥增, 张金燕, 张广辉, 等. 光强对三七光合能力及能量分配的影响[J]. 应用生态学报, 2018, 29(1): 193-204. DOI:10.13287/j.1001-9332.201801.008 |
 2023, Vol. 31
2023, Vol. 31


