近十几年来,人工纳米材料的应用日益广泛, 金属及金属氧化物纳米材料在许多领域中都占有一席之地,如建筑材料、化妆品[1]、食品添加剂[2]等。然而,纳米材料在生产、包装、使用过程中不可避免地释放到环境中,与环境相互作用,不仅对环境中的动植物产生毒性效应,还可能通过食物链的富集影响人类健康。由于纳米粒子、植物种类、地域环境等因素的不同,导致目前有关纳米粒子对植物毒性影响的研究结果多种多样,即使是同一种纳米粒子,同种植物,研究结论也不尽相同[3–4]。
TiO2 NPs作为目前国内产量最高、需求最大、应用领域最广泛的纳米材料之一,其毒性研究主要集中在藻类、微生物、无脊椎动物、哺乳动物及鱼类,对植物影响的研究较少。探究TiO2 NPs对植物生理效应影响,了解其对环境及生态系统的潜在危害,对规范其使用具有积极意义。
已有研究表明TiO2 NPs可以在植物组织中进行运输和积累,从而影响植物的生理代谢。兰丽贞等[5]研究表明TiO2 NPs减缓拟南芥(Arabidopsis thaliana)种子的萌发,抑制光系统II活性、碳同化和光合碳代谢,降低光合作用效率,进而抑制拟南芥的生长。隋海君等[6]报道TiO2 NPs进入玉米(Zea mays)幼苗后,从根部运输到各个部位,根部和地上部的生物累积系数分别为35.4%和13.6%,转运系数为0.38。吴碧莹[7]的研究表明,在TiO2 NPs暴露下水稻(Oryza sativa)体内能量代谢增强,糖累积降低,导致生物量降低,同时部分营养物质合成增强,最终可能影响到水稻的作物品质。也有研究表明TiO2 NPs对植物生长有积极作用。谢冬娣等[8]报道咪鲜胺添加纳米TiO2能明显延长淮山(Dioscorea oppo- sitifolia)贮藏寿命,降低腐烂指数和失质量率。陶希芹等[9]制备的壳聚糖/纳米TiO2复合涂膜可以显著降低金秋梨(Pyrus spp.)的呼吸作用,有利于果实的贮藏。刘娅等[10]报道TiO2 NPs通过减轻Cd氧化胁迫作用,有效缓解了Cd对小麦(Triticum aestivum)幼苗的毒害,提高了小麦幼苗的光合作用。纳米TiO2对植物的毒性效应受浓度、植物种类、培养方式、暴露途径等因素的影响,在不同试验条件下, 纳米TiO2对植物产生的毒性效应也有不同的表现。王苗苗等[11]报道TiO2 NPs作为载体显著促进了小白菜(Brassica campestris)根系对Cd的吸收,并使其转运至地上部,引起膜脂过氧化,破坏幼苗的叶绿体结构和抗氧化系统,增强Cd对小白菜生长的抑制作用。
生菜是美国环境保护署规定的研究污染物的植物吸收与迁移的18种标准植物之一,具有极大的研究价值,常作为研究纳米粒(石墨相氮化碳纳米材料[12]、氨基化碳纳米管[13]、纳米CeO2[14]、纳米Fe3O4[15]等)对植物生长胁迫以及毒性效应的实验材料。目前,关于TiO2 NPs对生菜的生长效应影响还未见报道。因此,本研究自行设计制作生菜水培装置,考察TiO2 NPs对生菜生长指标、抗氧化酶活性和过氧化氢含量的影响,探讨TiO2 NPs对生菜的生长效应,旨在为研究纳米颗粒对植物的毒性效应, 以及纳米材料生产应用的科学管理提供一定的理论依据。
1 材料和方法 1.1 材料供试材料生菜(Lactuca sativa)种子从国外引进品种中选出,购于中蔬种业科技(北京)有限公司。
纳米材料及主要试剂:TiO2 NPs购于南京先丰纳米材料科技有限公司,样品纯度 > 99%;植物蛋白提取试剂盒购于北京康为世纪生物科技有限公司; 蛋白浓度测定试剂盒(Thermo PierceTM BCA Protein Assay Kit)购于赛默飞世尔科技公司;过氧化物酶(POD)和超氧化物歧化酶(SOD)测定测试盒购于南京建成生物工程研究所;DAB购于Sigma-Aldrich (D12384);改良型霍格兰营养液购于北京酷来搏科技有限公司。
1.2 方法 1.2.1 TiO2 NPs溶液的配置TiO2 NPs产生植物效应的浓度范围为0.01~1 000 mg/L[16–18]。称取TiO2粉末分散于霍格兰营养液中,并进行超声处理,分别配置成0、300、600、900 mg/L溶液。为探究更高浓度TiO2 NPs对生菜生长发育的影响是否符合大多金属纳米离子对植物低促高抑规律[16],另配置了1 200 mg/L TiO2 NPs溶液。
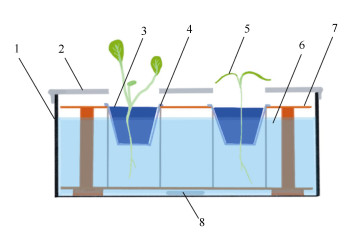
1.2.2 水培试验装置的制作如图 1所示,将配置好的5种浓度的TiO2 NPs溶液分别放进5个长方形种植盒中,并放入一枚磁力搅拌子。将离心管架用锡箔纸分成5个隔层,放进TiO2 NPs溶液中,用剪刀在一张大的锡箔纸剪出5个大小适中的洞,并将这张锡箔纸盖在种植盒上当做盖子。把生菜苗放入定植棉中,与定植篮一同放入小洞中,使TiO2 NPs溶液没过生菜的根。设1组对照组,4组试验组,共5组。
|
图 1 水培实验装置。1: 长方形种植盒; 2: 锡箔纸; 3: 定植棉; 4: 定植篮; 5: 植株; 6: 含TiO2 NPs的营养液; 7: 离心管架; 8: 转子。 Fig. 1 Hydroponic experimental device. 1: Rectangular planting box; 2: Tinfoil; 3: Stereotypes cotton; 4: Planting basket; 5: Plant; 6: TiO2 NPs solution; 7: Centrifugal tube; 8: Rotor. |
取颗粒饱满,大小均一的生菜种子清水浸泡3 h后,放在蒸馏水浸润的滤纸上于恒温培养箱内黑暗发芽2 d,培养箱温度为(25±1) ℃。选用发芽状态良好的幼苗转移至霍格兰营养液中培养5 d, 之后将幼苗转移至含有TiO2 NPs的霍格兰营养液中进行胁迫处理,每处理重复3次,7 d后对生菜取样。
1.3 指标测定 1.3.1 TiO2 NPs的粒径分析称取一定量的TiO2粉末,分散在蒸馏水中,制成悬液,利用超声波清洗器(昆山市超声仪器有限公司)对悬液进行超声(300 W, 15 min)处理使颗粒分散, 使用Nano ZS90纳米粒度及zeta电位仪(英国马尔文公司)进行悬液中纳米粒子的粒径分析。结果表明TiO2 NPs样品为单分散体,粒径主要分布在450~ 900 nm,平均粒径560.8 nm (图 2)。这个粒径大小的TiO2比较容易进入植物体内。

|
图 2 TiO2 NPs的粒径分布 Fig. 2 Size distribution of nano-TiO2 particles |
主要考察不同浓度TiO2 NPs对生菜生长指标的影响,包括根长、茎长、鲜重、叶表面积。将收获后的生菜用蒸馏水清洗3次,并用吸水纸将水分吸干,随机挑取生菜3株,用电子天平准确称取重量。然后选取最大叶片使用坐标纸进行叶面积测量。
1.3.3 SOD、POD活性和H2O2含量测定使用Solarbio的POD和SOD试剂盒进行检测。取1 g生菜根加9 mL 1×PBS (0.1 mol/L pH 7~7.4)制成10%的匀浆液,1 500×g离心10 min,取上清液待测。
SOD活性测定 10%匀浆液再用PBS稀释10倍。分别在对照孔、对照空白孔、测定孔、测定空白孔加入待测样品、酶工作液等相关试剂,在37 ℃恒温孵育20 min后,使用酶标仪在450 nm波长下测定吸光度值。根据公式计算SOD活性。
POD活性测定 在对照孔和测定孔中分别加入待测样品和相关试剂,在37 ℃下水浴30 min后,加入显色剂,混匀后1 200×g离心10 min,取上清液于波长420 nm处测定吸光度值。根据公式计算POD活性。
H2O2含量测定 参照Kumar等[19]的方法对生菜叶片进行DAB染色。首先配置DAB溶液(黑暗条件下进行),称取45 mg的DAB溶解于40 mL蒸馏水中,使用0.1 mol/L的HCl将pH调节至3.8, 完全溶解时,溶液是浅棕色透明的,此时加入蒸馏水使体积达到50 mL,得到1 mg/mL溶液。将叶子放入铝箔包裹的离心管中,加入DAB染色液,在室温下过夜12~16 h。将幼苗浸入无水乙醇中,并在沸水浴中加热10 min,除去叶绿素。之后将幼苗转移到一张浸有60%甘油的纸巾上。通过颜色对比, 确定H2O2含量。
1.4 数据的统计分析采用SPSS 20.0软件进行数据统计和单因素方差分析,结果以平均值±标准偏差表示;采用最小显著差数法(LSD)对数据进行显著性检验(P < 0.05)。利用Prism 8和Excel对数据进行绘图。
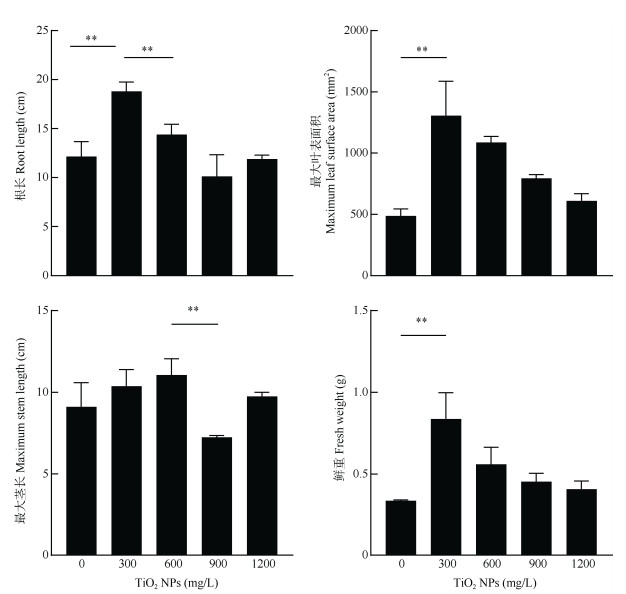
2 结果和分析 2.1 TiO2 NPs对生长指标的影响由图 3可见,在300 mg/L TiO2 NPs低浓度处理下,生菜根长有较为明显的增加,比对照长了约57%。随TiO2 NPs浓度升高,TiO2 NPs对根长的促进作用减弱。当TiO2 NPs增大到900 mg/L时,生菜根长比对照略有降低。1 200 mg/L TiO2 NPs下根长与对照相近,但比900 mg/L时略有升高。这说明水培条件下,0~600 mg/L TiO2 NPs暴露对生菜根伸长有促进作用,900 ~1 200 mg/L还未显现显著的毒性作用。
|
图 3 TiO2 NPs对生菜生长的影响。**: P < 0.01。下同 Fig. 3 Effect of TiO2 NPs on growth of Lactuca sativa. **: P < 0.01. The same below |
在TiO2 NPs为300 mg/L时,生菜最大叶表面积显著增大,为对照的2.6倍。随TiO2 NPs浓度升高, 最大叶表面积呈逐渐下降趋势,但仍高于对照组。
低浓度TiO2 NPs (300和600 mg/L)暴露促进了生菜茎的生长,而随着浓度升高,TiO2 NPs开始对生菜茎长产生抑制,在900 mg/L下茎的生长受到抑制,长度约为对照的75%;但在1 200 mg/L下抑制作用消失,茎长生长回复到对照水平。
低浓度(300 mg/L)的TiO2 NPs会对生菜生长产生明显促进作用,其鲜重是对照的2.5倍;随着TiO2 NPs浓度升高,生菜鲜重呈下降趋势,但仍高于对照。
可见,生菜对TiO2 NPs的响应具有浓度依赖性, 低浓度处理时TiO2 NPs可以促进植物生长,但是当浓度升高到一定数值时,这种促进作用会转变为一定的毒性作用,整体表现为“低促高抑”。
2.2 TiO2 NPs对生菜抗氧化酶活性的影响纳米粒子进入细胞后会引起活性氧(reactive oxygen species, ROS)生成。低水平ROS可以作为信号分子参与植物的生长发育,但是在胁迫条件下过量积累的ROS会导致细胞膜、DNA、蛋白质等其他细胞成分受损,从而抑制植物的生长[20]。为消除过量ROS的不利影响,植物会通过调节自身的抗氧化酶(SOD、POD)活性来维持体内的氧化平衡。
SOD在活性氧清除系统中作为第一道防线,能够将超氧阴离子自由基歧化成氧和过氧化氢,最后代谢成对机体无害的氧和水,在抗氧化酶中处于核心地位[21]。SOD在植物体内的水平高低可表征其抗不良胁迫能力。由图 4可见,在300 mg/L TiO2 NPs处理下,SOD活性出现了明显下降,推测TiO2 NPs对生菜产生了一定的毒性效应,但生菜并不将其作为严重的威胁;随着TiO2浓度的升高,SOD活性也逐步提升,推测生菜通过提升SOD活性逐渐清除ROS。

|
图 4 TiO2 NPs对生菜SOD和POD活性的影响。*: P < 0.05; ***: P < 0.001 Fig. 4 Effect of TiO2 NPs on activities of SOD and POD. *: P < 0.05; ***: P < 0.001 |
POD是一种活性较高的适应性酶,在逆境初期可清除H2O2,保护机体免受H2O2的损害。在300~ 900 mg/L TiO2 NPs处理下,POD活性显著提升。但在1 200 mg/L处理下POD活性显著降低,可能是由于TiO2 NPs浓度过高,毒性作用增强,致使POD活性下降。
2.3 TiO2 NPs对生菜H2O2含量的影响H2O2是一种活性氧(ROS),可以通过其含量的多少来判断植物体内ROS的相对含量。3, 3′-二氨基联苯胺(DAB)在过氧化物酶存在下,可以被H2O2氧化生成暗褐色沉淀,常被用作染色剂。采用DAB染色法可检测植物细胞中H2O2的存在和分布。
从图 5可见,暴露于0~900 mg/L TiO2 NPs下, 生菜叶片无明显的棕色沉淀,而在1 200 mg/L处理后,叶片上出现大片棕色沉淀,这表明H2O2在叶片中逐渐积累,导致生菜内部系统受到破坏,大量棕色沉淀表现在叶片上。

|
图 5 TiO2 NPs对生菜H2O2含量的影响 Fig. 5 Effect of TiO2 NPs on H2O2 content of Lactuca sativa |
纳米粒子会对植物生长产生促进或者毒性效应,引起植物生长指标的变化。用TiO2 NPs处理时, 生菜会产生相应的应激反应,其生长状态与TiO2 NPs浓度具有依赖性,表现为“低促高抑”。赵光雷[22]用多肽固体发酵工艺与TiO2 NPs制成叶面肥, 对番茄(Lycopersicon esculentum)种子浸种,获得相似结果。可见如果选用纳米材料作为肥料,需要提前进行预试验,过高浓度会使得效果不明显甚至会对植物生长产生毒性。本研究中,当TiO2 NPs为300 mg/L时,生菜的根长、茎长、最大叶表面积、鲜重都有显著提高。当TiO2 NPs为600 mg/L,生菜根长、茎长、最大叶表面积、鲜重呈下降趋势,说明促进作用在较高浓度下减弱。这表明低浓度(300 mg/L)的TiO2 NPs胁迫可在一定程度上促进生菜根茎伸长, 叶片长大,TiO2 NPs与其他有毒物质[23]一样可以对植物生长具有低浓度刺激效应。随着胁迫浓度持续升高,TiO2 NPs对植物生长的促进作用会减弱,当浓度继续增大时,其对植物的毒性效应开始显露, 从而抑制植物生长。
在300 mg/L TiO2 NPs处理下,生菜叶片的SOD和POD活性呈下降趋势,且SOD下降得更加明显, 说明低浓度TiO2 NPs没有诱发生菜的强烈应激反应。随着TiO2浓度不断升高,两种抗氧化酶活性提高, 表明生菜启动应激反应以应对高强度的毒害。Nel等[24]研究表明生物细胞表面电子供体受纳米材料刺激可以与氧分子反应,从而生成超氧自由基(
不同生物对胁迫有独特感知和反应,郭敏[25]报道MWCNTs对水稻根系细胞CAT和SOD活性只在较高浓度(100 mg/L)时才表现出明显升高,表明这时水稻才受到H2O2的氧化胁迫,机体通过提高CAT和SOD活性清除H2O2,使机体稳定。TiO2 NPs胁迫下,SOD与POD活性的变化存在一致性,即低浓度时表现毒性效应,SOD和POD活性下降;但随着浓度升高,两种酶活性呈上升趋势。这是由于浓度升高,生菜体内的H2O2含量显著变大,而生菜为了在TiO2 NPs浓度逐渐增加时保护机体不受H2O2的迫害,会提高体内SOD和POD活性以清除过量的H2O2。
综上,TiO2 NPs胁迫下生菜的生长与其生理生化行为密不可分,植物可以对纳米材料胁迫做出一定的生理响应,在低浓度时,纳米粒子可能会覆盖到植物根系表面,使得根系与营养物质的接触面积增加,促进根系对水分的吸收,同时纳米材料可作为一种无机肥料促进植物的生长。然而,伴随着环境中纳米颗粒污染的加重,纳米颗粒对植物根系过度作用,纳米颗粒可能会堵塞植物的吸水通道, 抑制根系发展,对根部表面造成严重的损伤,促使植物产生过量的ROS,这时植物会调动体内的抗氧化酶对ROS进行清除。
| [1] |
WANG J C, YI G B. Synthesis and application of silver nanoparticles as antimicrobial agent in cosmetics[J]. Appl Chem Ind, 2018, 47(10): 2094-2096. 王建超, 易国斌. 纳米银化妆品抗菌剂研制及应用[J]. 应用化工, 2018, 47(10): 2094-2096. DOI:10.3969/j.issn.1671-3206.2018.10.012 |
| [2] |
LI Y Y, XUE B, ZHAN P F, et al. Application of silkworm feed additive based on nano TiO2 in production[J]. Jiangsu Agric Sci, 2017, 45(3): 134-136. 李洋洋, 薛彬, 占鹏飞, 等. 基于纳米TiO2开发的家蚕饲料添加剂在生产上的应用[J]. 江苏农业科学, 2017, 45(3): 134-136. DOI:10.15889/j.issn.1002-1302.2017.03.038 |
| [3] |
PAVANI K V, BEULAH M, POOJITHA G U S. The effect of zinc oxide nanoparticles (ZnO NPs) on Vigna mungo L. seedling growth and antioxidant activity[J]. Nanosci Nanotechnol Asia, 2020, 10(2): 117-122. DOI:10.2174/2210681208666180820150647 |
| [4] |
PENG Q Q, YANG J Y, ZHONG M Z, et al. Effects of ZnO nanopar- ticles on the germination and seedling growth of four legume seeds[J]. J Agro-Environ Sci, 2021, 40(6): 1174-1182. 彭晴晴, 杨静雅, 钟民正, 等. ZnO NPs对四种豆科种子发芽及幼苗生长的影响[J]. 农业环境科学学报, 2021, 40(6): 1174-1182. DOI:10.11654/jaes.2020-1462 |
| [5] |
LAN L Z, ZHAO Q F. Accumulation, transport of nano-TiO2 and their effects on growth and physiology in Arabidopsis thaliana[J]. Acta Sci Circumst, 2018, 38(2): 837-846. 兰丽贞, 赵群芬. 纳米TiO2在拟南芥中的富集、转运及对其生长和生理的影响[J]. 环境科学学报, 2018, 38(2): 837-846. DOI:10.13671/j.hjkxxb.2017.0379 |
| [6] |
SUI H J. Effect of aging time of TiO2 and CeO2 engineered nano- particles in soil on growth of high plant [D]. Qingdao: Ocean University of China, 2014: 31–32. 隋海君. TiO2和CeO2人工纳米颗粒在土壤中的老化时间对高等植物生长的影响[D]. 青岛: 中国海洋大学, 2014: 31–32. |
| [7] |
WU B Y. The toxicity and metabolic effects of TiO₂ nano particles on rice (Oryza sativa L. ) [D]. Hangzhou: Zhejiang University, 2017: 41– 45. 吴碧莹. 纳米二氧化钛对水稻的毒性及代谢影响初探[D]. 杭州: 浙江大学, 2017: 41–45. |
| [8] |
XIE D D, WEI Y P, SONG M B, et al. Effects of prochloraz with nano-TiO2 on storage quality of Dioscorea opposite[J]. Jiangsu Agric Sci, 2019, 47(5): 166-169. 谢冬娣, 韦燕佩, 宋慕波, 等. 咪鲜胺添加纳米TiO2对淮山贮藏品质的影响[J]. 江苏农业科学, 2019, 47(5): 166-169. DOI:10.15889/j.issn.1002-1302.2019.05.041 |
| [9] |
TAO X Q, WANG M L, QIAO S B. Changes of enzyme activity during the preservation of 'Jinqiu' pear with chitosan/nano TiO2 composite coating[J]. Jiangsu Agric Sci, 2014, 42(1): 225-226. 陶希芹, 王明力, 谯顺彬. 壳聚糖/纳米TiO2复合涂膜保鲜金秋梨过程中酶活性变化[J]. 江苏农业科学, 2014, 42(1): 225-226. DOI:10.3969/j.issn.1002-1302.2014.01.083 |
| [10] |
LIU Y, CHEN J Q, YANG Z Y, et al. Growth and physiological indexes of wheat seedlings under cadmium stress alleviated by nano titanium dioxide[J]. Environ Eng, 2021, 39(5): 184-189. 刘娅, 陈金全, 杨子月, 等. 纳米二氧化钛缓解镉胁迫下小麦幼苗生长及生理变化[J]. 环境工程, 2021, 39(5): 184-189. DOI:10.13205/j.hjgc.202105026 |
| [11] |
WANG M M, QIANG L W, WANG W, et al. Effects of Nano titanium dioxide on the toxicity of Chinese cabbage under cadmium stress[J]. J Agro-Environ Sci, 2020, 39(6): 1185-1195. 王苗苗, 强沥文, 王伟, 等. 纳米二氧化钛对镉胁迫下小白菜毒性效应的影响[J]. 农业环境科学学报, 2020, 39(6): 1185-1195. DOI:10.11654/jaes.2019-1422 |
| [12] |
LAI Y, WANG R, LI X, et al. Effects of different dosage of nano- materials on germination of Lactuca sativa L. seeds[J]. Vegetables, 2019(4): 10-14. 赖钰, 汪瑞, 李鑫, 等. 不同用量纳米材料对生菜种子发芽的影响[J]. 蔬菜, 2019(4): 10-14. |
| [13] |
WANG R, LAI Y, YANG T B, et al. Effects of different amounts of aminated carbon nanotubes on the growth and quality of Lactuca sativa L.[J]. S China Agric, 2019, 13(22): 26-28. 汪瑞, 赖钰, 杨桐彬, 等. 不同用量氨基化碳纳米管对生菜生长和品质的影响[J]. 南方农业, 2019, 13(22): 26–28, 31. DOI:10.19415/j.cnki.1673-890x.2019.22.008 |
| [14] |
GUI X. Bio-effects and mechanisms of several Nano-oxide materials [D]. Beijing: China Agricultural University, 2016: 24–32. 桂新. 几种纳米氧化物的生物效应与机制[D]. 北京: 中国农业大学, 2016: 24–32. |
| [15] |
XU J B, WANG Y L, LUO X S, et al. Influence of Fe3O4 nanoparticles on lettuce (Lactuca sativa L.) growth and soil bacterial community structure[J]. Chin J Appl Ecol, 2017, 28(9): 3003-3010. 徐江兵, 王艳玲, 罗小三, 等. 纳米Fe3O4对生菜生长及土壤细菌群落结构的影响[J]. 应用生态学报, 2017, 28(9): 3003-3010. DOI:10.13287/j.1001-9332.201709.033 |
| [16] |
HAJRA A, MONDAL N K. Effects of ZnO and TiO2 nanoparticles on germination, biochemical and morphoanatomical attributes of Cicer arietinum L[J]. Energy Ecol Environ, 2017, 2(4): 277-288. DOI:10.1007/s40974-017-0059-6 |
| [17] |
WEN S X, WANG Y L. Effect of nano titanium dioxide with different particle size on the seed germination and plant growth and physiology of Ceratophyllum demersum in hydroponic experiments[J]. Asian J Ecotoxicol, 2018, 13(6): 268-277. 文双喜, 王毅力. 水培实验中不同粒径纳米TiO2对金鱼藻种子发芽和植株生长和生理的影响[J]. 生态毒理学报, 2018, 13(6): 268-277. |
| [18] |
HOU D Y, FENG J, XIE S L. Toxic effects of nanoparticle TiO2 stress on Chara vulgaris L.[J]. Acta Sci Circumst, 2012, 32(6): 1481-1486. 侯东颖, 冯佳, 谢树莲. 纳米二氧化钛胁迫对普生轮藻的毒性效应[J]. 环境科学学报, 2012, 32(6): 1481-1486. DOI:10.13671/j.hjkxxb.2012.06.006 |
| [19] |
KUMAR D, YUSUF M A, SINGH P, et al. Modulation of antioxidant machinery in α-tocopherol-enriched transgenic Brassica juncea plants tolerant to abiotic stress conditions[J]. Protoplasma, 2013, 250(5): 1079-1089. DOI:10.1007/s00709-013-0484-0 |
| [20] |
THUESOMBAT P, HANNONGBUA S, AKASIT S, et al. Effect of silver nanoparticles on rice (Oryza sativa L. cv. KDML 105) seed germination and seedling growth[J]. Ecotoxicol Environ Safety, 2014, 104: 302-309. DOI:10.1016/j.ecoenv.2014.03.022 |
| [21] |
CHEN J, XIEERWANIGULI S L, DENG X Y, et al. Toxic effects of nanoparticle TiO2 on Scenedesmus obliquus[J]. Acta Agric Univ Jiangxi, 2014, 36(1): 238-242. 成婕, 谢尔瓦妮古丽·苏来曼, 邓祥元, 等. 纳米二氧化钛对斜生栅藻的毒性效应研究[J]. 江西农业大学学报, 2014, 36(1): 238-242. DOI:10.3969/j.issn.1000-2286.2014.01.037 |
| [22] |
ZHAO G L. Study on solid-state fermentation of polypeptides and preparation of foliar fertilizer with them and nano-titanium dioxide [D]. Nanjing: Nanjing Agricultural University, 2017: 38. 赵光雷. 多肽固体发酵工艺及其与纳米二氧化钛制成叶面肥的研究[D]. 南京: 南京农业大学, 2017: 38. |
| [23] |
KHODAKOVSKAYA M V, DE SILVA K, BIRIS A S, et al. Carbon nanotubes induce growth enhancement of tobacco cells[J]. ACS Nano, 2012, 6(3): 2128-2135. DOI:10.1021/nn204643g |
| [24] |
NEL A, XIA T, MÄDLER L, et al. Toxic potential of materials at the nanolevel[J]. Science, 2006, 311(5761): 622-627. DOI:10.1126/science.1114397 |
| [25] |
GUO M. Phytotoxicity of typical manufactured nanomaterials on rice seedlings (Oryza sativa L. ) [D]. Changsha: Hunan University, 2016: 19–22. 郭敏. 典型人工纳米材料对水稻的植物毒性研究[D]. 长沙: 湖南大学, 2016: 19–22. |
 2023, Vol. 31
2023, Vol. 31


