光照是植物生长发育所必须的外界环境因子, 植物通过光合作用合成有机物满足自身营养需求, 在森林群落中,上层常绿植物的冠层遮阴往往会减弱光强和改变光质进而影响下层植物的生长发育。遮阴会对不耐阴的植物造成一种重要的非生物胁迫,影响植物的营养生长[1]、花色[2]以及叶色[3–4]等性状。木兰科(Magnoliaceae)植物是一类古老的植物种群,由于全球气候变化、亚热带常绿阔叶林的演替,多数木兰科植物都面临灭绝的危险。木兰科濒危物种生境多呈破碎化,多分布于阳光充足的林缘与溪沟边,在林下生长势弱或幼苗较少[5–8]。景宁木兰(Magnolia sinostellata)是木兰科木兰属植物,其自然分布区狭窄,属于浙江省极小种群濒危物种。景宁木兰属偏阳性树种[9],多生于针叶群落,在针阔叶群落中分布数量相对稀少,在常绿落叶群落中零星分布[10],群落中上层乔木的遮阴环境可能是削弱景宁木兰生长势,从而造成其濒危的重要因素之一。
TCP是植物特有的一类转录因子家族,广泛参与植物生长发育、激素信号传递和逆境胁迫等多个生物学过程。根据TCP结构域的不同,TCP家族可分为Class Ⅰ (PCF或TCP-P)和Class Ⅱ (TCP-C)两大类,Class Ⅱ类进一步分为CIN亚类和CYC/TB1亚类[11–12]。在Class Ⅰ类基因当中,水稻(Oryza sativa) PCF1和PCF2参与DNA复制和控制细胞周期[13]。拟南芥(Arabidopsis thaliana) TCP8在调控花期中发挥作用[14],AtTCP14和AtTCP15影响拟南芥的节间长度和叶片形状,同时介导赤霉素途径促进种子萌发[15]。菊花(Chrysanthemum morifolium) CmTCP20过表达能够增加菊花中侧根的数量和长度,并对侧根中生长素的积累产生积极作用[16]。Class Ⅱ类中,CIN亚类基因参与调控叶形态,AtTCP2、AtTCP3、AtTCP4、AtTCP10和AtTCP24受miR319的调控从而协调叶的发育[17];CYC/TB1亚类基因AtTCP18/ BRC1在控制腋芽分枝发育中发挥作用[18],AtTCP1能够结合油菜素内酯合成酶基因DWARF4的启动子,进而调控其表达[19]。迄今为止,已对拟南芥[20]、茶(Camellia sinensis) [21]、棉花(Gossypium raimondii)[22]等多种植物的TCP转录因子开展研究,而在遮阴胁迫下的相关研究鲜有报道。本研究模拟景宁木兰野外林下光照强度对其进行遮阴处理并进行转录组测序,通过分析差异表达基因,发现景宁木兰TCPs在遮阴胁迫下呈现差异表达,推测景宁木兰TCPs可能响应遮阴胁迫从而调控景宁木兰的生长发育。因此本研究基于景宁木兰遮阴转录组数据,对景宁木兰TCPs转录因子家族开展鉴定分析,探究其生物信息学特性及遮阴环境下的表达模式,为深入了解景宁木兰TCPs在遮阴下的调控网络奠定基础, 最终为解释景宁木兰的濒危机制提供理论依据。
1 材料和方法 1.1 材料供试材料来自浙江省杭州市青山湖花园中心苗圃(30°25′ N,119°81′ E)培育的景宁木兰3 a生嫁接苗。挑选长势、性状一致且无病害的嫁接苗作为材料,置于浙江省临安区浙江农林大学(30°26′ N, 119°73′ E)人工气候室进行培养,设置温度为(25±2) ℃、相对湿度为40%~60%、光照强度为648 µmol/(m2·s)。为模拟景宁木兰野外遮阴环境,采用3层黑色遮阳网及竹竿搭建遮阴处理装置[25%全光照,162 µmol/(m2·s)], 对照组幼苗不进行遮阴处理,其他条件保持不变。所有幼苗叶片间无重叠,每处理设置3个生物学重复。分别自处理的第0、5、15天采集景宁木兰中层叶片。所有样品取样后立即用锡箔袋包好,并迅速置于液氮中速冻,随后转入–80 ℃冰箱保存,用于后续RNA提取及荧光定量qRT-PCR反应,并委托深圳华大基因股份有限公司进行转录组测序,转录组测序中每个样本设置3个重复。
1.2 TCPs基因的筛选与理化性状分析景宁木兰TCPs基因的鉴定基于转录组测序数据。在转录组注释文件中的NR、NT、Swiss-Prot等3个数据库中进行关键词筛选,初步筛选到133个TCPs相关基因。用TBtools软件批量提取转录组氨基酸序列文件中对应基因的氨基酸序列,不存在氨基酸序列的基因不进行后续分析。通过Pfam和SMART工具进一步分析结构域,剔除不含有TCP结构域的序列。通过DNAman进行对比,去除相同基因的冗余转录本,最终获得12个景宁木兰TCPs基因,并根据TCP拟南芥命名法及NCBI blast比对结果进行命名。利用ExPASy中的ProtParam在线工具(https://web.expasy.org/protparam/)预测景宁木兰TCPs的氨基酸数量、等电点及分子量等理化性状;利用在线网站Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测亚细胞定位。
1.3 TCPs系统发育进化树构建利用MEGA 6.0将景宁木兰、拟南芥、望春玉兰(M. biondii)、水稻的TCPs氨基酸序列进行系统发育分析,采用邻接法(neighbor-joining),1 000次bootstrap检测,利用在线工具iTOL (https://itol.embl.de/)对系统发育进化树进行优化。拟南芥、水稻的TCPs氨基酸序列均下载自PlantTFDB网站(http://planttfdb.gao-lab.org/index.php),望春玉兰TCPs氨基酸序列筛选自望春玉兰基因组[23]。
1.4 TCPs氨基酸序列比对与保守结构域基序分析利用Clustal Omega在线工具(https://www.ebi.ac.uk/Tools/msa/clustalo/)对12个景宁木兰TCPs的氨基酸序列进行序列对比,利用jalview软件对多序列比对图谱进行优化;利用在线网站MEME (https://meme-suite.org/meme/tools/meme)对景宁木兰TCPs蛋白进行保守基序预测分析,设置参数为:任意重复次数,最多基序数量为10;利用NCBI CDD工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)
分析景宁木兰TCPs蛋白保守结构域。
1.5 TCPs的启动子克隆及顺式作用元件预测利用DNA提取试剂盒提取景宁木兰基因组DNA; 利用同属物种望春玉兰的基因组数据,从pfam数据库中下载TCP转录因子的HMM (Hindden Markov Model, 隐马尔科夫模型)文件,利用hmmer 3.0软件检索望春玉兰TCPs转录因子家族基因。调取望春玉兰基因组内景宁木兰同源TCPs基因上游2 000 bp的启动子序列,根据望春玉兰TCPs启动子序列设计引物(表 1),以景宁木兰DNA为模版,利用高保真酶扩增景宁木兰TCPs成员启动子片段,连接pCE2-TA载体并转化大肠杆菌感受态,将阳性菌送往公司进行测序,获得景宁木兰TCPs启动子序列。通过PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站对景宁木兰TCPs启动子序列进行预测,利用TBtools进行可视化分析。
| 表 1 景宁木兰TCPs启动子克隆引物 Table 1 Primers for TCPs promoter cloning of Magnolia sinostellata |
在转录组中获得12个景宁木兰TCPs基因的FPKM表达量数据,取平均值后利用TBtools软件进行归一化转换,利用HeatMap工具绘制热图。根据转录组数据结果,选取在遮阴处理第5和15天时表达量趋势一致的基因进行实时荧光定量实验。采用植物RNA提取试剂盒提取样品总RNA,利用反转录试剂盒进行第1链cDNA的合成。根据景宁木兰转录组数据,利用Premier 5.0软件设计特异性引物(表 2),景宁木兰EF1-α基因作为内参基因[24–25],引物均交由生物公司进行合成。利用Light Cycler 480Ⅱ (Roche)仪器进行目的基因荧光定量qRT-PCR表达分析。实时定量反应体系为10 μL,包括2 μL cDNA、5 μL BCG qPCR Master Mix、上、下游引物(10 μmol/L)各0.4 μL、ddH2O补足至10 μL, 设置3个重复。反应程序为:95 ℃预变性30 s,然后95 ℃变性5 s,58 ℃ 30 s,共40个循环。反应程序结束后,65 ℃~95 ℃每隔0.2 s作溶解曲线,采用2–ΔΔCT法计算目的基因的相对表达量。利用SigmaPlot 14进行绘图,SPSS 24.0进行显著性分析,采用独立样本t检验进行比较,显著性水平为0.05。
| 表 2 荧光定量引物 Table 2 Primers for qRT-PCR |
基于景宁木兰转录组数据库,最终鉴定出12个TCPs基因。利用ExPASy对12个景宁木兰TCPs蛋白进行氨基酸数量、等电点和分子量等理化性状分析,结果表明TCPs成员物理性质存在较大差异。氨基酸数量最多是MsTCP19,包含558个氨基酸, 氨基酸数量最少是MsTCP11,包含228个氨基酸; 等电点为6.24 (MsTCP11)~9.98 (MsTCP7-b); 分子量为23.7 (MsTCP11)~52.7 kDa (MsTCP8);12个TCPs蛋白均为不稳定蛋白、亲水性蛋白。亚细胞定位预测结果表明,12个TCPs均定位于细胞核, 其中MsTCP20-a、MsTCP20-b还定位于叶绿体(表 3)。
| 表 3 景宁木兰TCPs成员基本信息 Table 3 Basic information of TCPs in Magnolia sinostellata |
利用MEGA6.0软件将景宁木兰、拟南芥、水稻和望春玉兰的TCPs氨基酸序列进行对比,采用邻接法构建系统发育进化树(图 1)。结果表明,景宁木兰TCPs成员可被分为Class Ⅰ和Class Ⅱ两大类,其中Class Ⅰ类包含10个TCPs成员,Class Ⅱ类包含两个TCPs成员,且Class Ⅱ中的CYC/TB1亚家族无景宁木兰TCP成员。此外,景宁木兰TCP9含有两个同源基因MsTCP9-a/MsTCP9-b;TCP20含有两个同源基因MsTCP20-a/MsTCP20-b;TCP7含有两个同源基因MsTCP7-a/MsTCP7-b。

|
图 1 景宁木兰(Ms)与拟南芥(At)、水稻(Os)和望春玉兰(Mb) TCPs的系统进化分析 Fig. 1 Phylogenetic tree of TCPs in Magnolia sinostellata (Ms), Arabidopsis thaliana (At), Oryza sativa (Os) and M. biondii (Mb) |
利用Clustal Omega工具将12个景宁木兰TCPs氨基酸序列进行对比分析(图 2),结果表明12个TCPs均包含1个完整的TCP结构域,即高度保守且非典型的螺旋-环-螺旋(bHLH)结构域。在TCP结构域中共有13个高度保守的氨基酸,其中Basic区域含有8个,保守程度较高。Basic区域中,10个TCPs氨基酸序列出现4个氨基酸的缺失,属于Class Ⅰ类,MsTCP4与MsTCP2属于Class Ⅱ类。Class Ⅰ类氨基酸序列与Class Ⅱ类氨基酸序列在Helix I、Loop及Helix II区域差异较大,且Class Ⅰ类氨基酸序列之间保守性较高。

|
图 2 景宁木兰TCPs的氨基酸序列对比 Fig. 2 Alignment of TCPs amino acid sequence in Magnolia sinostellata |
利用MEME在线工具对景宁木兰TCPs蛋白进行保守基序分析,其中motif1为TCP结构域,存在于12个TCPs成员当中。景宁木兰TCPs蛋白保守基序的组成具有一定差异性,不同TCP成员含有不同保守基序,但亲缘关系较近的成员具有相似的保守基序,如MsTCP9-a与MsTCP9-b、MsTCP7-a与MsTCP7-b、MsTCP20-a与MsTCP20-b。利用NCBI CDD工具对景宁木兰TCPs蛋白进行保守结构域分析,结果表明均含有TCP结构域,属于TCP转录因子家族(图 3)。
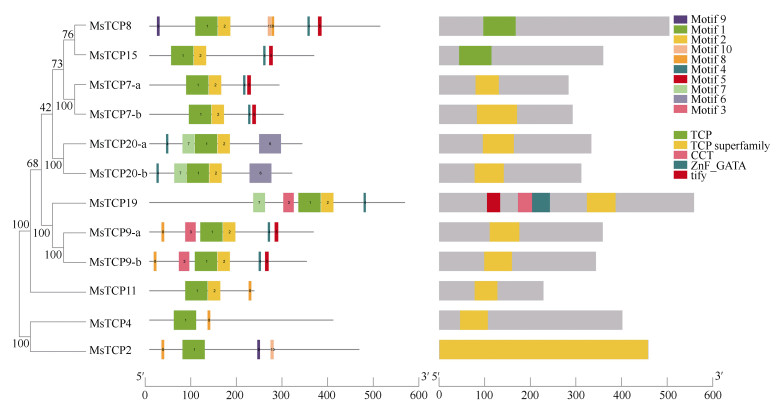
|
图 3 景宁木兰TCPs保守结构域和基序 Fig. 3 TCPs conserved domains and motifs in Magnolia sinostellata |
根据系统发育进化树分析结果,以同属植物望春玉兰TCPs同源基因启动子序列设计引物,利用景宁木兰DNA作为模版,除MsTCP20-a未能在望春玉兰中匹配到TCP同源基因外,其余景宁木兰TCPs基因均采用同源克隆的方法扩增到启动子片段,对目的条带进行回收(图 4),连接pCE2-TA载体,挑选阳性菌送往公司进行测序,测序结果与望春玉兰TCPs启动子序列匹配度均达到95%以上。
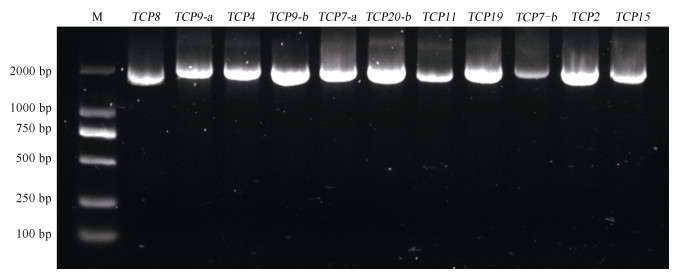
|
图 4 景宁木兰TCPs启动子的PCR扩增 Fig. 4 PCR amplification of TCPs promoters in Magnolia sinostellata |
利用PlantCARE对景宁木兰TCPs启动子进行顺式作用元件预测,发现光响应元件数量最多,且存在于所有TCPs家族成员中,表明TCPs家族成员均可能受到外界光照的调控,弱光环境下将影响景宁木兰TCPs家族的基因表达。生长素、脱落酸、茉莉酸、水杨酸、赤霉素5大类激素顺式作用元件存在于TCPs基因启动子中,说明激素对TCPs基因可能存在潜在的调控作用。此外,低温响应元件(CCGAAA)、细胞周期调控元件(TCCAACGGT)、分生组织表达元件(GCCACT)、玉米蛋白代谢调节元件(GATGACATGG)、防御和胁迫响应元件(ATT- CTCTAAC)等存在于TCPs基因启动子中,表明景宁木兰TCPs基因可能在参与植物生长发育、响应生物及非生物胁迫中发挥重要作用(图 5)。
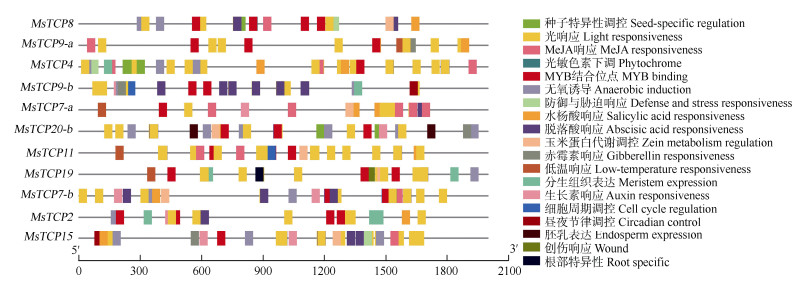
|
图 5 景宁木兰TCPs启动子顺式作用元件预测 Fig. 5 Cis-acting element prediction of TCPs promoters in Magnolia sinostellata |
通过转录组测序技术获得了在对照的第0 (CK D0)、5 (CK D5)、15天(CK D15)及遮阴第5 (ST D5)、15天(ST D15)的FPKM值,取平均值后运用TBtools工具绘制热图(图 6)。结果表明,在遮阴胁迫下12个TCPs成员均发生差异性变化,其中MsTCP9-a、MsTCP2的表达量在遮阴后第5、15天后均呈上升趋势;MsTCP8、MsTCP9-b、MsTCP7-a、MsTCP19、MsTCP15的表达量在遮阴后第5、15天后均呈下降趋势,其余TCPs成员的表达量变化不呈现规律性。

|
图 6 遮阴下景宁木兰TCPs表达量热图。CK: 对照; ST: 遮阴; D0: 第0天; D5: 第5天; D15: 第15天。下同 Fig. 6 Heatmap of expression of MsTCPs under shading. CK: Control; ST: Shading; D0: The 0 day; D5: The 5th day; D15: The 15th day. The same below |
根据景宁木兰TCPs转录组数据分析结果,对MsTCP8、MsTCP9-a、MsTCP9-b、MsTCP7-a、MsTCP19、MsTCP2、MsTCP15等7个基因进行实时荧光定量qRT-PCR检测,结果表明,MsTCP9-a和MsTCP2的表达在遮阴后第5、15天均呈上升趋势,而MsTCP8、MsTCP9-b、MsTCP7-a、MsTCP15则呈下降趋势(图 7)。
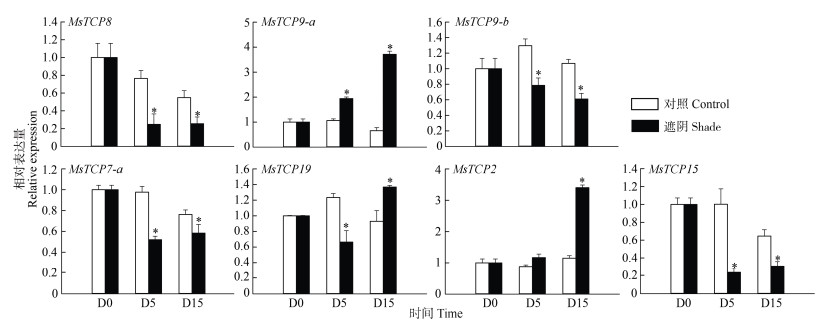
|
图 7 遮阴下景宁木兰TCPs的qRT-PCR分析。*: P < 0.05 Fig. 7 qRT-PCR of MsTCPs under shading. *: P < 0.05 |
虽然景宁木兰TCPs荧光定量结果在遮阴后的变化与转录组不同,但遮阴后的变化趋势与转录组总体一致,说明MsTCP8、MsTCP9-a、MsTCP9-b、MsTCP7-a、MsTCP2、MsTCP15能够响应遮阴胁迫。
3 结论和讨论上层树冠遮阴是影响下层植株生长发育的重要非生物胁迫,TCP是高等植物特有的一类转录因子家族,在植物生长发育及响应外界胁迫中发挥重要作用。景宁木兰是浙江省极小濒危物种,上层乔木的遮阴可能是导致其濒危的重要因素之一。本研究通过分析景宁木兰遮阴转录组数据,发现TCP呈差异表达。为了探讨景宁木兰TCPs在遮阴胁迫下的功能,本研究首先基于转录组数据筛选得到12个景宁木兰TCPs成员,这与拟南芥[20]、水稻[26]及望春玉兰的TCPs成员数量存在差距,一方面可能由于景宁木兰存在物种特异性,另一方面可能由于基因表达存在时空特异性,未能在叶片转录组数据库中鉴定出。亚细胞定位预测表明,12个TCPs均符合其转录因子特性,定位于细胞核中,其中MsTCP20-a、MsTCP20-a定位于叶绿体中,这与茶树CsTCP21[27]、油菜(Brassica napus)的BnTCP36[28]等定位在叶绿体的结果相一致,暗示其可能在叶绿体中发挥功能。
在系统发育进化树中,拟南芥TCPs成员被分为Class Ⅰ和Class Ⅱ两大类,Class Ⅱ进一步被分为CYC/TB1和CIN亚类,这与前人[20]研究结果一致。景宁木兰TCPs成员在Class Ⅰ类和CIN亚类中均有分布,但不存在CYC/TB1亚类,可能由于此类基因在叶中不发挥功能,CYC/TB1亚类基因主要控制植物花型的对称性[29]。氨基酸序列分析表明所有景宁木兰TCPs成员均含有TCP结构域,但不同类的TCPs成员其氨基酸序列和保守基序存在差异,说明其功能存在多样性。基因启动子是调控基因转录的重要元件[30]。本研究基于望春玉兰基因组,通过同源克隆的方法获得11个景宁木兰TCPs启动子序列,MsTCP20-a未能在望春玉兰基因组匹配到同源基因,可能是物种间基因数量存在一定的差异性。通过分析景宁木兰TCPs启动子序列,发现TCPs启动子含有大量光响应元件及脱落酸、茉莉酸等激素响应元件,这与桃(Prunus persica)的TCPs启动子作用元件分布类型相似[31],表明景宁木兰TCPs可能响应遮阴环境所导致的光信号与激素信号变化。
基因的表达模式变化通常能够反映其对非生物胁迫的应答能力。本研究结合转录组数据和qRT-PCR技术对景宁木兰TCPs在遮阴胁迫后的表达量进行了分析,结果表明MsTCP9-a和MsTCP2表达显著上升,MsTCP8、MsTCP9-b、MsTCP7-a、MsTCP15表达显著下降。气孔在响应胁迫中发挥重要作用,遮阴胁迫会加速植物气孔的闭合[32–33]。TCP9基因在豇豆(Vigna sinensis)调控气孔大小中发挥作用[34],景宁木兰MsTCP9-a与MsTCP9-b在遮阴胁迫下表达量呈差异性变化,推测MsTCP9-a与MsTCP9-b可能介导遮阴胁迫下景宁木兰的气孔开度。遮阴胁迫会促进植物茎的伸长生长,在矮牵牛(Petunia hybrida)中,TCP2能够介导矮牵牛茎的伸长生长[35],景宁木兰MsTCP2表达量呈显著性变化,推测其可能调控遮阴胁迫下景宁木兰茎的伸长生长。遮阴胁迫会诱导植物体生长素含量上升从而产生庇荫反应,然而过度遮阴会抑制植物体内生长素水平[36]。拟南芥AtTCP15在生长素信号传导中起到重要作用[37],景宁木兰MsTCP15基因在遮阴胁迫下显著下调,推测其可能介导遮阴胁迫下景宁木兰的生长素信号传导过程。水杨酸在植物免疫和抗病反应中发挥重要作用,遮阴胁迫下植物水杨酸含量呈下降趋势[38],拟南芥AtTCP8能够调控水杨酸合成酶基因ICS1的表达[39]。遮阴胁迫下景宁木兰AtTCP8下调,可能导致水杨酸合成受阻从而降低植物的抗性。景宁木兰MsTCP7-a表达量呈下调趋势,这与甘蓝型油菜BnTCP7在温度胁迫、损伤胁迫等非生物胁迫下的表达趋势相一致[40]。
本研究基于景宁木兰遮阴处理转录组数据,共鉴定得到12个景宁木兰TCPs成员;其蛋白均为不稳定蛋白、亲水性蛋白;12个TCPs均定位于细胞核,符合其转录因子特性,此外MsTCP20-a/b还定位于叶绿体;景宁木兰TCPs成员可分为Class Ⅰ和Class Ⅱ两大类,Class Ⅰ包含10个TCPs成员,Class Ⅱ包含两个TCPs成员,亲缘关系较近的成员具有相似的保守基序;对景宁木兰TCPs启动子进行同源克隆后发现含有大量光响应和激素响应元件;景宁木兰TCPs成员能够响应遮阴胁迫,其中MsTCP9-a与MsTCP2表达量显著上升,MsTCP8、MsTCP9-b、MsTCP7-a、MsTCP15表达量显著下降。
| [1] |
CHEN T T, ZHANG H J, ZENG R E, et al. Shade effects on peanut yield associate with physiological and expressional regulation on photosynthesis and sucrose metabolism[J]. Int J Mol Sci, 2020, 21(15): 5284. DOI:10.3390/ijms21155284 |
| [2] |
ZHAO D Q, HAO Z J, TAO J. Effects of shade on plant growth and flower quality in the herbaceous peony (Paeonia lactiflora Pall.)[J]. Plant Physiol Biochem, 2012, 61: 187-196. DOI:10.1016/j.plaphy.2012.10.005 |
| [3] |
QIAN P X, LI X F, WU Y Y, et al. Influence of shading on growth and physiological characteristics of container seedlings of Acer cinnamomifolium[J]. Jiangsu J Agric Sci, 2015, 31(3): 667-672. 钱萍仙, 李学孚, 吴月燕, 等. 遮阴对樟叶槭容器苗生长和生理特性的影响[J]. 江苏农业学报, 2015, 31(3): 667-672. DOI:10.3969/j.issn.1000-4440.2015.03.032 |
| [4] |
LI L, HUANG J Y, ZHANG S M, et al. Effect on different shade treatments of leaf color change of Selaginella uncinata[J]. Mol Plant Breed, 2015, 13(5): 1135-1140. 李林, 黄洁瑜, 张水木, 等. 不同遮荫处理对翠云草叶色变化的影响[J]. 分子植物育种, 2015, 13(5): 1135-1140. DOI:10.13271/j.mpb.013.001135 |
| [5] |
SETSUKO S, ISHIDA K, UENO S, et al. Population differentiation and gene flow within a metapopulation of a threatened tree, Magnolia stellata (Magnoliaceae)[J]. Am J Bot, 2007, 94(1): 128-136. DOI:10.3732/ajb.94.1.128 |
| [6] |
JIANG G M, SUN G, ZHANG G F, et al. Intra and interspecific competition of endangered plant Magnolia zenii[J]. Chin J Ecol, 2010, 29(2): 201-206. 蒋国梅, 孙国, 张光富, 等. 濒危植物宝华玉兰种内与种间竞争[J]. 生态学杂志, 2010, 29(2): 201-206. DOI:10.13292/j.1000-4890.2010.0029 |
| [7] |
YANG Y, JIA Z K, CHEN F J, et al. Optimal light regime for the rare species Magnolia wufengensis in northern China[J]. Plant Sci J, 2015, 33(3): 377-387. 杨杨, 贾忠奎, 陈发菊, 等. 珍稀树种红花玉兰在华北地区的最适光环境[J]. 植物科学学报, 2015, 33(3): 377-387. DOI:10.11913/PSJ.2095-0837.2015.30377 |
| [8] |
YANG Q P, XIAO Z Y, HU X D, et al. Endangered mechanisms of Sinomanglietia glauca: Exploring and prospect[J]. Guihaia, 2017, 37(5): 653-660. 杨清培, 肖智勇, 胡晓东, 等. 珍稀植物华木莲的现代濒危机制: 探析与展望[J]. 广西植物, 2017, 37(5): 653-660. DOI:10.11931/guihaia.gxzw201602006 |
| [9] |
YU Q, WANG Q Y, LIU Z G, et al. Comparison of the light response models of photosynthesis in leaves of Magnolia sinostellata under different light intensity and moisture conditions[J]. Chin J Ecol, 2018, 37(3): 898-905. 俞芹, 王倩颖, 刘志高, 等. 光强与水分处理下景宁木兰光合光响应模型拟合比较[J]. 生态学杂志, 2018, 37(3): 898-905. DOI:10.13292/j.1000-4890.201803.017 |
| [10] |
YU Z Z, CHEN X X, LU L, et al. Distribution and community structure of Magnolia sinostellata[J]. J Zhejiang For Sci Technol, 2015, 35(3): 47-52. 余泽智, 陈翔翔, 卢璐, 等. 玉景宁玉兰种群分布与群落结构研究[J]. 浙江林业科技, 2015, 35(3): 47-52. DOI:10.3969/j.issn.1001-3776.2015.03.009 |
| [11] |
MARTÍN-TRILLO M, CUBAS P. TCP genes: A family snapshot ten years later[J]. Trends Plant Sci, 2010, 15(1): 31-39. DOI:10.1016/j.tplants.2009.11.003 |
| [12] |
HOWARTH D G, DONOGHUE M J. Phylogenetic analysis of the "ECE" (CYC/TB1) clade reveals duplications predating the core eudicots[J]. Proc Natl Acad Sci USA, 2006, 103(24): 9101-9106. DOI:10.1073/pnas.0602827103 |
| [13] |
CUBAS P, LAUTER N, DOEBLEY J, et al. The TCP domain: A motif found in proteins regulating plant growth and development[J]. Plant J, 1999, 18(2): 215-222. DOI:10.1046/j.1365-313X.1999.00444.x |
| [14] |
WANG X Y, XU X T, MO X W, et al. Overexpression of TCP8 delays Arabidopsis flowering through a FLOWERING LOCUS C-dependent pathway[J]. BMC Plant Biol, 2019, 19(1): 534. DOI:10.1186/s12870-019-2157-4 |
| [15] |
RESENTINI F, FELIPO-BENAVENT A, COLOMBO L, et al. TCP14 and TCP15 mediate the promotion of seed germination by gibberellins in Arabidopsis thaliana[J]. Mol Plant, 2015, 8(3): 482-485. DOI:10.1016/j.molp.2014.11.018 |
| [16] |
FAN H M, SUN C H, WEN Z L, et al. CmTCP20 plays a key role in nitrate and auxin signaling-regulated lateral root development in Chrysanthemum[J]. Plant Cell Physiol, 2019, 60(7): 1581-1594. DOI:10.1093/pcp/pcz061 |
| [17] |
BRESSO E G, CHOROSTECKI U, RODRIGUEZ R E, et al. Spatial control of gene expression by miR319-regulated TCP transcription factors in leaf development[J]. Plant Physiol, 2018, 176(2): 1694-1708. DOI:10.1104/pp.17.00823 |
| [18] |
AGUILAR-MARTINEZ J A, POZA-CARRION C, CUBAS P. Arabidopsis BRANCHED1 acts as an integrator of branching signals within axillary buds[J]. Plant Cell, 2007, 19(2): 458-472. DOI:10.1105/tpc.106.048934 |
| [19] |
GUO Z X, FUJIOKA S, BLANCAFLOR E B, et al. TCP1 modulates brassinosteroid biosynthesis by regulating the expression of the key biosynthetic gene DWARF4 in Arabidopsis thaliana[J]. Plant Cell, 2010, 22(4): 1161-1173. DOI:10.1105/tpc.109.069203 |
| [20] |
YAO X, MA H, WANG J, et al. Genome-wide comparative analysis and expression pattern of TCP gene families in Arabidopsis thaliana and Oryza sativa[J]. J Integr Plant Biol, 2007, 49(6): 885-897. DOI:10.1111/j.1744-7909.2007.00509.x |
| [21] |
WEN B B, LUO Y, LIU D M, et al. Identification and expression profiling analysis of TCP family genes involved in growth and development in Camellia sinensis[J]. Acta Hort Sin, 2019, 46(12): 2369-2382. 温贝贝, 罗勇, 刘冬敏, 等. 茶树TCP转录因子的鉴定与表达分析[J]. 园艺学报, 2019, 46(12): 2369-2382. DOI:10.16420/j.issn.0513-353x.2019-0320 |
| [22] |
MA J, WANG Q L, SUN R R, et al. Genome-wide identification and expression analysis of TCP transcription factors in Gossypium raimondii[J]. Sci Rep, 2014, 4: 6645. DOI:10.1038/srep06645 |
| [23] |
DONG S S, LIU M, LIU Y, et al. The genome of Magnolia biondii Pamp. provides insights into the evolution of Magnoliales and biosynthesis of terpenoids[J]. Hort Res, 2021, 8: 38. DOI:10.1038/s41438-021-00471-9 |
| [24] |
YU Q, SHEN Y M, WANG Q Y, et al. Light deficiency and waterlogging affect chlorophyll metabolism and photosynthesis in Magnolia sinostellata[J]. Trees, 2019, 33(1): 11-22. DOI:10.1007/s00468-018-1753-5 |
| [25] |
LU D Y, LIU B, REN M J, et al. Light deficiency inhibits growth by affecting photosynthesis efficiency as well as JA and ethylene signaling in endangered plant Magnolia sinostellata[J]. Plants, 2021, 10(11): 2261. DOI:10.3390/plants10112261 |
| [26] |
GUAN Z W, CAO X Y, ZHANG X W, et al. Genome-wide identification and expression analysis of TCP gene family in rice (Oryza sativa L.)[J]. Mol Plant Breed, 2022, 20(10): 3145-3156. 关紫微, 曹希雅, 张先文, 等. 水稻TCP家族的全基因组鉴定及表达水平分析[J]. 分子植物育种, 2022, 20(10): 3145-3156. DOI:10.13271/j.mpb.020.003145 |
| [27] |
ZHOU Q Y, HAN Y H, ZHU Y, et al. Genome-wide identification, classification and expression analysis of TCP gene family in tea plant[J]. Acta Hort Sin, 2019, 46(10): 2021-2036. 周棋赢, 韩月华, 祝悦, 等. 茶树TCP家族的全基因组鉴定及其表达分析[J]. 园艺学报, 2019, 46(10): 2021-2036. DOI:10.16420/j.issn.0513-353x.2019-0389 |
| [28] |
LIU M M. Genome-wide analysis of TCP genes in Brassica napus L. and identification of candidates involved in regulating branching development[D]. Chongqing: Southwest University, 2020. 刘明明. 甘蓝型油菜TCP基因的全基因组分析及其中调控分枝发育基因的鉴定[D]. 重庆: 西南大学, 2020. |
| [29] |
SHI P B. Identification and function analvsis of TCP transcription factors in watermelon[D]. Hangzhou: Zhejiang University, 2016. 时丕彪. 西瓜TCP转录因子的鉴定及功能分析[D]. 杭州: 浙江大学, 2016. |
| [30] |
LIU H Y, GUO X T, LI Y, et al. Research progress of promoters in plant genetic engineering[J/OL]. Mol Plant Breed, (2022-03-11). 刘慧玉, 郭晓彤, 李悦, 等. 植物基因工程中启动子的研究进展[J]. 分子植物育种, [2022-03-11]. https://kns.cnki.net/kcms/detail/46.1068.S.20220309.1928.014.html. |
| [31] |
HAN J H, LIU J F, LIU H M. Identification and characterization of TCP transcription factors in Prunus persica[J]. Mol Plant Breed, 2020, 18(16): 5261-5267. 韩继红, 刘金凤, 刘慧敏. 桃TCP转录因子家族的鉴定与分析[J]. 分子植物育种, 2020, 18(16): 5261-5267. DOI:10.13271/j.mpb.018.005261 |
| [32] |
BAUER H, ACHE P, LAUTNER S, et al. The stomatal response to reduced relative humidity requires guard cell-autonomous ABA synthesis[J]. Curr Biol, 2013, 23(1): 53-57. DOI:10.1016/j.cub.2012.11.022 |
| [33] |
GERARDIN T, DOUTHE C, FLEXAS J, et al. Shade and drought growth conditions strongly impact dynamic responses of stomata to variations in irradiance in Nicotiana tabacum[J]. Environ Exp Bot, 2018, 153: 188-197. DOI:10.1016/j.envexpbot.2018.05.019 |
| [34] |
MISHRA S, SAHU G, SHAW B P. Insight into the cellular and physiological regulatory modulations of Class‐I TCP9 to enhance drought and salinity stress tolerance in cowpea[J]. Physiol Plant, 2022, 174(1): e13542. DOI:10.1111/ppl.13542 |
| [35] |
WANG H P. Cloning, expression analysis and overexpression of PhTCP2 in Petunia [D]. Chongqing: Southwest University, 2013. 王会平. 矮牵牛PhTCP2基因的克隆、表达分析及超量表达研究[D]. 重庆: 西南大学, 2013. |
| [36] |
HAN S, CHEN S M, JIANG J F, et al. Hormone levels and gene expression analysis of Chrysanthemum cultivar 'puma sunny' under low light intensity[J]. Sci Agric Sin, 2015, 48(2): 324-333. 韩霜, 陈素梅, 蒋甲福, 等. 弱光下菊花'清露'的激素水平及相关基因表达[J]. 中国农业科学, 2015, 48(2): 324-333. DOI:10.3864/j.issn.0578-1752.2015.02.12 |
| [37] |
FERRERO L V, GASTALDI V, ARIEL F D, et al. Class Ⅰ TCP proteins TCP14 and TCP15 are required for elongation and gene expression responses to auxin[J]. Plant Mol Biol, 2021, 105(1/2): 147-159. DOI:10.1007/s11103-020-01075-y |
| [38] |
XU Y. Study on the mechanical properties of soybean plant by canopy spectral composition and hormone regulation[D]. Harbin: Northeast Agricultural University, 2020. 徐瑶. 大豆植株力学特性受冠层光谱组成与激素调控的研究[D]. 哈尔滨: 东北农业大学, 2020. |
| [39] |
WANG X Y, GAO J, ZHU Z, et al. TCP transcription factors are critical for the coordinated regulation of ISOCHORISMATE SYNTHASE 1 expression in Arabidopsis thaliana[J]. Plant J, 2015, 82(1): 151-162. DOI:10.1111/tpj.12803 |
| [40] |
LIU S S, JIANG X F, YUE C, et al. Cloning and expression aanalysis of BnTCP7 gene in Brassica napus L.[J]. Acta Bot Boreali-Occid Sin, 2018, 38(7): 1187-1193. 刘双双, 蒋学飞, 岳出, 等. 甘蓝型油菜BnTCP7基因的克隆和表达分析[J]. 西北植物学报, 2018, 38(7): 1187-1193. DOI:10.7606/j.issn.1000-4025.2018.07.1187 |
 2023, Vol. 31
2023, Vol. 31



