2. 惠州学院生命科学学院, 广东 惠州 516007
2. School of Life Sciences, Huizhou University, Huizhou 516007, Guangdong, China
真菌代谢产物是发掘新抗生素的重要来源。甲基苯酚类化合物是由真菌或植物通过聚酮合成途径形成的一类重要天然产物类型,结构相对简单、分布广泛,常以单体、二聚体或三聚体形式存在, 其中不乏具有良好的生物活性。二聚体Violaceol I可抑制枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)等的生长[1];二聚体diorcinol不仅具有抗细菌活性,且可抑制黑色素瘤和人结肠直肠癌细胞增殖[2–3]。三聚体sydowiol C不仅可拮抗金黄色葡萄球菌,对结核分枝杆菌(Mycobacterium tuberculosis)也有良好的抑制活性[4]。
在前期活性筛选中,我们发现一株老鼠艻内生曲霉Aspergillus sp. HU0206的玉米发酵物在载样量为500 μg时对金黄色葡萄球菌及马铃薯黑胫病菌具有明显的抑制活性,抑菌圈半径分别为5.5和3 mm,随后在活性追踪的指导下,采用天然产物化学方法对其玉米发酵物的次生代谢产物进行研究,共分离鉴定了6个甲基苯酚类化合物和1个甲基环己酮二聚体。本文对这些化合物的来源、结构鉴定和抗菌活性进行报道。
1 材料和方法 1.1 材料和仪器供试菌株 曲霉Aspergillus sp. HU0206由惠州学院生命科学学院徐良雄博士等分离自滨海盐生植物老鼠艻(Spinifex littoreus)枝条,现保藏于惠州学院天然产物化学实验室菌种库;金黄色葡萄球菌(Staphylococcus aureus) ATCC6538、大肠杆菌(Escherichia coli) K12-MG1655分别购自广东省微生物菌种保藏中心和宝赛公司;耐甲氧西林金黄色葡萄球菌(methicillin-resistant S. aureus) 11646由广州呼吸疾病研究所提供;马铃薯黑胫病菌(Pectobacterium atroseptica) STB009、青枯病菌(Ralstonia solanacearum) STB020来自惠州学院天然产物化学实验室。
试剂和仪器 二氯甲烷等分析纯试剂(天津大茂),色谱纯甲醇(天津康科德),氘代试剂(美国剑桥),硫酸链霉素、盐酸万古霉素(上海麦克林生化科技),甲氧西林(美国Glpbio)。SYNERGY H1全功能酶标仪(美国BioTek),LC-16P高效液相色谱仪及LCMS-8040电喷雾质谱仪(日本Shimadzu), Quantum-I核磁共振波谱仪(武汉中科牛津),Bruker maXis超高分辨飞行时间质谱仪(德国Bruker)。
1.2 提取和分离将活化好的菌株接种至30 mL PDB培养基, 在150 r/min、28 ℃黑暗中培养3 d,制得一级种子液,吸取1 mL接种至200 mL PDB培养基,相同条件培养3 d,得二级种子液,然后接种至200个玉米培养基发酵瓶中(每500 mL含60 g玉米和60 mL自来水),28 ℃黑暗静置培养28 d。
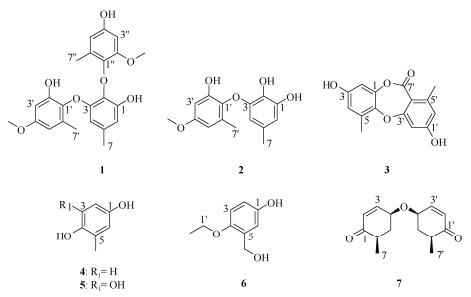
发酵物用95%乙醇浸提3次,每次24 h,浓缩去除乙醇并以石油醚脱脂后,以二氯甲烷萃取获得抗金黄色葡萄球菌活性部位(80.0 g),载样量为200 μg,该部位对金黄色葡萄球菌的抑菌圈半径为4 mm。该部位进行正相硅胶柱(100~200目,青岛基亿达)色谱,二氯甲烷-甲醇[100:0~50:50, V/V (下同)]梯度洗脱、合并得到流份Fr.1~Fr.12。Fr.4 (15.8 g)经凝胶柱(Sephadex LH-20, Amersham Biosciences)色谱,甲醇洗脱得到流份Fr.4-1~Fr.4-12。其中Fr.4-6经C18-反相硅胶柱(75 μm,日本富士硅化学)色谱纯化,以甲醇-水(10:90),洗脱得化合物7 (6.50 g); Fr.4-7 (99.7 mg)经HPLC纯化(C18柱, 5 μm, 10 mm× 250 mm, Shimadzu),以甲醇-水(20:80)洗脱得化合物6 (tR=37.5 min, 3.9 mg);Fr.4-12 (105.7 mg)经HPLC纯化,以甲醇-水(55:45)洗脱得化合物5 (tR=11.5 min, 4.0 mg)。流份Fr.6 (2.0 g)经C18-反相硅胶柱色谱, 甲醇-水(10:90~100:0)梯度洗脱得Fr.6-1~Fr.6-12,其中Fr.6-4 (62.3 mg)经HPLC纯化,以甲醇-水(10:90)洗脱得化合物4 (tR=7.4 min, 4.0 mg);流份Fr.6-11 (445.7 mg)经HPLC纯化,以甲醇-水(55:45)洗脱得化合物2 (tR=13.0 min, 67.0 mg)、1 (tR=32.5 min, 5.0 mg)和3 (tR=17.5 min, 11.0 mg) (图1)。
|
图 1 化合物1~7的结构 Fig. 1 Structures of compounds 1–7 |
采用滤纸片琼脂扩散法[5]测定化合物的抑菌圈半径,每滤纸片载样量为40 μg,甲氧西林、硫酸链霉素和盐酸万古霉素为阳性对照(载样量为20 μg),实验设3个重复,结果取平均值。并采用微量稀释法[6]测定活性化合物的最小抑制浓度(MIC)。
1.4 结构鉴定化合物1 浅黄色粉末,根据HR-ESI-MS m/z: 411.1451 [M − H]− (C23H23O7, 理论值为411.1449)推断分子式为C23H24O7。1H NMR (400 MHz, CD3OD): δ 6.46 (1H, d, J = 1.2 Hz, H-6), 6.39 (1H, d, J = 2.8 Hz, H-5″), 6.37 (1H, d, J = 2.8 Hz, H-3′), 6.29 (1H, d, J = 2.8 Hz, H-3″), 6.28 (1H, d, J = 2.8 Hz, H-5′), 5.82 (1H, d, J = 1.2 Hz, H-4), 3.77 (3H, s, 4′-OCH3), 3.63 (3H, s, 2″-OCH3), 2.26 (3H, s, H-7″), 2.16 (3H, s, H-7), 1.81 (3H, s, H-7′); 13C NMR (100 MHz, CD3OD): δ 158.7 (C-4′), 151.4 (C-2′), 153.9 (C-2″), 152.3 (C-1), 152.0 (C-3), 148.2 (C-4′), 139.7 (C-1″), 136.5 (C-5), 134.9 (C-1′), 133.9 (C-6′), 130.8 (C-2), 126.9 (C-6″), 111.3 (C-6), 110.2 (C-5″), 107.7 (C-5′), 106.4 (C-4),101.3 (C-3′), 100.8 (C-3″), 56.0 (4′-OCH3), 55.8 (4′-OCH3), 21.6 (C-7), 16.4 (C-7′), 16.3 (C-7″)。
1H NMR谱显示有6个苯环间位耦合质子[δH 5.82 (1H, d, J = 1.2 Hz, H-4), 6.46 (1H, d, J = 1.2 Hz, H-6); 6.37 (1H, d, J = 2.8 Hz, H-3′), 6.28 (1H, d, J = 2.8 Hz, H-5′); 6.29 (1H, d, J = 2.8 Hz, H-3″), 6.39 (1H, d, J = 2.8 Hz, H-5″)],2个甲氧基质子[δH 3.77 (3H, s, 4′-OCH3), 3.63 (3H, s, 2″-OCH3)]和3个单峰甲基质子[δH 2.16 (3H, s, H-7), 1.81 (3H, s, H-7′), 2.26 (3H, s, H-7″)]信号。13C NMR谱经HSQC归属后显示23个碳信号,其中18个芳环碳(12个为季碳)、2个甲氧基碳(δ 56.1, 55.8)和3个甲基碳(δ 21.6, 16.4, 16.3)信号。上述信息提示该化合物由3个甲基苯酚单元组成。通过HMBC谱(图2)对3个甲基苯酚单元的NMR数据进行归属,结果表明其甲基苯酚单元A和B的NMR信号,尤其13C NMR谱与5-methoxy-3,5′-dimethyl-2,3′-oxybiphenyl-1,1′,2′-triol (2)[7]相近。而甲基苯酚单元C中的H3-7″和C-4″/5″/6″相关、H-3″/5″和C-1″相关、甲氧基质子(δH 3.63)与C-2″ (δ 153.9)相关,且其NMR数据与文献报道的1-methoxy-3,5′-dimethyl-2,3′-oxybiphenyl-5,1′,2′-triol[8]中对应单元的基本一致,确定该甲基苯酚单元C的取代情况与单元B相同,但甲氧基连在C-2″上,即为新的甲基苯酚三聚体(图2),命名为sydowiol F。

|
图 2 化合物1的关键的HMBC (箭头)相关 Fig. 2 Key HMBC (arrows) correlations of compound 1 |
化合物2 浅黄色固体,HR-ESI-MS m/z: 275.0929 [M − H]−。1H NMR (400 MHz, CD3OD): δ 6.30 (1H, d, J = 1.2 Hz, H-4), 6.38 (1H, d, J = 2.8 Hz, H-6′), 6.33 (1H, d, J = 2.8 Hz, H-4′), 5.76 (1H, d, J = 1.2 Hz, H-6), 3.77 (3H, s, 4′-OCH3); 13C NMR (100 MHz,CD3OD): δ 158.5 (C-4′), 151.7 (C-2′), 147.9 (C-3), 147.1 (C-3), 136.0 (C-1′), 133.9 (C-6′), 132.6 (C-2), 129.7 (C-5), 110.8 (C-4), 107.9 (C-5′), 106.6 (C-6), 101.3 (C-3′), 55.8 (4′-OCH3), 21.2 (C-7), 16.4 (C-7′)。以上数据与文献[7]一致,故鉴定为5-methoxy-3,5′-dimethyl-2,3′-oxybiphenyl-1,1′,2′-triol。
化合物3 白色固体,ESI-MS: m/z: 271 [M − H]−。1H NMR (400 MHz, CD3OD): δ 6.57 (1H, d, J = 1.6 Hz, H-6′), 6.54 (1H, d, J = 1.6 Hz, H-2′), 6.46 (1H, d, J = 2.2 Hz, H-4), 6.45 (1H, d, J = 2.2 Hz, H-2); 13C NMR (100 MHz, CD3OD): δ 165.2 (C-3′), 165.0 (C-7′), 163.5 (C-1′), 155.8 (C-3), 146.5 (C-5′), 146.1 (C-1), 143.3 (C-6), 132.5 (C-5), 116.6 (C-4), 114.7 (C-2), 113.4 (C-4′), 105.8 (C-2′), 105.7 (C-2), 21.3 (C-6′), 16.0 (C-7)。以上数据与文献[9]一致,故鉴定为corynesidone A。
化合物4 白色针状结晶,ESI-MS m/z: 125 [M + H]+, 247 [2M − H]−。1H NMR (400 MHz, CD3OD): δ 6.58 (1H, d, J = 8.6 Hz, H-3), 6.52 (1H, d, J = 2.6 Hz, H-6), 6.45 (1H, dd, J = 8.6, 2.6 Hz, H-2), 2.12 (3H, s, H-7); 13C NMR (100 MHz, CD3OD): δ 151.0 (C-4), 149.3 (C-1), 126.5 (C-2), 118.4 (C-3), 116.3 (C-6), 113.8 (C-5), 16.4 (C-7)。以上数据与文献[10~11]一致,故鉴定为鹿蹄草素。
化合物5 白色针状结晶,ESI-MS m/z: 139 [M − H]−。1H NMR (400 MHz, CD3OD): δ 6.20 (1H, d, J = 2.4 Hz, H-6), 6.16 (1H, d, J = 2.4 Hz, H-2), 2.15 (3H, s, H-7); 13C NMR (100 MHz, CD3OD): δ 153.1 (C-4), 144.0 (C-6), 134.3 (C-1), 127.2 (C-2), 112.1 (C-3), 102.0 (C-5), 15.3 (C-7)。以上数据与文献[12]一致,故鉴定为3-羟基鹿蹄草素。
化合物6 白色粉末,ESI-MS m/z: 169 [M + H]+。1H NMR (400 MHz, CD3OD): δ 6.73 (1H, d, J = 2.8 Hz, H-6), 6.62 (1H, d, J = 8.6 Hz, H-3), 6.58 (1H, dd, J = 8.6, 2.8 Hz, H-2), 4.49 (2H, s, H-1′), 3.59 (2H, q, J = 7.2 Hz, H-7), 1.23 (3H, t, J = 6.8 Hz, H-2′); 13C NMR (100 MHz, CD3OD): δ 151.1 (C-1), 149.3 (C-4), 126.5 (C-5), 116.8 (C-6), 116.7 (C-3), 116.1 (C-2), 68.9 (C-7), 66.8 (C-1′), 15.4 (C-2′)。以上数据与文献[13]一致,故鉴定为4-乙氧基-3-羟甲基苯酚。
化合物7 无定形粉末,比旋光([α]D25 +61.5, c=1.6 mg/ml, CH3OH), ESI-MS m/z: 469 [2M + H]+, 233 [M − H]−。1H NMR (400 MHz, CD3OD): δ 6.96 (1H, dd, J = 4.6, 9.9 Hz, H-3), 6.96 (1H, dd, J = 4.6, 9.9 Hz, H-3′), 5.92 (1H, d, J = 10.1 Hz, H-2), 5.89 (1H, d, J = 10.1 Hz, H-2′), 4.48 (1H, dd, J = 4.6, 9.4 Hz, H-4′), 4.47 (1H, dd, J = 4.6, 9.4 Hz, H-4), 2.72~2.76 (2H, m, H-6), 2.72-2.76 (2H, m, H-6′), 2.04~2.12 (2H, m, H-5), 2.04~2.12 (2H, m, H-5′), 1.16 (3H, d, J = 7.2 Hz, H-7′), 1.14 (3H, d, J = 7.2 Hz, H-7); 13C NMR (100 MHz, CD3OD): δ 204.3 (C-1), 203.5 (C-1′), 155.9 (C-3′), 151.6 (C-3), 129.1 (C-2), 128.9 (C-2′), 67.9 (C-4′), 63.7 (C-4), 42.4 (C-5′), 39.6 (C-5), 41.2 (C-6′), 39.1 (C-6), 15.6 (C-7), 15.2 (C-7′)。以上数据与文献[14]一致,故鉴定为epoxydine A。
1.5 抗细菌活性化合物1~6的活性测试表明,载样量为40 μg时所有化合物对大肠杆菌没有显示明显的抑菌圈, 而化合物1~4分别对另外4株测试菌有较明显和较微弱的抑制活性。微量稀释法测试结果表明, 化合物1、2和4对金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、黑胫病菌和青枯病菌抑菌效果较好,MIC为50或100 μg/mL,而化合物3的MIC> 400 μg/mL (表1)。
| 表 1 化合物1~4的细菌拮抗活性 Table 1 Antibacterial activity of compounds 1–4 |
非还原型聚酮合酶(NRPKSs)可催化生成芳环化合物,如苔色酸合酶催化1分子的乙酰辅酶A和3分子的丙二酰辅酶A,经缩合、脱水、烯醇化、水解等反应生成含甲基的苯甲酸——苔色酸[15]。甲基苯酚类化合物1~6应是苔色酸经脱羧、羟基化和脱水缩合形成的衍生物,但本研究还在同一发酵物中发现了大量非芳环化合物甲基环己酮二聚体epoxydine A。最近Liu等[16]报道,生防真菌绿木霉(Trichoderma virens)中水杨酸类似物Salicylaldehydes在被黄素依赖性酶VirI氧化成醌后,再由VirH进行环氧化修饰生成环己二酮,最后酮基被VirK和VirL还原成相应的醇,即环氧环己醇天然产物trichoxide。这曲霉HU0206代谢产物中的甲基环己酮类物质可能是通过聚酮合成途径生成苔色酸及甲基苯酚类化合物后,继续被修饰的产物。
活性测试表明,化合物1、2和4对多株测试细菌的活性较好,而所有化合物对大肠杆菌,以及其它化合物对所有5株测试细菌均未显示明显的拮抗活性。说明此类甲基苯酚类化合物对细菌具有拮抗特异性,芳环的羟基数量和取代位置对此类化合物的生物活性具有显著影响。
本研究从植物内生曲霉HU0206发酵物中得到1个新甲基苯酚类三聚体,以及6个已知的甲基苯酚类和甲基环己酮类化合物,并对其生源关系和抗菌活性进行了研究和探讨,初步阐明了该菌发酵物的抗菌物质基础,丰富了曲霉属真菌次生代谢产物的化学多样性,对相关化合物的合成及活性研究具有一定的参考价值。
| [1] |
FREMLIN L J, PIGGOTT A M, LACEY E, et al. Cottoquinazoline A and cotteslosins A and B, metabolites from an Australian marine-derived strain of Aspergillus versicolor[J]. J Nat Prod, 2009, 72(4): 666-670. DOI:10.1021/np800777f |
| [2] |
BUNYAPAIBOONSRI T, YOIPROMMARAT S, INTEREYA K, et al. New diphenyl ethers from the insect pathogenic fungus Cordyceps sp. BCC 1861[J]. Chem Pharm Bull, 2007, 55(2): 304-307. DOI:10.1248/cpb.55.304 |
| [3] |
ZHURAVLEVA O I, AFIYATULLOV S S, VISHCHUK O S, et al. Decumbenone C, a new cytotoxic decaline derivative from the marine fungus Aspergillus sulphureus KMM 4640[J]. Arch Pharm Res, 2012, 35(10): 1757-1762. DOI:10.1007/s12272-012-1007-9 |
| [4] |
LIU X R, SONG F H, MA L, et al. Sydowiols A–C: Mycobacterium tuberculosis protein tyrosine phosphatase inhibitors from an East China Sea marine-derived fungus, Aspergillus sydowii[J]. Tetrahedron Lett, 2013, 54(45): 6081-6083. DOI:10.1016/j.tetlet.2013.08.137 |
| [5] |
PONGTHARANGKUL T, DEMIRCI A. Evaluation of agar diffusion bioassay for nisin quantification[J]. Appl Microb Biotechnol, 2004, 65(3): 268-272. DOI:10.1007/s00253-004-1579-5 |
| [6] |
WIEGAND I, HILPERT K, HANCOCK R E W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances[J]. Nat Protoc, 2008, 3(2): 163-175. DOI:10.1038/nprot.2007.521 |
| [7] |
DU L, KING J B, MORROW B H, et al. Diarylcyclopentendione metabolite obtained from a Preussia typharum isolate procured using an unconventional cultivation approach[J]. J Nat Prod, 2012, 75(10): 1819-1823. DOI:10.1021/np300473h |
| [8] |
SUMILAT D A, YAMAZAKI H, KANNO S I, et al. Biphenyl ether derivatives with protein tyrosine phosphatase 1B inhibitory activity from the freshwater fungus Phoma sp.[J]. J Antibiot, 2017, 70(3): 331-333. DOI:10.1038/ja.2016.147 |
| [9] |
CHOMCHEON P, WIYAKRUTTA S, SRIUBOLMAS N, et al. Aromatase inhibitory, radical scavenging, and antioxidant activities of depsidones and diaryl ethers from the endophytic fungus Corynespora cassiicola L36[J]. Phytochemistry, 2009, 70(3): 407-413. DOI:10.1016/j.phytochem.2009.01.007 |
| [10] |
PAN W W, PEI G, WANG Y M, et al. Studies on the chemical constituents isolated from Pyrola calliantha[J]. NW Pharm J, 2014, 29(3): 221-222. 潘微薇, 裴刚, 王亚敏, 等. 鹿衔草的化学成分研究[J]. 西北药学杂志, 2014, 29(3): 221-222. DOI:10.3969/j.issn.1004-2407.2014.03.001 |
| [11] |
ZHOU Y B, LI H X, WANG J H, et al. Studies on the chemical constituents of Pyrola chlorantha Sw.[J]. Res Inf Trad Chin Med, 2005, 7(6): 11-13. 周玉波, 李洪侠, 王金辉, 等. 绿花鹿蹄草中的化学成分[J]. 中药研究与信息, 2005, 7(6): 11-13. DOI:10.3969/j.issn.1673-4890.2005.06.005 |
| [12] |
SEKIGUCHI J, KATAYAMA S, YAMADA Y. 6-Methyl-1,2,4-benzenetriol, a new intermediate in penicillic acid biosynthesis in Penicillium cyclopium[J]. Appl Environ Microbiol, 1987, 53(7): 1531-1535. DOI:10.1128/aem.53.7.1531-1535.1987 |
| [13] |
ZHANG Z Q, ZHENG C J, CHEN G Y, et al. Chemical constituents and antibacterial activities of the stems of Homalium stenophyllum Merr. et Chun[J]. Chin Trad Patent Med, 2015, 37(10): 2203-2208. 张中奇, 郑彩娟, 陈光英, 等. 海南天料木茎化学成分和抗菌活性的研究[J]. 中成药, 2015, 37(10): 2203-2208. DOI:10.3969/j.issn.1001-1528.2015.10.022 |
| [14] |
QIN S, HUSSAIN H, SCHULZ B, et al. Two new metabolites, epoxydine A (Ⅰ) and B (Ⅱ), from Phoma sp.[J]. Helv Chim Acta, 2010, 41(21): 169-174. DOI:10.1002/hlca.200900199 |
| [15] |
SMIT A J. Medicinal and pharmaceutical uses of seaweed natural products: A review[J]. J Appl Phycol, 2004, 16(4): 245-262. DOI:10.1023/B:JAPH.0000047783.36600.ef |
| [16] |
LIU L, TANG M C, TANG Y. Fungal highly reducing polyketide synthases biosynthesize salicylaldehydes that are precursors to epoxy-cyclohexenol natural products[J]. J Am Chem Soc, 2019, 141(50): 19538-19541. DOI:10.1021/jacs.9b09669 |
 2023, Vol. 31
2023, Vol. 31


