植物在整个生长发育过程中,生长、维持、防御和繁殖等各种功能对有限资源始终存在着竞争[1],植物必须权衡这些功能间的资源分配,才能达到最佳分配策略[2]。因此,生殖过程中的生殖分配格局以及植物如何调节其生殖分配以适应特定生存环境,是生殖生态学研究的重要任务[3]。生殖分配指植物1年中繁殖占其所同化资源的比例,也就是总资源供给繁殖器官的比例[4]。生殖分配作为生活史进化理论的一个重要组成部分[5],早已引起生态学界的高度重视[6]。生殖分配的研究在国内起步相对较晚[4],现有的研究主要集中在草地[7–9]、沙漠[10–12]、森林[13–14]等生境的植物,水生植物[15–17]也有少量报道。大量的研究表明,生境异质性、演替状态、种群密度和个体大小等都会影响植物的生殖分配。生殖分配除了受外界环境因子的影响外[4,18],自身繁育系统等内在因素也会对其产生影响。但有关繁育系统对生殖分配影响的讨论鲜见报道。
中国南方的喀斯特地区已被公认为世界植物多样性中心之一[19], 分布着很多石壁附生的植物类群,主要包括苦苣苔科(Gesneriaceae)、秋海棠科(Begoniaceae)等。喀斯特石壁土壤较浅,pH值较高,储水能力较低[20]。尽管喀斯特地区的生态环境极其脆弱,但喀斯特植物群落却表现出非常高的物种丰富度和特有性,其原因可能是这些地区高的土壤和气候变异性[19]。目前对这一特殊生境地区植物的生殖分配了解有限。研究这些脆弱生境里植物对有限资源如何在不同的构件之间分配对于本地区植物的生态适应及生物多样性保护具有重要的意义。
黄花大苞姜(Caulokaempferia coenobialis)为多年生、落叶宿根、柔弱的草本植物,仅分布于我国的广东、广西,生于海拔300~500 m的亚热带季雨林下潮湿处或山谷溪流边陡峭石壁上。黄花大苞姜常常在石壁上成片生长,株高15.9~53.1 cm[21]。黄花大苞姜拥有植物界中一种全新的自花传粉机制——花粉滑动自花传粉机制[21]。因此,本文对自交的黄花大苞姜种群在不同物候期,不同生境的生殖分配进行对比研究,主要探讨以下两个问题:(1) 黄花大苞姜各构件生物量分配在不同生境和不同物候期的变化规律如何?(2) 自交的繁育系统和石壁附生的生境条件如何影响黄花大苞姜的生殖分配?了解黄花大苞姜如何适应其特殊的生境,并为大量石生植物的生态适应性研究提供参考。
1 材料和方法 1.1 研究区概况试验地位于广东省南昆山自然保护区(113°50′ E,23°37′ N,海拔480 m)。该区年均温20.8 ℃,年均降水量2 163 mm。根据黄花大苞姜的不同生境(林窗、山谷和林内),我们选择了3个种群:天堂顶种群、上坪种群和云天海种群。天堂顶种群位于小溪旁,林边,光照充足,所附生的石壁较湿润;上坪种群位于山谷瀑布旁,附生的石壁十分潮湿,阳光直射不到该种群;云天海种群位于密林内, 较为荫蔽,附生的石壁上密布一层苔藓植物,石壁干燥。
1.2 方法在黄花大苞姜的生长周期里,分别于种群的花蕾期、盛花期和果期取材。取材时,连根茎一起挖出,用清水把根茎冲洗干净。然后按根茎、茎、叶、花、蕾、果分开装入信封带回实验室备用。在实验室里将其放入烘箱,105 ℃烘干。然后用Sartorius (BT224S d=0.1 mg)电子天平称重。生殖分配由生殖构件干重除以整株植物干重得出。另外在每一种群随机选取20株以上的植株,用数显卡尺测量株高和花部大小。数据采用SPSS software (v 20.0; IBM Corp., Armonk, NY, USA)的One-Way ANOVA和一般线性模型(general linear model, GLM)多变量(multivariate)方差分析比较各构件的生物量分配和变化;用Bivariate Correlations的Pearson相关分析法对各构件的生物量进行相关性分析;利用Curve Estimation对植株总生物量与根茎、茎、叶、生殖构件生物量和生殖分配进行回归分析,在直线方程、幂函数和指数函数3种关系间进行比较,选择拟合系数最高的函数关系作为不同器官生物量关系的分析模型。差异显著性水平均为P < 0.05。变异系数(coefficient of variation, CV)为标准差(standard deviation, SD)与平均数的比率。
2 结果和分析 2.1 不同种群黄花大苞姜植株的形态特征从表 1可见,黄花大苞姜的株高、花唇瓣面积和花冠管长度在不同种群间的变化趋势一致, 且差异显著,均以上坪 > 天堂顶 > 云天海,可能一定的光照和石壁湿度组合是黄花大苞姜最适的生长环境。太强的光照(天堂顶)和相对干燥且荫蔽的环境(云天海)可能会限制黄花大苞姜的生长发育。
| 表 1 黄花大苞姜种群的形态特征 Table 1 Characters of Caulokaempferia coenobialis in different populations |
由图 1可见,黄花大苞姜在生殖生长过程中叶、茎和根茎的生物量分配占有绝对优势,生殖部分所占比例相对较少。果期,根茎生物量分配占36.46%,茎为24.40%,叶为27.27%,而生殖构件只占11.85%。在整个花果期,根茎、叶和生殖部分的生物量分配都随物候期的发展有较大的变化。
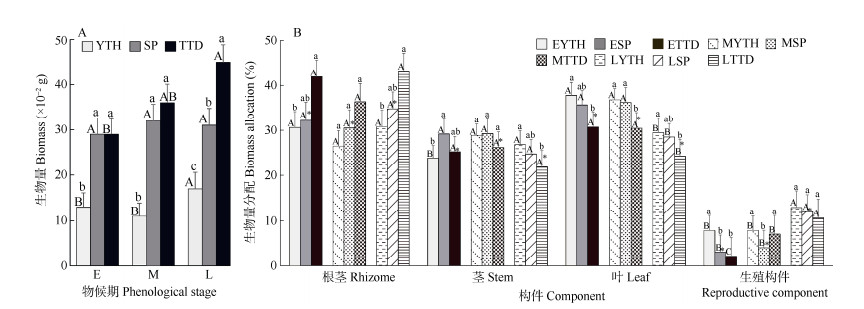
|
图 1 黄花大苞姜不同物候期的生物量(A)和构件生物量分配(B)。E: 花蕾期; M: 盛花期; L: 果期; YTH: 云天海; SP: 上坪; TTD: 天堂顶; *: 物候期的平均生物量分配值; 柱上不同大、小写字母分别表示同一种群不同物候期、同一物候期不同种群间差异显著(P < 0.05)。下同 Fig. 1 Biomass (A) and component biomass allocation (B) in different phenological stages of Caulokaempferia coenobialis. E: Flower bud phase: M: Bloom phase; L: Fruiting phase; YTH: Yuntianhai; SP: Shangping; TTD: Tiantangding; *: Mean of biomass allocation of phenological stage; Different capital and small letters indicate significant differences at 0.05 level among different phenological stages of the same population, and different populations at the same phenological stage, respectively. The same below |
在生殖生长期,随着物候期的推进,个体逐渐增大,果期达到最大。根茎的生物量分配由蕾期的34.86%先逐渐下降到盛花期的31.88%。随后,由于营养向根茎积累,其生物量分配迅速提高,果期达到最高,为36.46%;茎生物量分配的变化趋势和根茎相反,表现为先上升后下降;叶作为主要的营养器官,在营养生长转向生殖生长时(蕾期),生物量分配达到最大,平均为34.76%。随着物候期的推移,一方面营养在果实中积累,另一个方面伴随叶的逐渐衰老,其生物量分配迅速下降;而生殖构件的生物量分配则刚好与叶相反,从花蕾期到果期呈上升趋势,即从4.48%增加到11.85%。在生殖生长的各阶段,生殖构件所占比例都较小,均在13%以下。变异系数是衡量表型可塑性的重要指标。随着物候期的推移,生殖器官生物量分配的表型可塑性逐渐变小,而营养器官生物量分配的可塑性具有变大的趋势。果期,个体大小的变异系数最大,其次是作为储藏器官的根茎和生殖部分生物量分配,茎和叶生物量分配的变异系数最小,表明黄花大苞姜的个体大小和生殖分配及根茎生物量分配个体间具有较大的表型可塑性。
2.3 同一物候期的构件生物量分配比较由图 1可见,在整个生殖生长过程中,黄花大苞姜各构件生物量分配总体上变化不大。根茎和叶的比例较大,分别为31.88%~36.46%和27.27%~34.76%;其次是茎,为24.40%~25.89%;生殖构件的比例最低。不同的物候期里,构件间生物量分配的比重稍有不同,蕾期和果期各构件生物量分配是根茎 > 叶 > 茎 > 生殖构件,而盛花期为叶 > 根茎 > 茎 > 生殖构件。可见在生殖生长最旺盛的时期,黄花大苞姜将最多的资源投资在叶上,以便增加资源的获取能力。
2.4 不同种群间的构件生物量分配动态由图 1可见,黄花大苞姜的构件生物量分配在种群间的变化规律不同。花蕾期,云天海和上坪种群生物量分配是叶 > 根茎 > 茎 > 生殖构件,而天堂顶则是根茎 > 叶 > 茎 > 生殖构件。根茎和叶的生物量分配方面,云天海和天堂顶的差异显著, 但表现不同,云天海种群叶的生物量分配显著高于天堂顶,而根茎的生物量分配却显著低于天堂顶。生殖构件方面,云天海显著高于其他两个种群。盛花期,3个种群的构件生物量分配不同, 根茎与茎生物量分配在种群间没有显著差异,天堂顶的叶生物量分配显著低于其他两个种群,而生殖分配却是上坪显著低于其他两个种群。果期,3个种群的构件生物量分配都是根茎 > 叶 > 茎 > 生殖构件,种群间根茎和叶生物量分配规律和花蕾期相同,也是云天海种群叶的生物量分配显著高于天堂顶,根茎的生物量分配明显低于天堂顶,但生殖构件在3个种群间没有显著差异。可见,在光照不足的种群(云天海),黄花大苞姜进化出了增加叶的投资,减小根茎投资,从而保证生殖的生物量分配策略。在光照强的种群,则减少对叶的投资,在保证生殖的同时,增加储存构件根茎的投资。3个种群中,天堂顶种群不同构件在不同物候期的变异系数基本上都是最大的,表明光照充足的天堂顶种群各构件的表型可塑性最大。
2.5 生殖分配的年度变化为了探讨不同年度间黄花大苞姜生物量分配的变化,我们比较了2007—2009年3个年度的生物量分配情况(图 2),黄花大苞姜生殖构件的生物量分配在种群间和年度间变化较小,为9.13%~10.87%; GLM统计表明,种群和年度对生殖构件生物量分配没有显著影响,说明黄花大苞姜生殖构件的生物量分配在种群和年度间均保持稳定。黄花大苞姜营养构件的生物量分配在年度和种群间变化显著(图 2),但其变化规律不明显。根茎的生物量分配2008年显著高于2007和2009年。茎则是2007年显著高于2008和2009年,叶的生物量分配2009年显著高于2007和2008年。种群间的生物量分配,云天海种群叶的投资比例最大,而根茎的投资比例最小。可见,根茎生物量分配与茎和叶的生物量分配间存在某种权衡。
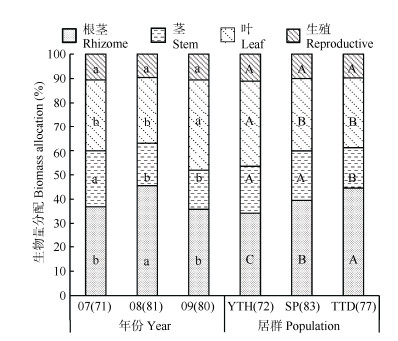
|
图 2 黄花大苞姜构件生物量分配的年度和种群变化。柱上不同大、小写字母分别表示年度和种群间差异显著(P < 0.05)。 Fig. 2 Annual and population changes in components biomass allocation of Caulokaempferia coenobialis. Different capital and small letters indicate significant differences at 0.05 level among years and populations, respectively. |
植物在生长发育过程中,构件生物量与总生物量间常见的关系有指数函数、幂函数和线性关系。由表 2可知,黄花大苞姜植株总生物量与构件生物量的关系在3个种群间表现出相似的规律。根茎、茎和叶的生物量都与总生物量呈显著正相关(P < 0.01), 但拟合方程稍有不同。不同种群根茎生物量与总生物量呈显著的线性关系,且决定系数(R2)较高,为0.810~0.929。茎生物量与总生物量的关系在种群间有差异,云天海种群呈直线关系,即茎的生物量随总生物量增加的速率不变;而在上坪和天堂顶,茎生物量与总生物量则呈现幂函数的异速生长曲线,茎生物量随总生物量增加的速率越来越小, R2相对较小(0.330~0.674)。叶生物量与总生物量的关系在种群间表现一致,最佳的拟合曲线为幂函数方程,即表现为异速生长曲线。生殖构件的生物量和生殖构件的生物量分配与总生物量的关系呈现出有趣的现象:在云天海种群生殖构件生物量与总生物量呈显著的正相关,拟合的直线方程的R2也高达0.741;而在上坪和天堂顶种群二者没有显著相关性,然而,生殖构件的生物量分配则表现出相反的结果,云天海种群生殖构件的生物量分配与总生物量没有显著相关性,在上坪和天堂顶却表现出显著的线性负相关,其R2相对较小(0.382和0.398)。总的来看,总生物量与根茎生物量表现为显著的线性函数同速生长,而对生殖分配的影响较小。
| 表 2 3个不同生境黄花大苞姜总生物量与构件生物量、生殖分配的拟合方程 Table 2 Fitted equation between total biomass and component biomass and reproductive allocation (RA) of Caulokaempferia coenobialis |
植物繁殖体大小与个体大小的关系被认为是生活史理论中最基本的研究内容,也是生态学家十分关注的问题[22]。本研究中,在3个种群黄花大苞姜投入到根茎、茎和叶的生物量都与植株总生物量呈显著正相关,说明营养构件的生物量是依赖于总生物量的,这与李蕾等[23]对狮牙草状风毛菊(Saussurea leontodontoides)的研究结果一致;而生殖构件的生物量分配在种群间却表现不同。云天海种群的总生物量与生殖分配间没有显著相关性;而上坪和天堂顶种群则呈显著的负相关,但决定系数很小,这可能与植物本身的遗传特性及其所处的具体生境(光照强度、土壤水分等)有关。3个种群的生境差异较大:云天海种群的生境光线较弱,相对干燥, 当个体可利用资源量较多时(个体越大意味着利用资源量越多),植物相应地会将更多的资源投入到生殖中去,这与高海拔地区的紫翅猪毛菜(Salsola affinis)的表现一致[24],但其生殖分配则不依赖于总生物量,这与同样处于较强胁迫生境(干热河谷)的车桑子(Dodonaea viscosa)[25]的表现相似,说明生殖分配可能以遗传因素为主导影响;上坪和天堂顶种群的生境条件较好,个体间竞争激烈,随着个体的增大可能投资到繁殖支持构件上的资源会更多,使得植物的繁殖分配相应减小[26]。这与前人对4种白刺属(Nitraria)植物[27]、黄帚橐吾(Ligularia virgaurea)[6]、肉苁蓉(Cistanche deserticola)[28]、唐古特雪莲(Saussurea tangutica)[29]和狮牙草状风毛菊[23]的研究结果相似。
3.2 不同物候期的生物量分配规律生殖分配是一个动态过程,植物在不同的物候期对各构件的生物量投资也不尽相同。本研究结果表明,黄花大苞姜种群随着物候期的推移,总生物量逐渐增大,根茎生物量分配先降低后增加,叶生物量分配则一直显著降低,生殖构件的生物量持续增加,这体现了不同物候期同化产物分配中心的差异。根茎作为黄花大苞姜的储存器官,在营养生长转换为生殖生长后,其内部储存的营养可能也要运输给生殖构件,导致其生殖分配有所下降,到了果期,黄花大苞姜又将一部分营养分配给根茎作为储存物质,以便用于未来的生存竞争。叶作为主要的产生同化物的构件,在生殖生长开始时,就已经达到了最高的生物量分配,随着物候期的推移,其产生的营养物质大多转运到了果实和根茎里,且伴随着叶的衰老,其生殖分配必然逐渐下降。生殖构件的生物量分配随物候期营养物质在果中不断积累而逐渐升高。这与前人对苦马豆(Sphaerophysa salsula)[30]、胀果甘草(Glycyrrhiza inflata)[31]、华北驼绒藜(Ceratoides arborescens)[32]和薇甘菊(Mikania micrantha)[33]的研究结果一致,即在果实成熟期, 种子的形成和发育过程需要大量营养物质,随着营养物质加速向果实运输,生殖分配逐渐增加。但也有研究表明生殖分配并非都是随物候期的发展而逐渐升高,马尾松(Pinus massoniana)[34]、东北蒲公英(Taraxacum ohwianum)[35]和狼毒(Stellera chamaejasme)[36]等的生殖配置动态变化呈现低→渐高→高→低的规律,这可能与其大量的花没有受精结果有关。黄花大苞姜是一种依靠花粉滑动实现自交的植物,没有大量的落花落果现象,结实率高达95%[21],这可能保证了生殖分配随果实的成熟而逐渐提高。
3.3 黄花大苞姜的生殖分配植物生殖分配的影响因素非常复杂。操国兴等[4]认为基因型、生活型、繁育系统、雌雄异株、种群密度、演替状态、环境可塑性及生境因子等因素对生殖分配的影响很大。外界干扰(如放牧、施肥、刈割)、逆境胁迫、植物的生物学特性等方面对植物生殖分配也有很大影响[18]。总体来讲,植物的生物量分配特征是内部因素(生物学特性)和外部因素(环境资源条件)共同作用的结果,反映出植物对环境的适应能力和生长发育规律[37]。
黄花大苞姜果期生殖分配在种群间没有明显差异,稳定在10.66%~12.95%,而营养构件生物量分配的比重高达88.15%。这与相似生境的飞机草(Eupatorium odoratum)生殖分配格局相似[38]。黄花大苞姜所生长的石壁土层较薄,保水性较差,且生境比较狭小,种群密度较大,因此种内竞争激烈,黄花大苞姜种群只有加大营养构件的资源投资,才能获得更多的养分、光照等资源,在种内竞争中占据优势。这与生境稳定性假说预测一致[39–40], 所以在某种意义上飞机草和黄花大苞姜营养构件占绝对优势的资源配置格局反映了它们对该环境的适应性。
黄花大苞姜果期的生殖分配在不同种群和年度间保持相对恒定,营养构件的生物量分配却存在差异,说明不同营养构件间存在某种权衡,而生殖分配却不受环境因素影响。因此,我们推测黄花大苞姜的生殖分配可能受遗传因素控制。生殖分配是物种对其生活环境长期适应的结果,对一个物种来说,个体的生殖分配主要取决于其生物学特性,即使所生长的环境不同,个体的总生物量有差异,但其生殖分配往往是稳定的[41]。Ackerly等[42]对豚草(Ambrosia artemisiifolia)和邢福等[36]对狼毒种群的生殖分配研究也表明,生殖分配不受环境的影响, 始终保持稳定。这类植物的生殖分配策略就是Harper[41]认为的遗传型决定的繁殖对策。
黄花大苞姜种群生殖分配偏低,除了与上述环境条件有关外,还可能与自交的繁育系统、多年生的生活史和具有根茎的生物学特征有关。据我们所知, 探讨繁育系统与生殖分配关系的研究较少。Sharma等[43]对6种车前属(Plantago)不同繁育系统植物的生殖分配研究表明,自交物种的繁殖分配明显高于远交物种,但P. major是一个例外,虽然是近交物种,但其生殖分配只有21%,是6种植物中最低的, Sharma认为可能在于其是多年生植物。有研究表明, 多次生殖的植物为了和未来潜在的生殖机会进行权衡所以每年只分配0~20%[4, 44–45];且具有根茎的植物倾向于更低的生殖分配[44]。由此推测,具有根茎的多年生自交植物可能具有较低的生殖分配。黄花大苞姜就属于这种情况。黄花大苞姜拥有自然界独特的花粉滑动自花授粉的繁育系统,且是一种多年生宿根植物,这些生物学特征共同决定了其较低的生殖分配。
综上所述,由于环境和自身生物学特性的共同影响,黄花大苞姜在长期的进化过程中形成了较高的营养构件生物量分配以提高资源获取能力;稳定的生殖分配以保证种群的延续,两种分配共同协调作用进而适应石壁这一独特的脆弱生境。
致谢 感谢南昆山省级自然保护区管理处工作人员特别是林捷夫科长及其家人对野外实验的大力支持。感谢李新亮、武文华、何禾在野外工作中给予的帮助。
| [1] |
ROFF D A, FAIRBAIRN D J. The evolution of trade-offs: Where are we?[J]. J Evol Biol, 2007, 20(2): 433-447. DOI:10.1111/j.1420-9101.2006.01255.x |
| [2] |
PÉREZ-MARTÍNEZ E, MÉNDEZ M. Reproductive allocation in plants: a reappraisal of the currency issue[J]. Nord J Bot, 2021, 39(6). DOI:10.1111/njb.03034 |
| [3] |
SU Z X, ZHONG Z C. Studies on the reproductive ecology of Gordonia acuminata population: Ⅱ. The patterns of reproductive allocation on the biomass in the population[J]. Acta Ecol Sin, 1998, 18(4): 379-385. 苏智先, 钟章成. 四川大头茶种群生殖生态学研究: Ⅱ. 种群生物量生殖配置格局研究[J]. 生态学报, 1998, 18(4): 379-385. |
| [4] |
CAO G X, XIE D T, ZHONG Z C, et al. Reproductive allocation of plant population[J]. J Sichuan For Sci Technol, 2003, 24(2): 25-29. 操国兴, 谢德体, 钟章成, 等. 植物种群的生殖分配[J]. 四川林业科技, 2003, 24(2): 25-29. DOI:10.3969/j.issn.1003-5508.2003.02.006 |
| [5] |
WENK E H, FALSTER D S. Quantifying and understanding reproductive allocation schedules in plants[J]. Ecol Evol, 2015, 5(23): 5521-5538. DOI:10.1002/ece3.1802 |
| [6] |
LIU Z J, DU G Z, CHEN J K. Size-dependent reproductive allocation of Ligularia virgaurea in different habitats[J]. Acta Phytoecol Sin, 2002, 26(1): 44-50. 刘左军, 杜国祯, 陈家宽. 不同生境下黄帚橐吾(Ligularia virgaurea)个体大小依赖的繁殖分配[J]. 植物生态学报, 2002, 26(1): 44-50. |
| [7] |
SONG Y Y, YANG Y F. Module structures and the growth analysis of Achnatherum sibiricum clones in forest margin grassland in the Songnen Plain, China[J]. Acta Pratac Sin, 2019, 28(7): 168-174. 宋月媛, 杨允菲. 松嫩平原林缘草地羽茅无性系构件结构与生长分析[J]. 草业学报, 2019, 28(7): 168-171. DOI:10.11686/cyxb2018396 |
| [8] |
LIU Y J, LI Z Q. Effects of water addition on reproductive allocation of dominant plant species in Inner Mongolia steppe[J]. Front Plant Sci, 2020, 11: 555743. DOI:10.3389/fpls.2020.555743 |
| [9] |
LI Z M, LIU J S, WU J F, et al. Effects of nitrogen deposition on grassland plant reproduction strategies[J]. Chin J Grassland, 2021, 43(7): 106-114. 李梓萌, 刘鞠善, 吴金凤, 等. 氮沉降对草地植物生殖策略的影响[J]. 中国草地学报, 2021, 43(7): 106-114. DOI:10.16742/jz.gcdxb.20200382 |
| [10] |
XU L, YU M H, DING G D, et al. Soil biocrusts reduce seed germination and contribute to the decline in Artemisia ordosica Krasch. shrub populations in the Mu Us Sandy Land of north China[J]. Glob Ecol Conserv, 2021, 26: e01467. DOI:10.1016/j.gecco.2021.e01467 |
| [11] |
LI G Q, ZHAO P P, SHAO W S, et al. Effect of enclosure on reproductive allocation of wheatgrass Agropyron mongolicum populations in desert steppes[J]. Ecol Evol, 2019, 9(24): 14023-14030. DOI:10.1002/ece3.5839 |
| [12] |
YIN C L, ZHAO J C, HU J L, et al. Phenotypic variation of a potential food crop, Agriophyllum squarrosum, impacted by environmental heterogeneity[J]. Sci Sin Vitae, 2016, 46(11): 1324-1335. 尹成亮, 赵杰才, 胡进玲, 等. 环境异质性对潜在粮食作物沙米表型变异的影响[J]. 中国科学: 生命科学, 2016, 46(11): 1324-1335. DOI:10.1360/N052015-00294 |
| [13] |
SUN F, ZHONG Z C. Reproductive allocation in Gordonia acuminata in subtropical evergreen broad-leaved forest and analysis of its adaptation using gray rational degree[J]. Acta Phytoecol Sin, 1997, 21(1): 44-52. 孙凡, 钟章成. 四川大头茶繁殖分配及其环境适应性的关联度研究[J]. 植物生态学报, 1997, 21(1): 44-52. |
| [14] |
WANG D, GAN X H, ZHANG X M, et al. Reproductive allocation in each DBH class for Tetracentron sinense Oliv. at individual modules level[J]. For Res, 2017, 30(4): 667-673. 王东, 甘小洪, 张雪梅, 等. 水青树不同径级个体构件水平上的生殖配置研究[J]. 林业科学研究, 2017, 30(4): 667-673. DOI:10.13275/j.cnki.lykxyj.2017.04.019 |
| [15] |
LI L, BARRETT S C H, SONG Z P, et al. Sex-specific plasticity of reproductive allocation in response to water depth in a clonal, dioecious macrophyte[J]. Am J Bot, 2019, 106(1): 42-50. DOI:10.1002/ajb2.1218 |
| [16] |
LI L, DING M M, LAN Z C, et al. Light availability and patterns of allocation to reproductive and vegetative biomass in the sexes of the dioecious macrophyte Vallisneria spinulosa[J]. Front Plant Sci, 2019, 10: 572. DOI:10.3389/fpls.2019.00572 |
| [17] |
LI L, BONSER S P, LAN Z C, et al. Water depth affects reproductive allocation and reproductive allometry in the submerged macrophyte Vallisneria natans[J]. Sci Rep, 2017, 7(1): 16842. DOI:10.1038/s41598-017-16719-1 |
| [18] |
GUO W, DENG W, YAN X F, et al. Research advances on impact factors of plant reproductive allocation[J]. J NE Agric Univ, 2010, 41(9): 150-156. 郭伟, 邓巍, 燕雪飞, 等. 植物生殖分配影响因素的研究进展[J]. 东北农业大学学报, 2010, 41(9): 150-156. DOI:10.19720/j.cnki.issn.1005-9369.2010.09.028 |
| [19] |
HAO Z, KUANG Y W, KANG M. Untangling the influence of phylogeny, soil and climate on leaf element concentrations in a biodiversity hotspot[J]. Funct Ecol, 2015, 29(2): 165-176. DOI:10.1111/1365-2435.12344 |
| [20] |
NIE Y P, CHEN H S, WANG K L, et al. Seasonal water use patterns of woody species growing on the continuous dolostone outcrops and nearby thin soils in subtropical China[J]. Plant Soil, 2011, 341(1/2): 399-412. DOI:10.1007/s11104-010-0653-2 |
| [21] |
WANG Y Q, ZHANG D X, RENNER S S, et al. A new self-pollination mechanism[J]. Nature, 2004, 431(7004): 39-40. DOI:10.1038/431039b |
| [22] |
KLINKHAMER P G L, MEELIS E, DE JONG T J, et al. On the analysis of size-dependent reproductive output in plants[J]. Funct Ecol, 1992, 6(3): 308-316. DOI:10.2307/2389522 |
| [23] |
LI L, WANG Y F, GOU W X, et al. Response of resource allocation of Saussurea leontodontoides during its fruiting stage to the elevation[J]. Chin J Plant Ecol, 2020, 44(11): 1164-1171. 李蕾, 王一峰, 苟文霞, 等. 狮牙草状风毛菊果期资源分配对海拔的响应[J]. 植物生态学报, 2020, 44(11): 1164-1171. DOI:10.17521/cjpe.2020.0201 |
| [24] |
LIU Z C, LIU H F, ZHAO D, et al. Influence of altitude and difference of different-sized individuals on reproductive allocation in Salsola affinis C. A. Mey. and Salsola nitraria Pall[J]. Acta Ecol Sin, 2015, 35(18): 5957-5965. 刘尊驰, 刘华峰, 赵丹, 等. 紫翅猪毛菜、钠猪毛菜不同个体大小繁殖分配差异及随海拔的变化[J]. 生态学报, 2015, 35(18): 5957-5965. DOI:10.5846/stxb201401150116 |
| [25] |
LU X J, LIU F Y, GAO C J, et al. Gender differences in biomass allocation of reproductive twigs of Dodonaea viscosa in the Dry-hot Valley of Jinsha river[J]. Acta Bot Boreali-Occid Sin, 2018, 38(9): 1733-1739. 卢雪佳, 刘方炎, 高成杰, 等. 金沙江干热河谷车桑子生殖枝生物量分配的性别差异[J]. 西北植物学报, 2018, 38(9): 1733-1739. DOI:10.7606/j.issn.1000-4025.2018.09.1733 |
| [26] |
REEKIE E G. An explanation for size-dependent reproductive allocation in Plantago major[J]. Can J Bot, 1998, 76(1): 43-50. DOI:10.1139/b97-160 |
| [27] |
LI Q H, XIN Z M, GAO T T, et al. Reproductive allocation in four desert species of the genus Nitraria L.[J]. Acta Ecol Sin, 2012, 32(16): 5054-5061. 李清河, 辛智鸣, 高婷婷, 等. 荒漠植物白刺属4个物种的生殖分配比较[J]. 生态学报, 2012, 32(16): 5054-5061. DOI:10.5846/stxb201111221782 |
| [28] |
WANG X, CHEN J, XU R, et al. Preliminary study of reproductive allocation in Cistanche deserticola[J]. China J Chin Mat Med, 2011, 36(4): 409-413. 王霞, 陈君, 徐荣, 等. 宁夏地区肉苁蓉人工栽培居群生殖分配规律的初步研究[J]. 中国中药杂志, 2011, 36(4): 409-413. DOI:10.4268/cjcmm20110406 |
| [29] |
YANG Y J, WANG Y F, QI R L, et al. Discrepancy caused by various altitudes in both floral traits and reproductive allocation of Saussurea tangutica[J]. Guihaia, 2018, 38(2): 159-168. 杨亚军, 王一峰, 祁如林, 等. 唐古特雪莲花部特征及生殖分配的海拔差异[J]. 广西植物, 2018, 38(2): 159-168. DOI:10.11931/guihaia.gxzw201707007 |
| [30] |
ZHOU X L, JIANG H, XI L Q, et al. Research on reproductive module and reproductive allocation of swainsonine [Sphaerophysa salsula (Pall) DC.] in different phenological stages[J]. J Tarim Univ, 2013, 25(4): 57-63. 周小玲, 蒋慧, 席琳乔, 等. 不同物候期苦马豆生殖构件及生殖分配的研究[J]. 塔里木大学学报, 2013, 25(4): 57-63. DOI:10.3969/j.issn.1009-0568.2013.04.011 |
| [31] |
ZHOU X L, MA X E, SHANG K W, et al. Research on reproductive allocation of biomass and nutrients in different phenological stages of Glycyrrhiza inflata[J]. Acta Pratac Sin, 2012, 21(4): 25-32. 周小玲, 马新娥, 尚可为, 等. 不同物候期胀果甘草生物量和营养物质生殖分配研究[J]. 草业学报, 2012, 21(4): 25-32. |
| [32] |
WANG P C, YI J, HAN Z L, et al. Patterns of reproductive biomass allocation of the Ceratoides arborescens population[J]. J Arid Land Res Environ, 2008, 22(12): 174-179. 王普昶, 易津, 韩智龙, 等. 华北驼绒藜种群生殖分配格局的研究[J]. 干旱区资源与环境, 2008, 22(12): 174-179. |
| [33] |
HONG L, LIU M J, SHEN H, et al. Reproductive allocation of biomass in Mikania micrantha populations from two Habitats[J]. J Wuhan Bot Res, 2010, 28(5): 598-605. 洪岚, 刘梦佼, 沈浩, 等. 两种生境中薇甘菊种群的生物量生殖分配[J]. 武汉植物学研究, 2010, 28(5): 598-605. DOI:10.3724/SP.J.1142.2010.50598 |
| [34] |
CHEN J S, SU Z X. Reproductive allocation of biomass in Pinus massoniana at MT. Jinyun[J]. Acta Phytoecol Sin, 2001, 25(6): 704-708. 陈劲松, 苏智先. 缙云山马尾松种群生物量生殖配置研究[J]. 植物生态学报, 2001, 25(6): 704-708. |
| [35] |
ZHANG J. Study on reproductive biology of Taraxacum species in northeast China[D]. Shenyang: Shenyang Agricultural University, 2013. 张建. 蒲公英属植物繁殖生物学研究[D]. 沈阳: 沈阳农业大学, 2013. |
| [36] |
XING F, GUO J X, WANG K. Study on the demography of reproductive modulars and reproductive allocation of a Stellera chamaejasme population[J]. Acta Pratac Sin, 2005, 14(4): 111-115. 邢福, 郭继勋, 王珂. 狼毒种群生殖构件数量特征与生殖配置研究[J]. 草业学报, 2005, 14(4): 111-115. DOI:10.3321/j.issn:1004-5759.2005.04.018 |
| [37] |
ZHANG W, YANG X R, JIANAER A H, et al. Biomass allocation among components of compound leaves of Fraxinus sogdiana in Yili River Reaches, Xinjiang[J]. Arid Zone Res, 2016, 33(1): 114-119. 张维, 杨晓绒, 贾娜尔·阿汗, 等. 新疆伊犁河岸小叶白蜡复叶构件生物量分配[J]. 干旱区研究, 2016, 33(1): 114-119. DOI:10.13866/j.azr.2016.01.14 |
| [38] |
WEI C Q, TANG S C, LIU M C, et al. Study on reproductive allocation of Eupatorium odoratum population in Karst mountain in Pingguo County of Guangxi[J]. Weed Sci, 2011, 29(4): 20-23. 韦春强, 唐赛春, 刘明超, 等. 广西平果县岩溶石山飞机草种群的生殖配置研究[J]. 杂草科学, 2011, 29(4): 20-23. DOI:10.3969/j.issn.1003-935X.2011.04.006 |
| [39] |
NIU J W, LEI Z L, ZHOU H K, et al. Reproductive allocation of Elymus nutans under different planting densities and nitrogen fertilizing treatments[J]. Pratac Sci, 2014, 31(7): 1343-1351. 牛建伟, 雷占兰, 周华坤, 等. 种植密度和施氮水平对垂穗披碱草生物量分配的影响[J]. 草业科学, 2014, 31(7): 1343-1351. DOI:10.11829/j.issn.1001-0629.2014-0089 |
| [40] |
CAO G X, ZHONG Z C, XIE D T, et al. The relationship between reproductive allocation, fruit set and individual size of Camellia rosthorniana in different communities[J]. Acta Phytoecol Sin, 2005, 29(3): 361-366. 操国兴, 钟章成, 谢德体, 等. 不同群落中川鄂连蕊茶的生殖分配与个体大小之间关系的探讨[J]. 植物生态学报, 2005, 29(3): 361-366. DOI:10.17521/cjpe.2005.0047 |
| [41] |
HARPER J L. Population Biology of Plants[M]. London: Academic Press, 1977: 1-892.
|
| [42] |
ACKERLY D D, JASIEŃSKI M. Size-dependent variation of gender in high density stands of the monoecious annual, Ambrosia artemisiifolia (Asteraceae)[J]. Oecologia, 1990, 82(4): 474-477. DOI:10.1007/BF00319788 |
| [43] |
SHARMA N, KOUL A, KAUL V. Pattern of resource allocation of six Plantago species with different breeding systems[J]. J Plant Res, 1999, 112(1): 1-5. DOI:10.1007/PL00013850 |
| [44] |
WILSON A M, THOMPSON K. A comparative study of reproductive allocation in 40 British grasses[J]. Funct Ecol, 1989, 3(3): 297-302. DOI:10.2307/2389369 |
| [45] |
ABRAHAMSON W G. Patterns of resource allocation in wildflower populations of fields and woods[J]. Am J Bot, 1979, 66(1): 71-79. DOI:10.2307/2442627 |
 2023, Vol. 31
2023, Vol. 31



