1b. 华东师范大学上海市城市化生态过程与生态恢复重点实验室, 上海 200241;
2. 崇明生态研究院, 上海 202162;
3. 自然资源部大都市区国土空间生态修复工程技术创新中心, 上海 200062
1b. Key Laboratory of Urbanization and Ecological Restoration of Shanghai, East China Normal University, Shanghai 200241, China;
2. Institute of Eco-Chongming (IEC), Shanghai 202162, China;
3. Technology Innovation Center for Land Spatial Eco-restoration in Metropolitan Area, Ministry of Natural Resources, Shanghai 200062, China
种群内功能性状变异指的是同一种群内不同的小种群间或个体间的功能性状差异,属于种内变异。Daniel等[1]总结了种内性状变异改变群落结构或动态的6种机制,认为忽略种内性状变异,可能会影响群落研究结果的正确性。此后的一项研究量化了种内性状变异对群落总体性状变异的贡献程度,证实了种内性状变异,对群落植物功能类型研究结果的潜在影响[2]。
植物生态对策是植物在适应环境胁迫和干扰、维持种群存续的过程中所产生的一系列特征[3]。随着全球尺度植物生态学研究的不断推进,科学家们提出了多种生态对策体系,通过刻画植物对多维度环境因子的适应性权衡来划分植物功能类型,从而达到简化群落研究的目的[4]。然而,无论生态对策分类体系如何发展,植物性状始终都是表征植物生态对策的基础指标,因此,同一物种的不同个体, 在性状上若存在显著差异,即意味着不同个体在生态对策上也可能存在较为明显的区别。一些研究表明,同一物种的不同种群,在性状上的显著差异, 的确使得不同种群在生态对策体系中的分布有所区别[5–6]。但也有的研究认为,现有的生态对策体系,无法反映出种内性状变异的真实模式及变异水平[7–8]。这些研究结果提醒我们,在利用生态对策体系对群落结构进行简化时,若简单地将某一物种当成一个整体来讨论,可能会对该物种在群落中的功能产生错误评估,但一个具有高度种内性状变异性的物种,是否也会具有种内生态对策多样性还有待验证。
CSR体系(competitors-stress tolerators-ruderal species)和LHS体系(leaf-height-seed)是2种在植物生态学研究中应用最为广泛的生态对策体系。前者认为,所有的植物在生存环境中,都将面临竞争、胁迫及干扰3种环境因子的挑战。植物生态对策应当是植物对三者适应性的综合体现,并以3种对策间的权衡关系进行表征[9]。该体系自Grime首次提出以来,经历了3次分类方法的革新[10],被逐步应用、扩展,并分别向上和向下延伸至全球水平[11]和个体水平[12]。目前已有研究案例,应用Pierce等[11]所开发的电子表格工具“StrateFy”,成功揭示出种内不同种群间,以及同一物种不同个体发育阶段间的生态对策差异[5–13]。LHS体系与“StrateFy”的建立基础不同,除叶片性状之外,它还包括植株整体大小(株高)及种子(质量)的相关性状。直接利用比叶面积、株高及种子质量3项指标的性状值进行三维投射,即可比较目标对象在LHS体系中的分布差异[3]。
芦苇(Phragmites australis)是一种在世界范围内广泛分布的禾本科(Poaceae)植物, 由多种单倍型组成(haplotype)[14]。我国境内的芦苇种群具有多样化的单倍型[15],是常用于湿地治理和造纸的、具有生态和经济双重价值的本土物种[16]。自19世纪芦苇被引入北美洲之后[17],单倍型M便迅速入侵了当地生态系统。在加拿大某些地区,该单倍型甚至取代了当地芦苇单倍型[18]。于北美洲而言,芦苇种下水平的多样性使其具有本土种和入侵种的双重身份,深刻地影响着当地生态系统的结构与功能。芦苇在基因-生态系统水平上的多样性,使得其成为研究植物环境适应对策的模式生物[19]。作为崇明岛湿地的优势种之一,芦苇不仅对整个湿地的结构与功能具有重要影响,还能为迁徙鸟类提供越冬及繁殖的生境和食物[20]。据观察,分布在崇明东滩湿地的芦苇种群,沿东西方向呈现出较为明显的形态学差异。此外,在生长季末期时,芦苇种群中同时存在处于繁殖期的个体(分株)和少部分仍处在营养生长期的个体(分株),且二者的形态学特征也存在较为明显的区别。崇明东滩湿地芦苇种群结构所展现出的多样性,使其成为研究种内性状及生态对策变异的合适样地。
目前国外利用生态对策理论体系探讨植物种群生态对策的案例相对较多[5–8],而国内在此方面的研究则较为稀缺[10],只有少数针对种间水平的研究[21–22]。有研究曾对黄河三角洲的芦苇种内CSR对策差异进行过分析[23],但并没有关注芦苇种群内不同发育阶段分株间的生态对策差异,也没有比较CSR体系和LHS体系在芦苇种群内功能性状及生态对策变异研究方面的差异和实际效果。
为探究崇明东滩湿地芦苇种群的种群内功能性状及生态对策变异,本文依据形态学性状和分布特征,将该芦苇种群划分为3个小种群(或称亚种群), 将处于繁殖生长期的分株与处于营养生长期的分株视为2个不同的分株集合,比较了3个小种群与2个分株集合的25项和20项功能性状,及3个小种群在2种生态对策体系中的特征,并提出以下假设:(1) 崇明东滩芦苇种群存在较高的种群内功能性状变异,表现为不同小种群及不同发育阶段的分株集合在所调查的功能性状上存在显著差异;(2) 芦苇种群具有生态对策变异,且不同小种群在CSR和LHS体系中的表现存在显著差异,不同发育阶段分株集合的CSR得分也存在显著差异。本研究旨在为深刻认识崇明东滩湿地沿环境梯度分布的芦苇种群的适应机制提供崭新视角;揭示的芦苇种群内功能性状及生态对策变异特征,有望为该区芦苇种群的生态保育和恢复实践,提供重要的理论参考和技术支撑。
1 材料和方法 1.1 研究区域及采样设置研究地点位于上海市崇明东滩湿地鸟类保护区的东部。沿东西方向,把广泛分布于东滩湿地的芦苇种群,划分为3个小种群,从东至西分别为: 前沿近海小种群(31°30′37″ N, 121°59′15″ E)、中部小种群(31°30′10″ N, 121°58′5″ E)及后沿近陆小种群(31°30′24″ N, 121°56′55″ E)。其中,前沿近海小种群呈斑块状分布,中部小种群及靠近98大堤的后沿近陆小种群沿南北方向呈带状分布。
于2021年10—11月对3个小种群进行采样。在中部小种群、后沿近陆小种群内,沿98大堤(南北)方向随机选取3个50 cm×50 cm的小样方,且小样方间相隔20 m以上。在前沿近海小种群中,随机选取3个50 cm×50 cm的小样方,以代表整个斑块小种群的生长状况。计数每个小样方内,芦苇的植株密度及结实率(即结实株数占植株总数的比例),然后,在每个小样方内,随机选取5株处于繁殖生长阶段的植株和5株处于营养生长阶段的植株, 测量其株高和基茎。每株植株择茎干中上部的一片完整叶片剪下,放入黑色塑料封口袋中,供后续指标的测量;其余叶片及花序剪下后,放至信封中, 并将植株齐地收获带回实验室。
1.2 植株性状及测量方法针对崇明东滩盐沼湿地的生境特征,本研究选择了25项功能性状指标对芦苇种群潜在的种群内功能性状差异进行分析。将采集的叶片放入装满水的、黑色不透光的密封袋内,于4 ℃冷藏1晚后用纸巾擦净表面水分,进行饱和鲜重(LSW)的测定; 随后用佳能扫描仪LIDE 110对叶片进行扫描,再利用Image J (2.1.0.)测量叶长(Lleaf)、叶宽(Wleaf)与叶面积(LA);最后将上述叶片放入烘箱,80 ℃烘干后称量叶片干重(LDW),并计算叶片干物质含量(LDMC)及比叶面积(SLA)[12]。干重测量完毕后将叶片粉碎用于后续生理生态学指标的测量。将信封中的叶片一并放入80 ℃烘箱中烘干,叶片总干重(ALDW)等于信封中的叶片干重与密封袋中单叶的干重之和。依据叶痕判断叶片总数(LN)及叶片死亡数(DL); 未离体的叶片则以50%的叶面积枯萎为标准进行死亡判定,叶片死亡率(DLR)为叶片死亡数占叶片总数的百分比。用卷尺测量花序长度(Linf),再将花序及采集的茎干部分放入80 ℃烘箱中烘干进行花序干重(DWinf)与茎干重(SDW)的测量。地上生物量为各器官干重的总和。对于处于繁殖时期的分株,利用各器官干重占地上生物量的百分比计算叶片(rleaf)、茎(rstem)及花序生物量(rinf)分配率。
采用蒽酮比色法测定非结构性碳水化合物含量(NSC)。取0.05 g干叶样品,加入7.5 mL蒸馏水,在沸水浴中提取20 min。冷却过滤后收集滤液,用蒸馏水定容至50 mL。取1 mL提取产物与4 mL 0.1% (W/V)的蒽酮溶液混合均匀(蒽酮溶液由体积分数为80%的H2SO4溶液制备)。在沸水浴中浸泡10 min后,于620 nm波长下测定吸光值。同时制备0、10、20、40、60、80、100 μg/L的葡萄糖溶液以绘制标准曲线。NSC=(C×Vt)/(W×Vd)×100%, 式中,C为在标准曲线上查出的糖含量(μg),Vt为提取液总体积(50 mL),W为样品重量(50 μg),Vd为测定时取用的体积(1 mL)。
采用福林酚试剂法[24]测定总酚含量, 取0.2 g粉碎的干叶片样品,放入40 mL的蒸馏水中,于80 ℃的水浴锅内,提取30 min,迅速冷却过滤,滤液定容至50 mL后备用。吸取1 mL待测样品,加入5 mL蒸馏水、1 mL福林酚试剂及3 mL质量浓度为7.5%的Na2CO3溶液,混合均匀后,于暗处显色2 h,在765 nm波长下,测定反应体系的吸光值。配置浓度为0、10、20、30、40、50 mg/L的没食子酸溶液,以绘制标准曲线。没食子酸标准溶液吸光值的测定步骤与样品相同。总酚含量参照Kapali等[25]的公式计算。
参照Tong等[26]的方法测量叶绿素含量,将0.05 g干叶片样品放入体积分数为95%的乙醇溶液中,浸提24 h,计算叶绿素a (Chl a)、b (Chl b)及总叶绿素含量(Chl a+b)。
1.3 芦苇分株在CSR及LHS生态对策体系中的分布利用Pierce等[11]提出的Excel工具“StrateFy”对芦苇分株的CSR对策得分进行计算并分类;通过输入叶面积、叶片饱和鲜重及叶片干重3项原始数据,即可返回CSR对策得分结果及分株对策类型。
本研究选择花序干重代替种子质量,进行LHS体系的构建。此外,由于种群内水平功能性状变异的范围要远小于种间水平,因此,本研究将采用比叶面积、株高和花序干重数据的绝对值来比较3个小种群在体系中的分布差异。
1.4 数据处理与分析生长末期前沿近海、中部及后沿近陆小种群的结实率分别为87.94%、73.56%及77.59%,这意味着3个小种群内的大部分植株都处于繁殖阶段,因此,应选择繁殖分株的性状数据集,来代表3个小种群的性状变异情况,以进行后续分析。
对3个小种群的25项功能性状进行单因素方差分析。若数据既符合正态分布,也符合方差齐次性,则用R 4.2.0中的“aov”函数,进行显著性检验,同时,使用“agricolae”包进行事后多重比较。当数据不符合正态分布或方差齐次性时,使用“PMCM- Rplus”包,进行方差分析及多重比较。对于叶片总数、叶片枯萎数等不连续型性状,可以将其视为有序分类变量,分析方法与不符合正态分布或方差齐次性的数据相同。对“StrateFy”返回的C、S、R对策得分,以同样的方法,进行单因素方差分析,同时,利用R中的“ggtern”函数,绘制各样本在CSR体系中的分布图。
用R中自带的“t.test”函数,对处于繁殖生长期的分株集合与处于营养生长期的分株集合的性状差异,进行独立样本t检验。对于不满足正态分布或方差齐次性的数据,以及离散型的性状指标,如叶片数、叶片枯萎数,则需使用“wilcox.test”函数, 进行非秩序性检验。不同个体发育时期分株集合, 在CSR对策得分上的差异,以同样的方式进行分析; CSR分布图采用“ggtern”函数绘制。
为了更好地展示芦苇种群处于繁殖生长期的个体在LHS体系中的分布情况,本研究选择对比叶面积、株高和花序干重性状值进行二维投影,利用“cor.test”函数,对3个性状间的相关关系进行检验,并用“ggplot2”包绘制二维体系分布图。
2 结果和分析 2.1 功能性状的差异分析生长末期3个小种群(以处于繁殖生长时期的分株代表整个小种群)在25项功能性状指标中,仅有4项未见显著差异,分别是Wleaf、LDMC、DLR和NSC (表 1)。后沿近陆小种群繁殖分株在叶片、茎、花序及植株整体大小上(形态学大小包括长度和重量两个方面)都占据优势地位,而中部小种群繁殖分株虽然在叶片、茎、植株整体大小以及花序长度上都显著小于后沿近陆小种群的繁殖分株,但其花序重量与后沿近陆小种群间,不存在显著差异。这与3个小种群在地上生物量分配方面的特征相符。分析结果表明,前沿近海小种群在叶片生物量分配上,显著高于其他2个小种群,而后沿近陆小种群则倾向于将大部分生物量分配给茎部,以支撑植株高度。与前沿近海小种群不同的是,尽管中部小种群的地上总生物量较低,但其仍倾向于将较多生物量分配于花序生长。生理生态学指标数据表明,前沿近海小种群具有较高的总酚含量,而中部小种群的叶绿素含量显著高于其他2个小种群。在与CSR对策体系直接相关的3项叶片性状指标中,LDMC在各小种群间不存在显著差异,而前沿近海小种群和后沿近陆小种群分别在SLA和LA值上占据优势。
| 表 1 芦苇小种群的功能性状特征 Table 1 Characteristics of functional traits of Phragmites australis subpopulations |
前沿近海、中部和后沿近陆3个小种群分别有18、12和15项功能性状指标在不同发育阶段的分株集合间存在显著差异(表 2)。3个小种群内不同发育阶段分株在Wleaf和NSC2项指标上均无显著差异。形态学指标分析结果显示,各小种群的生殖生长分株,在茎干及植株大小性状值、LDMC、DL和DLR上均显著高于营养生长分株。生理生态学指标的分析结果则表明,营养生长分株的叶片总酚含量及叶绿素含量显著高于生殖生长分株(仅后沿近陆小种群的营养生长分株与生殖生长分株在叶片总酚含量上不存在显著差异)。前沿近海与后沿近陆小种群生殖生长分株的LA值显著大于营养生长个体;各小种群生殖生长分株的SLA值均显著小于营养生长分株,而各小种群生殖生长分株的LDMC值则显著高于营养生长分株。
| 表 2 芦苇不同发育阶段分株集合的功能性状 Table 2 Functional trait of ramets at different developmental stages of Phragmites australis subpopulations |
生长末期各小种群在CSR的3项对策得分(即各小种群生殖生长分株的CSR得分)如下:前沿近海小种群(C=34.93±3.42, S=58.44±2.39, R=6.63±2.38), 中部小种群(C=35.34±5.40, S=60.38±5.96, R=4.29± 2.30),后沿近陆小种群(C=39.11±4.62, S=58.18±4.86, R=2.72±2.33)。其中后沿近陆小种群的C对策得分显著高于其他2个小种群(P < 0.05),而前沿近海小种群的R对策得分则在3个小种群中占据极显著优势(P < 0.001),各小种群的S对策得分不存在显著差异。生长末期种群内的分株主要属于CS、S/CS和S/CSR等3种类型。其中前沿近海和中部小种群的分株主要为前两类对策,所占比例分别为66.67%、33.33%和46.67%、53.33%。后沿近陆小种群3种对策类型的分株比例分别为60%、33.33%和6.67%。综合来看,该湿地芦苇种群整体偏向CS对策类型,其中中部小种群比其他2个小种群更偏向S对策(图 1: D)。
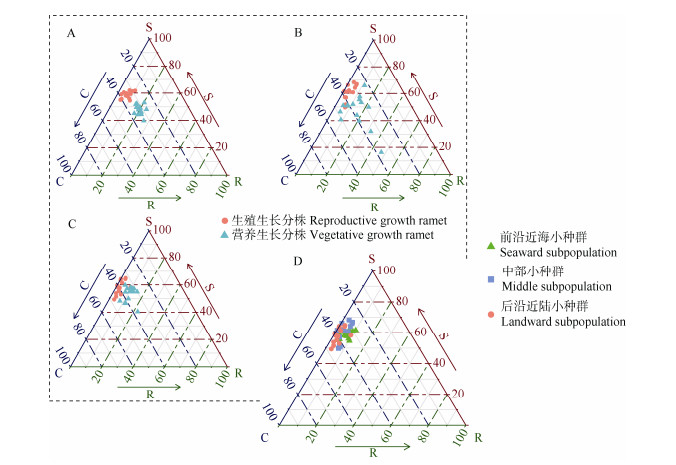
|
图 1 芦苇各小种群和不同发育阶段分株集合的CSR排序。A: 前沿近海; B: 中部; C: 后沿近陆; D: 生长末期。 Fig. 1 CSR ordinations of Phragmites australis subpopulations and ramets at different developmental stages. A: Seaward; B: Middle; C: Landward; D: End of growing stage. |
不同发育阶段分株集合在CSR体系中的排序如图 1: A~C所示。前沿近海、中部及后沿近陆小种群营养生长分株的CSR得分分别为(C=32.19±2.52, S= 47.80±3.49, R=20.02±3.01)、(C=37.05±7.59, S=47.13± 11.75, R=15.82±11.30)和(C=35.82±4.26, S=53.04± 5.39, R=11.15±4.07)。前沿近海小种群10—11月营养生长分株共包含3种对策类型,分别为S/CSR (46.67%)、CS/CSR (46.67%)及CSR (6.67%),中部小种群营养分株共包含S/CSR、CS/CSR、CSR、CS、CR/CSR和S/CS共5种对策类型(分别占26.67%、13.33%、6.67%、40%、6.67%和6.67%),而后沿近陆小种群的营养分株则有S/CSR (40%)、CS/CSR (26.67%)和CS (33.33%)共3种对策类型。综合来看,各小种群营养生长分株的R对策得分均显著高于生殖生长分株(P < 0.001),而其S对策得分则显著低于后者(前沿近海和中部小种群的显著水平为α=0.001, 后沿近陆小种群的显著水平为α=0.05)。在C对策得分上,仅有前沿近海小种群的生殖生长分株与营养生长分株间存在显著差异(P < 0.05)。
2.3 各小种群在LHS体系中的排序生长末期3个小种群在LHS体系中的二维排序如图 2所示。在崇明东滩湿地芦苇种群中,LHS体系的3个性状指标间存在显著的相关性,具体表现为SLA与其他2个性状呈负相关,而株高和花序干重则呈显著正相关关系。各小种群在3项指标的搭配上存在差异,使得LHS体系可以把不同小种群区分开来(大致以SLA=11.5 mm2/mg、株高=175 cm和DWinf=4 g为分界线)。前沿近海小种群个体倾向于高SLA值、较低的株高和较小的DWinf;中部小种群个体倾向于低SLA值、较低的株高和较大的DWinf;后沿近陆小种群个体则倾向于较低的SLA值、较高的株高和较大的DWinf。较大的SLA值与较小的DWinf是前沿近海小种群有别于其他2个小种群的特征,而中部小种群与后沿近陆小种群则可以依靠株高进行区分。
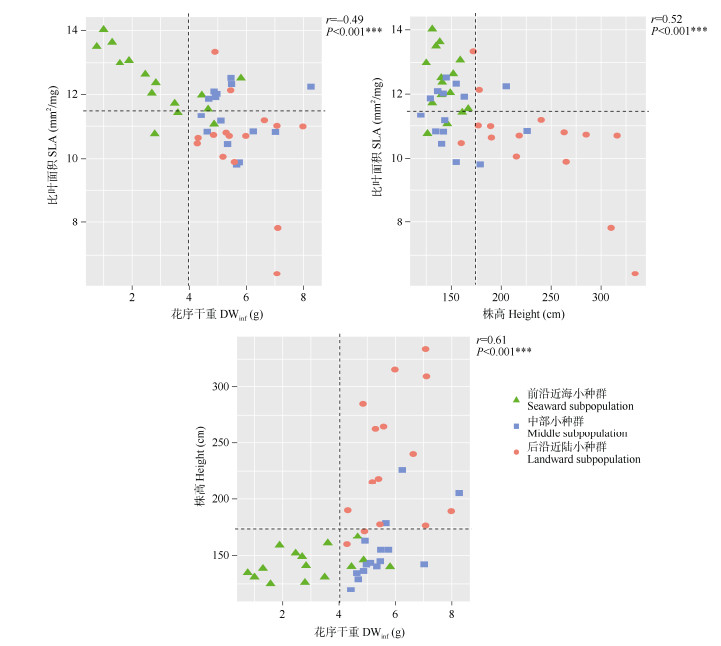
|
图 2 芦苇生长末期3个小种群在LHS体系中的二维排序 Fig. 2 Two-dimensional ordination of 3 Phragmites australis subpopulations in LHS scheme at the end of growing stage |
通过性状对比分析、CSR体系排序及LHS体系排序研究,崇明东滩湿地3个芦苇小种群间及各小种群内不同发育阶段的分株集合间都存在较为显著的功能性状差异及生态对策差异。
沿东滩湿地东西方向,芦苇种群呈现出C对策得分逐渐上升,而R对策得分逐渐降低的趋势。各小种群间CSR对策得分的差异模式基本符合芦苇种群水平的功能性状变异特征,且CSR对策的差异, 主要由植株大小性状的差异导致。3个小种群在以SLA、株高及DWinf构建的LHS体系中,具有明显的排序差异。
在崇明东滩湿地,生境胁迫因子为塑造芦苇功能性状和生态对策的主导因素,而干扰因子则是芦苇种群内功能性状和生态对策变异产生的原因。水盐因子是盐沼湿地的主要限制性因子[27],二者会对植物生长产生胁迫作用。有研究表明,NSC是植物抗逆性的重要指标之一,环境胁迫会促使植物体内的可溶性糖积累[28–30]。而本研究中,芦苇各小种群的NSC含量未见显著差异,这说明尽管在该生境内存在盐分梯度[31],但盐胁迫对各小种群的影响程度大致相同。此外,很多植物还能够通过增加叶片周转率来抵抗胁迫因子[32]。崇明东滩芦苇种群尽管在叶片死亡数和叶片总数上都存在显著的种内差异, 但是各小种群的叶片死亡率却保持基本一致,这一结果同样能够验证上述观点。CSR对策分析结果表明,芦苇各小种群的S对策得分无显著差异,且芦苇种群主要呈现CS对策,芦苇种群内功能性状及生态对策的差异模式说明盐沼湿地以胁迫为主导环境因素,但不同胁迫程度所产生的影响无显著差异。同时,在该生境内,离海更近的区域受潮汐以及波浪干扰作用明显[31],因此,前沿近海小种群呈现出较高的R对策及总酚含量(总酚含量可被用来指征干扰因子的影响程度[33–34])。而后沿近陆小种群由于受到的干扰较少,生物量积累时间较多,因此株高一般较大、C对策得分较高。
有研究表明,植物在个体发育过程中,将经历由R对策向S或C对策的转变,且植物幼苗的SLA及LA值往往大于成熟的植株个体,而LDMC则小于后者[13]。芦苇显然也符合这一规律,芦苇幼苗(处于营养生长的分株)在植株大小上显著小于生殖生长期的成熟分株,同时,较高的SLA值说明幼苗更倾向于将资源和能量投入至与资源获取相关的性状中[12],这样的特征使芦苇幼苗比处于生殖生长期的分株,具有更高的R对策得分及较低的S对策得分。此外,在本研究中,不同发育阶段分株集合处在同一时间节点、同一小种群内,因此,环境因子可能不是二者产生差异的主要原因。
3.2 基于CSR和LHS体系的芦苇种群内功能性状及生态对策比较有研究认为,种内性状的高度变异性不会导致CSR对策差异[8],原因可能是因为其仅仅对CSR对策类型进行了探讨,而没有对3项对策的具体得分进行比较分析。本研究结果表明,“StrateFy”表格工具确实能够揭示同一生境内芦苇的种群内功能性状变异特征。
尽管应用CSR体系确实检验了东滩湿地芦苇种群内功能性状变异的存在,但该分类方法在种内水平应用时,仍然表现出一些不足之处,具体体现在CSR体系无法反映芦苇花序性状的变异特征。一些研究发现,繁殖性状(如种子大小)的变异特征可能独立于叶片经济谱系及植株大小的变异特征,并成为植物应对干扰因子的主要对策[35–36]。在本研究中,芦苇中部小种群具有较小的植株及较高的花序生物量分配比,这些都是R对策植物所拥有的典型特征[9],但是CSR对策分析结果却显示中部小种群R对策得分与后沿近陆小种群无显著差异,这表明基于叶片性状指标建立的CSR分类方法,可能较难揭示芦苇种群内水平上繁殖性状的变异特征。
与CSR体系相比,LHS体系既包含叶片性状,也包含茎干及繁殖性状,这使其能够更好地刻画种群内功能性状变异及生态对策差异。在初始的LHS生态对策体系中,Westoby[3]选择种子质量这一繁殖性状来表征物种成功定植于其他生境或斑块的机会。然而,有研究表明,比起种子质量,植株高度才是决定种子传播距离的关键特征[37],这质疑了种子质量对物种传播对策的解释。相比之下,花序干重作为种子和其他传播结构的质量总和,比种子质量更能代表物种的传播能力。本研究通过花序干重、比叶面积及株高的性状组合,成功区分出了3个小种群,说明以花序干重代替种子质量所构建的LHS体系符合芦苇种群内功能性状变异特征。此外, 在种群内水平下,株高的变异程度要高于叶片化学计量特征性状及叶片形态学性状的变异程度[2], 这说明较之以叶片形态学指标为基础的CSR分类方法,LHS体系可能更能展示出种群内生态对策变异的真实水平。
综上,崇明东滩湿地3个芦苇小种群间及各小种群内不同发育阶段的分株集合间,都存在较为显著的功能性状差异及生态对策差异,且二者的差异模式基本吻合。在该湿地生境内,胁迫因子为塑造芦苇功能性状和生态对策的主导因素,而干扰因子和个体发育过程则是芦苇种群内功能性状变异和生态对策变异产生的原因。3个芦苇小种群在21项功能性状指标及C、R对策得分上均存在显著差异。在LHS体系中,以比叶面积、株高和花序干重的特定取值为分界线,可对3个小种群进行区分。由SLA、株高及DWinf所构建的LHS体系能够兼顾叶片、植株整体及繁殖性状的变异特征,因此,该体系在芦苇种群内功能性状及生态对策差异研究方面,可能要优于以叶片性状为基础的CSR分类方法。该研究结果深化了我们此前对崇明东滩湿地沿环境梯度分布的芦苇种群适应机制的认识;基于芦苇种群内功能性状及生态对策变异特征,可为该区芦苇种群的生态保育和恢复实践,提供重要的理论参考和技术支撑。
| [1] |
BOLNICK D I, AMARASEKARE P, ARAúJO M S, et al. Why intraspecific trait variation matters in community ecology[J]. Trends Ecol Evol, 2011, 26(4): 183-192. DOI:10.1016/j.tree.2011.01.009 |
| [2] |
SIEFERT A, VIOLLE C, CHALMANDRIER L, et al. A global meta- analysis of the relative extent of intraspecific trait variation in plant communities[J]. Ecol Lett, 2015, 18(12): 1406-1419. DOI:10.1111/ele.12508 |
| [3] |
WESTOBY M. A leaf-height-seed (LHS) plant ecology strategy scheme[J]. Plant Soil, 1998, 199(2): 213-227. DOI:10.1023/a:1004327224729 |
| [4] |
WESTOBY M, FALSTER D S, MOLES A T, et al. Plant ecological strategies: Some leading dimensions of variation between species[J]. Annu Rev Ecol Syst, 2002, 33(1): 125-159. DOI:10.1146/annurev.ecolsys.33.010802.150452 |
| [5] |
ASTUTI G, CICCARELLI D, ROMA-MARZIO F, et al. Narrow endemic species Bellevalia webbiana shows significant intraspecific variation in tertiary CSR strategy[J]. Plant Biosyst, 2019, 153(1): 12-18. DOI:10.1080/11263504.2018.1435576 |
| [6] |
DE FRENNE P, GRAAE B J, KOLB A, et al. An intraspecific appli- cation of the leaf-height-seed ecology strategy scheme to forest herbs along a latitudinal gradient[J]. Ecography, 2011, 34(1): 132-140. DOI:10.1111/j.1600-0587.2010.06399.x |
| [7] |
KURZE S, BAREITHER N, METZ J. Phenology, roots and repro- ductive allocation, but not the LHS scheme, shape ecotypes along an aridity gradient[J]. Perspect Plant Ecol Evol Syst, 2017, 29: 20-29. DOI:10.1016/j.ppees.2017.09.004 |
| [8] |
LEVAČIĆ D, JELASKA S D. Consistent grime's CSR strategy of daisy fleabane Erigeron annuus (L.) Pers. despite its high morphological variability-a case study from Zagreb and Medvednica Mt., Croatia[J]. Diversity, 2022, 14(1): 45. DOI:10.3390/d14010045 |
| [9] |
GRIME J P. Vegetation classification by reference to strategies[J]. Nature, 1974, 250(5461): 26-31. DOI:10.1038/250026a0 |
| [10] |
YAO Z, WU Y M, YOU H L, et al. Research progress of plant competitor-stress tolerator-ruderal (CSR) theory and its application[J]. Acta Ecol Sin, 2022, 42(1): 24-36. 姚忠, 吴永明, 游海林, 等. 竞争- 耐胁迫-杂草型植物对策理论及其应用研究进展[J]. 生态学报, 2022, 42(1): 24-36. DOI:10.5846/stxb202101060055 |
| [11] |
PIERCE S, NEGREIROS D, CERABOLINI B E L, et al. A global method for calculating plant CSR ecological strategies applied across biomes world-wide[J]. Funct Ecol, 2017, 31(2): 444-457. DOI:10.1111/1365-2435.12722 |
| [12] |
PIERCE S, BRUSA G, VAGGE I, et al. Allocating CSR plant func- tional types: The use of leaf economics and size traits to classify woody and herbaceous vascular plants[J]. Funct Ecol, 2013, 27(4): 1002-1010. DOI:10.1111/1365-2435.12095 |
| [13] |
DAYRELL R L C, ARRUDA A J, PIERCE S, et al. Ontogenetic shifts in plant ecological strategies[J]. Funct Ecol, 2018, 32(12): 2730-2741. DOI:10.1111/1365-2435.13221 |
| [14] |
SALTONSTALL K. The naming of Phragmites haplotypes[J]. Biol Invasions, 2016, 18(9): 2433-2441. DOI:10.1007/s10530-016-1192-4 |
| [15] |
AN J X, WANG Q, YANG J, et al. Phylogeographic analyses of Phragmites australis in China: Native distribution and habitat prefe- rence of the haplotype that invaded North America[J]. J Syst Evol, 2012, 50(4): 334-340. DOI:10.1111/j.1759-6831.2012.00192.x |
| [16] |
JI Y H, ZHOU G S, LV G H, et al. Expansion of Phragmites australis in the Liaohe Delta, north-east China[J]. Weed Res, 2009, 49(6): 613-620. DOI:10.1111/j.1365-3180.2009.00727.x |
| [17] |
SALTONSTALL K. Cryptic invasion by a non-native genotype of the common reed, Phragmites australis, into North America[J]. Proc Natl Acad Sci USA, 2002, 99(4): 2445-2449. DOI:10.1073/pnas.032477999 |
| [18] |
LELONG B, LAVOIE C, JODOIN Y, et al. Expansion pathways of the exotic common reed (Phragmites australis): A historical and genetic analysis[J]. Divers Distrib, 2007, 13(4): 430-437. DOI:10.1111/j.1472-4642.2007.00351.x |
| [19] |
SALTONSTALL K, MEYERSON L A. Phragmites australis: From genes to ecosystems[J]. Biol Invasions, 2016, 18(9): 2415-2420. DOI:10.1007/s10530-016-1240-0 |
| [20] |
GAN X J, CAI Y T, CHOI C, et al. Potential impacts of invasive Spartina alterniflora on spring bird communities at Chongming Dongtan, a Chinese wetland of international importance[J]. Estuar Coast Shelf Sci, 2009, 83(2): 211-218. DOI:10.1016/j.ecss.2009.03.026 |
| [21] |
YANG Y T, ZENG H W, WEN Z M, et al. Classification of plant functional types based on LHS strategy in Yanhe River Basin[J]. J NW For Univ, 2019, 34(2): 84-91. 杨玉婷, 曾鸿文, 温仲明, 等. 基于LHS策略的延河流域植物功能型划分[J]. 西北林学院学报, 2019, 34(2): 84-91. DOI:10.3969/j.issn.1001-7461.2019.02.13 |
| [22] |
XU P C, YOU Z T, JI Y H, et al. Study on ecological strategies of 22 common woody plants in Castanopsis kawakami Nature Reserve[J]. J Subtrop Resour Environ, 2019, 14(4): 23-29. 徐鹏程, 游章湉, 纪宇皝, 等. 格氏栲自然保护区22种常见木本植物的生态策略[J]. 亚热带资源与环境学报, 2019, 14(4): 23-29. DOI:10.19687/j.cnki.1673-7105.2019.04.004 |
| [23] |
ZHOU D Y, NI Y H, YU X N, et al. Trait-based adaptability of Phragmites australis to the effects of soil water and salinity in the Yellow River Delta[J]. Ecol Evol, 2021, 11(16): 11352-11361. DOI:10.1002/ece3.7925 |
| [24] |
LI J, NIE J Y, LI H F, et al. On determination conditions for total polyphenols in fruits and its derived products by Folin-phenol methods[J]. J Fruit Sci, 2008, 25(1): 126-131. 李静, 聂继云, 李海飞, 等. Folin-酚法测定水果及其制品中总多酚含量的条件[J]. 果树学报, 2008, 25(1): 126-131. DOI:10.3969/j.issn.1009-9980.2008.01.026 |
| [25] |
KAPALI J, SHARMA K R. Estimation of phytochemicals, antioxidant, antidiabetic and brine shrimp lethality activities of some medicinal plants growing in Nepal[J]. J Med Plants, 2021, 20(80): 102-116. DOI:10.52547/jmp.20.80.102 |
| [26] |
TONG Y, GAO L J, XIAO G M, et al. Microwave pretreatment- assisted ethanol extraction of chlorophylls from Spirulina platensis[J]. J Food Process Eng, 2012, 35(5): 792-799. DOI:10.1111/j.1745-4530.2010.00629.x |
| [27] |
CUI L L, LI G S, OUYANG N L, et al. Response of variation of net primary productivity to edaphic factors in the coastal salt marshes[J]. Acta Ecol Sin, 2020, 40(19): 7018-7029. 崔林林, 李国胜, 欧阳宁雷, 等. 滨海盐沼湿地植被净初级生产力变化对土壤因子的响应[J]. 生态学报, 2020, 40(19): 7018-7029. DOI:10.5846/stxb201905301134 |
| [28] |
BEN DKHIL B, DENDEN M. Salt stress induced changes in germi- nation, sugars, starch and enzyme of carbohydrate metabolism in Abelmoschus esculentus L. (Moench.) seeds[J]. Afr J Agric Res, 2010, 5(12): 1412-1418. |
| [29] |
MALONE J G, MITTOVA V, RATCLIFFE R G, et al. The response of carbohydrate metabolism in potato tubers to low temperature[J]. Plant Cell Physiol, 2006, 47(9): 1309-1322. DOI:10.1093/pcp/pcj101 |
| [30] |
SCHMITZ J, HEINRICHS L, SCOSSA F, et al. The essential role of sugar metabolism in the acclimation response of Arabidopsis thaliana to high light intensities[J]. J Exp Bot, 2014, 65(6): 1619-1636. DOI:10.1093/jxb/eru027 |
| [31] |
DING W H, JIANG J Y, LI X Z, eta al. Spatial distribution of species and influencing factors across salt marsh in southern Chongming Dongtan[J]. Acta Phytoecol Sin, 2015, 39(7): 704-716. 丁文慧, 姜俊彦, 李秀珍, 等. 崇明东滩南部盐沼植被空间分布及影响因素分析[J]. 植物生态学报, 2015, 39(7): 704-716. DOI:10.17521/cjpe.2015.0067 |
| [32] |
SHAAR-MOSHE L, HAYOUKA R, ROESSNER U, et al. Phenotypic and metabolic plasticity shapes life-history strategies under combinations of abiotic stresses[J]. Plant Direct, 2019, 3(1): e00113. DOI:10.1002/pld3.113 |
| [33] |
FEENY P. Seasonal changes in oak leaf tannins and nutrients as a cause of spring feeding by winter moth caterpillars[J]. Ecology, 1970, 51(4): 565-581. DOI:10.2307/1934037 |
| [34] |
FORKNER R E, MARQUIS R J, LILL J T. Feeny revisited: condensed tannins as anti-herbivore defences in leaf-chewing herbivore commu- nities of Quercus[J]. Ecol Entomol, 2004, 29(2): 174-187. DOI:10.1111/j.1365-2311.2004.0590.x |
| [35] |
LAVOREL S, MCINTYRE S, LANDSBERG J, et al. Plant functional classifications: From general groups to specific groups based on response to disturbance[J]. Trends Ecol Evol, 1997, 12(12): 474-478. DOI:10.1016/s0169-5347(97)01219-6 |
| [36] |
PIERCE S, BOTTINELLI A, BASSANI I, et al. How well do seed production traits correlate with leaf traits, whole-plant traits and plant ecological strategies?[J]. Plant Ecol, 2014, 215(11): 1351-1359. DOI:10.1007/s11258-014-0392-1 |
| [37] |
THOMSON F J, MOLES A T, AULD T D, et al. Seed dispersal distance is more strongly correlated with plant height than with seed mass[J]. J Ecol, 2011, 99(6): 1299-1307. DOI:10.1111/j.1365-2745.2011.01867.x |
 2023, Vol. 31
2023, Vol. 31


