2. 江西省林业科学院林木遗传育种与栽培研究所, 南昌 330032;
3. 峡江县林木良种场, 江西 吉安 331409
2. Institute of Forest Genetic Breeding and Cultivation, Jiangxi Academy of Forestry, Nanchang 330032, China;
3. Xiajiang County Forest Seed Farm, Ji'an 331409, Jiangxi, China
湿地松(Pinus elliottii)属于常绿乔木,自上世纪三十年代从美国引进国内[1],因其生长迅速、产脂力高、抗性强等特点,很快成为我国南方地区重要的造林树种[2]。近年来,湿地松因其松脂产量高、杂质少、松节油含量高等优势,脂用价值日益凸显,加上松材线虫病危害致使马尾松(P. massoniana)栽培面积不断缩减,在某些地区湿地松已逐渐取代马尾松成为主要采脂树种[3-4]。
松脂不仅能为生产林化产品提供可再生的原料,也是松树抵御昆虫以及食草动物攻击的重要手段[5]。松脂是萜烯类混合物,以异戊二烯亚基(C5)为基本单位,主要通过2种不同的途径:甲羟戊酸(mevalonic acid, MVA)和甲基赤藓糖磷酸(methyl- erythritol phosphate, MEP)途径合成。目前在马尾松中利用转录组测序[6]、在油松(P. tabuliformis)中利用基因组测序[7]初步解析了松脂生物合成调控机制, 并发现了一些可能参与调控松脂合成的关键基因,如萜烯合酶、细胞色素P450、ABC转运蛋白和香叶基二磷酸合酶等。然而,相对于其他产脂树种,湿地松松脂合成相关的调控机制方面研究较少。
江西省湿地松的采脂期通常为5月—10月,松脂产量在7、8月达到峰值,到10月底采脂活动基本结束。本研究选取湿地松第一代种子园中同一无性系Ⅱ-142在不同采脂期4、8、10月的木质部和针叶作为样本进行转录组测序,与火炬松(P. taeda)基因组进行比对,以了解湿地松松脂合成相关基因随季节性变化的表达差异,并通过对比产脂高峰期(8月)与产脂量低谷时期(4、10月)、高产脂无性系与低产脂无性系的基因表达差异,筛选出松脂合成的关键调控基因,以期为后续的高产脂育种工作提供科学的参考。
1 材料和方法 1.1 材料选择江西省峡江县林木良种场湿地松第一代种子园(115°24′ E, 27°33′ N)中无性系Ⅱ-142为试验材料,分别在4月(采脂前期)、8月(采脂高峰期)和10月(采脂结束期)采集无性系1.3 m胸径处树干的木质部组织和针叶,4、8、10月的木质部样本编号为SAPB、SAUB、SOCB,针叶为混样,编号为SPN,每组样本设置3个重复。采集同一种子园中的高产脂无性系2-0420 (产量约20 kg/ind.)和低产脂无性系2-113 (产量约5 kg/ind.)的木质部和针叶进行RT- qPCR (real-time reverse-transcription polymerase chain reaction)验证,所有样品采集后放入液氮速冻,保存在-80 ℃超低温冰箱中随时取用。
1.2 RNA提取和转录组测序CTAB法提取总RNA,采用琼脂糖凝胶电泳、Nanodrop及Agilent 2100分析仪检测总RNA的浓度、纯度以及完整性。构建cDNA文库,首先利用Oligo(dT)磁珠对mRNA进行富集,然后用阳离子随机打断mRNA,并以得到的片段为模板获得cDNA文库。文库构建后使用Agilent 2100 bioanalyzer和RT-qPCR对文库质量进行检测,检测合格后采用IlluminaHiSep4000进行转录组测序。
1.3 数据质控、基因比对及组装转录组测序获得的原始数据(raw reads)首先要进行过滤,除掉质量低的、带接头的以及碱基信息不明确的reads,从而获得高质量的clean reads。其次,对clean data进行Q20、Q30和GC含量的计算。最后使用HISAT2软件将质控后的clean reads与火炬松基因组进行比对,并用StringTie软件进行新转录本组装。
1.4 差异基因筛选及富集分析差异基因表达分析通过DESeq2软件(1.20.0)进行,并使用Hochberg和Benjamini的方法来对P值进行调整,以P < 0.05,|log2FoldChange| > 1.0为标准筛选差异基因,通过clusterProfiler (3.4.4)软件对差异基因进行GO和KEGG富集分析,并修正了基因长度偏差。
1.5 产脂相关基因表达验证挑选8个与产脂相关的基因进行实时荧光定量PCR,验证其在无性系Ⅱ-142的4、6、8、10月的木质部和针叶中的表达量以及在高、低产脂的无性系中的表达量差异。利用PrimeScript™ RT Master Mix (Perfect Real Time)试剂盒(TaKaRa, 大连)进行反转录,并通过Primer-BLAST在线平台设计引物(表 1),内参基因为UBI。用CFX实时定量PCR扩增仪(Bio-Rad, 上海)进行实时荧光定量PCR,反应程序为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40次循环。使用2-∆∆CT法计算相对表达量。
| 表 1 荧光定量PCR引物 Table 1 Primers of quantitative real-time PCR |
对原始数据进行过滤得到546 356 450条clean reads, 总碱基为81.94G。每个样本的Q20值均超过98%,Q30值平均为94.77%,GC含量为44~46.5,且与火炬松基因组的平均比对率达到90.21% (表 2)。不同样本间的相关性系数为0.829~0.961,说明样本间的表达模式比较接近。这表明转录组数据质量较好,可以用于后续分析。并利用StringTie软件共获得了16 460条新的unigenes,加上比对上火炬松转录组的51 751条unigenes,共获得68 211条unigenes。
| 表 2 样品测序的质量评估 Table 2 Quality assessment of sample sequencing |
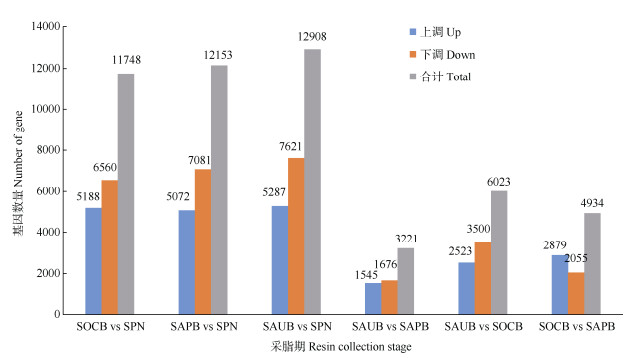
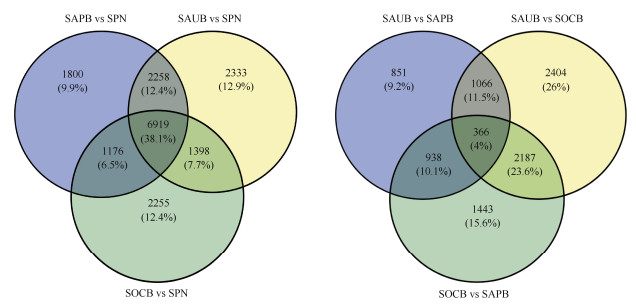
以P < 0.05,|log2FoldChange| > 1.0为基因差异表达的筛选标准,从图 1可见,不同采脂时期木质部中差异表达基因数量不一,其中以8月与10月样品间(SAUB vs SOCB)的差异基因最多,为6 023个unigenes,8月与4月间(SAUB vs SAPB)的差异基因最少,为3 221个unigenes,3个对比组合(图 2)共有的差异基因仅为366个unigenes,少于它们各自独有的差异基因。
|
图 1 不同采脂时期湿地松不同器官的差异基因数。SAPB: 4月木质部; SAUB: 8月木质部; SOCB: 10月木质部; SPN: 针叶。下同 Fig. 1 DEGs in different organs of Pinus elliottii at different resin collection stages. SAPB: Xylem in April; SAUB: Xylem in August; SOCB: Xylem in October; SPN: Needle. The same below |
|
图 2 差异基因韦恩图 Fig. 2 Wayne diagram of DEGs |
相对于不同采脂时期,不同组织间获得的差异基因数量较多(图 1),其中以8月份木质部与针叶间(SAUB vs SPN)的差异基因最多,为12 908个unigenes, 包括5 287个上调基因和7 621个下调基因,3个不同比对组合(SAPB vs SPN、SAUB vs SPN、SOCB vs SPN)中,共有的差异基因为6 919个,4、8、10月各自独有的差异基因分别为1 800、2 333和2 255个(图 2)。
2.3 差异基因的GO富集分析对所有样本间的差异基因进行GO富集分析(图 3), 结果表明木质部与针叶间(SAPB vs SPN、SAUB vs SPN、SOCB vs SPN)差异最显著的条目均为光合作用,而SOCB vs SPN组合用于蛋白质翻译的tRNA氨基酰化(tRNA aminoacylation for protein translation)、tRNA氨基酰化(tRNA aminoacylation)等分类差异也比较显著;不同采脂时期的木质部间(SAUB vs SAPB、SAUB vs SOCB、SOCB vs SAPB)的差异基因GO富集分析表明,SAUB vs SOCB、SOCB vs SAPB间的差异基因富集的条目基本一致, 但SAUB vs SOCB差异最显著的条目为有机物分解代谢过程,SOCB vs SAPB差异最显著的条目为对生物胁迫的反应。对于SAUB vs SAPB组合,差异基因主要富集在对非生物胁迫的反应和对水分的反应这2条类目中。

|
图 3 差异基因的GO富集分析 Fig. 3 Enriched GO terms of DEGs |
将不同样本间的差异基因进行KEGG富集分析(图 4),结果表明木质部与针叶间差异基因富集的通路差别不大,差异最显著的通路为卟啉与叶绿素代谢、光合作用、玉米素生物合成等。不同采脂时期的木质部间差异基因的KEGG富集表明,SAUB vs SAPB、SAUB vs SOCB差异最显著的通路都为类黄酮生物合成,而SOCB vs SAPB差异最显著的富集通路为苯丙烷生物合成。与松脂合成相关的萜类通路方面,SAPB vs SPN、SOCB vs SPN、SOCB vs SAPB间均有差异基因富集在二萜生物合成通路, 而SAPB vs SPN在萜类骨架合成、单帖生物合成等通路的差异也很显著。

|
图 4 差异基因的KEGG富集分析 Fig. 4 Enriched KEGG pathways of DEGs |
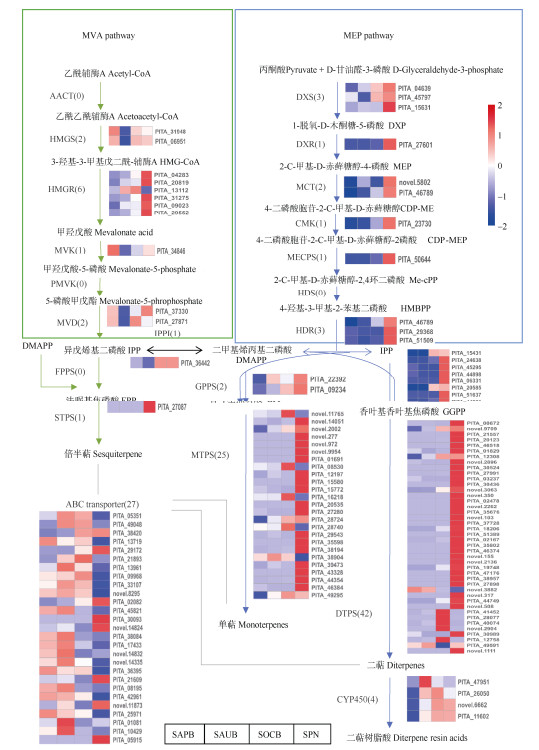
为深入了解湿地松松脂在基因和酶水平上的代谢,基于KEGG富集结果对萜类合成相关通路进行了分析,并对其在不同阶段不同组织中表达谱绘制了热图,以说明参与松脂生物合成和积累的候选基因的表达谱。分析表明萜类合成相关的差异基因共有133个(图 5),参与MEP途径的差异基因有93个,其中3个DXS基因;参与MVA途径的差异基因仅有12个,其中有6个为HMGR基因。在通路中共发现68个TPS基因,其中有42个二萜合酶、25个单萜合酶、1个倍半萜合酶;ABC转运蛋白基因有27个,其中13个在8月表达量最高。
|
图 5 湿地松萜烯生物合成途径。AACT: 乙酰辅酶A乙酰转移酶; HMGS: 羟甲基戊二酰辅酶A合成酶; HMGR: 羟基甲基戊二酰辅酶A还原酶; MVK: 甲羟戊酸激酶; PMVK: 磷酸甲戊酸激酶; MVD: 二磷酸戊二酸脱羧酶; DXS: 1-脱氧-d-木酮糖-5-磷酸合酶; DXR: 1-脱氧-d-木酮糖-5-磷酸还原酶; MCT: 2-C-甲基-d-赤藓糖醇4-磷酸胞苷基转移酶; CMK: 4-二磷酸胞苷基-2-C-甲基-d-赤藓糖醇激酶; MECPS: 2-C-甲基-d-赤藓糖醇2, 4-环二磷酸合酶; HDS: 2-C-甲基-d-赤藓糖醇2, 4-环二磷酸合酶; HDR: 2-甲基-d-赤藓糖醇2, 4-环二磷酸还原酶; IPPI: 异戊烯基二磷酸δ异构酶; GPPS: 香叶基二磷酸合酶; FPPS: 法呢基焦磷酸合酶; GGPPS: 香叶基香叶基二磷酸合酶; STPS: 倍半萜合酶; MTPS: 单萜合酶; DTPS: 二萜合酶; CYP450: 细胞色素P450。 Fig. 5 Resin terpene biosynthesis pathways in Pinus elliottii. AACT: Acetyl-CoA acetyltransferase; HMGS: Hydroxy methylglutaryl-CoA synthase; HMGR: Hydroxy methylglutaryl-CoA reductase; MVK: Mevalonate kinase; PMVK: Phosphomevalonate kinase; MVD: Diphosphomevalonate decarboxylase; DXS: 1-Deoxy-d-xylulose-5-phosphate synthase; DXR: 1-Deoxy-d-xylulose-5-phosphatereductoisomerase; MCT: 2-C-Methyl-d-erythritol 4-phosphate cytidylyl- transferase; CMK: 4-Diphosphocytidyl-2-C-methyl-Derythritolkinase; MECPS: 2-C-Methyl-d-erythritol 2, 4-cyclodiphosphate synthase; HDS: 2-C-Methyl-d- erythritol 2, 4-cyclodiphosphate synthase; HDR: 2-Cmethyl-d-erythritol 2, 4-cyclodiphosphate reductase; IPPI: Isopentenyl-diphosphate δ-isomerase; GPPS: Geranyl diphosphate synthase; FPPS: Farnesyl pyrophosphate synthase; GGPPS: Geranylgeranyl diphosphate synthase; STPS: Sesquiterpene synthase; MTPS: Monoterpene synthase; DTPS: Diterpene synthase; CYP450: Cytochrome P450. |
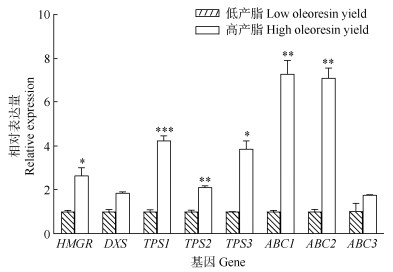
从差异基因(图 5)中选择萜类合成通路上游的HMGR、DXS基因和下游的TPS基因,以及具有转运功能ABC转运蛋白基因进行实时定量PCR验证,结果表明(图 6, 7),HMGR (PITA_13112)基因在10月的表达量最高,在高产脂无性系中的表达量显著高于低产脂无性系;DXS (PITA_15631)基因在针叶中表达量显著高于木质部,而在不同月份的木质部之间差异不大,在高产脂无性系中的表达量高于低产脂无性系, 但差异并不显著;3个TPS基因(PITA_ 39473、PITA_ 38904和PITA_28724)在8月的表达量显著高于其他月份和针叶的,高产脂无性系表达量显著高于低产脂无性系,其中TPS1 (PITA_39473)基因在高、低产脂无性系中的差异极显著(P < 0.001); 除了ABC2 (PITA_ 13961)基因在10月的表达量高于8月,其他ABC转运蛋白基因(PITA_33107、PITA_05351)都在8月的表达量最高,整体上在高产脂的无性系中的表达量高于低产脂无性系。实时荧光定量的结果与转录组数据基本一致,说明转录组数据是可靠的。#

|
图 6 8个基因实时荧光定量PCR结果。柱上不同字母表示显著差异(P < 0.05); 4: 4月的木质部; 6: 6月的木质部; 8: 8月的木质部; 10: 10月的木质部。 Fig. 6 RT-qPCR analysis results of 8 genes. Different letters upon column indicate significant difference at 0.05 level. 4: Xylem in April; 6: Xylem in June; 8: Xylem in August; 10: Xylem in October. |
|
图 7 8个差异基因的表达。*: P < 0.05; **: P < 0.01; ***: P < 0.001。 Fig. 7 Expression of 8 DEGs in Pinus elliottii. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
湿地松是重要的产脂树种之一,由于其基因组较大和遗传背景不清,调控松脂合成的机制研究进展缓慢。测序技术的快速发展,为湿地松松脂合成的分子机制研究提供了很好的研究手段,目前已经完成了湿地松全长转录组和高通量转录组测序工作[8-9]。但针对松脂合成通路解析及其相关调控基因挖掘与鉴定等方面的分析则较少涉及,分子调控机制的研究还处于开始阶段。因此,本研究以湿地松无性系的针叶与不同采脂时期的木质部作对比, 针对松脂产量季节性变化开展二代高通量测序,并以火炬松基因组为参考进行有参分析,Q30平均为94.77%,与火炬松基因组的平均比对率为90.21%,高于前人[10]的研究报道,说明本实验的转录组数据质量较高。
松脂主要由萜类物质组成,在针叶树种中萜类物质通过MVA和MEP途径合成,有很多基因参与萜类物质生物合成[6]。本研究中发现133个差异基因参与萜类物质合成,包括HMGR、DXS、ABC转运蛋白基因等。HMGR和DXS基因分别是MVA途径和MEP途径中的第1个关键的限速酶[11-12]。本研究中共发现6个HMGR基因,其中5个在针叶中表达量较高,而在油松中发现HMGR基因在新萌发的针叶中表达量显著高于1 a生和2 a生针叶,说明新萌发针叶可能是萜类物质合成的主要场所[7];1个HMGR (PITA_13112)基因在10月木质部和针叶中呈高表达,实时定量PCR验证结果发现该基因在10月产脂量最高,与转录组测序结果一致,且该基因在高产脂的无性系中的表达量显著高于低产脂无性系,说明该基因在湿地松中可能是调控松脂合成的关键基因。但在思茅松(Pinus kesiya var. lang- bianensis)的高产脂机制研究中,HMGR基因在高、低产脂无性系中无差异表达[13]。因此,HMGR基因在不同松类树种中表达模式不一,在湿地松萜类物质合成中的具体调控作用尚需进一步验证。在湿地松中发现3个DXS基因呈差异表达,选择DXS基因(PITA_15631)进行验证,发现在不同月份的木质部之间表达量差异不显著,在高产脂无性系与低产脂无性系中差异也不显著。在思茅松中,DXS基因(AIY22671.1)在高产脂无性系中呈现高表达[13],该基因与DXS基因(PITA_15631)相似度为98.81%, 为同一家族中不同基因;而在马尾松的8个DXS基因中有5个在低产脂无性系中呈现高表达,仅有1个在高产脂无性系中具有较高表达量[14],因此,该DXS基因与其他松树中已报道的DXS基因序列存在差异,其生物学功能可能存在差异,故其在湿地松中的调控作用尚需要深入开展功能验证。
萜烯合酶基因(TPS)分为7个基因亚家族,包括TPS-a、TPS-b、TPS-c、TPS-d、TPS-e/f、TPS-g和TPS-h, 松属植物的TPS基因通常属于TPS-d家族[14], 它是萜类合成通路下游的一个关键基因,催化底物(如GPP、FPP、GGPP和OPP)上烯丙基二磷酸键的断裂或质子化,电离产生酶结合活性碳阳离子中间体,然后在酶活性位点的空间约束下重新排列或环化,最终形成不同链长的有环或无环萜类化合物, 对萜类多样性的贡献极大[15-16]。已有研究表明,松科植物中含有大量的萜类合成酶,火炬松中鉴定出68个萜类合成酶[17],马尾松中有50个TPS转录本,19个呈差异表达[18],通过基因组测序发现油松有134个TPS基因,远高于其他植物中发现的TPS基因数量[7]。本研究通过转录组测序发现了68个TPS基因,其中绝大部分在针叶中表达量较高,而在不同月份的木质部中呈差异表达的TPS有19个。在木质部呈差异表达的19个TPS基因中选择3个进行实时定量PCR验证,结果表明3个TPS基因在产脂高峰期的表达与其他时期具有显著差异,其中2个TPS基因(PITA_39473和PITA_38904)的表达趋势与测序结果一致,1个TPS基因(PITA_28724)与测序结果有点偏差,但在高产脂无性系中表达量也显著高于低产脂无性系。这与思茅松、马尾松的研究结果相似[13-14],说明这3个TPS基因正调控萜类物质合成。
ABC转运蛋白是进行生物体内跨膜运输的一种特殊蛋白,含有1个由12个跨膜螺旋组成的跨膜结构域(TMD)和与ATP结合的区域(NBD),可分为内向转运蛋白和外向转运蛋白[19]。ABC转运蛋白参与植物次生代谢物的运输,还具有调控基因转录的功能[20]。在松属植物中,ABC参与松脂合成相关的萜烯类物质转运,已经发现其ABC转运基因表达在火炬松和马尾松中与松脂合成相关[6, 21]。本研究通过转录组测序分析,发现了27个ABC转运基因, 其中大部分在8月的表达量最高。3个ABC转运基因,除了ABC2 (PITA_13961)外,ABC1 (PITA_33107)和ABC3 (PITA_05351)均在产脂高峰期(8月)的表达量最高,与转录组测序结果一致,且整体上在高产脂无性系中的表达量高于低产脂无性系。同样,在湿地松中通过转录组测序与分析筛选出6个与产脂相关的ABC转运基因,其中4个ABC转运基因在高产脂无性系中表达量较高,2个ABC转运基因则在低产脂无性系中表达量较高[22],在马尾松中也有类似情况[6]。因此,ABC转运基因家族中不同基因可能在松脂合成调控中发挥不同作用,具体调控机制尚需要开展进一步的研究与探索。
综上,本研究挖掘出133个参与萜类物质合成通路的相关差异基因,其中HMGR、DXS、TPS、ABC转运蛋白等基因在萜类物质合成中发挥重要的调控作用,HMGR和DXS基因为松脂萜类物质合成上游通路中关键的限速酶,而3个TPS基因(PITA_39473、PITA_38904和PITA_28724)和2个ABC转运蛋白基因(PITA_33107和PITA_05351)在松脂萜类物质合成下游通路中发挥关键的正调控作用。
| [1] |
DING W, GU Z J, HUANG W H, et al. Evaluation of growth and adaptability of American Pinus elliottii in south Jiangxi[J]. S China For Sci, 2020, 48(5): 37-40. 丁伟, 谷振军, 黄文晖, 等. 美国引种湿地松在赣南地区生长适应性评价[J]. 南方林业科学, 2020, 48(5): 37-40. DOI:10.16259/j.cnki.36-1342/s.2020.05.008 |
| [2] |
DENG L P, HUANG T, WANG Z, et al. Genetic analysis of clones and a new round breeding parents selection in the improved slash pine seed orchard[J]. For Environ Sci, 2020, 36(4): 1-7. 邓乐平, 黄婷, 王哲, 等. 湿地松改良种子园无性系的遗传评价及新一轮育种亲本选择[J]. 林业与环境科学, 2020, 36(4): 1-7. DOI:10.3969/j.issn.1006-4427.2020.04.001 |
| [3] |
ZHUANG W Y, ZHANG Y Y, ZOU Y X. Selection for high-resin yield of slash pine and analysis of factors concerned[J]. Acta Agric Univ Jiangxi, 2007, 29(1): 55-60. ZHUANG W Y, ZHANG Y Y, ZOU Y X. 高产脂湿地松选择和相关因子的分析[J]. 江西农业大学学报, 2007, 29(1): 55-60. DOI:10.3969/j.issn.1000-2286.2007.01.012 |
| [4] |
ZHAO Z D, WANG J, LU Y J, et al. Demand analysis of individuation pine resources for fine chemical utilization of pine oleoresin[J]. Chem Ind For Prod, 2021, 41(3): 1-10. 赵振东, 王婧, 卢言菊, 等. 松脂精细化学利用对个性化松树资源的需求分析[J]. 林产化学与工业, 2021, 41(3): 1-10. DOI:10.3969/j.issn.0253-2417.2021.03.001 |
| [5] |
HAMBERGER B, OHNISHI T, HAMBERGER B, et al. Evolution of diterpene metabolism: Sitka spruce CYP720B4 catalyzes multiple oxidetions in resin acid biosynthesis of conifer defense against insects[J]. Plant Physiol, 2011, 157(4): 1677-1695. DOI:10.1104/pp.111.185843 |
| [6] |
BAI Q S, HE B X, CAI Y L, et al. Transcriptomic and metabolomic analyses reveal several critical metabolic pathways and candidate genes involved in resin biosynthesis in Pinus massoniana[J]. Mol Genet Genom, 2020, 295(2): 327-341. DOI:10.1007/s00438-019-01624-1 |
| [7] |
NIU S H, LI J, BO W H, et al. The Chinese pine genome and methy- lome unveil key features of conifer evolution[J]. Cell, 2022, 185(1): 204-217. DOI:10.1016/j.cell.2021.12.006 |
| [8] |
DING X Y, DIAO S, LUAN Q F, et al. A transcriptome-based association study of growth, wood quality, and oleoresin traits in a slash pine breeding population[J]. PLoS Genet, 2022, 18(2): e1010017. DOI:10.1371/journal.pgen.1010017 |
| [9] |
DIAO S, DING X Y, LUAN Q F, et al. A complete transcriptional landscape analysis of Pinus elliottii Engelm. Using third-generation sequencing and comparative analysis in the Pinus phylogeny[J]. Forests, 2019, 10(11): 942. DOI:10.3390/f10110942 |
| [10] |
DE OLIVEIRA JUNKES C F, DE ARAÚJO JÚNIOR A T, DE LIMA J C, et al. Resin tapping transcriptome in adult slash pine (Pinus elliottii var. elliottii)[J]. Ind Crops Prod, 2019, 139: 111545. DOI:10.1016/j.indcrop.2019.111545 |
| [11] |
CHEN Y, XIE Q D, TANG Y Q, et al. Advances in synthetic metabolic pathways and rate-limiting enzymes of plant terpene[J]. Mol Plant Breed, 2018, 16(7): 2371-2379. 陈瑶, 谢琴鼎, 唐亚琴, 等. 植物萜类合成代谢途径及限速酶的研究进展[J]. 分子植物育种, 2018, 16(7): 2371-2379. DOI:10.13271/j.mpb.016.002371 |
| [12] |
CHU W, LIU Y Y, LI Y B, et al. Advances on plant 3-hydroxy-3- methylglutaryl coenzyme a reductase (HMGR) genes[J]. Curr Biotechnol, 2018, 8(2): 93-102. 褚蔚, 刘洋洋, 李永波, 等. 植物3-羟基-3-甲基戊二酰辅酶A还原酶基因研究进展[J]. 生物技术进展, 2018, 8(2): 93-102. DOI:10.19586/j.2095-2341.2017.0126 |
| [13] |
WANG Y, YUAN X L, MEI H, et al. Transcriptome and gene expression analysis revealed mechanisms for producing high oleoresin yields from Simao pine (Pinus kesiya var. langbianensis)[J]. Plant Omics J, 2018, 11(1): 42-49. DOI:10.21475/poj.11.01.18.pne1085 |
| [14] |
LIU Q H, ZHOU Z C, WEI Y C, et al. Genome-wide identification of differentially expressed genes associated with the high yielding of oleoresin in secondary xylem of Masson pine (Pinus massoniana Lamb.) by transcriptomic analysis[J]. PLoS One, 2015, 10(7): e0132624. DOI:10.1371/journal.pone.0132624 |
| [15] |
ZHU P H, CHEN Y, JI K S. A review of terpene synthases and genes in Pinaceae[J]. J Nanjing For Univ (Nat Sci), 2021, 45(3): 233-244. 朱沛煌, 陈妤, 季孔庶. 松科植物萜类合成酶及其基因家族研究进展[J]. 南京林业大学学报(自然科学版), 2021, 45(3): 233-244. DOI:10.12302/j.issn.1000-2006.202004027 |
| [16] |
CELEDON J M, BOHLMANN J. Oleoresin defenses in conifers: chemical diversity, terpene synthases and limitations of oleoresin defense under climate change[J]. New Phytol, 2019, 224(4): 1444-1463. DOI:10.1111/nph.15984 |
| [17] |
CHEN X E. Identification and functional analysis of Pt, TPS and P450 genes in terpenoid synthesis pathway of loblolly pine[D]. Xi'an: Shaanxi Normal University, 2017: 19-35. 陈小娥. 火炬松萜类合成途径中PT、TPS和P450基因的鉴定与功能分析[D]. 西安: 陕西师范大学, 2017: 19-35. |
| [18] |
MEI L N, LI Z C, YAN Y J, et al. Identification and functional study of oleoresin terpenoid biosynthesis-related genes in masson pine (Pinus massoniana L.) based on transcriptome analysis[J]. Tree Genet Genom, 2020, 16(4): 53. DOI:10.1007/s11295-020-01448-w |
| [19] |
CHEN D B, WANG J Y, XIAO C W, et al. Research progress in structure of ABC transporters and their function in pathogenic fungi[J]. Prog Biochem Biophys, 2021, 48(3): 309-316. 陈道波, 王教瑜, 肖琛闻, 等. ABC转运蛋白结构及在植物病原真菌中的功能研究进展[J]. 生物化学与生物物理进展, 2021, 48(3): 309-316. DOI:10.16476/j.pibb.2020.0238 |
| [20] |
BRAZ A S K, FINNEGAN J, WATERHOUSE P, et al. A plant ortho- logue of RNase L inhibitor (RLI) is induced in plants showing RNA interference[J]. J Mol Evol, 2004, 59(1): 20-30. DOI:10.1007/s00239-004-2600-4 |
| [21] |
WESTBROOK J W, RESENDE JR M F R, MUNOZ P, et al. Association genetics of oleoresin flow in loblolly pine: Discovering genes and predicting phenotype for improved resistance to bark beetles and bioenergy potential[J]. New Phytol, 2013, 199(1): 89-100. DOI:10.1111/nph.12240 |
| [22] |
ZHOU C C, LI Y L, WANG Z, et al. Screening and expression analysis of different genes for oleoresin production in the specific period of Pinus elliottii×P. caribaea by RNA-Seq technology[J]. Bull Bot Res, 2021, 41(3): 419-428. 周晨晨, 李义良, 王哲, 等. 基于RNA-Seq技术的湿加松特定时期产脂差异基因筛选及表达分析[J]. 植物研究, 2021, 41(3): 419-428. DOI:10.7525/j.issn.1673-5102.2021.03.012 |
 2023, Vol. 31
2023, Vol. 31


