铁皮石斛(Dendrobium officinale)为兰科(Orchidaceae)石斛属多年生草本植物,位列“中华九大仙草”之首,具有滋阴清热、生津益胃、润肺止咳、抗肿瘤、抗氧化、增强人体免疫力和降低血糖等作用。由于铁皮石斛自然分布较少,生长缓慢,繁殖率低以及过度采伐,其野生资源已遭严重破坏,被列为濒危保护的中药品种。随着组织培养技术的发展和应用,现阶段铁皮石斛的组织培养技术已经趋于成熟,铁皮石斛的有机种植、林下种植以及仿野生种植已成为近年的热点,但因产量过低制约着铁皮石斛种植的发展,提高铁皮石斛产量成为了亟待解决的问题。
兰科菌根系统中存在多种内生真菌类型,主要属担子菌门、半知菌门和子囊菌门,其中担子菌类真菌为优势菌群[1]。担子菌胶膜菌科中的无性态属瘤菌根菌属(Epulorhiza sp.)以及瘤菌根菌属的有性态胶膜菌属(Tulasnella)是兰科植物的主要共生真菌[2]。瘤菌根菌在铁皮石斛的生长发育中起着促进生长的作用[3–4]。金辉等[5]通过双重培养条件研究了铁皮石斛组培苗在接种瘤菌根菌60 d后的变化, 发现接菌苗鲜重显著增加, 体内B、Si、Fe、Cu、Mn等多种矿质元素含量显著提高。
近年来,有关铁皮石斛的分子遗传学、基因组、转录组、蛋白质组与代谢组等已有研究[6–8],Wu等[9]利用大规模代谢组学和转录技术,基于生理特征分析研究了低温信号转导、转录调控和基因表达,揭示了铁皮石斛幼苗对低温驯化的响应。但目前对瘤菌根菌与铁皮石斛中的互作和促生机制还未有系统的研究。本研究在前期已开展了瘤菌根菌的分离纯化、鉴定,发现瘤菌根菌与铁皮石斛根系形成共生关系后对铁皮石斛的生长具有促进效果,提高铁皮石斛的产量和营养成分的含量[10–11]。本研究将通过转录组和代谢组比较分析瘤菌根菌侵染后促生机制,进而为铁皮石斛的分子育种、功能基因的挖掘和活性成分的生物合成提供依据,对铁皮石斛种植具有重要的应用价值。
1 材料和方法 1.1 材料供试材料为冠豸山野生铁皮石斛(Dendrobium officinale),瘤菌根菌菌株(Epulorhiza sp.)在福建省农业科学院亚热带农业研究所保存。
1.2 方法石斛盆栽苗的准备 泥炭土高温灭菌后装入未使用过的花盆,将生根培养基中4 cm高的铁皮石斛组培苗种在花盆中,每盆种3丛,每丛3株石斛苗。
菌液培育与接菌处理 配制液体PDA培养液,接入瘤菌根菌,放入180 r/min摇床,28 ℃震荡培育7 d后用粉碎机搅碎大块菌丝至均匀,用5 mL移液枪将菌液接种在石斛的根基部,每丛分3点各接5 mL,接80盆。接菌的为处理组(T),未接菌的为对照组(CK)。每月接菌1次,总共接菌3次。当根系开始分叉时进行随机取样,设置3个生物学重复。
1.3 数据处理转录组测序、数据的拼接、组装和功能注释由北京百迈克生物科技有限公司完成,测序平台为Illumina HiSeq 4000。代谢组测定使用安捷伦1290超高效液,所使用的色谱柱为购自Waters的UPLC BEH Amide色谱柱(1.7 μm, 2.1 mm×100 mm)。采用DPS对所得数据进行统计处理及显著性检验分析, 显著水平为0.05。
2 结果和分析 2.1 瘤菌根菌对铁皮石斛新芽生长的影响当无菌组培苗移载到花盆2个月后植株停止生长但会长出新芽,新芽长出新根。从图 1和表 1可见,不管接菌与否,铁皮石斛新芽的生长周期基本相同,新芽都在每年的3月长出,到12月植株封顶停止生长,即新芽的生长周期大约为10个月。铁皮石斛在9至12月的生长速度较快,是最适生长期,接菌处理的表现更为显著,茎增长了11.16 cm, 叶片数增加了11.39片,而未接菌的茎增长了9.39 cm, 叶片数增加了10.1片。未接菌植株新芽在整个生育期生长比较缓慢,植株矮小,叶片数少,与接菌处理的茎长和叶片数差异显著;9月后的差异更显著。在生长期内接菌处理的新芽生长速度较未接菌快。植株的叶片数越多,茎干就越长,叶片数与茎长呈显著正相关关系,相关系数为0.993。因此,推测接菌一方面诱导了根系分叉,加大根系面积,增强营养的吸收;另一方面诱导植株发生一系列代谢变化来调控生长。

|
图 1 铁皮石斛新芽的生长。A, B, C分别为未接菌1、6、9个月; D, E, F分别为接菌1、6、9个月。标尺=2 cm。 Fig. 1 Growth of new bud of Dendrobium officinale. A, B, C show uninoculation for 1, 6, 9 months, respectively; D, E, F show inoculation for 1, 6, 9 months, respectively. Bars=2 cm |
| 表 1 铁皮石斛新芽的根茎叶变化 Table 1 Changes in roots, stems and leaves of new buds of Dendrobium officinale |
设定阈值VIP>1.0,FC>1.2或FC<0.833且P<0.05,未接菌与接菌处理的根系共筛选出262条差异基因,差异表达基因有177条,接菌处理中上调表达的有59条,下调表达的有118条。与常用数据库进行比对,获得注释的差异基因共有172条, 其中GO数据库注释了38个差异表达基因, 占总数的22.1%;而KEGG数据库注释了70个差异表达基因, 占40.7%。在GO数据库中,植物基因划分为3类,分别为生物学过程、细胞成分和分子功能。GO富集分析表明,38个DEGs分为20个功能组,其中生物学过程61条、细胞成分57条和分子功能40条。在分子功能分类中以催化活性和结合基因为主,占92.11%,其中催化活性占52.63%;参与细胞组分的DEGs在细胞和细胞组分占比最高,其次为细胞膜和细胞器;参与生物学过程的DEGs主要集中在代谢过程、细胞过程和单组织过程,以代谢过程占比最高(图 2)。

|
图 2 差异表达基因的GO富集分析。1: 催化活性; 2: 转运体活性; 3: 绑定; 4: 细胞外区域; 5: 细胞; 6: 膜; 7: 细胞连接; 8: 大分子复合物; 9: 细胞器; 10: 细胞器部分; 11: 膜部分; 12: 细胞部分; 13: 共质体; 14: 代谢过程; 15: 细胞过程; 16: 多细胞生物过程; 17: 发育过程; 18: 单一生物过程; 19: 应激反应; 20: 定位。 Fig. 2 Gene ontology analysis of differentially expressed genes (DEGs). 1: Catalytic activity; 2: Transporter activity; 3: Binding; 4: Extracellular region; 5: Cell; 6: Membrane; 7: Cell junction; 8: Macromolecular complex; 9: Organelle; 10: Organelle part; 11: Membrane part; 12: Cell part; 13: Symplast; 14: Metabolic process; 15: Cellular process; 16: Multicellular organismal process; 17: Developmental process; 18: Single-organism process; 19: Response to stimulus; 20: Localization. |
在KEGG PATHWAY数据库中,植物的生物代谢通路划分为5类,分别为细胞过程、环境信息处理、遗传信息处理、新陈代谢和生物体系统。KEGG通路分析结果表明,35条DEGs注释到35条KEGG通路(图 3),其中12条上调表达的DEGs注释到17条通路,23条下调表达的DEGs注释到22条通路中,遗传信息处理类中的内质网蛋白质加工通路的基因最多, 有199条,其中DEG有7条;其次是新陈代谢类中的氨基糖和核苷酸糖代谢通路,有124条基因,DEG有3条。
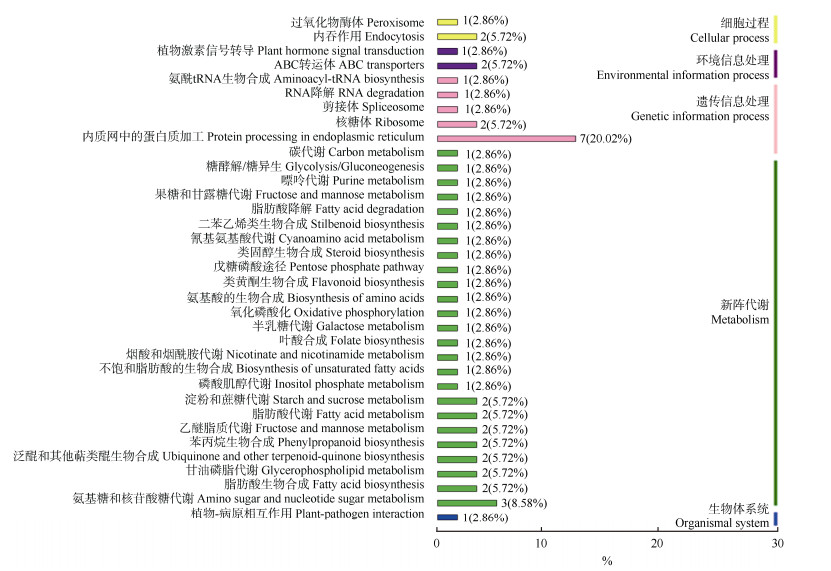
|
图 3 铁皮石斛根系DEGs的KEGG分析 Fig. 3 KEGG analysis of DEGs in Dendrobium officinale roots |
设定阈值VIP>1.0,FC>1.2或FC<0.833且P<0.05,从未接菌与接菌处理的根系中共检测出2 543个代谢物,筛选出194个差异代谢物(DMs),其中104个在接菌根系中含量上调,90个含量下调,接菌处理显著提高了铁皮石斛根系的代谢物含量。
有59个差异代谢产物在KEGG数据库中没有注释,对注释的135个差异代谢物进行分类,主要包括糖类、氨基酸及其衍生物、有机酸及衍生物、核苷酸及衍生物、脂肪酸类、黄酮类、萜类、苯丙素类、生物碱、醇类、酯类以及植物激素类等(图 4),其中氨基酸及其衍生物占20.0%,其次糖类(14.1%),有机酸及有机酸盐和苯丙素类分别占12.6%和8.9%。
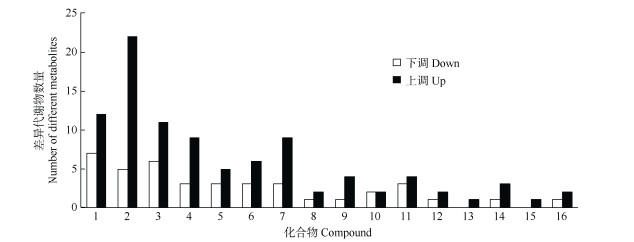
|
图 4 差异代谢物的数量。1: 糖; 2: 氨基酸及其衍生物类; 3: 有机酸及衍生物; 4: 脂肪酸类; 5: 核苷酸及衍生物; 6: 酮; 7: 苯丙素类; 8: 生物碱; 9: 萜类; 10: 醇类; 11: 酯类; 12: 植物激素类; 13: 胺; 14: 醌; 15: 酚; 16: 其他。 Fig. 4 Number of differential metabolites. 1: Carbohydrates; 2: Amino acids and derivatives; 3: Organic acids and derivatives; 4: Fatty acids; 5: Nucleotides and derivatives; 6: Ketone; 7: Phenylpropanoids; 8: Alkaloids; 9: Terpenes; 10: Alcohols; 11: Ester; 12: Plant hormones; 13: Amine; 14: Quinone; 15: Pheno; 16: Others. |
KEGG分析表明(图 5),54个差异代谢物分布在5类生物代谢通路的33个途径中,参与包括代谢途径、微生物代谢、抗生素的生物合成、碳代谢、氨基酸的生物合成、玉米素生物合成及植物次生代谢产物的生物合成等活动,与糖类、氨基酸等初生代谢产物积累或主要次生代谢物积累及植物激素的合成相关, 其中参与代谢途径的差异代谢物数量最多,有113个代谢物,其中9个差异显著代谢物;其次是不同环境的微生物代谢,有63个代谢物,4个差异显著代谢物。
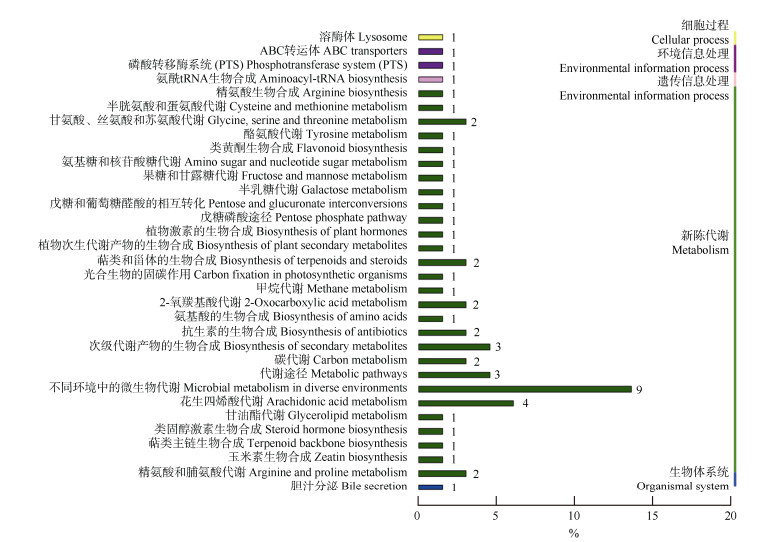
|
图 5 注释的差异代谢物通路分类图 Fig. 5 Pathway classification map of annotated differential metabolites |
对不同处理的铁皮石斛根系的差异基因和差异代谢物进行关联分析,找到9条共同富集代谢通路(表 2),分别为氨基酸的生物合成、半乳糖代谢、类黄酮生物合成、碳代谢、ABC转运体、果糖和甘露糖代谢、氨基糖和核苷酸糖代谢、磷酸戊糖途径以及氨酰基-tRNA的生物合成。这些通路中有9个DEGs和6个DMs, 9个DEGs分别为转醛醇酶基因(TAL1)、内切-1, 4-β-甘露糖苷酶基因(MAN)、莽草酸O-羟基肉桂酰基转移酶基因(HCT)、几丁质酶基因(CHI)、Ⅲ类酸性内切几丁质酶基因(CHⅢ)、几丁质酶Hevamine基因(CHH)、ATP结合盒蛋白亚家族B成员1转运蛋白基因(ABCB1)、ATP结合盒蛋白亚家族B成员2转运蛋白基因(ABCB2)和组氨酸tRNA合成酶基因(HARS1), 其中3个通路的DEG为TAL1, 且接菌处理比未接菌上调;2个通路的DEG为MAN,接菌处理比未接菌显著上调。
| 表 2 瘤菌根菌促进铁皮石斛生长的DEGs与DMs的联合分析 Table 2 Combined analysis of DEGs and DMs related to promoting of Dendrobium officinale growth |
半乳糖代谢、ABC转运体、果糖和甘露糖代谢及氨基糖和核苷酸糖代谢4个通路共有7个DEGs,其中半乳糖代谢通路有1个(MAN),ABC转运体有2个(ABCB1,ABCB2),果糖和甘露糖代谢通路有1个(MAN)、氨基糖和核苷酸糖代谢通路有3个(CHI、CHⅢ、CHH)。但这些通路中共同的DM为上调表达的D-甘露糖。在氨基酸的生物合成、碳代谢和氨酰基-tRNA的生物合成3个通路中只有2个DEGs (TAL1和HARS1),1个共同的DM,为显著上调表达的3-磷酸丝氨酸,log2FC为1.350 7。除共同的DM,氨基酸的生物合成通路中还有1个DM (N-乙酰-L-谷氨酸);碳代谢通路有2个DMs,分别是下调表达的二羟基丙酮和上调表达的2-脱氢-3-脱氧-D-葡萄糖酸盐;而氨酰基-tRNA的生物合成通路中只有1个DM, 即3-磷酸丝氨酸。在磷酸戊糖途径通路的DEG为TAL1,DM为上调表达的2-脱氢-3-脱氧-D-葡萄糖酸盐。而类黄酮生物合成通路的DEG是HCT,DM为上调表达的新橙皮苷。
氨基酸的生物合成、氨酰基-tRNA的生物合成和碳代谢途径的DEG和DM的差异均达到极显著水平,推测瘤菌根菌与铁皮石斛根系共生后诱导调控了TAL1和HARS1表达,从而改变了促进铁皮石斛生长的主要代谢物氨基酸和糖含量。
3 结论和讨论内生真菌对宿主的系统演化、生长发育及提高抗逆性具有十分重要的作用,几乎可以被当作植物的一个“组织器官”,是影响植物发育、生理、代谢的重要因素[12]。内生真菌侵染组织后,为了行使特定的生物学功能,互作双方在形态、生理和分子水平均发生着深刻的变化,从而建立稳定有效的共生体。
内生真菌与寄主互作时会引起菌体和寄主的形态变化。一方面互作时内生真菌的菌丝形态发生变化,Chacón等[13]利用激光共聚焦技术观察了GFP标记的哈茨木霉菌株侵染番茄(Lycopersicon esculentum)根系的菌丝形态变化,结果表明共培养2 d后菌丝顶端呈现酵母状的乳突型细胞,推测这种特异性的形态变化有助于双方营养的交换。另一方面互作时寄主植物发生农艺性状的变化,如丛枝菌根(AM)真菌可以促进紫穗槐(Amorpha fruticosa)结瘤数量来提高固氮能力[14]。本课题组前期研究表明, 瘤菌根菌与铁皮石斛根形成菌根并建立起共生关系后,原本只有1条主根的根系结构发生了变化, 主根上长出许多侧根和根毛,侧根上还会形成二级侧根,增加了根尖数和根体积[4]。本研究表明瘤菌根菌会促使新芽分化,长出新根并分叉生成侧根。在从发芽到封顶的整个生育期相对固定,接菌处理加快了新芽的生长速度,增加叶片数和茎干长度,进而提高了产量,这与前期[11]的研究结果一致。
内生真菌与寄主互作时还会引起寄主的基因表达和代谢物的变化。菌株侵染根系后能削弱根部细胞HvBI-1基因的表达,HvBI-1的过表达却限制菌丝的侵染强度[15]。对丛枝菌根和外生菌根的研究表明,根系分泌物中的倍半萜类、黄酮类物质充当了信号分子,促进孢子萌发[16]。李娜[17]通过代谢组研究野生稻(Oryza granulata)内生真菌与拟南芥(Arabidopsis thaliana)的共生关系,结果表明宿主代谢途径中的三羧酸途径发生改变,致使淀粉积累减少。本研究转录组分析表明,瘤菌根菌和铁皮石斛根系共生后,根系的糖分解代谢途径中的磷酸戊糖途径的转醛醇酶基因的表达显著上调,这为合成代谢提供了多种原料,即转醛醇酶基因上调表达,加强了细胞碳代谢以及糖代谢的磷酸戊糖途径,产生供生物合成所需的还原力NADPH、ATP和核酸合成所需的戊糖,以及磷酸戊糖的中间物4-磷酸赤藓糖,也为合成更多的芳香族氨基酸及其衍生物提供了前体。Hasunuma等[18]认为TAL对环境因素的响应表明其可能在植物体其他代谢途径中起作用,并推测可能与初生和次生代谢中的碳通量调节有关。
氨酰-tRNA合成酶(aaRS)是生物体内蛋白质合成途径中的一类关键酶,能够精确地识别tRNA使其氨酰化,在蛋白合成过程中,不同的氨基酸需要特定的aaRS转运[19–20]。Glu被谷氨酰-tRNA合成酶催化产生的L-谷氨酰-tRNA普遍被认为是叶绿素合成的起点[21]。aaRS在蛋白质的生物合成中起重要作用,为蛋白质合成提供原料,从而将遗传信息翻译成蛋白质行使细胞的生物功能,它们一旦被抑制,整个细胞生长都将被抑制[22]。本研究表明,磷酸丝氨酰tRNA合成酶基因的表达上调,提高了氨酰tRNA合成酶的活性,生成更多具有生物功能的蛋白质,促进细胞生长。
D-甘露糖是葡萄糖的C-2差向异构体,天然存在于许多植物中,D-甘露糖在医学上具有重要的应用[23–25]。多糖水解物主要含甘露糖、葡萄糖及微量的阿拉伯糖和木糖,其中水溶性多糖的单糖组成以D-甘露糖和D-葡萄糖为主,D-甘露糖以游离状态存在于果皮中,如柑橘(Citrus reticulata)、桃(Amygdalus persica)和苹果(Malus pumila)等[26]。铁皮石斛多糖是铁皮石斛的主要活性成分,含量高达29%以上[27], 其中D-甘露糖、葡萄糖、半乳糖以140:35:1的较恒定比例关系存在于铁皮石斛多糖中[28]。β-1, 4-甘露聚糖内切酶是一种多糖降解酶,能够水解β-1, 4-D-甘露糖苷键连接的甘露聚糖生成甘露糖[29]。本研究表明,在瘤菌根菌共生后半乳糖代谢、果糖和甘露糖代谢通路中的β-1, 4-甘露聚糖内切酶基因表达量显著增加,因此增强了对甘露聚糖的水解而生成更多的甘露寡糖,甘露寡糖在β-1, 4-甘露糖苷酶的作用下生成甘露糖,因而D-甘露糖含量高。
综上,瘤菌根菌与铁皮石斛根系共生后新芽能更快速生长,增加叶片数和茎干长,转录组和代谢组联合分析表明接菌后转醛醇酶基因、氨酰tRNA合成酶基因、ATP结合框转运蛋白基因、内切-1, 4-β-甘露聚糖酶和几丁质酶基因均显著上调表达,其代谢产物氨基酸、糖类、有机酸盐、类黄酮、生长素以及其他生物活性物质含量也显著增加。因此,这些关键差异基因的上调表达和代谢物的增加可能是瘤菌根菌促进铁皮石斛生长和提升品质的重要原因,这为进一步对这些关键基因进行功能研究奠定了基础。
| [1] |
ZHANG J. Research on diversity of endosymbiotic fungi in roots of Cymbidium [D]. Beijing: Chinese Academy of Forestry, 2012. 张辑. 中国兰属植物内生菌多样性研究[D]. 北京: 中国林业科学研究院, 2012. |
| [2] |
XU L, TIAN J N, WANG T, et al. Symbiosis established between orchid and Tulasnella spp. fungi[J]. J Nucl Agric Sci, 2017, 31(5): 876-883. 许璐, 田佳妮, 王涛, 等. 胶膜菌属真菌与兰科植物的共生体系建立[J]. 核农学报, 2017, 31(5): 876-883. DOI:10.11869/j.issn.100-8551.2017.05.0876 |
| [3] |
ZHU X M, HU H, LI S Y, et al. Interaction between endophytic fungi and seedlings of two species of Paphiopedilum during symbiotic culture[J]. Plant Diver Resour, 2012, 34(2): 171-178. 朱鑫敏, 胡虹, 李树云, 等. 内生真菌与两种兜兰共培养过程中的相互作用[J]. 植物分类与资源学报, 2012, 34(2): 171-178. DOI:10.3724/SP.J.1143.2012.11144 |
| [4] |
WANG W Y, ZOU H, DAI Y M, et al. Effect of Epulorhiza sp. on root morphology of Dendrobium officinale and their symbiotic relationship[J]. J Trop Subtrop Bot, 2020, 28(2): 124-130. 王伟英, 邹晖, 戴艺民, 等. 瘤菌根菌对铁皮石斛根系形态的影响及其共生关系的研究[J]. 热带亚热带植物学报, 2020, 28(2): 124-130. DOI:10.11926/jtsb.4093 |
| [5] |
JIN H, XU Z X, CHEN J H, et al. Interaction between tissue-cultured seedlings of Dendrobium officinale and mycorrhizal fungus (Epulorhiza sp.) during symbiotic culture[J]. Chin J Plant Ecol, 2009, 33(3): 433-441. 金辉, 许忠祥, 陈金花, 等. 铁皮石斛组培苗与菌根真菌共培养过程中的相互作用[J]. 植物生态学报, 2009, 33(3): 433-441. DOI:10.3773/j.issn.1005-264x.2009.03.002 |
| [6] |
LIN J B, WANG W Y, ZOU H, et al. Analysis of related genes in phytosterol biosynthesis in Dendrobium officinale based on transcriptome sequencing technology[J]. J Trop Subtrop Bot, 2019, 27(6): 693-701. 林江波, 王伟英, 邹晖, 等. 基于转录组测序的铁皮石斛植物甾醇生物合成相关基因分析[J]. 热带亚热带植物学报, 2019, 27(6): 693-701. DOI:10.11926/jtsb.4025 |
| [7] |
ZHAN Z G. Research progress on genomics, transcriptomics and functional genes of Dendrobium officinale[J]. Chin Trad Herb Drugs, 2019, 50(16): 3979-3989. 詹忠根. 铁皮石斛基因组学、转录组学与功能基因研究进展[J]. 中草药, 2019, 50(16): 3979-3989. DOI:10.7501/j.issn.0253-2670.2019.16.034 |
| [8] |
QIAO Y C, ZHOU S J, SONG M F, et al. Research progress on molecular genetics and multi-omics of Dendrobium officinale[J]. Biotechnol Bull, 2019, 35(3): 151-163. 乔宇琛, 周思静, 宋梅芳, 等. 铁皮石斛分子遗传学和多组学研究进展[J]. 生物技术通报, 2019, 35(3): 151-163. DOI:10.13560/j.cnki.biotech.bull.1985.2018-0759 |
| [9] |
WU Z G, JIANG W, CHEN S L, et al. Insights from the cold transcriptome and metabolome of Dendrobium officinale: Global reprogramming of metabolic and gene regulation networks during cold acclimation[J]. Front Plant Sci, 2016, 7: 1653. DOI:10.3389/fpls.2016.01653 |
| [10] |
WANG W Y, QIU S L, ZOU H, et al. Identification of an endophytic fungus and its morphological effect on Dendrobium officinale[J]. Fujian J Agric Sci, 2019, 34(7): 837-841. 王伟英, 邱珊莲, 邹晖, 等. 一株铁皮石斛内生真菌的鉴定及对株型的影响[J]. 福建农业学报, 2019, 34(7): 837-841. DOI:10.19303/j.issn.1008-0384.2019.07.013 |
| [11] |
WANG W Y, ZOU H, DAI Y M, et al. Growth and nutrient content of Dendrobium officinale as affected by Epulorhiza symbiosis[J]. Fujian J Agric Sci, 2021, 36(2): 188-194. 王伟英, 邹晖, 戴艺民, 等. 瘤菌根菌对铁皮石斛生长和营养成分的影响[J]. 福建农业学报, 2021, 36(2): 188-194. DOI:10.19303/j.issn.1008-0384.2021.02.008 |
| [12] |
CHRISTIAN N, SULLIVAN C, VISSER N D, et al. Plant host and geographic location drive endophyte community composition in the face of perturbation[J]. Microb Ecol, 2016, 72(3): 621-632. DOI:10.1007/s00248-016-0804-y |
| [13] |
CHACÓN M R, RODRÍGUEZ-GALÁN O, BENÍTEZ T, et al. Microscopic and transcriptome analyses of early colonization of tomato roots by Trichoderma harzianum[J]. Int Microbiol, 2007, 10(1): 19-27. |
| [14] |
ZHUANG Q, ZHAO X J, SONG F Q. Amorpha fruticosa arbuscular mycorrhizal (AM) root exudates induced nodulation factors of rhizobia and their interactions[J]. J NE For Univ, 2018, 33(3): 164-168. 庄倩, 赵晓娟, 宋福强. 紫穗槐丛枝菌根(AM)根系分泌物诱导根瘤菌结瘤因子及作用研究[J]. 西北林学院学报, 2018, 33(3): 164-168. DOI:10.3969/j.issn.1001-7461.2018.03.25 |
| [15] |
DESHMUKH S, HÜCKELHOVEN R, SCHÄFER P, et al. The root endophytic fungus Piriformospora indica requires host cell death for proliferation during mutualistic symbiosis with barley[J]. Proc Natl Acad Sci USA, 2006, 103(49): 18450-18457. DOI:10.1073/pnas.0605697103 |
| [16] |
STEINKELLNER S, LENDZEMO V, LANGER I, et al. Flavonoids and strigolactones in root exudates as signals in symbiotic and pathogenic plant-fungus interactions[J]. Molecules, 2007, 12(7): 1290-1306. DOI:10.3390/12071290 |
| [17] |
LI N. The symbiosis between endophytic fungi from wild rice and Arabidopsis thaliana [D]. Hangzhou: Zhejiang University, 2012. 李娜. 野生稻内生真菌与拟南芥的共生关系研究[D]. 杭州: 浙江大学, 2012. |
| [18] |
HASUNUMA T, SANDA T, YAMADA R, et al. Metabolic pathway engineering based on metabolomics confers acetic and formic acid tolerance to a recombinant xylose-fermenting strain of Saccharomyces cerevisiae[J]. Microb Cell Fact, 2011, 10(1): 2. DOI:10.1186/1475-2859-10-2 |
| [19] |
YANG Y H, TANG Y F. Research progress of aminoacyl-tRNA synthetase inhibitors[J]. Chin J Med Chem, 2021, 31(1): 23-38. 杨玉宏, 唐叶峰. 氨酰-tRNA合成酶抑制剂的研究进展[J]. 中国药物化学杂志, 2021, 31(1): 23-38. DOI:10.14142/j.cnki.cn21-1313/r.2021.01.004 |
| [20] |
LIU T, ZONG G N, ZHU R, et al. Structure and function of aminoacyl-tRNA synthetase and application in pharmaceutical research[J]. CS Pharm, 2020, 18(8): 1273-1283. 刘涛, 宗广楠, 朱瑞, 等. 氨酰-tRNA合成酶的结构、功能及其在药物研发中的应用[J]. 中南药学, 2020, 18(8): 1273-1283. |
| [21] |
LI J J, YU X D, CAI Z P, et al. An overview of chlorophyll biosynthesis in higher plants[J]. Mol Plant Breed, 2019, 17(18): 6013-6019. 李佳佳, 于旭东, 蔡泽坪, 等. 高等植物叶绿素生物合成研究进展[J]. 分子植物育种, 2019, 17(18): 6013-6019. DOI:10.13271/j.mpb.017.006013 |
| [22] |
ZENG Q Y, ZHOU X L, WANG E D. The development of multiple synthetase complex (MSC)[J]. Chin Bull Life Sci, 2021, 33(4): 401-406. 曾奇玉, 周小龙, 王恩多. 多氨基酰-tRNA合成酶复合物的发生发展[J]. 生命科学, 2021, 33(4): 401-406. DOI:10.13376/j.cbls/2021044 |
| [23] |
ZHANG D F, CHIA C, JIAO X, et al. D-mannose induces regulatory T cells and suppresses immunopathology[J]. Nat Med, 2017, 23(9): 1036-1045. DOI:10.1038/nm.4375 |
| [24] |
GONZALEZ P S, O'PREY J, CARDACI S, et al. Mannose impairs tumour growth and enhances chemotherapy[J]. Nature, 2018, 563(7733): 719-723. DOI:10.1038/s41586-018-0729-3 |
| [25] |
KRANJČEC B, PAPEŠ D, ALTARAC S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: A randomized clinical trial[J]. World J Urol, 2014, 32(1): 79-84. DOI:10.1007/s00345-013-1091-6 |
| [26] |
LI D D, SONG Y, WU M Y, et al. Review on the hydrolysis of plant polysaccharides and the structure of hydrolysate[J]. Food Ferm Ind, 2013, 39(7): 165-170. 李丹丹, 宋烨, 吴茂玉, 等. 植物多糖的水解及水解物结构的研究进展[J]. 食品与发酵工业, 2013, 39(7): 165-170. DOI:10.13995/j.cnki.11-1802/ts.2013.07.019 |
| [27] |
YANG B X, SHEN C X, WANG Z, et al. Determination of mannose in Dendrobium officinale Kimuraet et Migo beverage by HPLC[J]. Food Sci, 2011, 32(8): 275-277. 杨兵勋, 沈春香, 王增, 等. HPLC法测定铁皮石斛饮料中D-甘露糖的含量[J]. 食品科学, 2011, 32(8): 275-277. |
| [28] |
ZHANG N N, XU L F, XU D P, et al. Main differences of mannose content in fresh epiphytic Dendrobium officinal attached to different materials by HPLC method[J]. Asia-Pacific Trad Med, 2017, 13(12): 37-39. 张宁南, 徐兰芳, 徐大平, 等. HPLC法测定不同附生铁皮石斛鲜品中甘露糖含量[J]. 亚太传统医药, 2017, 13(12): 37-39. |
| [29] |
WANG A X, ZHANG B X, LI J F. Effect of endo-β-1, 4-mannanase in tomato development events[J]. Acta Hort Sin, 2006, 33(5): 1157-1161. 王傲雪, 张丙秀, 李景富. β-1, 4-甘露聚糖内切酶在番茄发育中的作用[J]. 园艺学报, 2006, 33(5): 1157-1161. DOI:10.3321/j.issn:0513-353X.2006.05.055 |
 2023, Vol. 31
2023, Vol. 31


