2. 贵州省天然产物研究中心, 贵阳 550014;
3. 贵州医科大学省部共建药用植物功效与利用国家重点实验室, 贵阳 550014
2. Natural Products Research Center of Guizhou Province, Guiyang 550014, China;
3. State Key Laboratory of Functions and Applications of Medicinal Plants/School of Pharmaceutial Sciences, Guizhou Medcial University, Guiyang 550025, China
贵州鼠尾草(Salvia cavaleriei)是唇形科(Lamiaceae)鼠尾草属一年生草本植物[1],主要分布在四川、贵州以及云南等地,多生长于多岩石的山坡、林下和水沟边,海拔530~1 300 m的地区[2]。贵州鼠尾草在贵州全省广泛分布,是一味典型的特色药用植物,其味苦、辛,性寒,具有清热解毒、凉血止血、活血消肿、利湿之功效,民间常以其全草入药,用于治疗疮毒、吐血、咳血、血痢、湿热泄痢、疮痈肿痛及跌打损伤等[3]。相比于药理活性的研究,贵州鼠尾草化学成分的研究报道相对较少,虽有学者研究了其他地方生长的贵州鼠尾草的化学成分,从中报道了三萜、二萜、倍半萜及其苷类等[4],但鲜有学者对贵州这一道地产区生长的贵州鼠尾草的化学成分进行研究,目前为止相关报道仍然较少, 主要从贵州兴义生长的贵州鼠尾草中报道了少量的三萜、甾体和长链烷烃类化合物[5]。为了进一步深入阐明不同地区生长的贵州鼠尾草植物化学成分的差异性,本研究选取生长于贵州遵义的贵州鼠尾草进行系统研究,从其95%的乙醇提取物中获得了16个单体化合物,包括倍半萜类化合物4个、酚酸类化合物6个、长链烷烃类化合物3个以及其他类型结构化合物3个。
1 材料和方法 1.1 材料贵州鼠尾草植物于2020年8月采集于贵州省遵义市绥阳县宽阔镇。标本经贵阳市药用植物园侯小琪副研究员鉴定为唇形科鼠尾草属植物贵州鼠尾草(Salvia cavaleriei),标本保存在贵州省中国科学院天然产物化学重点实验室(样品号:20200802)。
柱色谱正相色谱硅胶为青岛海洋化工有限公司产品(60~80、200~300、300~400目);薄层色谱正相硅胶板为青岛海洋化工有限公司产品;凝胶Sephadex LH-20为瑞典Amersham Biosciences公司生产。
1.2 仪器和试剂美国安捷伦公司Agilent 1100高效液相色谱仪; 江苏汉邦科技有限公司NP7005C半制备液相色谱仪; 昆山市超声仪器有限公司KQ5200DE型超声清洗器;德国Heidolph公司Hei-VAP DigitalG3旋转蒸发仪;美国瓦里安公司INOVA-400MHz、WIPM 500MHz、INOVA-600MHz核磁共振仪;瑞士梅特勒-托利多公司ME204E/02电子分析天平;美国惠普公司HP-5973质谱仪;上海力辰邦西仪器科技有限公司ZF-1三用紫外分析仪;郑州长城科工贸有限公司DLSB-5/20低温冷却液循环泵。
实验中所用试剂(无水乙醇、三氯甲烷、石油醚、甲醇、乙酸乙酯等)为重蒸处理后的工业试剂;氘带甲醇为萨恩化学技术(上海)有限公司生产;半制备-高效液相色谱所用试剂(甲醇、乙腈)为萨恩化学技术(上海)有限公司生产,纯度均为色谱纯;超纯水为杭州娃哈哈集团有限公司生产的饮用纯净水;显色剂:5%硫酸乙醇溶液,5%磷钼酸乙醇溶液。
1.3 提取和分离贵州鼠尾草干燥全草样品(20 kg),粉碎成粗粉后用95%的乙醇冷浸提取2次,每次2 h,合并提取液,减压浓缩后得浸膏(1.3 kg)。浸膏以甲醇溶剂溶解分散,加入60~80目硅胶拌样,挥发干燥后, 经硅胶柱色谱进行分段纯化,以二氯甲烷-甲醇(1:0~ 0:1)梯度洗脱,经TLC薄层色谱检测合并主点相同的组分后共得到7组分(Fr. A~Fr. G),进一步对每个组分进行系统分离纯化。
Fr.A (123.1 g)经MCI柱层析脱色素处理,以50%~100%甲醇梯度洗脱,得到6个组分(Fr.A1~ Fr.A6)。其中,Fr.A3有不溶物析出,洗涤不溶物后得纯品为化合物14 (2.0 g)。Fr.A2先后经正相硅胶柱层析分离纯化(石油醚: 丙酮=100:1~1:1)、凝胶柱层析纯化(三氯甲烷: 甲醇=1:1)后,进一步经半制备HPLC纯化(甲醇: 水=70:30)后得到化合物8 (保留时间tR=46 min, 65.5 mg)。Fr.A6经正相硅胶柱色谱分离,以石油醚: 丙酮=80:1洗脱后,得到Fr.A6-1~ Fr.A6-12。Fr.A6-3有白色粉末析出,为化合物15 (186.7 mg); Fr.A6-2经半制备HPLC纯化(甲醇: 水= 90:10)后分别得到化合物1 (tR=12 min, 20.1 mg)、2 (tR=15 min, 23.2 mg)、3 (tR=25 min, 7.9 mg)和4 (tR= 32 min, 33.7 mg);Fr.A6-12经正相硅胶柱色谱梯度洗脱(石油醚: 丙酮=80:1~1:1)后,得到Fr.A6-12-1~ Fr.A6-12-9。Fr.A6-12-9经凝胶柱色谱纯化(三氯甲烷: 甲醇=1:1)后得到3部分(A6-12-9-1~Fr.A6-12-9-3), Fr.A6-12-9-2进一步经正相硅胶柱层析(石油醚: 丙酮=60:1~1:1)纯化后,再经半制备HPLC分离纯化(乙腈: 水=90:10),得到化合物10 (tR=39 min, 51.3 mg); Fr.A6-12-9-3经聚酰胺柱色谱纯化,以50%~100%甲醇梯度洗脱后,有白色粉末析出得到化合物9 (12.1 mg)。
Fr.B (74.1 g)经MCI柱色谱分离,以40%~100%甲醇梯度洗脱,利用TLC检测合并主点相同的部分, 得到5个组分(Fr.B1~Fr.B5)。Fr.B1经正相硅胶柱层析(石油醚: 丙酮=50:1~1:1)洗脱,再经半制备HPLC纯化(甲醇: 水=48:52)后,分别得到化合物6 (tR=28 min, 21.3 mg)和7 (tR=32 min, 6.1 mg)。
Fr.C (103.5 g)经反相硅胶柱层析分离,以40%~ 100%甲醇梯度洗脱,利用TLC检测合并主点相同的部分,得到8个组分(Fr.C1~Fr.C8)。Fr.C1经正相硅胶柱层析,以三氯甲烷-甲醇(50:1~1:1)梯度洗脱,再经HPLC纯化(甲醇: 水=90:10)后得化合物11 (tR= 48 min, 3.9 mg)。此外,Fr.C1-5进一步经LH-20柱层析后得到化合物12 (20 mg)。Fr.C2经正相硅胶柱层析,以三氯甲烷-甲醇(20:1~1:1)梯度洗脱,再经HPLC纯化(甲醇: 水=39:61)后得化合物5 (tR=15 min, 11 mg)。Fr.C3经正相硅胶柱层析纯化(三氯甲烷: 甲醇=50:1~1:1)后,再经凝胶LH-20洗脱(三氯甲烷: 甲醇=1:1),最后经半制备HPLC纯化(甲醇: 水=65:35)后得到化合物13 (tR=18 min, 2.7 mg)。Fr.C6经硅胶柱层析洗脱(三氯甲烷: 甲醇=50:1~1:1)后,再经MCI柱色谱分离(60%~100%甲醇梯度洗脱)以及凝胶柱色谱纯化后,得到化合物16 (8.1 mg)。
1.4 结构鉴定化合物1 黄色油状液体; [α]D20 +9.5° (c 0.21 CHCl3), ESI-MS m/z: 205.1 [M + H]+, 分子式C15H24; 1H NMR (600 MHz, CDCl3): δ 6.14 (1H, dd, J = 10.0, 2.4 Hz, H-2), 5.68 (1H, d, J = 10.0 Hz, H-1), 5.10 (1H, t, J = 7.1 Hz, H-10), 4.74 (2H, d, J = 10.8 Hz, H-15), 2.44 (1H, dt, J = 15.0, 4.2 Hz, H-4a), 2.28 (1H, m, H-4b), 2.21 (1H, m, H-6), 2.03 (1H, m, H-9a), 1.93 (1H, m, H-9b), 1.71 (1H, m, H-5), 1.68 (3H, s, H-13), 1.61 (3H, s, H-12), 1.51~1.57 (1H, m, H-7), 1.39 (1H, m, H-5), 1.37 (1H, m, H-8a), 1.20 (1H, m, H-8b), 0.87 (3H, d, J = 7.2 Hz, H-14); 13C NMR (150 MHz, CDCl3): δ 135.4 (C-1), 129.6 (C-2), 143.9 (C-3), 30.5 (C-4), 34.4 (C-5), 40.7 (C-6), 36.7 (C-7), 24.6 (C-8), 26.2 (C-9), 124.9 (C-10), 131.4 (C-11), 17.8 (C-12), 25.9 (C-13), 16.0 (C-14), 110.0 (C-15)。上述数据与文献[6]报道一致,故鉴定为β-倍半水芹烯。
化合物2 黄色油状液体;ESI-MS m/z: 207.3 [M + H]+,结合该化合物氢谱和碳谱确定其分子式为C14H22O (表 1),表明有4个不饱和度。核磁共振氢谱显示有3个明显的甲基信号[δH 1.69 (3H, s), 1.61 (3H, s)和0.89 (3H, d, J = 7.2 Hz)]和3个双键氢信号[δH 6.84 (1H, d, J = 10.2 Hz), 6.01 (1H, dd, J = 10.2, 2.4 Hz)和5.09 (1H, t, J = 7.2 Hz)],其中包括1个典型的异戊烯基基团。此外,核磁共振碳谱结合DEPT谱显示14个碳信号包括了3个甲基、4个亚甲基、5个次甲基以及2个季碳,其中有2个不饱和双键和1个不饱和羰基信号(δC 200.4)。进一步根据该化合物的不饱和度,推测该化合物另外还具有1个环系骨架结构。将碳谱信息进行微谱数据库检索表明,与已知化合物6-(7, 11-二甲基-10-乙烯亚基)-环己烯酮一致[7]。该已知化合物为Biyouyanagin A的全合成中间体,在合成过程中分别产生了6R、7R和6R、7S两种构型,但这两种构型其手性中心化学位移值差异性较明显,而化合物2的波谱数据与6R、7R构型的数据一致,进一步根据其旋光值[α]D20 +27.4° (c 0.07 CHCl3)一致。故鉴定为6R-(7R, 11-二甲基-10-乙烯亚基)-环己烯酮。
| 表 1 化合物2的核磁共振氢谱和碳谱数据(CDCl3) Table 1 1H and 13C NMR data of compound 2 in CDCl3 |
化合物3 黄色油状液体;[α]D20 -132.1° (c 0.05 MeOH), ESI-MS m/z: 205.4 [M + H]+, 分子式为C15H24; 1H NMR (600 MHz, CDCl3): δ 5.41 (1H, m, H-2), 5.13 (1H, m, H-10), 4.75 (2H, d, J = 10.2 Hz, H-14), 2.15~1.78 (7H, m, H-4, 6, 8, 9), 1.69 (3H, s, H-13), 1.65 (3H, s, H-15), 1.61 (3H, s, H-12), 1.65~ 1.43 (2H, m, H-5); 13C NMR (150 MHz, CDCl3): δ 30.9 (C-1), 121.0 (C-2), 133.9 (C-3), 31.6 (C-4), 28.5 (C-5), 39.9 (C-6), 154.4 (C-7), 35.1 (C-8), 27.0 (C-9), 124.5 (C-10), 131.6 (C-11), 25.8 (C-12), 17.9 (C-13), 107.2 (C-14), 23.6 (C-15)。上述数据与文献[8]报道一致,故鉴定为β-没药烯。
化合物4 淡黄色油状液体; [α]D20 +61.7° (c 0.31 MeOH), ESI-MS m/z: 203.5 [M + H]+, 分子式C15H22; 1H NMR (600 MHz, CDCl3): δ 7.08 (4H, m, H-1, 2, 4, 5), 5.09 (1H, t, J = 7.2 Hz, H-10), 2.65 (1H, m, H-7), 2.31 (3H, s, H-15), 1.87 (2H, m, H-9), 1.67 (3H, s, H-13), 1.59 (2H, m, H-8), 1.52 (3H, s, H-12), 1.21 (3H, d, J = 7.0 Hz, H-14); 13C NMR (150 MHz, CDCl3): δ 127.0 (C-1, 5), 129.1 (C-2, 4), 135.2 (C-3), 144.8 (C-6), 39.1 (C-7), 38.6 (C-8), 26.3 (C-9), 124.7 (C-10), 131.4 (C-11), 17.8 (C-12), 25.8 (C-13), 22.6 (C-14), 21.1 (C-15)。上述数据与文献[9]报道一致, 故鉴定为α-姜黄烯。
化合物5 白色粉末; ESI-MS m/z: 205.2 [M + Na]+, 分子式C9H10O4; 1H NMR (600 MHz, CD3OD): δ 6.68 (1H, d, J = 7.8 Hz, H-5), 6.68 (1H, d, J = 1.8 Hz, H-2), 6.54 (1H, dd, J = 8.0, 2.4 Hz, H-6), 3.64 (3H, s, H-9), 3.44 (2H, s, H-7); 13C NMR (150 MHz, CD3OD): δ 126.9 (C-1), 117.3 (C-2), 146.3 (C-3), 145.5 (C-4), 116.3 (C-5), 121.6 (C-6), 41.2 (C-7), 174.6 (C-8), 52.4(C-9)。上述数据与文献[10]报道一致,故鉴定为3, 4-二羟基苯乙酸甲酯。
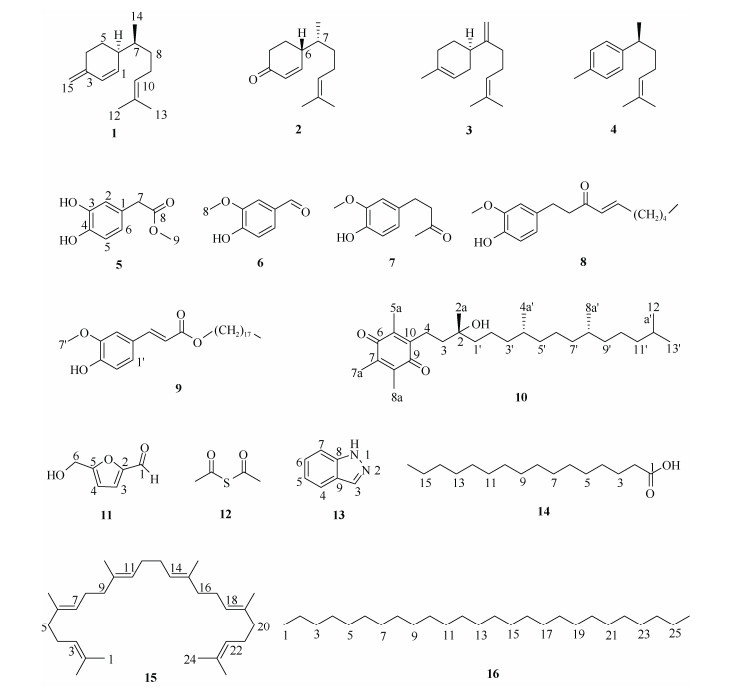
|
图 1 化合物1~16的结构 Fig. 1 Structures of compounds 1-16 |
化合物6 黄色油状液体; ESI-MS m/z: 153.2 [M + H]+, 分子式为C8H8O3; 1H NMR (600 MHz, CDCl3): δ 9.65 (1H, s, H-7), 9.60 (1H, s, 4-OH), 6.82 (1H, d, J = 8.0 Hz, H-5), 6.71 (1H, d, J = 1.8 Hz, H-2), 6.68 (1H, dd, J = 1.2, 8.0 Hz, H-6), 3.78 (3H, s, H-8); 13C NMR (150 MHz, CDCl3): δ 128.30 (C-1), 110.20 (C-2), 148.1 (C-3), 153.5 (C-4), 115.2 (C-5), 126.1 (C-6), 190.28 (C-7), 55.41 (C-8)。上述数据与文献[11]报道一致,故鉴定为香草醛。
化合物7 黄色油状液体; ESI-MS m/z: 195.1 [M + H]+, 分子式为C11H14O3; 1H NMR (600 MHz, CDCl3): δ 6.85 (1H, d, J = 8.0 Hz, H-5), 6.72 (1H, d, J = 1.8 Hz, H-2), 6.69 (1H, dd, J = 8.0, 1.8 Hz, H-6), 5.32 (1H, br s, 4-OH), 3.89 (3H, s, H-11), 2.85 (2H, t, J = 7.8 Hz, H-8), 2.75 (2H, t, J = 7.8 Hz, H-7), 2.16 (3H, s, H-10); 13C NMR (150 MHz, CDCl3): δ 133.1 (C-1), 111.2 (C-2), 146.5 (C-3), 144.0 (C-4), 114.5 (C-5), 120.9 (C-6), 29.6 (C-7), 45.7 (C-8), 208.4 (C-9), 30.3 (C-10), 56.0 (C-11)。上述数据与文献[12]报道一致,故鉴定为姜油酮。
化合物8 黄色油状液体; ESI-MS m/z: 277.0 [M + H]+, 分子式C17H24O3; 1H NMR (600 MHz, CDCl3): δ 6.82 (1H, m, H-5), 6.82 (1H, d, J = 8.0 Hz, H-5′), 6.71 (1H, d, J = 1.8 Hz, H-2′), 6.68 (1H, dd, J = 1.2, 8.0 Hz, H-6′), 6.09 (1H, d, J = 15.6 Hz, H-4), 3.86 (3H, s, H-7′), 2.85 (4H, m, H-6, 7), 2.19 (2H, m, H-2), 1.44 (2H, m, H-1), 1.29 (4H, m, H-8, 9), 0.89 (3H, t, J = 7.2 Hz, H-10); 13C NMR (150 MHz, CDCl3): δ 133.2 (C-1), 111.2 (C-2), 146.5 (C-3), 143.9 (C-4), 114.4 (C-5), 120.8 (C-6), 31.1 (C-7), 42.0 (C-8), 200.0 (C-9), 130.3 (C-10), 148.0 (C-11), 32.5 (C-12), 27.8 (C-13), 29.9 (C-14), 22.4 (C-15), 14.0 (C-16), 55.9 (C-17)。上述数据与文献[13]报道一致,故鉴定为6-姜烯酚。
化合物9 白色粉末; ESI MS m/z: 445.6 [M-H]–, 分子式C28H46O4; 1H NMR (600 MHz, CDCl3): δ 7.61 (1H, d, J = 15.6 Hz, H-3), 7.07 (1H, dd, J = 8.4, 1.8 Hz, H-6′), 7.03 (1H, d, J = 1.5 Hz, H-2′), 6.92 (1H, d, J = 8.4 Hz, H-5′), 6.29 (1H, d, J = 15.6 Hz, H-2), 5.84 (1H, s, 4′-OH), 4.19 (2H, t, J = 6.7 Hz, H-1′′), 3.93 (3H, s, H-7′), 1.69 (2H, m, H-2′′), 1.39 (2H, m, H-3′′), 1.26 (28H, m, H-4′′~H-17′′), 0.88 (3H, t, J = 7.2 Hz, H-18′′); 13C NMR (150 MHz, CDCl3): δ 167.3 (C-1), 115.9 (C-2), 144.8 (C-3), 127.2 (C-1′), 109.4 (C-2′), 148.0 (C-3′), 146.9 (C-4′), 114.8 (C-5′), 123.2 (C-6′), 64.8 (C-1″), 28.9 (C-2′′), 26.2 (C-3′′), 29.8, 29.8, 29.7, 29.5, 29.5 (C-4′′−C-15′′), 32.1 (C-16″), 22.8 (C-17′′), 14.3 (C-18′′), 56.1 (3′-OMe)。上述数据与文献[14]报道一致,故鉴定为阿魏酸十八烷酯。
化合物10 黄色油状液体; ESI-MS m/z: 447.2 [M + H]+, 分子式为C29H50O3; 1H NMR (600 MHz, CDCl3): δ 2.52 (2H, m, H-4), 2.01 (3H, s, H-5a), 1.98 (6H, s, H-7a, 8a), 1.21 (3H, s, H-2a), 1.52~1.00 (23H, m, H-3, 1′~12′), 0.84 (9H, d, J = 6.6 Hz, H-4′a, 8′a, 12′a), 0.82 (3H, d, J = 6.6 Hz, H-13′); 13C NMR (150 MHz, CDCl3): δ 72.7 (C-2), 40.3 (C-3), 21.4 (C-4), 140.6 (C-5), 187.8 (C-6), 140.3 (C-7), 140.5 (C-8), 187.3 (C-9), 144.6(C-10), 42.4 (C-1′), 21.5 (C-2′), 37.7 (C-3′), 32.9 (C-4′), 37.5 (C-5′, 7′), 24.6 (C-6′), 32.9 (C-8′), 37.4 (C-9′), 24.9 (C-10′), 39.5 (C-11′), 28.1 (C-12′), 22.7 (C-13′), 26.7(C-2a), 12.06 (C-5a), 12.39 (C-7a), 12.47 (C-8a), 19.9 (C-4′a), 19.8 (C-8′a), 22.8 (C-12′a)。上述数据与文献[15]报道一致,故鉴定为维生素E醌。
化合物11 棕色油状液体; ESI-MS m/z: 127.1 [M + H]+, 分子式C6H6O3; 1H NMR (600 MHz, CD3OD): δ 9.54 (1H, s, H-1), 7.39 (1H, d, J = 3.6 Hz, H-3), 6.59 (1H, d, J = 3.6 Hz, H-4), 4.62 (2H, s, H-6); 13C NMR (150 MHz, CD3OD): δ 179.4 (C-1), 163.2 (C-2), 124.9 (C-3), 110.9 (C-4), 153.9(C-5), 57.6 (C-6)。上述数据与文献[22]报道一致,故鉴定为5-羟甲基-2-糠醛。
化合物12 无色片状晶体(甲醇),mp 141 ℃~ 145 ℃; ESI-MS m/z: 117.2 [M-H]–,分子式C4H6O2S; 1H NMR (600 MHz, CD3OD): δ 2.56 (6H, s, Me×2); 13C NMR (150 MHz, CD3OD): δ 179.2 (C=O×2), 29.8 (Me×2)。上述数据与文献[23]报道一致,故鉴定为硫代乙酸酐。
化合物13 白色粉末; ESI-MS m/z: 117.5 [M-H]–, 分子式为C7H6N2; 1H NMR (600 MHz, CD3OD): δ 8.06 (1H, dd, J = 7.2, 1.8 Hz, H-4), 7.90 (1H, s, H-3), 7.40 (1H, dd, J = 7.2, 1.2 Hz, H-7), 7.17~7.11 (2H, m, H-5, 6); 13C NMR (150 MHz, CD3OD): δ 133.2 (C-3), 122.3 (C-4), 122.1 (C-5), 127.6 (C-6), 112.8 (C-7), 138.2 (C-8), 123.5 (C-9)。上述数据与文献[24]报道一致,故鉴定为吲唑。
化合物14 无色油状; ESI-MS m/z: 255.3 [M-H]–, 分子式C16H32O2; 1H NMR (600 MHz, CDCl3): δ 2.35 (2H, t, J = 7.2 Hz, H-2), 1.63 (2H, m, H-15), 1.28 (22H, m, H-3~H-14), 0.88 (3H, t, J = 7.2 Hz, H-16); 13C NMR (150 MHz, CDCl3): δ 178.57 (C-1), 33.98, 32.15, 31.15, 29.92, 29.88, 29.86, 29.81, 29.66, 29.58, 29.46, 29.29, 24.92, 22.92, 14.34 (C-2~C-16)。上述数据与文献[25]报道一致,故鉴定为棕榈酸。
化合物15 无色油状液体; ESI-MS m/z: 413.4 [M + H]+, 分子式C30H50; 1H NMR (600 MHz, CDCl3): δ 5.23 (6H, m, H-3, 7, 11, 14, 18, 22), 2.05~ 2.22 (20H, m, H-4, 5, 8, 9, 12, 13, 16, 17, 20, 21), 1.78 (6H, s, H-1, 24), 1.71 (18H, s, Me×6); 13C NMR (150 MHz, CDCl3): δ 17.8 (C-1, 24), 131.1 (C-2, 23), 124.6 (C-3, 22), 27.0 (C-4, 21), 39.9 (C-5, 9, 16, 20), 134.9 (C-6, 19), 124.5 (C-7, 18), 26.8 (C-8, 17), 135.1 (C-10, 15), 124.5 (C-11, 14), 28.5 (C-12, 13), 25.8 (Me-2, 23), 16.1 (Me-6, 19), 16.1 (Me-10, 15)。上述数据与文献[26]报道一致,故鉴定为角鲨烯。
化合物16 白色粉末; ESI-MS m/z: 367.1 [M + H]+, 分子式C26H54; 1H NMR (600 MHz, CDCl3): δ 1.26 (48H, m, H-2~H-25), 0.88 (6H, t, J = 7.2 Hz, H-1, 26); 13C NMR (150 MHz, CDCl3): δ 31.94, 29.71, 29.67, 29.38, 22.70 (C-2~C-25), 14.13 (C-1, 26)。上述数据与文献[27]报道一致,故鉴定为二十六烷。
2 结果和讨论本研究从贵州鼠尾草95%乙醇提取物中分离得到了16个化合物,分别鉴定为:β-倍半水芹烯(1)、6R-(7R, 11-二甲基-10-乙烯亚基)-环己烯酮(2)、β-没药烯(3)、α-姜黄烯(4)、3, 4-二羟基苯乙酸甲酯(5)、香草醛(6)、姜油酮(7)、6-姜烯酚(8)、阿魏酸十八烷酯(9)、维生素E醌(10)、5-羟甲基-2-糠醛(11)、硫代乙酸酐(12)、吲唑(13)、棕榈酸(14)、角鲨烯(15)和二十六烷(16)。其中,化合物2为新天然产物。除化合物3、4和6外,所有化合物均为首次从贵州鼠尾草植物中分离得到,此外, 化合物2、5、9和12为首次从唇形科植物中分离得到,化合物1和15为首次从鼠尾草属植物中分离得到。16个化合物结构类型包括倍半萜类化合物4个、酚酸类化合物6个、长链烷烃类化合物3个以及其他类型结构化合物3个。本研究从贵州遵义生长的贵州鼠尾草植物中获得的化合物结构类型, 与已报道的贵州其他产地以及分布于其他省份的同种植物中所含的结构类型差异较大,进一步表明该种药用植物的次生代谢产物可能易受外界生长环境影响。本研究结果为进一步开展该植物的系统研究及其品质评价提供了一定的科学依据。
贵州鼠尾草的民间药用多以清热解毒、抗菌消炎等为主。本研究获得的16个单体化合物中,化合物6~8、12、13和15均具有相关的药用活性,初步推测这些化合物是贵州鼠尾草发挥清热解毒以及抗菌消炎药效的活性成分[22–24]。此外,据报道化合物1、6~11以及15均具有较好的抗氧化活性[24–27], 且其中部分化合物含量相对较大。但贵州鼠尾草的药理研究中关于抗氧化的报道较少,下一步的研究中可重点探索贵州鼠尾草的抗氧化活性,以进一步深入开发利用该特色药用植物。
| [1] |
Editorial Committee of Chinese Flora, Chinese Academy of Sciences. Florae Republicae Popularis Sinicae, Tomus 66[M]. Beijing: Science Press, 2004: 416. 中国科学院中国植物志编辑委员会. 中国植物志, 第66卷[M]. 北京: 科学出版社, 2004: 416. |
| [2] |
HE S Z, XU W F. Study on Resources of Chinese Herbal Medicine in Guizhou[M]. Guiyang: Guizhou Science and Technology Press, 2007: 582-590. 何顺志, 徐文芬. 贵州中草药资源研究[M]. 贵阳: 贵州科技出版社, 2007: 582-590. |
| [3] |
LI Y, ZHANG Y, ZHANG J J, et al. Guizhou nationality folk medicinal Salvia genus plant[J]. J Med Pharm Chin Minor, 2019, 25(6): 65-67. 李毅, 张义, 张敬杰, 等. 贵州民族民间药用的鼠尾草属植物[J]. 中国民族医药杂志, 2019, 25(6): 65-67. DOI:10.16041/j.cnki.cn15-1175.2019.06.035 |
| [4] |
ZHANG M K. Study on chemical constituents and bioactivities of Rhododendron micranthum, Salvia cavaleriei and Salvia deserta[D]. Wuhan: Huazhong University of Science and Technology, 2015. 张孟科. 照山白、贵州鼠尾草和新疆鼠尾草化学成分及生物活性研究[D]. 武汉: 华中科技大学, 2015. |
| [5] |
WANG H Y. Study on chemical constituents of Salvia cavaleriei Lévl and Sophora tonkinensis Gapnep. [D]. Guiyang: Guizhou University, 2009. 王和英. 贵州鼠尾草、山豆根化学成分的研究[D]. 贵阳: 贵州大学, 2009. |
| [6] |
KHRIMIAN A, ZHANG A J, WEBER D C, et al. Discovery of the aggregation pheromone of the brown marmorated stink bug (Halyomorpha halys) through the creation of stereoisomeric libraries of 1-bisabolen-3-ols [J]. J Nat Prod, 2014, 77(7): 1708-1717. DOI:10.1021/np5003753 |
| [7] |
NICOLAOU K C, WU T R, SARLAH D, et al. Total synthesis, revised structure, and biological evaluation of biyouyanagin A and analogues thereof[J]. J Am Chem Soc, 2008, 130(33): 11114-11121. DOI:10.1021/ja802805c |
| [8] |
TERIS A, GERRIT P L. Isolation and identification of the five major sesquiterpene hydrocarbons of ginger[J]. Phytochem Anal, 1991, 2(1): 26-34. DOI:10.1002/pca.2800020106 |
| [9] |
HASEGAWA T, NAKATANI K, FUJIHARA T, et al. Aroma of turmeric: Dependence on the combination of groups of several odor constituents[J]. Nat Prod Commun, 2015, 10(6): 1047-1050. DOI:10.1177/1934578X1501000663 |
| [10] |
ZHANG Z Z, XIAO B H, CHEN Q, et al. Synthesis and biological evaluation of caffeic acid 3, 4-dihydroxyphenethyl ester[J]. J Nat Prod, 2010, 73(2): 252-254. DOI:10.1021/np900519d |
| [11] |
CHALLICE J S, LOEFFLER R S T, WILLIAMS A H. Structure of calleryanin and its benzylic esters from Pyrus and Prunus[J]. Phytochemistry, 1980, 19(11): 2435-2437. DOI:10.1016/s0031-9422(00)91043-4 |
| [12] |
SANZ J F, BARBERA O, MARCOA J A. Sesquiterpene lactones from Artemisia hispanica[J]. Phytochemistry, 1989, 28(8): 2163-2167. DOI:10.1016/s0031-9422(00)97936-6 |
| [13] |
XIAO Y C. Study on chemical constituents of Zingiber officinale [D]. Yunnan: Kunming Institute of Botany, Chinese Academy of Sciences, 2003. 肖业成. 生姜植物的化学成分研究[D]. 云南: 中国科学院昆明植物研究所, 2003. |
| [14] |
SONAR V P, FOIS B, DISTINTO S, et al. Ferulic acid esters and withanolides: In search of Withania somnifer GABAA receptor modulators[J]. J Nat Prod, 2019, 82(5): 1250-1257. DOI:10.1021/acs.jnatprod.8b01023 |
| [15] |
CHO J G, LEE D Y, LEE J W, et al. Acyclic diterpenoids from the leaves of Capsicum annuum[J]. J Korean Soc Appl Biolo Chem, 2009, 52(2): 128-132. DOI:10.3839/jksabc.2009.024 |
| [16] |
ZHANG Z, WANG D, ZHAO Y, et al. Fructose-derived carbohydrates from Alisma orientalis[J]. Nat Prod Res, 2009, 23(11): 1013-1020. DOI:10.1080/14786410802391120 |
| [17] |
HU L, DING Z H, LIU J K. The chemical constituents of basidiomycetes Boletopsis grisea[J]. Acta Bot Yunnan, 2002, 24(5): 667-670. 胡琳, 丁智慧, 刘吉开. 灰黑拟牛肝菌的化学成分[J]. 云南植物研究, 2002, 24(5): 667-670. |
| [18] |
LUO P, SHU Y, ZHU L, et al. Secondary metabolites of Fusarium sambucinum B10.2 from Aconitum vilmorinianum Kom.[J]. Nat Prod Res Dev, 2020, 32(6): 1000-1005. 罗萍, 舒燕, 朱丽, 等. 黄草乌内生真菌接骨木镰孢菌B10.2次生代谢产物研究[J]. 天然产物研究与开发, 2020, 32(6): 1000-1005. DOI:10.16333/j.1001-6880.2020.6.013 |
| [19] |
REN R B, XIA B, LI W L, et al. Study on chemical constituents of Stenoloma chusanum (L.) Ching (Ⅱ)[J]. Chin Trad Herb Drug, 2009, 40(S1): 104-106. 任冰如, 夏冰, 李维林, 等. 乌韭的化学成分研究(Ⅱ)[J]. 中草药, 2009, 40(S1): 104-106. |
| [20] |
XU W Q, GONG X J, ZHOU X, et al. Chemical constituents from Kalimeris indica[J]. Chin Trad Herb Drug, 2010, 41(7): 1056-1060. 许文清, 龚小见, 周欣, 等. 马兰化学成分研究[J]. 中草药, 2010, 41(7): 1056-1060. |
| [21] |
YE F M, XIE Y G, ZHU Y, et al. Chemical constituents of branches and leaves of Illicium wardii A. C. Smith[J]. Nat Prod Res Dev, 2015, 27(4): 604-608. DOI:10.16333/j.1001-6880.2015.04.009 |
| [22] |
TANG L, CHEN Y C, JIANG Z B, et al. Phytochemical investigation of the marine alga Grateloupia livida[J]. Chem Nat Compoud, 2017, 53(4): 770-774. DOI:10.1007/s10600-017-2117-x |
| [23] |
IMM J Y, ZHANG G D, CHAN L Y, et al. [6]-Dehydroshogaol, a minor component in ginger rhizome, exhibits quinone reductase inducing and anti-inflammatory activities that rival those of curcumin[J]. Food Res Inter, 2010, 43(8): 2208-2213. DOI:10.1016/j.foodres.2010.07.028 |
| [24] |
ZHAO X Y, WANG G, WANG Y, et al. Chemical constituents from Alisma plantago-aquatica subsp. Orientale (Sam.) Sam and their antiinflammatory and antioxidant activities[J]. Nat Prod Res, 2018, 32(23): 2749-2755. DOI:10.1080/14786419.2017.1380024 |
| [25] |
ZHAO J, ZHANG J S, YANG B, et al. Free radical scavenging activity and characterization of sesquiterpenoids in four species of Curcuma using a TLC bioautography assay and GC-MS analysis[J]. Molecules, 2010, 15(11): 7547-7557. DOI:10.3390/molecules15117547 |
| [26] |
DHANALAKSHMI C, JANAKIRAMAN U, MANIVASAGAM T, et al. Vanillin attenuated behavioural impairments, neurochemical deficts, oxidative stress and apoptosis against rotenone induced rat model of Parkinson's disease[J]. Neuro Chem Res, 2016, 41(8): 1899-1910. DOI:10.1007/s11064-016-1901-5 |
| [27] |
MOLTKE A D, DURAND E, LAGUERRE M, et al. Antioxidant properties and efficacies of synthesized alkyl caffeates, ferulates, and coumarates[J]. J Agric Food Chem, 2014, 62: 12553-12562. DOI:10.1021/jf500588s |
 2023, Vol. 31
2023, Vol. 31



