2. 曲靖市富源县经济作物技术推广站, 云南 富源 655500;
3. 云南农业大学农科教学实验中心, 昆明 650201
2. Station of Cash Crop at Fuyuan County in Qujing City, Fuyuan 655500, Yunnan, China;
3. Agricultural Teaching Experiment Center, Yunnan Agricultural University, Kunming 650201, China
山药(Dioscorea opposita)具有增强免疫、抗衰老、抗癌等功效[1]。山药是以块茎和零余子等营养器官进行无性繁殖,在引种、繁殖和生产过程中易受到山药病毒病的交叉感染、潜伏侵染和蔓延扩散。山药病毒病发生普遍,山药不同品种的染病程度不同,河南温县怀山药病毒病发病率可高达50%[2];河北保定田间病毒病植株发病率约为30%[3];广西山药品种中DNA病毒Badna-virus的发病率最高,YMMV病毒感染率其次,感染2种病毒的约占16.67%[4];江西瑞昌山药的病毒病发病率最高达50%,主要为JYMV病毒浸染[5];参薯(Dioscorea alata)中YVX病毒病感染率为16.2%[6]。山药病毒病害主要有薯蓣潜隐病毒(dioscorea latent virus, DLV)[7]、中国淮山药坏死花叶病毒(Chinese yam necrotic mosaic virus, CYNMY)[8]、薯蕷绿带花叶病毒(dioscorea-banding mosaic virus, DGBMV)[9]、参署环斑病毒(dioscorea alata ring mottle virus, DARMV)、山药斑驳病毒(yam mottle virus, YMOV)[10]、淮山药温和花叶病毒(yam mild mosaic virus, YMMV)[11–12]、日本山药花叶病毒(Japaese yam mosaic virus, JYMV)[11]、马铃薯X和M病毒(potato virus X, M, PVX, PVM)[6]等。
光合作用是植物生长发育和实现经济价值的主要途径[13]。叶片是植物进行光合作用的主要场所。有研究表明,人参(Panax ginseng)感染病毒病时,株高只有健康植株的1/5,叶片总面积也只有健康植株的1/4~1/6,根质量只有健康植株的1/2[14],严重影响人参的光合作用。花叶病毒侵入淮安红椒(Capsicum annuum var. grossum)后,开花结果期出现叶片斑驳、植株矮化的病症[15]。烟草(Nicotiana tabacum)被烟草坏斑坏死病毒[16]、番茄(Lycopersicon esculentum)被番茄不孕病毒[17]侵染后植株的光合速率明显降低[18]。柑橘叶斑驳病毒(citrus leaf blotch virus, CLBV)侵染猕猴桃(Actinidia chinensis)后表现出花叶、明脉间叶片黄化症状[19]。山药病毒病害有多种,当病毒入侵山药时,会改变叶片内细胞的代谢途径,导致山药的生理机能受到影响,严重时可使山药坏死,植株萎缩矮化且地下块根畸形[20],品质变劣,甚至丧失经济价值。对于‘牛尾’山药感染斑驳病毒病后的光合作用研究还鲜有报道, 本研究主要探究山药斑驳病毒病对‘牛尾’山药光合作用特性的影响,为深入研究山药斑驳病毒病的农业生产特性提供理论依据。
1 材料和方法 1.1 材料试验地点位于云南省昆明市盘龙区阿子营镇露地种植田和云南农业大学校内试验基地大棚内。试验材料为云南省禄丰县‘牛尾’山药(Dioscorea opposite ‘Liuwei’),露地种植的山药发病较重、叶片黄化斑驳明显(叶片90%以上面积斑驳),大棚种植的山药发病较轻、叶片黄化斑驳不明显(仅叶片中间约30%面积斑驳)。经RT-PCR检测,均受YMOV病毒侵染(引物分别为5′-ATTGTGGTTCATGCAGTTGCAGG-3′和5′-ATATACAACAAGTGCAACTAACACG-3′,由云南农业大学兰平秀博士惠赠)。
1.2 叶片光合色素含量的测定2021年7月14和17日在山药旺盛生长期,分别在阿子营镇和云南农业大学采集山药叶片测定光合色素含量。选相同大小的健康叶片和病株叶片各3片,设3次重复。避开叶片叶脉精确称0.1 g新鲜叶片,将叶片放入25 mL的棕色容量瓶中,加入混合浸提液(无水乙醇: 丙酮: 水=4.5:4.5:1) 20 mL,黑暗处理24 h,定容至25 mL;用AOE翱艺A580型双光束紫外可见分光光度计测量吸光度,以浸提液为空白对照。计算叶绿素a、b和类胡萝卜素及总叶绿素含量, 叶绿素a含量(Chl a, mg/L)=12.21A663–2.81A646, 叶绿素b含量(Chl b, mg/L)=20.13A646–5.03A663,类胡萝卜素含量(Cr, mg/L)=(1000A470–3.27Ca–104Cb)/ 229, 总叶绿素含量(Chl a+b)=Chl a+Chl b, 式中, A663、A646和A470分别为色素提取液在波长663、646和470 nm下的吸光度。
1.3 叶片光合气体交换参数日变化的测定2021年7月27日和2021年8月4日(山药旺盛生长期)分别在阿子营镇和云南农业大学,选取位置相近、长势一致、向阳的健康植株和带病毒病植株叶片各3片,采用Li-6400便携式光合测定仪测定净光合速率、气孔导度、蒸腾速率和胞间CO2浓度。从8:00到18:00,每隔2 h测定1次。两地都在田间选3个种植区进行测定,作为3次重复。
1.4 数据的统计分析采用SPSS 19.0软件对数据进行统计分析和方差分析,采用邓肯检验法进行多重比较。
2 结果和分析 2.1 叶片光合色素的含量由表 1可见,阿子营镇的健康植株和重病植株叶片的光合色素含量存在显著差异,重病植株的叶绿素a、叶绿素b和类胡萝卜素含量显著低于健康植株(分别低22.22%、24.49%和11.11%),重病植株的总叶绿素含量极显著低于健康植株(降低23.44%)。大棚种植的轻病植株的叶绿素a和总叶绿素含量也显著低于健康植株(分别低50.28%和64.09%),其叶绿素b和总类胡萝卜素含量与健康植株的差异不显著。这表明山药感染斑驳病毒病后叶片光合色素含量降低。
| 表 1 健康植株和带病毒病植株光合色素含量比较 Table 1 Comparison of photosynthetic pigment content between healthy plants and virus infected plants |
由图 1可见,健康植株的净光合速率基本上都比感病植株高。在阿子营镇,健康植株叶片的净光合速率在8:00、10:00、16:00、18:00均显著高于重病植株,14:00时极显著高于重病植株(高80.01%);健康植株和重病植株叶片均在10:00和14:00显著高于12:00, 18:00时最低。在云南农业大学,健康植株与轻病植株的净光合速率也有差异,除12:00时无显著差异外,其余时间健康植株均显著高于轻病植株;健康植株和轻病植株的净光合速率在10:00和14:00显著高于12:00,14:00后逐渐降低。两地净光合速率的日变化均呈现“双峰”型,10:00的光合速率明显高于14:00。两地健康植株的净光合速率明显高于感染斑驳病毒病植株,重病和轻病植株在14:00分别极显著和显著低于健康植株。
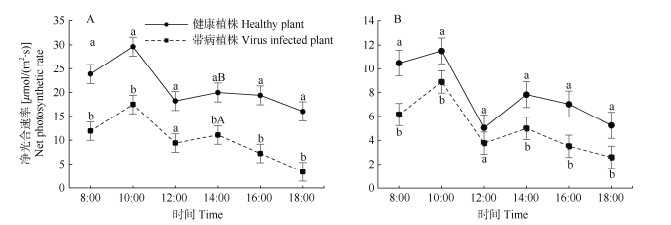
|
图 1 叶片的净光合速率日变化。A: 阿子营; B: 云南农业大学; 不同大、小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。下同 Fig. 1 Diurnal changes in net photosynthetic rate. A: Aziying; B: Yunnan Agricultural University; Different capital and small letters indicate significant differences at 0.01 and 0.05 levels, respectively. The same below |
由图 2可见,气孔导度的日变化和净光合速率不同,健康植株和感病植株气孔导度的日变化总体呈现下降的趋势。在阿子营镇,12:00、14:00和18:00时重病植株的气孔导度显著低于健康植株,16:00时的差异极显著,8:00和10:00重病植株较健康植株低,但差异不显著;健康植株在16:00时有明显的上升趋势,较14:00时升高了55.93%。在云南农业大学,轻病植株的气孔导度在10:00、12:00和14:00显著较健康植株低(分别低58.24%、87.94%、98.33%),8:00、16:00、18:00时也低于健康植株, 但差异不显著;16:00时健康植株和轻病植株的气孔导度都有明显上升。两地植株的气孔导度日变化总体呈下降的趋势,8:00时为最高,18:00时最低; 健康植株和轻病植株在16:00有上升,而重病植株在16:00无上升现象。

|
图 2 叶片的气孔导度日变化 Fig. 2 Diurnal changes in stomatal conductance |
由图 3可见,胞间CO2浓度的日变化曲线和气孔导度相似,总体呈现下降趋势。在阿子营镇重病植株的胞间CO2浓度与健康植株无显著差异。健康植株的胞间CO2浓度在12:00略有升高,重病植株则逐渐下降。胞间CO2浓度在两地都是8:00时最高, 18:00最低。两地健康植株在中午12:00升高,感病植株则都呈现下降趋势,病毒的感染影响了植物午休时胞间CO2浓度的升高。
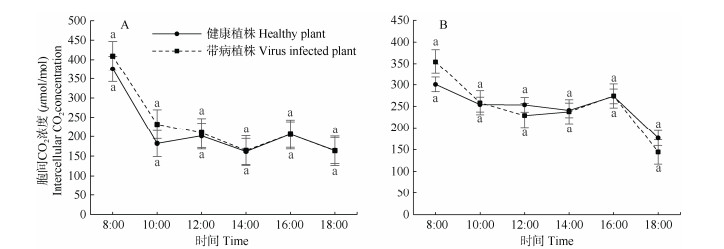
|
图 3 叶片的胞间CO2浓度日变化 Fig. 3 Diurnal changes in intercellular CO2 concentration |
由图 4可见,阿子营镇健康植株叶片的蒸腾速率在12:00、14:00、18:00时显著高于重病植株,16:00时达极显著差异。重病植株的叶片蒸腾速率在12:00上升较快,较10:00升高了75.69%,午休后呈缓慢下降趋势。云南农业大学健康植株的叶片蒸腾速率在14:00显著高于轻病植株(高74.39%),12:00时达极显著差异(高96.84%),其余时间健康植株较轻病植株高,但无显著差异。轻病植株在16:00前呈现缓慢升高趋势,在16:00达到最高。两地健康植株的叶片蒸腾速率都较感病植株高,健康植株在12:00上升到最高,在16:00也有明显升高,呈现双峰型。重病植株在12:00达峰值后便开始下降,轻病植株在16:00时达峰值后急速下降。这说明斑驳病毒侵染导致植株蒸腾速率降低。

|
图 4 叶片的蒸腾速率日变化 Fig. 4 Diurnal changes in transpiration rate |
本研究结果表明,相同生长期的山药健康植株的叶绿素含量和类胡萝卜素较感染斑驳病毒植株的高,且健康植株和带病植株间的总叶绿素含量都呈极显著差异。植物在感染病毒后,叶片的叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量都显著下降,但在病症较轻时叶绿素b和总类胡萝卜素含量下降不显著。植物在病毒入侵后叶片细胞中的叶绿素含量减少,叶片细胞坏死、解体,运输营养物质的韧皮部受到阻碍,最终影响光合产物的有机物分配[21]。在叶绿体中的叶绿素a、叶绿素b、类胡萝卜素主要负责收集光能,在叶绿体中的单位含量直接决定着植物光合作用的强弱[22]。光合作用产生的能量是植物生命活动的来源[23]。叶绿素是光合作用能量转化的机器,叶绿素的含量与光合作用的强弱成正相关趋势。本研究结果表明,山药斑驳病毒影响山药叶片光合色素含量,发病越严重对光合色素含量的影响越大,山药斑驳病毒病可能主要通过降低叶绿素b和类胡萝卜素含量来影响光合作用。
本研究在两个试验点进行光合参数的测定,结果表明健康植株叶片的净光合速率明显高于感病植株,净光合速率曲线呈现双峰型,有轻微的午休现象,细毛山药(Dioscorea opposite)也有这一现象[24]。光合作用的日变化反映了植物的光合能力的强弱,光合作用强则产量也相应较高,反之则低[25]。有些植物在中午12:00会出现‘休眠现象’,所以光合速率会出现双峰值,还有一些植物则没有‘休眠现象’,光合速率曲线则呈现单峰型。本研究中,健康植株在14:00出现第2个峰值后缓慢下降,而感病植株则快速下降,说明斑驳病毒影响了植物叶片的净光合速率。光合作用的强弱对植物的生物产量和经济价值起决定性作用[26]。当光合速率强烈时光合作用也随之增强,产生的有机物随之增多,植物体的生长发育状况良好最终会获得较好的经济效益。斑驳病毒影响了植物的净光合速率,光合作用也随之降低,影响植物的有机物合成,最终导致植株生长缓慢。
植物的光合速率受多种因素的影响[27],而气孔作为CO2进入植物体内的通道,对植物的光合作用起着至关重要的作用[28]。气孔导度在12:00前迅速下降,而净光合速率在12:00也下降,这与气孔关闭影响CO2进入有关。盾叶薯蓣(D. zingiberensis)和黄山药(D. panthaica)也表现出这一特性[29]。气孔是CO2进入细胞内的唯一途径,本研究结果表明, 感染斑驳病毒的山药植株的气孔导度总体都比健康植株低,这也是导致感病植株光合作用低的重要原因之一。
CO2是光合作用的重要原料,对光合作用起着至关重要的作用[30]。在番茄感染番茄黄花曲叶病毒(tomata yellow leaf curl virus, TYLCV)[31]、TMV病毒[32]侵染烟草后,叶片的净光合速率也明显降低, 而胞间CO2浓度则有所提高。本研究中, 健康植株的胞间CO2浓度在12:00和16:00有两次升高,而感病植株只在16:00时有1次升高。这可能是感病植株的净光合速率和气孔导度下降导致胞间CO2浓度较健康植株略高。
蒸腾作用是将植物体内的水分以水蒸汽的形式通过叶片散发到大气中的过程。在正午太阳光照射较强时蒸腾作用可降低植物叶片表面的温度,防止叶片灼伤[22]。感病植物的蒸腾速率较低,水分利用效率也较低,导致对温度的调节能力差,出现叶片灼伤,导致光合能力下降[33]。本研究结果表明, 健康的‘牛尾’山药植株的叶片蒸腾速率日变化曲线呈现双峰型,在12:00和16:00出现峰值;感病植株的蒸腾速率低于健康植株;轻病植株只有1个峰值(在16:00),16:00后急剧下降;重病植株的蒸腾速率在12:00后开始下降。这说明斑驳病毒病使山药叶片蒸腾速率降低,可能影响叶片温度的调节, 从而影响对CO2的吸收利用。
综上,感染山药斑驳病毒病的‘牛尾’山药植株叶片的叶绿素含量、净光合速率、蒸腾速率、气孔导度等均低于健康植株,这为后续研究‘牛尾’山药斑驳病毒病提供了理论依据。
| [1] |
KERDKANKAEW S, LUANGJAME J, KHUMMONGKOL P. Effects of photosynthetically active radiation and air temperature on CO2 uptake of Pterocarpus macrocarpus in the open field[J]. Agric Sci China, 2005, 4(4): 263-272. |
| [2] |
LI M J, ZHANG F, CHEN M X, et al. Study on virus diseases of Dioscorea opposita[J]. Chin Trad Herb Drugs, 2003, 34(11): 100-102. 李明军, 张峰, 陈明霞, 等. 怀山药病毒病的研究[J]. 中草药, 2003, 34(11): 100-102. DOI:10.3321/j.issn:0253-2670.2003.11.043 |
| [3] |
CHEN H Y, LIU X Y, QI H R, et al. Preliminary report on the main diseases of yam and damage characteristics[J]. China Plant Prot, 2010, 30(6): 24-26. 陈红岩, 刘晓芸, 齐红茹, 等. 保定市山药病害种类及为害特点调查初报[J]. 中国植保导刊, 2010, 30(6): 24-26. DOI:10.3969/j.issn.1672-6820.2010.06.007 |
| [4] |
ZOU C W, MENG J R, WEI B H, et al. Identification of new pathogen of Huai yam virus disease by deep sequencing[C]// Proceedings of 2012 Academic Annual Meeting of Chinese Society of Plant Pathology. Qingdao: Chinese Society of Plant Pathology, 2012: 225. 邹承武, 蒙姣荣, 韦本辉, 等. 利用深度测序技术鉴定淮山药病毒病新病原[C]// 中国植物病理学会2012年学术年会论文集. 青岛: 中国植物病理学会, 2012: 225. |
| [5] |
HUANG T. Preliminary study on pathogen of Ruichang yam anthracnose and pathogenic identification of the virus and nematode diseases[D]. Nanchang: Jiangxi Agricultural University, 2015. 黄婷. 瑞昌山药炭疽病菌初步研究及其病毒和线虫病害病原鉴定[D]. 南昌: 江西农业大学, 2015. |
| [6] |
ZOU C W. Disease survey, diagnosis, and molecular characterization of viruses infecting yam in China[D]. Nanning: Guangxi University, 2014. 邹承武. 中国淮山药病毒病调查、诊断和病原病毒分子生物学的研究[D]. 南宁: 广西大学, 2014. |
| [7] |
LIU Z, PENG Q P, XIANG Y Y, et al. Damage and control of viral diseases on common medicinal plants in China[J]. Plant Prot, 2018, 44(1): 9-19. 刘舟, 彭秋平, 向云亚, 等. 我国常见药用植物病毒病的危害与防控[J]. 植物保护, 2018, 44(1): 9-19. DOI:10.16688/j.zwbh.2017380 |
| [8] |
KWON S J, CHO I S, CHOI S K, et al. Complete sequence analysis of a Korean isolate of Chinese yam necrotic mosaic virus and generation of the virus specific primers for molecular detection[J]. Res Plant Dis, 2016, 22(3): 194-197. DOI:10.5423/RPD.2016.22.3.194 |
| [9] |
HE Z, CHEN C F, ZHANG Z X, et al. Advances in molecular evolution of viruses in the family Potyviridae[J]. Plant Prot, 2017, 43(3): 13-22. 贺振, 陈春峰, 张志想, 等. 马铃薯Y病毒科分子进化研究进展[J]. 植物保护, 2017, 43(3): 13-22. DOI:10.3969/j.issn.0529-1542.2017.03.003 |
| [10] |
LAN P X, MENG Y, SHEN P, et al. Complete genome sequence of yam chlorotic necrosis virus, a novel macluravirus infecting yam[J]. Arch Virol, 2018, 163(8): 2275-2278. DOI:10.1007/s00705-018-3851-5 |
| [11] |
ZOU C W, MENG J R, SONG J J, et al. Investigation of yam virus disease and identification of virus pathogen in Huaishan, Guangxi[C]// Proceedings of the 2011 Annual Meeting of the Chinese Society of Plant Pathology. Yichang: Chinese Society of Plant Pathology, 2011: 288. 邹承武, 蒙姣荣, 宋静静, 等. 广西淮山药病毒病调查及病毒病原鉴定[C]// 中国植物病理学会2011年学术年会论文集. 宜昌: 中国植物病理学会, 2011: 288. |
| [12] |
HE Z, HUANG T, QIN S L, et al. Pathogen identification of Ruichang yam virus disease [C]// Proceedings of 2016 Academic Annual Meeting of Chinese Society of Plant Pathology. Nanjing: Chinese Society of Plant Pathology, 2016: 280. 贺哲, 黄婷, 秦双林, 等. 瑞昌山药病毒病病原鉴定[C]// 中国植物病理学会2016年学术年会论文集. 南京: 中国植物病理学会, 2016: 280. |
| [13] |
WEN G Q, LIU Y X, NONG M L, et al. Effects of plant growth regulators (combination) on leaf photosynthesis of yam in South China[J]. SW China J Agric Sci, 2016, 29(7): 1590-1594. 温国泉, 刘永贤, 农梦玲, 等. 不同植物生长调节剂对南方淮山药叶片光合作用的影响[J]. 西南农业学报, 2016, 29(7): 1590-1594. DOI:10.16213/j.cnki.scjas.2016.07.016 |
| [14] |
TIAN C G, ZHANG Z W, WANG Z Q. Observation on the field incidence of ginseng virus disease[C]// Proceedings of 2008 China Jilin International Ginseng Conference. Changchun: Jilin Provincial People's Government, Chinese Pharmacological Society, 2008. 田成刚, 张占伟, 王稚琪. 人参病毒病田间发病规律的观察[C]// 2008中国·吉林国际人参大会论文集. 长春: 吉林省人民政府, 中国药理学会, 2008. |
| [15] |
WANG W W, WANG G L, SUN Y D, et al. Effect of mosaic virus on appearance quality and yield of Huai'an red pepper[J]. J Zhejiang Agric Sci, 2021, 62(10): 1968-1969. 王玮玮, 汪国莲, 孙玉东, 等. 花叶病毒对淮安红椒外观品质及产量的影响[J]. 浙江农业科学, 2021, 62(10): 1968-1969. DOI:10.16178/j.issn.0528-9017.20211021 |
| [16] |
LI F, CHEN H R. Studies on plant viruses associated with tobacco diseases[J]. J Yunnan Agric Univ, 2001, 16(2): 160-166. 李凡, 陈海如. 引起烟草病害的病毒种类研究[J]. 云南农业大学学报, 2001, 16(2): 160-166. DOI:10.3969/j.issn.1004-390X.2001.02.022 |
| [17] |
YING F Q, LIU Z L, HUANG W, et al. Detection and analysis of tomato virus diseases in spring in Henan Province[J]. China Fruit Veget, 2017, 37(9): 30-32. 应芳卿, 刘宗立, 黄文, 等. 河南省春季番茄病毒病种类检测分析[J]. 中国果菜, 2017, 37(9): 30-32. DOI:10.19590/j.cnki.1008-1038.2017.09.009 |
| [18] |
ZHU C W, ZHU J G, CAO J, et al. Biochemical and molecular characteristics of leaf photosynthesis and relative seed yield of two contrasting rice cultivars in response to elevated[CO2][J]. J Exp Bot, 2014, 65(20): 6049-6056. DOI:10.1093/jxb/eru344 |
| [19] |
ZHU C X, WANG G P, ZHENG Y Y, et al. RT-PCR detection and sequence analysis of coat protein gene of citrus leaf blotch virus infecting kiwifruit trees[J]. Acta Phytopathol Sin, 2016, 46(1): 11-16. 朱晨熹, 王国平, 郑亚洲, 等. 来源于猕猴桃的柑橘叶斑驳病毒的RT-PCR检测及外壳蛋白基因序列分析[J]. 植物病理学报, 2016, 46(1): 11-16. DOI:10.13926/j.cnki.apps.2016.01.002 |
| [20] |
HUANG T, JIANG J X, YU G Q, et al. Latest advance in researches on Dioscorea opposite Thunb. diseases[J]. Biol Dis Sci, 2014, 37(1): 74-78. 黄婷, 蒋军喜, 余国庆, 等. 山药病害最新研究进展[J]. 生物灾害科学, 2014, 37(1): 74-78. DOI:10.3969/j.issn.2095-3704.2014.01.014 |
| [21] |
CAO X C, ZHONG C, ZHU L F, et al. Glycine increases cold tolerance in rice via the regulation of N uptake, physiological characteristics, and photosynthesis[J]. Plant Physiol Biochem, 2017, 112: 251-260. DOI:10.1016/j.plaphy.2017.01.008 |
| [22] |
WU Y W, LI Q, JIN R, et al. Effect of low-nitrogen stress on photosynthesis and chlorophyll fluorescence characteristics of maize cultivars with different low-nitrogen tolerances[J]. J Integr Agric, 2019, 18(6): 1246-1256. DOI:10.1016/S2095-3119(18)62030-1 |
| [23] |
FENG L Y, RAZA M A, LI Z C, et al. The influence of light intensity and leaf movement on photosynthesis characteristics and carbon balance of soybean[J]. Front Plant Sci, 2019, 9: 1952. DOI:10.3389/fpls.2018.01952 |
| [24] |
XU H J, GONG X D. Study on the photosynthetic properties of some local fine root hair yam varieties[J]. Seed, 2010, 29(5): 19-21. 徐恒戬, 巩旭东. 地方细毛山药品种光合特性的研究[J]. 种子, 2010, 29(5): 19-21. DOI:10.3969/j.issn.1001-4705.2010.05.006 |
| [25] |
PADHAN B, PANDA D. Variation of photosynthetic characteristics and yield in wild and cultivated species of yams (Dioscorea spp.) from Koraput, India[J]. Photosynthetica, 2018, 56(4): 1010-1018. DOI:10.1007/s11099-018-0823-7 |
| [26] |
THINH N C, KUMAGAI E, SHIMONO H, et al. Effects of elevated atmospheric CO2 concentration on morphology of leaf blades in Chinese yam[J]. Plant Prod Sci, 2018, 21(4): 311-321. DOI:10.1080/1343943X.2018.1511377 |
| [27] |
YE Z P. A review on modeling of responses of photosynthesis to light and CO2[J]. Chin J Plant Ecol, 2010, 34(6): 727-740. 叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740. DOI:10.3773/j.issn.1005-264x.2010.06.012 |
| [28] |
ZOU W T, WANG Y J, CAO Z, et al. Effects of heavy metal pollution on photosynthetic characteristics and heavy metal contents in forage leaves under different planting patterns[J]. J Trop Subtrop Bot, 2021, 29(1): 31-40. 邹文桐, 王艳君, 曹智, 等. 不同种植模式下重金属污染对牧草叶片光合特性和重金属含量的影响[J]. 热带亚热带植物学报, 2021, 29(1): 31-40. DOI:10.11926/jtsb.4244 |
| [29] |
XU Y J, GUO H C. Comparison on the photosynthetic characteristics of Dioscorea zingiberensis, D. panthcica and D. parriflora[J]. J Yunnan Agric Univ, 2004, 19(4): 409-412. 徐亚军, 郭华春. 盾叶薯蓣、黄山药、小花盾叶薯蓣的光合特性比较[J]. 云南农业大学学报, 2004, 19(4): 409-412. DOI:10.3969/j.issn.1004-390X.2004.04.011 |
| [30] |
TAY S, HE J, YAM T W. Photosynthetic light utilization efficiency, water relations and leaf growth of C3 and CAM tropical orchids under natural conditions[J]. Am J Plant Sci, 2015, 6(18): 2949-2959. DOI:10.4236/ajps.2015.618290 |
| [31] |
YU L, GUO S R, ZHU W M, et al. Effects of tomato yellow leaf curl virus on photosynthetic characteristics and chloroplast ultra-structure of the tomato leaves[J]. Acta Bot Boreali-Occid Sin, 2011, 31(7): 1355-1359. 于力, 郭世荣, 朱为民, 等. 番茄黄化曲叶病毒对番茄叶片光合特性和叶绿体超微结构的影响[J]. 西北植物学报, 2011, 31(7): 1355-1359. |
| [32] |
NI G S, ZHANG X J, BI Q W, et al. Changes in photosynthesis characteristics of flue-cured tobacco infected with tobacco mosaic virus[J]. Chin Tobacco Sci, 2010, 31(5): 58-61. 倪国仕, 章新军, 毕庆文, 等. 受烟草花叶病毒侵染程度不同的烤烟叶片光合特性的变化[J]. 中国烟草科学, 2010, 31(5): 58-61. DOI:10.3969/j.issn.1007-5119.2010.05.012 |
| [33] |
HAN Z M, WANG Y H, HAN M, et al. Comparative study on photosynthesis of medicinal plant Saposhnikovia divaricata in different periods[J]. Acta Ecol Sin, 2009, 29(3): 1382-1390. 韩忠明, 王云贺, 韩梅, 等. 药用植物防风(Saposhnikovia divaricata)不同时期光合作用特性比较[J]. 生态学报, 2009, 29(3): 1382-1390. DOI:10.3321/j.issn:1000-0933.2009.03.035 |
 2023, Vol. 31
2023, Vol. 31



