湿地是全世界生产力最高的生态系统之一,由于其具有广泛的环境功能和生态效益而被描述为地球的肾脏[1]。自然条件下磷循环为不完全循环, 导致陆地生态系统的磷含量逐渐减少[2]。全球大约43%的自然土地处于磷限制状态[3],磷缺乏问题几乎发生在所有陆地生态系统中。而鸟类栖息地土壤养分却显著区别于其它陆地生态系统,劭学新等[4]报道鹭鸟栖息地出现土壤养分富集现象,这主要与鸟粪输入有关。研究表明,海鸟能够通过捕食、繁殖等生命活动将大量氮、磷等营养元素从海洋传输到陆地栖息地,显著提高了栖息地土壤[5]及沉积物中的磷含量[6],进而改变栖息地植被群落及物种丰富度[7]。相比于氮,来源于鸟粪中的磷形态相对稳定、滞留能力较强,能够在栖息地土壤中长期积累[8],使海鸟栖息地土壤中全磷及土壤有效磷含量长期处于较高水平[9]。
鸟粪衍生的氮、磷等营养元素可以促进植物生长、改变植物群落结构[10–11]。研究表明,不同鸟类栖息地植物群落结构差异主要与栖息地土壤磷酸盐含量有关,且食性不同的鸟类会以更复杂的方式影响北极高等植被[12]。在海鸟密度较高的岛屿,岛上植被以生长迅速的禾本科植物为主, 而海鸟较少的区域则以生长缓慢的低矮灌木为主[13]。与无海鸟栖息区域相比,海鸟栖息区域受鸟粪影响植物丰度更高[14]。而在森林生态系统研究中发现,物种丰富度随着磷有效性的提高而下降[15–16]。
退化湿地生态系统特别是水鸟栖息地退化生态系统的修复是湿地修复的主要任务之一。水鸟依据营巢地不同可分为树巢类和芦巢类,其中白鹭属主要于乔木、灌木、竹林中营巢,夜鹭属主要于乔木上营巢[17]。生态系统服务功能退化的单一生境不利于水鸟栖息繁殖[18],因此如何在保护水鸟正常栖息繁衍的同时,构建乔、灌、草物种组成和结构完整的水鸟栖息地森林生态系统,保障湿地生态系统的自然属性不受破坏是水鸟栖息地修复的关键。
为了探究水鸟活动对于人工湿地植物群落结构和土壤磷分含量的影响,并降低研究地点差异对于结果的可能影响,增强结论在广东地区的普适性,本研究选择广东省内类型相同且水鸟入园时间相近的顺德水鸟天堂(顺德)、广东星湖国家湿地公园(星湖)及江门小鸟天堂国家湿地公园(江门) 3个人工湿地中分别设立水鸟区和对照区样地,并提出以下假设:(1) 水鸟繁殖、觅食等活动能够影响栖息地土壤理化性质,使栖息地出现土壤养分(主要为磷素)富集现象;(2) 水鸟栖息能够影响栖息地植物群落组成,降低栖息地植物物种多样性,导致栖息地退化。
1 材料和方法 1.1 研究区概况本研究区域分别位于广东省佛山市顺德区、肇庆市及江门市,属于南亚热带,是全国光、热、水资源最丰富的地区之一。本研究区域全年气温较高,年平均气温21.8 ℃,年均降雨量约为1 777 mm。
顺德水鸟天堂(22°50′37.78″ N,113°17′22.72″ E)位于广东省佛山市顺德区,为人工湿地,占地面积约11.3 hm2。该湿地以麻竹(Dendrocalamus latiflorus)、簕竹(Bambusa blumeana)和撑篙竹(B. pervariabilis)等形成的竹林为主要植被类型,部分区域种有榕树(Ficus microcarpa)。湿地位于公路旁,部分区域原为农田及鱼塘,距离人类生活区较近,受人类活动干扰较严重。水鸟于1999年夏季入园,湿地内栖息水鸟主要为白鹭(Egretta garzetta)、夜鹭(Nycticorax nycticorax)等。
广东星湖国家湿地公园(23°03′26″ N, 112°26′ 36″ E)位于广东省肇庆市端州区星湖景区内,占地面积约677 hm2。据管理处记录,该区域水鸟于2012年由七星岩景区落羽杉林迁至星湖湿地南方鸟岛。水鸟种类主要为苍鹭(Ardae cinerea)、白鹭、池鹭(A. bacchus)、绿鹭(Butorides striatus)、夜鹭等。水鸟栖息区域植被类型以草本为主。该湿地公园水鸟栖息区域保护良好,受人类活动干扰程度较轻。
江门小鸟天堂国家湿地公园(22°27′48.23″ N, 113°02′54.53″ E)位于广东省江门市新会城区以南10 km的天马村,于2002年在原有古榕岛的基础上规划扩建,建成占地0.4 hm2的人工湿地,以竹林为主要植被类型,郁闭度较高。据记载该湿地公园的水鸟于2012年自古榕岛迁入相邻的竹岛,竹岛栖息水鸟种类主要为苍鹭、白鹭、绿鹭、池鹭、牛背鹭(Bubulcus ibi)、大白鹭(Egretta alba)等,水鸟栖息地保护情况较好。
1.2 样地设置和调查方法于2021年9—10月,在顺德、星湖及江门的水鸟栖息区域(水鸟区)及无水鸟栖息区域(对照)各设置1条10 m×40 m的样带,每条样带分成4个10 m×10 m的样方。为了减少土壤空间异质性的影响,所选对照区样带与水鸟区尽量靠近且林龄和植被类型相似。星湖对照区距离水鸟区直线距离约655 m;江门对照区距离水鸟区直线距离约190 m; 顺德对照区距离水鸟区直线距离约200 m。顺德、星湖及江门的水鸟区和对照区均为人工湿地,且均高于湖堤,因此土壤是恒干的。对每个样方中胸径≥1 cm的乔木进行每木检尺,并记录种名、树高、胸径等信息。在每个样方中随机设立1个5 m×5 m的灌木层样方和1个2 m×2 m的草本层样方,调查并记录灌木层内胸径 < 1 cm且树高 > 50 cm的灌木和草本层样方中所有草本植物的种类、高度、冠幅或盖度等信息。
1.3 土壤样品的采集和测定2021年9—10月,植物调查时进行土壤样品采集。在每条样带中随机选择8个采样点,除去采样点表面凋落物后使用不锈钢土钻采集0~10 cm的土壤,混合。土壤样品自然风干后,过2 mm筛去除植物细根及石砾,用于测量土壤pH、容重、有机质、全氮、全磷、有效磷、有机磷及无机磷。
土壤pH采用pH计(Starter2100, Ohaus, USA)测定(土: 水=1:2.5, W/V), 土壤容重采用环刀法测定[19], 有机质采用TOC分析仪测定[20],全氮参照《HJ 717—2014土壤质量全氮的测定凯氏法》测定,有效氮采用碱解扩散法测定[21],全磷采用《HJ 632—2011土壤总磷的测定碱熔-钼锑抗分光光度法》测定,有效磷采用双酸(HCL-H2SO4)浸提-钼锑抗比色法测定[22],有机磷及无机磷采用硫酸与氢氧化钠浸提法测定。
1.4 数据分析生物多样性分析采用物种的丰富度指数、多样性指数和均匀度指数。丰富度指数Richness=S; Shannon-Wiener指数Sw=-ΣPilnPi;Pielou指数E= Sw/log2S,式中, S为样方的植物种数;Pi为种i的个体数占总个体数的比率。
使用R4.1.2进行数据分析,采用t检验或Kruskal- Wallis检验对比同一地点对照区与水鸟栖息地土壤理化性质、植物物种多样性指数差异。采用基于转化的冗余分析(tb-RDA)分析群落物种组成受环境变量约束的关系,显著性水平设置为P < 0.05。
2 结果和分析 2.1 土壤理化性质顺德、江门、星湖的土壤为酸性土壤,对照区土壤pH值显著高于水鸟区,说明鸟粪输入显著降低了土壤pH值。星湖水鸟区土壤有机质含量(71.7 g/kg)与对照区(50.2 g/kg)存在显著差异,而顺德和江门的水鸟区与对照区的土壤有机质含量差异并不显著。由表 1可见,土壤全氮含量的变化趋势与土壤有机质基本一致,除星湖水鸟区比对照区的含量高1.4 g/kg外,其余2个地区的水鸟区与对照区差异不显著。
| 表 1 土壤理化性质 Table 1 Soil physical and chemical properties |
3个地区的土壤全磷含量变化趋势与土壤有机质、全氮不同。水鸟区土壤全磷含量为星湖(6.4 g/kg) > 顺德(2.9 g/kg) > 江门(1.7 g/kg),对照区土壤全磷含量显著低于水鸟区(P < 0.05)。同为水鸟区, 星湖的土壤有效磷含量最高,约为顺德的3.9倍,江门的最小。而对照区,土壤有效磷含量最高为江门,其次为星湖、顺德。水鸟区与对照区的土壤全磷、有效磷含量差异显著,说明水鸟活动提高了栖息地土壤全磷、有效磷含量。
土壤有机磷主要包括核蛋白、核酸、磷脂等, 在微生物的矿化作用下,土壤有机磷可以转化为无机磷酸盐并被植物吸收利用。顺德、星湖水鸟区的土壤有机质均显著高于对照区。水鸟区中, 星湖的土壤有机质含量最高,其次为顺德,江门土壤有机质含量最少。而对照区中,江门土壤有机质含量分别比顺德、星湖高178.6%和61.6%。顺德、江门、星湖的水鸟区土壤有机磷含量均显著高于对照区。在顺德、江门和星湖的水鸟栖息区域中,星湖的土壤有机磷含量最高,分别是顺德、江门的2.6、3.5倍。
由表 2可知,顺德、江门的水鸟区与对照区土壤的C: N存在显著差异,且对照区均高于水鸟区。顺德、星湖水鸟区与对照区的土壤C: P、C: N均存在显著差异,均以星湖的最大。但江门水鸟区与对照区间的土壤C: P和N: P均无显著差异。
| 表 2 土壤的化学计量学 Table 2 Soil chemometrics |
江门水鸟区主要植被类型为人工竹林,郁闭度约80%,乔木层有3种维管束植物,隶属于2科2属,样地内未见灌木、草本。对照区为人工竹木混交林,共有维管束植物22种,隶属于17科19属。
顺德水鸟区主要植被类型为人工竹林,林下无灌木,乔木层和草本层共有4种维管束植物,隶属于4科4属。对照区为人工竹木混交林,共有维管束植物17种,隶属于13科15属,其中乔木、灌木、草本层物种数分别占物种总数的41.2%、29.4%和29.4%。
星湖的水鸟区为次生林,共有19种维管束植物, 隶属于14科17属,草本层植物种类占总种数的52.6%,乔木层中榕属植物占该层植物种数的44.4%,水鸟区未见灌木,乔木层有大量树木干枯死亡。对照区也为次生林,共有24种维管束植物,隶属于15科18属,灌木层植物种类最多,占总种数的45.8%,乔木层占33.3%,草本层占20.9%。
由图 1可知,同一地点的水鸟区与对照区物种丰富度差异显著(P < 0.05)。星湖对照区的植物物种丰富度(Richness)、多样性指数(Shannon-Wiener指数)及均匀度指数(Pielou指数)均最高,说明星湖对照区的植物物种多样性最高、植被分布最均匀。且星湖对照区的植物物种丰富度及均匀度指数均显著高于水鸟区,其余两地也表现出相似的规律。星湖、顺德、江门水鸟区的植物物种丰富度、多样性指数及均匀度指数依次为星湖 > 顺德 > 江门,与栖息地土壤有效磷含量变化趋势一致,说明水鸟向栖息地输入的磷素对该区域植物群落造成了一定影响。
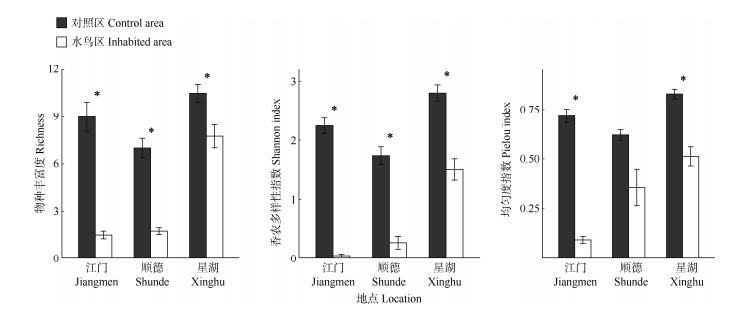
|
图 1 植物物种多样性指数的变化。*: P < 0.05 Fig. 1 Changes in species diversity indexes. *: P < 0.05 |
从环境因子数据中通过前向选择方法筛选出土壤pH、容重、土壤有机质及土壤有效磷4种环境因子,结合对应区域植物群落数据进行RDA分析。根据分析结果,RDA1、RDA2轴分别解释了总变异的21.2%、13.2%。所选4个环境因子对植物群落变异影响的总解释率为46%,有效磷、土壤有机质、pH及容重与植物群落关系均达到显著水平(P < 0.05)。环境因子对植物群落结构的影响顺序由大到小排序为有效磷 > 土壤有机质 > 容重 > pH。由图 2可见,水鸟区植物群落主要受土壤有效磷及土壤有机质影响更大,对照区植物群落主要受土壤pH及容重影响。

|
图 2 植物物种多样性与环境因子间的RDA排序 Fig. 2 RDA ranking between plant diversity and environmental factors |
我国土壤表层磷含量为0.2~1.1 g/kg[23],广东省2006—2010年间耕地土壤有效磷均值为(41.1± 4.9) mg/kg[24]。江门、顺德、星湖水鸟栖息区土壤全磷含量均高于上述水平,且水鸟栖息区域的土壤全磷、有效磷均显著高于对照区,说明鸟粪显著提高水鸟栖息区域土壤肥力,影响了土壤理化性质, 这与前人研究结果相符[8, 25]。土壤磷素可分为有机磷及无机磷,其中土壤无机磷包括铁磷、铝磷、钙磷和闭蓄态磷,约占土壤全磷的50%~80%[26–27]。顺德、江门及星湖土壤磷素主要以无机磷形式存在, 水鸟栖息区域无机磷占全磷的92%~94%,高于平均水平,可能是由于水鸟通过鸟粪向栖息地输入磷素的主要形态为无机磷[28],这进一步说明水鸟栖息地鸟粪输入影响了土壤磷素的积累及形态。
物种多样性是植物丰富度与其分布均匀性的综合指标,体现了种群及群落的发展变化[29]。植物群落与土壤理化性质密切相关[30],土壤有机质及氮素对植物群落多样性有重要影响[31],但这并不适用于水鸟栖息地。栖息地乔木和灌木随着鸟粪沉积、土壤营养物质含量增加而减少[32–33]。Zwolicki等[12]报道海鸟栖息地部分乔木和灌木被蕨类、草本和苔藓取代;Gillham等[34]报道海鸟栖息地植物群落中一年生草本显著多于对照区。本研究中,星湖水鸟区木本植物生长受到明显抑制,未见灌木,而草本层物种丰富度、盖度较高,这与前人的研究结论相似。江门、顺德水鸟栖息地主要以竹林为主,未见灌木,但林下草本数量极少,其可能原因是竹林林分郁闭度较高,林下没有充足的光照条件导致物种丰富度降低[35]。
本研究结果表明,土壤有效磷及土壤有机质为水鸟栖息地植物物种多样性的主要影响因子,土壤磷含量与植物群落多样性存在明显相关性[36]。这与前人[13–14]研究结果不同,可能是由于本研究中3处水鸟栖息地筑巢时间较前人的研究更短,同时也反映出水鸟栖息地生态系统结构差异和空间异质性。土壤营养物质能够影响植物物种多样性,研究表明植物物种多样性的提高有利于提高植物生产力同时平衡土壤C: N: P[37]。因此保护水鸟栖息地植物多样性,修复栖息地退化的生态系统对水鸟栖息地长期发展尤为重要。
一般来说,土壤有机质输入量主要受有机残体归还量及腐殖化难易程度的影响。土壤有机质包含非腐殖质物质和腐殖质物质,其中腐殖质物质为土壤有机质的主要成分,新鲜动植物残体进入土壤后,经微生物分解彻底转化合成腐殖质[27]。湿地鸟粪的输入能够提高凋落物分解速率,有利于养分释放[38]。土壤有机质的分解转化主要是在微生物的主导下进行的,微生物主要以碳、氮构成自身细胞, 其生命活动最适有机质的C: N约为25:1[27]。当C: N < 25:1时,有利于微生物分解有机质,并将多余的氮素释放进土壤成为养分。可见,本研究中水鸟栖息地鸟粪输入、土壤C: N促进了枯落物分解转化及土壤有机质分解,改变栖息地植物有效营养物质含量[39],最终影响植物群落物种多样性。氮、磷是植物生长的主要限制性营养元素,星湖、顺德水鸟区的土壤N: P显著高于对照区,这意味着水鸟区更容易受到氮限制[40],可能与水鸟向栖息地输入大量磷素有关。土壤养分的限制类型可以通过N: P判断,N: P升高意味着受到的磷限制增强,星湖、顺德对照区土壤N: P显著高于水鸟区,星湖N: P高于顺德、江门对照区,表明星湖、顺德对照区植物生长受磷限制且星湖受磷限制作用更强。
综上,水鸟栖息地土壤全磷、有效磷含量均显著高于无水鸟栖息区域。受水鸟活动影响,栖息地植被主要以草本类为主,少见灌木。顺德、星湖、江门研究区域植物群落与环境因子的冗余分析结果表明水鸟栖息地植物群落物种多样性与土壤有效磷、有机质含量有显著相关性,无水鸟栖息区域则与土壤容重、pH值显著相关。水鸟栖息会造成栖息地磷素富集,从而可能对适应低磷环境的植物造成胁迫,因此,在恢复水鸟栖息地植被时建议选择适应高磷胁迫的植物,如榕属植物、苦楝(Melia azedarach)、乌桕(Triadica sebifera)、朴树(Celtis sinensis)、樟树(Cinnamomum camphora)等四旁树种。
| [1] |
WU C Y, CHEN W, CAO C X, et al. Diagnosis of wetland ecosystem health in the Zoige wetland, Sichuan of China[J]. Wetlands, 2018, 38(3): 469-484. DOI:10.1007/s13157-018-0992-y |
| [2] |
LI B. Ecology[M]. Beijing: Higher Education Press, 2000: 1-399. 李博. 生态学[M]. 北京: 高等教育出版社, 2000: 1-399. |
| [3] |
DU E Z, TERRER C, PELLEGRINI A F A, et al. Global patterns of terrestrial nitrogen and phosphorus limitation[J]. Nat Geosci, 2020, 13(3): 221-226. DOI:10.1038/s41561-019-0530-4 |
| [4] |
SHAO X X, YANG H, LIU X C, et al. Nutrient accumulation characteristics of soil in egret habitat in Hangzhou Bay Wetland[J]. J Forest Environ, 2019, 39(4): 404-409. 邵学新, 杨慧, 刘旭川, 等. 杭州湾湿地鹭鸟栖息地土壤养分累积特征[J]. 森林与环境学报, 2019, 39(4): 404-409. DOI:10.13324/j.cnki.jfcf.2019.04.012 |
| [5] |
OTERO X L, TEJADA O, MARTíN-PASTOR M, et al. Phosphorus in seagull colonies and the effect on the habitats. The case of yellow- legged gulls (Larus michahellis) in the Atlantic Islands National Park (Galicia-NW Spain)[J]. Sci Total Environ, 2015, 532: 383-397. DOI:10.1016/j.scitotenv.2015.06.013 |
| [6] |
LITAOR M I, REICHMANN O, DENTE E, et al. The impact of ornithogenic inputs on phosphorous transport from altered wetland soils to waterways in East Mediterranean ecosystem[J]. Sci Total Environ, 2014, 473–474: 36-42. DOI:10.1016/j.scitotenv.2013.11.126 |
| [7] |
DUDA M P, GLEW J R, MICHELUTTI N, et al. Long-term changes in terrestrial vegetation linked to shifts in a colonial seabird population[J]. Ecosystems, 2020, 23(8): 1643-1656. DOI:10.1007/s10021-020-00494-8 |
| [8] |
IRICK D L, GU B H, LI Y C, et al. Wading bird guano enrichment of soil nutrients in tree islands of the Florida Everglades[J]. Sci Total Environ, 2015, 532: 40-47. DOI:10.1016/j.scitotenv.2015.05.097 |
| [9] |
ZHONG H T, KIM Y N, SMITH C, et al. Seabird guano and phosphorus fractionation in a rhizosphere with earthworms[J]. Appl Soil Ecol, 2017, 120: 197-205. DOI:10.1016/j.apsoil.2017.08.006 |
| [10] |
BOKHORST S, CONVEY P, AERTS R. Nitrogen inputs by marine vertebrates drive abundance and richness in Antarctic terrestrial ecosystems[J]. Curr Biol, 2019, 29(10): 1721-1727.e3. DOI:10.1016/j.cub.2019.04.038 |
| [11] |
ELLIS J C. Marine birds on land: A review of plant biomass, species richness, and community composition in seabird colonies[J]. Plant Ecol, 2005, 181(2): 227-241. DOI:10.1007/s11258-005-7147-y |
| [12] |
ZWOLICKI A, ZMUDCZYŃSKA-SKARBEK K, MATUŁA J, et al. Differential responses of arctic vegetation to nutrient enrichment by plankton- and fish-eating colonial seabirds in Spitsbergen[J]. Front Plant Sci, 2016, 7: 1959. DOI:10.3389/fpls.2016.01959 |
| [13] |
MARON J L, ESTES J A, CROLL D A, et al. An introduced predator alters Aleutian Island plant communities by thwarting nutrient sub- sidies[J]. Ecol Monogr, 2006, 76(1): 3-24. DOI:10.1890/05-0496 |
| [14] |
WAIT D A, AUBREY D P, ANDERSON W B. Seabird guano influences on desert islands: Soil chemistry and herbaceous species richness and productivity[J]. J Arid Environ, 2005, 60(4): 681-695. DOI:10.1016/j.jaridenv.2004.07.001 |
| [15] |
CEULEMANS T, STEVENS C J, DUCHATEAU L, et al. Soil phosphorus constrains biodiversity across European grasslands[J]. Glob Change Biol, 2014, 20(12): 3814-3822. DOI:10.1111/gcb.12650 |
| [16] |
WASSEN M J, VENTERINK H O, LAPSHINA E D, et al. Endangered plants persist under phosphorus limitation[J]. Nature, 2005, 437(7058): 547-550. DOI:10.1038/nature03950 |
| [17] |
DENG T P. A preliminary study on nidification habitat selection and niche of Ardeidae birds[D]. Zhengzhou: Henan University, 2008 邓天鹏. 鹭科鸟类营巢地选择和生态位的研究[D]. 郑州: 河南大学, 2008. |
| [18] |
GE P Y, YANG T W, ZHANG P, et al. Ecological restoration project for Yancheng Coastal Wetland based on bird habitat demand: A case study of Chenjiagang Reservoir[J]. Wetl Sci Manag, 2021, 17(4): 33-36. 戈萍燕, 杨棠武, 张鹏, 等. 基于鸟类栖息需求的盐城滨海湿地生态修复工程: 以陈家港水库生态修复工程为例[J]. 湿地科学与管理, 2021, 17(4): 33-36. DOI:10.3969/j.issn.1673-3290.2021.04.07 |
| [19] |
HU H R, TIAN K. Guidance Course for Soil Experiment[M]. Beijing: China Forestry Publishing House, 2012: 1-107. 胡慧蓉, 田昆. 土壤学实验指导教程[M]. 北京: 中国林业出版社, 2012: 1-107. |
| [20] |
QIAN B, LIU L, XIAO X. Comparative tests on different methods for content of soil organic matter[J]. J Hohai Univ (Nat Sci), 2011, 39(1): 34-38. 钱宝, 刘凌, 肖潇. 土壤有机质测定方法对比分析[J]. 河海大学学报(自然科学版), 2011, 39(1): 34-38. DOI:10.3876/j.issn.1000-1980.2011.01.008 |
| [21] |
LI J Y. Determination of hydrolyzable nitrogen in soil (alkaline hydrolysis diffusion method)[J]. Inform Agric Sci Technol, 2010(10): 15. 李金彦. 土壤水解性氮的测定(碱解扩散法)[J]. 农业科技与信息, 2010(10): 15. DOI:10.3969/j.issn.1003-6997.2010.10.008 |
| [22] |
QIAO R Z, DONG H Y, SUN Q W, Phosphorus determination methods of forest soil: LY/T 1232–2015[S]. Beijing: China Quality and Standards Publishing & Media Co., Ltd, 2015: 1–16 焦如珍, 董红玉, 孙启武. 森林土壤磷的测定: LY/T 1232–2015[S]. 北京: 中国标准出版社, 2015: 1–16. |
| [23] |
SUN X Y. Pedology[M]. Beijing: China Forestry Publishing House, 2005: 1-358. 孙向阳. 土壤学[M]. 北京: 中国林业出版社, 2005: 1-358. |
| [24] |
ZENG Z B, ZENG S J, TANG J D, et al. Space-temporal variation of farmland soil AP in Guangdong Province and their causing factors[J]. Ecol Environ Sci, 2014, 23(3): 444-451. 曾招兵, 曾思坚, 汤建东, 等. 广东省耕地土壤有效磷时空变化特征及影响因素分析[J]. 生态环境学报, 2014, 23(3): 444-451. DOI:10.3969/j.issn.1674-5906.2014.03.012 |
| [25] |
ZHAO Y H, WU M, SHAO X X. Impact of egrets habitation on accumulation and distribution of various forms of phosphorus in soils of Hangzhou Bay wetland[J]. Acta Ecol Sin, 2021, 41(20): 8246-8255. 赵亦欢, 吴明, 邵学新. 鹭鸟栖息对杭州湾湿地土壤磷累积及形态分布的影响[J]. 生态学报, 2021, 41(20): 8246-8255. DOI:10.5846/stxb202010192658 |
| [26] |
CHEN G C, GAN L, WANG S L, et al. Progress in geochemistry of phosphorus in soils[J]. Geology-Geochemistry, 2001, 29(2): 78-81. 陈刚才, 甘露, 王仕禄, 等. 土壤中元素磷的地球化学[J]. 地质地球化学, 2001, 29(2): 78-81. DOI:10.3969/j.issn.1672-9250.2001.02.013 |
| [27] |
HU H R, BEI R T, WANG Y X. Forest Pedology[M]. Beijing: China Forestry Publishing House, 2019: 1-274. 胡慧蓉, 贝蓉塔, 王艳霞. 森林土壤学[M]. 北京: 中国林业出版社, 2019: 1-274. |
| [28] |
LUIS O X, DE LA PEñA-LASTRA S, PÉREZ-ALBERTI A, et al. Seabird colonies as important global drivers in the nitrogen and phosphorus cycles[J]. Nat Commun, 2018, 9(1): 246. DOI:10.1038/s41467-017-02446-8 |
| [29] |
PENG S L, CHEN Z H. Research on the species divercity of plant of the subtropical forests in Guangdong[J]. Ecol Sci, 1983(2): 98-104. 彭少麟, 陈章和. 广东亚热带森林群落物种多样性[J]. 生态科学, 1983(2): 98-104. |
| [30] |
SIEFERT A, RAVENSCROFT C, ALTHOFF D, et al. Scale depen- dence of vegetation-environment relationships: A meta-analysis of multivariate data[J]. J Veg Sci, 2012, 23(5): 942-951. DOI:10.1111/j.1654-1103.2012.01401.x |
| [31] |
LI X N, ZHANG W W, ZHAO C Q, et al. Plant diversity and soil physicochemical properties in the wasteland of Yanqing District[J]. Acta Agrest Sin, 2019, 27(3): 695-701. 李晓娜, 张微微, 赵春桥, 等. 延庆区荒滩地土壤理化性质及其对植物多样性的影响[J]. 草地学报, 2019, 27(3): 695-701. DOI:10.11733/j.issn.1007-0435.2019.03.023 |
| [32] |
HEBERT C E, DUFFE J, WESELOH D V C, et al. Unique island habitats may be threatened by double-crested cormorants[J]. J Wildl Manage, 2005, 69(1): 68-76. DOI:10.2193/0022-541X(2005)069<0068:UIHMBT>2.0.CO;2 |
| [33] |
STEWART E M, MICHELUTTI N, SHENSTONE-HARRIS S, et al. Tracking the history and ecological changes of rising double-crested cormorant populations using pond sediments from islands in Eastern Lake Ontario[J]. PLoS One, 2015, 10(7): e0134167. DOI:10.1371/journal.pone.0134167 |
| [34] |
GILLHAM M. Destruction of indigenous heath vegetaion in Victorian sea-bird colonies[J]. Aust J Bot, 1960, 8(3): 277-317. DOI:10.1071/BT9600277 |
| [35] |
ZHAN M C, GUAN F Y, YAN Y J, et al. Effects of strip harvesting on species diversity of undergrowth in bamboo (Phyllostachys edulis) forest[J]. Acta Ecol Sin, 2020, 40(12): 4169-4179. 詹美春, 官凤英, 晏颖杰, 等. 带状采伐对毛竹林林下植被物种多样性的影响[J]. 生态学报, 2020, 40(12): 4169-4179. DOI:10.5846/stxb201902200301 |
| [36] |
NEWBERY D M C, GARTLAN J S, MCKEY D B, et al. The influence of drainage and soil phosphorus on the vegetation of Douala-Edea Forest Reserve, Cameroun[J]. Vegetatio, 1986, 65(3): 149-162. DOI:10.1007/BF00044815 |
| [37] |
CHEN X L, CHEN H Y H. Plant mixture balances terrestrial eco- system C׃N׃P stoichiometry[J]. Nat Commun, 2021, 12(1): 4562. DOI:10.1038/s41467-021-24889-w |
| [38] |
ZHANG Q J, ZHANG G S, WAN S X, et al. Effects of herbivorous overwintering migratory birds' droppings on the decomposition of Carex cinerascens Kükenth and C, N, P release in Lake Poyang wetland[J]. J Lake Sci, 2019, 31(3): 814-824. 张全军, 张广帅, 万松贤, 等. 鄱阳湖植食越冬候鸟粪便对洲滩湿地薹草枯落物分解过程及碳、氮、磷释放的影响[J]. 湖泊科学, 2019, 31(3): 814-824. DOI:10.18307/2019.0319 |
| [39] |
ELWOOD J W, NEWBOLD J D, TRIMBLE A F, et al. The limiting role of phosphorus in a woodland stream ecosystem: Effects of P enrichment on leaf decomposition and primary producers[J]. Ecology, 1981, 62(1): 146-158. DOI:10.2307/1936678 |
| [40] |
YU M F, TAO Y X, LIU W Z, et al. C, N, and P stoichiometry and their interaction with different plant communities and soils in subtropical riparian wetlands[J]. Environ Pollut Res, 2020, 27(1): 1024-1034. DOI:10.1007/s11356-019-07004-x |
 2023, Vol. 31
2023, Vol. 31


