1b. 海南大学热带作物学院, 海口 570228;
2. 中国热带农业科学院热带作物品种资源研究所, 海口 571101
1b. College of Tropical Crops, Hainan University, Haikou 570228, China;
2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China
茎的次生生长是树木茎增粗的主要方式,包括次生木质部和次生韧皮部的形成等一系列过程,与木材形成密切相关[1]。近年来,植物茎次生生长的研究主要在杨属(Populus)植物中开展。Dharma- wardhana等[2]研究表明,胡杨(P. trichocarpa)部分转录因子(transcription factors, TFs)基因上调表达与茎的次生生长相关,对其生长速度、木材质量等方面起促进作用。Seyfferth等[3]确定了白杨(Temulus tremula)转录组中与木材相关的基因,并探究了木材形成中与乙烯相关的基因表达网络,然而目前的研究集中在杨属等速生树种。
蛋白激酶(protein kinases, PKs)在细胞信号转导中发挥重要作用,其主要通过使底物蛋白磷酸化的方式将信号逐级放大从而引起细胞反应[4]。植物类受体激酶(receptor-like kinases, RLKs)是PKs中重要的一类。RLKs定位在细胞膜上,典型的RLKs调控机制为信号分子与其胞外结构域特异性结合后, 激活胞内激酶域进而实现跨膜信号的传导[5]。茎的次生生长主要依赖于形成层的活动,Agusti等[6]通过反向遗传学分析确定了拟南芥(Arabidopsis thaliana)中的RLK基因AtRUL1和AtMOL1以相反的作用调节形成层的活动。TFs作为一类反式作用因子,能与启动子区域的顺式作用元件特异性结合,调控基因表达[7]。有研究表明,POPCORONA (PtPCN)转录因子在杨树茎的次生生长过程中能够调控细胞的分化[8],PtNAC、PtbZIP等转录因子与胡杨茎的次生生长密切相关[9]。PtGRF9转录因子通过调节毛果杨(P. trichocarpa)细胞壁的生物合成,进而调控茎的次生生长[10]。但相关研究大多在正常植株中开展,对白化突变体茎次生生长中PKs和TFs的研究还鲜见报道。
菠萝蜜(Artocarpus heterophyllus)是优质的木材树种,能够带来良好的经济效益。白化突变体已被运用在杂交育种、分子标记等诸多方面。本课题组前期考察中发现了白化菠萝蜜苗(albino Artocarpus heterophyllus seedling, AAS),并对其次生生长茎进行了结构解剖观察,其次生木质部、次生韧皮部及周皮的厚度均减小[11],且次生木质部导管和次生韧皮部筛管的孔径和面积减小,密度增大[12],这说明白化现象对菠萝蜜茎的次生生长具有负面影响。然而在细胞信号转导中起重要作用的PKs和TFs基因表达如何变化还需深入分析。
因此,本研究对白化菠萝蜜苗次生生长茎中PKs和TFs的差异表达基因(DEGs)进行预测及分类, 并通过构建系统进化树等方法对挑选出的2个PKs和4个TFs家族进行分析,为研究植物白化对茎PKs和TFs的影响提供参考。
1 材料和方法 1.1 材料菠萝蜜(Artocarpus heterophyllus)采自海南省儋州市海南大学儋州校区。菠萝蜜母株具有隐性的白化突变,且子代能分离出白化(AAS)和正常幼苗[13],以分离出的正常幼苗作为对照(CK)。将萌发40 d的AAS与CK次生生长茎置于液氮中速冻保存(-196 ℃), 送华大基因公司进行RNA提取、文库构建和测序。
1.2 转录组数据来源次生生长茎DEGs的编码序列(coding sequence, CDS)、蛋白序列及基因表达量(fragments per kilo- base million, FPKM)从谢柳青等[14]获取,SRA数据库登录号为PRJNA611876。43 881个DEGs的表达差异均在2倍以上,且Q-value < 0.001。
1.3 菠萝蜜PKs和TFs预测将菠萝蜜DEGs的CDS上传到ITAK (http://itak.feilab.net/cgi-bin/itak/index.cgi)网站进行PKs和TFs预测。对预测结果进行统计,分析PKs和TFs家族中上下调基因的数量并绘制柱状图。
1.4 多序列比对及系统进化树的构建拟南芥蛋白序列或基因信息从TAIR (https://www.arabidopsis.org/)数据库获得。进化树的构建采用MEGA 6.05软件,用Clustal W将拟南芥和菠萝蜜蛋白进行多序列比对。以邻接法(neighbor-joining, NJ)建树,设置Boot-strap为1 000,模式为Poisson model,缺口设为Pairwise deletion。
1.5 各家族DEGs的表达分析通过在线网站Expression Heatmapper (http://www2.heatmapper.ca/expression/)将样品的FPKM进行可视化处理。采用Row Z-score标准化方法绘制热图。
2 结果和分析 2.1 PKs和TFs的数量和长度本研究选取前期研究[14]得到的43 881个DEGs, 对其中PKs和TFs相关基因进行分析。结果表明, PKs中上、下调DEGs分别为517和873个,其中26个(IV)仅在AAS中表达,67个(I)仅在CK中表达。TFs中上、下调DEGs分别为865和773个,其中34个(IV)仅在AAS中表达,43个(I)仅在CK中表达(图 1: A, B)。仅在AAS中表达的PKs和TFs基因长度中位数均最小,分别为2 262和1 251.5 bp (图 1: C, D)。

|
图 1 PKs和TFs中DEGs数量(A, B)和长度(C, D)。I: 仅在CK中表达; II: CK和AAS共有且在AAS中上调表达; III: CK与AAS共有且在AAS中下调表达; IV: 仅在AAS中表达。 Fig. 1 Number (A, B) and length (C, D) of DEGs in PKs and TFs. I: Only expressed in CK; II: Common in CK and AAS and up-regulated in AAS; III: Common in CK and AAS and down-regulated in AAS; IV: Only expressed in AAS. |
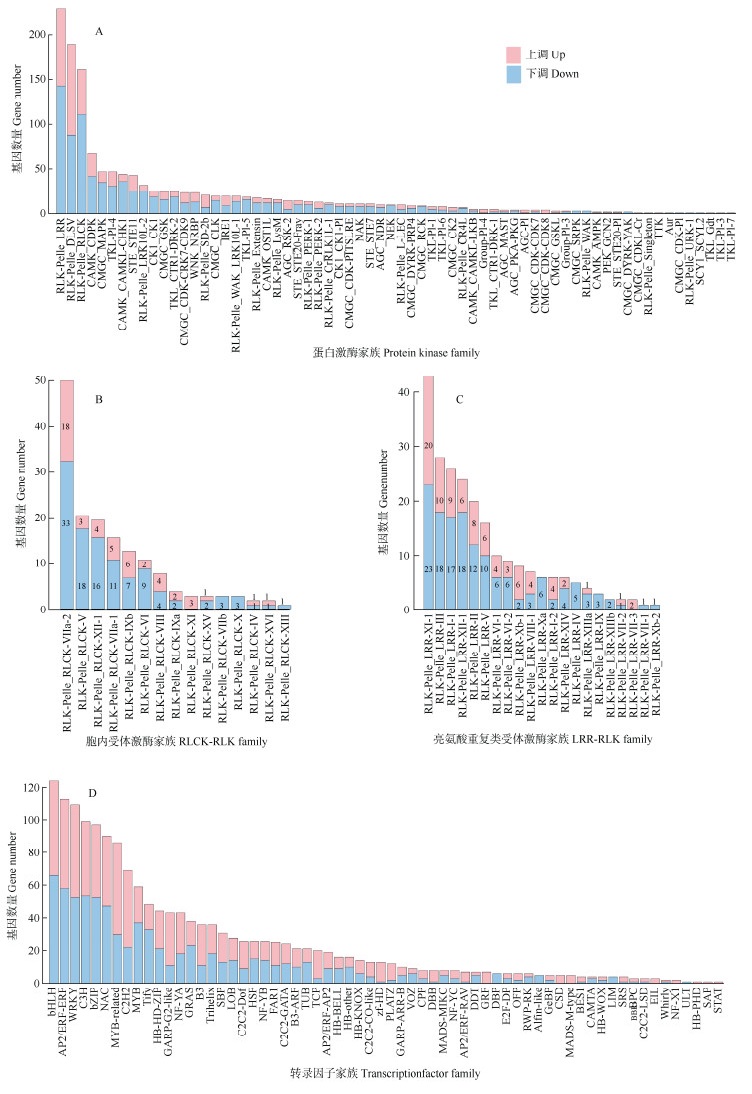
在预测的1 390个PKs DEGs中,RLK超家族有747个,占53.74%,其中RLCK-RLK、LRR-RLK的DEGs数量较多,共有390个,占RLK总数的52.21% (图 2: A)。根据蛋白序列(下同),RLCK-RLK的DEGs被划分为12个亚家族,RLCK-RLK-VIIa-2的数量最多(51个),RLCK-RLK-VIII是DEGs上下调表达各占50%的4个家族中基因数最多的,且其亚组内基因表达差异明显(图 2: B)。LRR-RLK的DEGs被划分为14个亚家族,LRR-RLK-XI-1中的数量最多(43个),以上调表达的居多。而LRR-RLK- Xa和LRR-RLK-Xb-2的DEGs均下调表达(图 2: C)。在预测的1 638个TFs DEGs中,上调表达(865个)比下调表达(773个)的多。且有11个家族中上调的DEGs均超过70%,其中TCP中的DEGs数量最多(20个),且大多数上调表达。zf-HD中上调的DEGs占总数的92.31%,GRF中的均上调表达。此外, 有6个家族中下调的DEGs数量超过各自所含总数的70%,其中Alfin-like中的DEGs均下调表达(图 2: D)。综上,预测到RLCK-RLK-VIII、LRR-RLK-X、TCP、zf-HD、GRF和Alfin-like中的DEGs数量相对较多,且这6个家族中的DEGs上下调表达差异显著(或亚组内基因表达差异明显),故选择其进行后续分析。
|
图 2 不同家族中的DEGs数量。A: PKs家族; B: RLCK-RLK家族; C: LRR-RLK家族; D: TFs家族。 Fig. 2 Number of DEGs in different families. A: PKs family; B: RLCK-RLK family; C: LRR-RLK family; D: TFs family. |
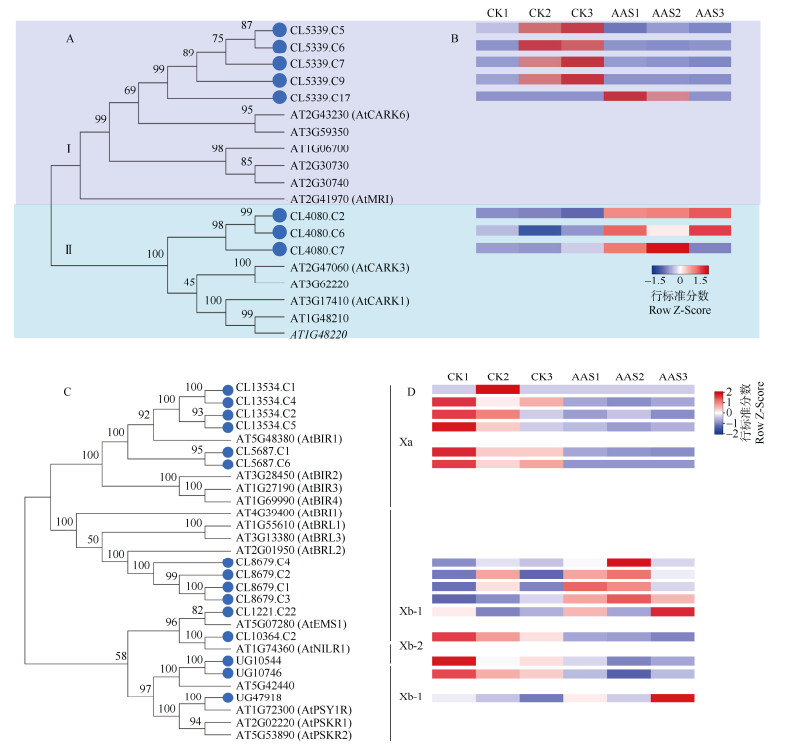
RLCK-VIII家族中共预测到8个DEGs,主要聚于2个分支,其中,CL5339.C5、CL5339.C6、CL5339.C7、CL5339.C9、CL5339.C17与AtCARK6、AT3G59350聚为一支,除CL5339.C17外的DEGs均在AAS中下调表达。而另一支中的CL4080.C2、CL4080.C6、CL4080.C7均上调表达(图 3: A, B)。I分支中的RLCK- RLK-VIII基因家族成员DEGs在AAS中下调表达的居多,而II分支中则均上调表达。
|
图 3 菠萝蜜和拟南芥的RLCK-VIII (A)、LRR-RLK-X (C)家族系统进化树和菠萝蜜DEGs表达(B, D)分析 Fig. 3 Phylogenetic tree of RLCK-VIII (A) and LRR-RLK-X (C) families in Artocarpus heterophyllus and Arabidopsis thaliana and DEGs expression (B, D) in A. heterophyllus |
对预测的LRR-RLK DEGs进行分析,结果表明,在LRR-RLK-Xa中,CL13534.C1、CL13534.C4、CL13534.C2、CL13534.C5、CL5687.C1、CL5687.C6与AtBIR1为同源基因,且均在AAS中下调表达。在LRR- RLK-Xb-1中,CL8679.C4、CL8679.C2、CL8679.C1、CL8679.C3与AtBRL2为直系同源基因,且均上调表达。CL1221.C22、UG47918、CL10364.C2分别与AtEMS1、AtPSY1R、AtNILR1为直系同源基因, CL1221.C22、UG47918上调表达,而CL10364.C2下调表达,且被认为属于RLK-LRR-Xb-2。UG10544和UG10746与AT5G42440聚为一支,均下调表达(图 3: C, D)。表达分析表明,LRR-RLK-Xa和LRR- RLK-Xb-2中的DEGs均下调表达,而LRR-RLK- Xb-1的均上调表达。
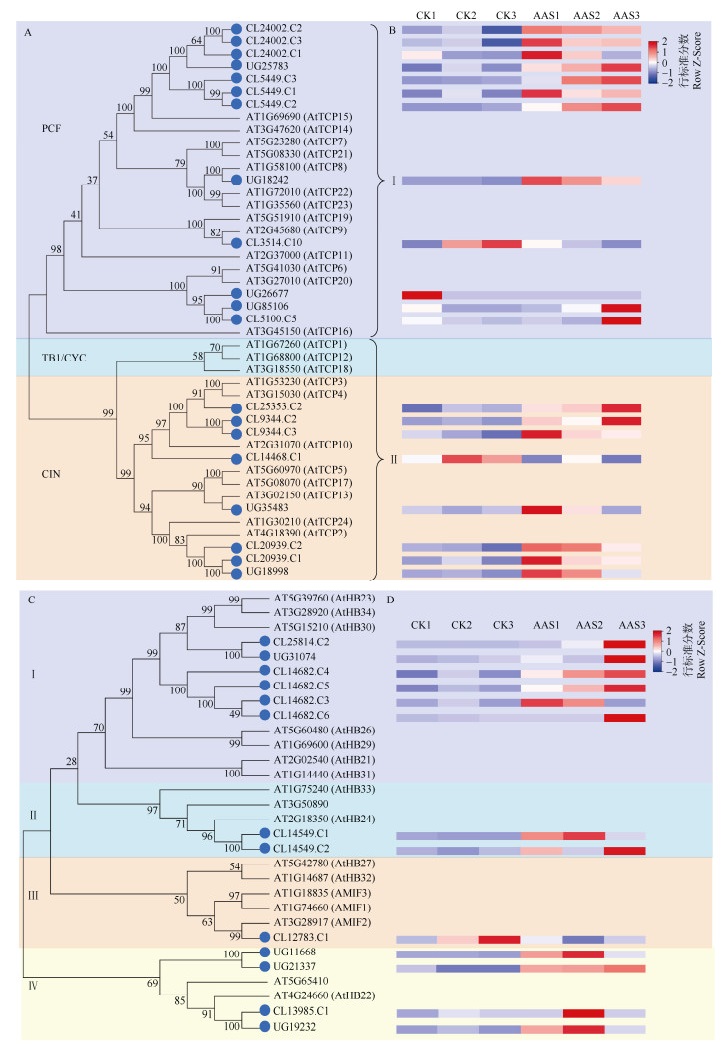
2.4 TCP和zf-HD转录因子家族分析TCP家族同源性分析结果表明(图 4),AAS中TCP家族的DEGs与PCF和CIN 2个亚家族的相关基因同源性更高,而在TB1/CYC亚家族中不存在DEGs。有12个DEGs存在于PCF中,8个DEGs存在于CIN中(图 4: A)。在PCF中,CL24002.C2、CL24002.C3、CL24002.C1、UG25783、CL5449.C3、CL5449.C1、CL5449.C2与AtTCP15聚为一支且置信度高于95%, 均在AAS中上调表达。UG18242、CL3514.C10分别与AtTCP8、AtTCP9为直系同源基因,UG18242在AAS中上调表达,CL3514.C10则下调表达。UG26677、UG85106、CL5100.C5与AtTCP6、AtTCP20亲缘关系最近,且均下调表达。总体而言,PCF中的DEGs上调表达的居多;在CIN中,除CL14468.C1外均在AAS中上调表达。CL25353.C2、CL9344.C2、CL9344.C3、CL14468.C1与AtTCP3、AtTCP4、AtTCP10聚为一个大的分支。CL20939.C2、CL20939.C1、UG18998与AtTCP24、AtTCP2为同源基因,UG35483与AtTCP13为直系同源基因(图 4: A, B)。表达分析表明,大多数DEGs在AAS中上调表达。
|
图 4 菠萝蜜和拟南芥的TCP (A)、zf-HD (C)家族系统进化树及菠萝蜜DEGs表达(B, D)分析 Fig. 4 Phylogenetic tree of TCP (A) and zf-HD (C) families in Artocarpus heterophyllus and Arabidopsis thaliana and DEGs expression (B, D) in A. heterophyllus |
zf-HD家族中共预测到13个DEGs,主要聚于4个分支,其中CL25814.C2、UG31074、CL14682.C4、CL14682.C5、CL14682.C3、CL14682.C6与AtHB23、AtHB34、AtHB30聚于一支,除CL14682.C6外均在AAS中上调表达。CL14549.C1、CL14549.C2与AtHB24为同源基因,UG11668、UG21337、CL13985.C1、UG19232与AtHB25、AtHB22聚于一大支,且除CL13985.C1外均在AAS中上调表达。CL12783.C1与AtMIF2为直系同源基因,并与AtMIF1和AtMIF3聚于一大支,且下调表达(图 4: C, D)。表达分析表明,DEGs在AAS中上调表达的居多。
2.5 GRF和Alfin-like转录因子家族分析从图 5: A, B可见,GRF家族中共预测到7个DEGs,主要分布在I、III和IV分支中, 其中UG18693与AtGRF2、AtGRF1为同源基因。CL13839.C2与AtGRF3、AtGRF4聚为一支。IV分支中CL13507.C1、CL13507.C2、UG40918、CL13507.C3、UG40920与AtGRF7、AtGRF8亲缘关系较近。表达分析表明, 除CL13507.C3和UG40920外均在AAS中上调表达。

|
图 5 菠萝蜜和拟南芥的GRF (A)、Alfin-lik (C)家族系统进化树及菠萝蜜DEGs表达(B, D)分析 Fig. 5 Phylogenetic tree of GRF (A) and Alfin-lik (C) families in Artocarpus heterophyllus and Arabidopsis thaliana and DEGs expression (B, D) in A. heterophyllus |
在AAS中,Alfin-like家族的DEGs仅存在于第I和IV分支中。CL4364.C5与AtAL7、AtAL6高度同源,UG11526、UG30907、CL6395.C1、UG10716与AtAL4聚为一支,且置信度大于75%。表达分析表明,这5个DEGs均在AAS中下调表达(图 5: C, D)。
3 结论和讨论Pittermann等[15]的研究表明,白化北美红杉(Sequioa sempervirens)茎的木质部结构较柔弱,且光合作用能力的丧失导致茎木质部发育迟缓。王开荣[16]研究了7种白化茶的生长发育过程,白化茶的茎次生生长受到不同程度的抑制,白化程度最高的‘白叶茶1号’地径最小。董俊娜等[11]报道AAS茎发育不良,其茎粗小于正常植株。这说明白化现象不利于茎的次生生长。
RLCK家族中的第VIII亚家族与脱落酸(abscisic acid, ABA)的调控密切相关,AtCARK6是胞质ABA受体激酶的成员之一[17]。AtCARK6在拟南芥的ABA信号传导中起着积极的作用,可通过提高细胞对ABA的敏感性,从而增强植物抗旱等抗环境胁迫的能力[18]。而AAS中与AtCARK6同源的5个DEGs中有4个下调表达,可能是其茎的次生生长过程对ABA不敏感的原因。由此推测RLK-RLCK-VIII亚家族可能通过ABA途径调控菠萝蜜茎的次生生长。
LRR-RLK是RLK中最大的一个家族,几乎在植物生长发育的所有过程中发挥重要的调控作用[19]。Costa等[20]的研究表明,LRR-RLK中的一些基因(SlSOBIR1来自AtSOBIR1)在感染病毒的番茄(Lyco- persicon esculentum)叶中下调表达。AtBIR1是第X家族成员之一,Gao等[21]报道,敲除AtBIR1会导致拟南芥细胞死亡。AAS生长到40 d时,茎变黄变褐甚至衰老死亡,这可能与AtBIR1同源的6个DEGs均下调表达有关。油菜素甾醇是木质部发育的调节因子[22]。AtBRI1、AtBRL1和AtBRL3是BR信号的受体[23],AAS中与其同源的5个DEGs均上调,这可能是茎木质部发育受到影响的原因。
TCP是转录因子中的一个大家族。其中, AtTCP14和AtTCP15在植物生长发育、生物胁迫等方面发挥作用[24]。Li等[25]检测了AtTCP15在拟南芥根、茎、叶和花等器官中的表达,其在茎中的表达量较高。Lopez等[26]认为AtTCP14、AtTCP15在植物免疫中发挥作用。AAS中与AtTCP14和AtTCP15同源的7个DEGs均上调表达,这可能使茎次生生长的发育和免疫功能受到影响。此外,有研究表明AtTCP3过表达会降低植物对生长素(IAA)的敏感性[27]。而AAS中与AtTCP3同源的3个DEGs均上调表达, 这可能是其对IAA的敏感性降低的原因之一。
zf-HD家族是陆生植物所特有的一类转录因子, 在植物生长发育过程中发挥作用,如响应逆境胁迫、调控花的发育以及种子的寿命等[28]。Bueso等[29]研究表明拟南芥中的AtHB25转录因子能够诱导赤霉素(GA)生物合成酶基因GA3OX2的表达,从而使具有生物活性的GA含量提高,AAS中与AtHB25同源的4个DEGs均上调可能会改变GA的含量, 使茎的次生生长受到一定影响。AtHB33的表达可促进细胞的增殖[30],AAS中与AtHB33同源的2个DEGs均上调可能会促进茎中细胞的增殖。
GRF是一类植物所特有的转录因子,主要功能是调控植物器官或组织的发育[31]。有研究表明,辣椒(Capsicum annuum)幼苗经GA处理后,CaGRF4的表达受到抑制[32]。而AAS中与AtGRF4同源的2个DEGs均上调,可能是对GA敏感性降低所导致的结果。Wang等[33]报道BR信号能促进AtGRF7和AtGRF8的表达,调控黄化苗的转绿。AAS中与AtGRF7和AtGRF8同源的5个DEGs均上调,这与AAS的BRI1同源基因上调表达相一致,预示AAS茎中BR信号可能有所增强,从而导致GRF的表达发生上调。
Alfin-like (AL)是植物特有的小型基因家族,在非生物胁迫反应中起作用[34]。在拟南芥中,ABA可诱导AtAL5基因的表达,且AtAL5的高表达使植物对盐分、干旱及低温胁迫的耐受性增强从而提高植物的抗逆性[35]。而AAS中与AtAL5同源的4个DEGs均下调,可能是ABA含量较低所造成的结果。
综上,本研究通过预测AAS次生生长茎中PKs和TFs的DEGs,结果表明,RLCK-VIII、LRR-RLK-X、TCP、zf-HD、GRF和Alfin-like中的DEGs上、下调表达差异显著且数量均较多,这6个家族可能分别通过调控ABA途径、影响茎木质部发育、降低IAA敏感性、促进茎细胞增殖、增强茎BR信号、降低ABA含量的方式调控光合作用下菠萝蜜茎的次生生长,但具体机制还有待进一步探索。
| [1] |
YIN S G. Functional analysis of LBD21-31 gene in regulating stem secondary growth of Populous[D]. Taian: Shandong Agricultural University, 2020. 殷时光. LBD21-31基因调控杨树茎干次生生长的功能分析[D]. 泰安: 山东农业大学, 2020. doi: 10.27277/d.cnki.gsdnu.2020.000488 . |
| [2] |
DHARMAWARDHANA P, BRUNNER A M, STRAUSS S H. Genome-wide transcriptome analysis of the transition from primary to secondary stem development in Populus trichocarpa[J]. BMC Genom, 2010, 11(1): 150. DOI:10.1186/1471-2164-11-150 |
| [3] |
SEYFFERTH C, WESSELS B, JOKIPII-LUKKARI S, et al. Ethylene- related gene expression networks in wood formation[J]. Front Plant Sci, 2018, 9: 272. DOI:10.3389/fpls.2018.00272 |
| [4] |
ARDITO F, GIULIANI M, PERRONE D, et al. The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy[J]. Int J Mol Med, 2017, 40(2): 271-280. DOI:10.3892/ijmm.2017.3036 |
| [5] |
ZHU W W, MA T Y, ZHANG M J, et al. Research progress of receptor- like protein kinases in plants[J]. Genom Appl Biol, 2018, 37(1): 451-458. 朱巍巍, 马天意, 张梅娟, 等. 类受体蛋白激酶在植物中的研究进展[J]. 基因组学与应用生物学, 2018, 37(1): 451-458. DOI:10.13417/j.gab.037.000451 |
| [6] |
AGUSTI J, LICHTENBERGER R, SCHWARZ M, et al. Characteri- zation of transcriptome remodeling during cambium formation iden- tifies MOL1 and RUL1 as opposing regulators of secondary growth[J]. PLoS Genet, 2011, 7(2): e1001312. DOI:10.1371/journal.pgen.1001312 |
| [7] |
GUO G Y, BAI F, LIU W, et al. Advances in research of the regulation of transcription factors of lignin biosynthesis[J]. Sci Agric Sin, 2015, 48(7): 1277-1287. 郭光艳, 柏峰, 刘伟, 等. 转录因子对木质素生物合成调控的研究进展[J]. 中国农业科学, 2015, 48(7): 1277-1287. DOI:10.3864/j.issn.0578-1752.2015.07.03 |
| [8] |
DU J, MIURA E, ROBISCHON M, et al. The Populus class III HD ZIP transcription factor POPCORONA affects cell differentiation during secondary growth of woody stems[J]. PLoS One, 2011, 6(2): e17458. DOI:10.1371/journal.pone.0017458 |
| [9] |
CHAO Q, GAO Z F, ZHANG D, et al. The developmental dynamics of the Populus stem transcriptome[J]. Plant Biotechnol J, 2019, 17(1): 206-219. DOI:10.1111/pbi.12958 |
| [10] |
FURCHES A, KAINER D, WEIGHILL D, et al. Finding new cell wall regulatory genes in Populus trichocarpa using multiple lines of evidence[J]. Front Plant Sci, 2019, 10: 1249. DOI:10.3389/fpls.2019.01249 |
| [11] |
DONG J N, XIE L Q, CHU W Q, et al. Structural analysis of the stem of the chlorophyll deficient mutant from Artocarpus heterophyllus seedlings[J]. Chin J Trop Crops, 2021, 42(6): 1654-1660. 董俊娜, 谢柳青, 楚文清, 等. 菠萝蜜叶绿素缺失突变体幼苗茎的解剖结构[J]. 热带作物学报, 2021, 42(6): 1654-1660. DOI:10.3969/j.issn.1000-2561.2021.06.021 |
| [12] |
DONG J N, WANG Z X, YU X D, et al. Vascular tissue structure analysis of chlorophyll deficient mutant seedlings from Artocarpus heterophyllus[J]. Chin J Trop Crops, 2021, 42(7): 1948-1956. 董俊娜, 王之欣, 于旭东, 等. 菠萝蜜叶绿素缺失突变体幼苗维管组织结构分析[J]. 热带作物学报, 2021, 42(7): 1948-1956. DOI:10.3969/j.issn.1000-2561.2021.07.018 |
| [13] |
FU Y, YU X D, CAI Z P, et al. Characters of albino mutant of Artocarpus heterophyllus Lam.[J]. Chin J Trop Crops, 2018, 39(6): 1081-1086. 付影, 于旭东, 蔡泽坪, 等. 菠萝蜜白化突变体的性状研究[J]. 热带作物学报, 2018, 39(6): 1081-1086. DOI:10.3969/j.issn.1000-2561.2018.06.007 |
| [14] |
XIE L Q, DONG J N, YU X D, et al. Transcriptome analysis of stem secondary growth in chlorophyll deficient mutant of Artocarpus heterophyllus[J]. Mol Plant Breed, 2020, 18(18): 5958-5969. 谢柳青, 董俊娜, 于旭东, 等. 菠萝蜜叶绿素缺失突变体茎次生生长转录组分析[J]. 分子植物育种, 2020, 18(18): 5958-5969. DOI:10.13271/j.mpb.018.005958 |
| [15] |
PITTERMANN J, COWAN J, KAUFMAN N, et al. The water relations and xylem attributes of albino redwood shoots (Sequioa sempervirens (D. Don.) Endl.)[J]. PLoS One, 2018, 13(3): e0191836. DOI:10.1371/journal.pone.0191836 |
| [16] |
WANG K R. The research on the comprehensive characters of albino tea as germplasm resources[D]. Hangzhou: Zhejiang University, 2006. 王开荣. 白化茶种质资源综合性状研究[D]. 杭州: 浙江大学, 2006. |
| [17] |
WANG G F. Cloning and functional studies of two ROS regulation related RPK genes in rice[D]. Xianyang: Northwest Agricultrual & Forestry University, 2014. 王刚锋. 水稻两个ROS调控相关RPK基因的克隆及其功能研究[D]. 咸阳: 西北农林科技大学, 2014. |
| [18] |
WANG J L, ZHANG Q, YU Q, et al. CARK6 is involved in abscisic acid to regulate stress responses in Arabidopsis thaliana[J]. Biochem Biophys Res Commun, 2019, 513(2): 460-464. DOI:10.1016/j.bbrc.2019.03.180 |
| [19] |
ZHU H P, WANG Y D, YIN H F, et al. Genome-wide identification and characterization of the LRR-RLK gene family in two Vernicia species[J]. Int J Genom, 2015, 2015, 823427. DOI:10.1155/2015/823427 |
| [20] |
COSTA A T, BRAVO J P, KRAUSE-SAKATE R, et al. The receptor- like kinase SlSOBIR1 is differentially modulated by virus infection but its overexpression in tobacco has no significant impact on virus accumulation[J]. Plant Cell Rep, 2016, 35(1): 65-75. DOI:10.1007/s00299-015-1868-8 |
| [21] |
GAO M H, WANG X, WANG D M, et al. Regulation of cell death and innate immunity by two receptor-like kinases in Arabidopsis[J]. Cell Host Microbe, 2009, 6(1): 34-44. DOI:10.1016/j.chom.2009.05.019 |
| [22] |
FUKUDA H. Signals that control plant vascular cell differentiation[J]. Nat Rev Mol Cell Biol, 2004, 5(5): 379-91. DOI:10.1038/nrm1364 |
| [23] |
KWEZI L, MEIER S, MUNGUR L, et al. The Arabidopsis thaliana brassinosteroid receptor (AtBRI1) contains a domain that functions as a guanylyl cyclase in vitro[J]. PLoS One, 2007, 2(5): e449. DOI:10.1371/journal.pone.0000449 |
| [24] |
BAO S, ZHANG Z, LIAN Q, et al. Evolution and expression of genes encoding TCP transcription factors in Solanum tuberosum reveal the involvement of StTCP23 in plant defence[J]. BMC Genet, 2019, 20(1): 91. DOI:10.1186/s12863-019-0793-1 |
| [25] |
LI Z Y, LI B, DONG A W. The Arabidopsis transcription factor AtTCP15 regulates endoreduplication by modulating expression of key cell-cycle genes[J]. Mol Plant, 2012, 5(1): 270-280. DOI:10.1093/mp/ssr086 |
| [26] |
LOPEZ J A, SUN Y, BLAIR P B, et al. TCP three-way handshake: Linking developmental processes with plant immunity[J]. Trends Plant Sci, 2015, 20(4): 238-245. DOI:10.1016/j.tplants.2015.01.005 |
| [27] |
LI S T, ZACHGO S. TCP3 interacts with R2R3-MYB proteins, promotes flavonoid biosynthesis and negatively regulates the auxin response in Arabidopsis thaliana[J]. Plant J, 2013, 76(6): 901-913. DOI:10.1111/tpj.12348 |
| [28] |
LIU M. Identification and preliminary functional analysis of ZF-HD gene family in woodland strawberry[D]. Fuzhou: Fujian Agriculture and Forestry University, 2019. 刘敏. 森林草莓ZF-HD基因家族的鉴定与功能初步分析[D]. 福州: 福建农林大学, 2019.doi: 10.27018/d.cnki.gfjnu.2019.000053 . |
| [29] |
BUESO E, MUÑOZ-BERTOMEU J, CAMPOS F, et al. Arabidopsis thaliana HOMEOBOX25 uncovers a role for gibberellins in seed longevity[J]. Plant Physiol, 2014, 164(2): 999-1010. DOI:10.1104/pp.113.232223 |
| [30] |
KIM J B, KANG J Y, PARK M Y, et al. Arabidopsis zinc finger homeodomain protein ZHD5 promotes shoot regeneration and confers other cytokinin-related phenotypes when overexpressed[J]. Plant Cell Tiss Org Cult, 2019, 137(1): 181-185. DOI:10.1007/s11240-018-01546-7 |
| [31] |
CHEN F, YANG Y, LUO X, et al. Genome-wide identification of GRF transcription factors in soybean and expression analysis of GmGRF family under shade stress[J]. BMC Plant Biol, 2019, 19(1): 269. DOI:10.1186/s12870-019-1861-4 |
| [32] |
ZHAO H X, LI F X, GUO R, et al. Genome-wide characterization and expression analysis of GRF gene family in Capsicum[J]. Acta Hort Sin, 2020, 47(11): 2145-2160. 赵慧霞, 李凤霞, 郭瑞, 等. 辣椒属GRF基因家族全基因组鉴定和表达分析[J]. 园艺学报, 2020, 47(11): 2145-2160. DOI:10.16420/j.issn.0513-353x.2020-0064 |
| [33] |
WANG L Y, TIAN Y C, SHI W, et al. The miR396-GRFs module mediates the prevention of photo-oxidative damage by brassinosteroids during seedling de-etiolation in Arabidopsis[J]. Plant Cell, 2020, 32(8): 2525-2542. DOI:10.1105/tpc.20.00057 |
| [34] |
TAO J J, WEI W, PAN W J, et al. An Alfin-like gene from Atriplex hortensis enhances salt and drought tolerance and abscisic acid response in transgenic Arabidopsis[J]. Sci Rep, 2018, 8(1): 2707. DOI:10.1038/s41598-018-21148-9 |
| [35] |
WEI W, ZHANG Y Q, TAO J J, et al. The Alfin-like homeodomain finger protein AL5 suppresses multiple negative factors to confer abiotic stress tolerance in Arabidopsis[J]. Plant J, 2015, 81(6): 871-883. DOI:10.1111/tpj.12773 |
 2023, Vol. 31
2023, Vol. 31



