1882年,Müller Arg.综合运用显微技术与化学分析方法,基于孢子褐色且细胞横向排列的特征, 以Phaeographis dendritica (Ach.) Müll. Arg.作为模式种建立黑文衣属(Phaeographis Müll. Arg.)。Staiger结合分子生物学方法,对Müller Arg.的分类系统进行修正,承认并重新定义黑文衣属[1]。
该属为泛热带分布,隶属于真菌界(Fungi)子囊菌门(Ascomycota)茶渍纲(Lecanoromycetes)厚顶盘亚纲(Ostropomycetidae)厚顶盘目(Ostropales)文字衣科(Graphidaceae)[2]。该属主要特征为地衣体壳状,表面蜡质或粗糙;子囊盘伸长为线状,弯曲或具有分支,少数聚生为类似子座结构;盘唇张开, 大多覆有白色粉霜;盘被不炭化至轻微炭化;子囊含8个孢子;子囊孢子褐色,横隔凸透镜型或砖壁型;共生藻为橘色藻属(Trentepohlia sp.)[3–4]。
目前世界范围内报道黑文衣属约230种,中国仅报道25种[5–10]。因此,有必要对我国黑文衣属类群进行进一步研究,为我国地衣型真菌物种资源开发及利用提供基础资料。
1 材料和方法 1.1 材料本研究标本采自福建、云南,现馆藏于聊城大学生命科学学院地衣标本室(LCUF)。
1.2 表型分析使用体视显微镜OLYMPUS SZX16观察地衣体外部形态特征,光学显微镜OLYMPUS BX53观察解剖特征。通过滴加10% KOH溶液、NaClO饱和水溶液、P溶液(将对苯二胺溶于无水乙醇,配成5%乙醇溶液)、碘液观察颜色反应,薄层层析法(TLC)对地衣化学物质进行鉴定[11–12]。
1.3 基因型分析DNA提取、PCR扩增、测序 使用Sigma-Aldrich REDExtract-N-AmpTM植物PCR试剂盒从子囊盘中提取基因组DNA,并采用引物mtSSU1与mtSSU3R对线粒体小亚基片段进行扩增[13]。PCR体系总体积为50 μL:2×Taq PCR master mix 25 μL,ddH2O 19 μL,引物各2 μL,基因组DNA 2 μL;扩增程序为:95 ℃预变性5 min;然后94 ℃变性45 s,50 ℃退火1 min,72 ℃延伸90 s,共35个循环; 最后72 ℃延伸10 min。PCR完成后,用1%琼脂糖凝胶电泳检测目的产物,并由铂尚生物技术(上海)有限公司测序。序列信息见表 1。
| 表 1 系统发育分析所用标本信息和GenBank登录号 Table 1 Specimen information and GenBank accession numbers for phylogenetic analysis |
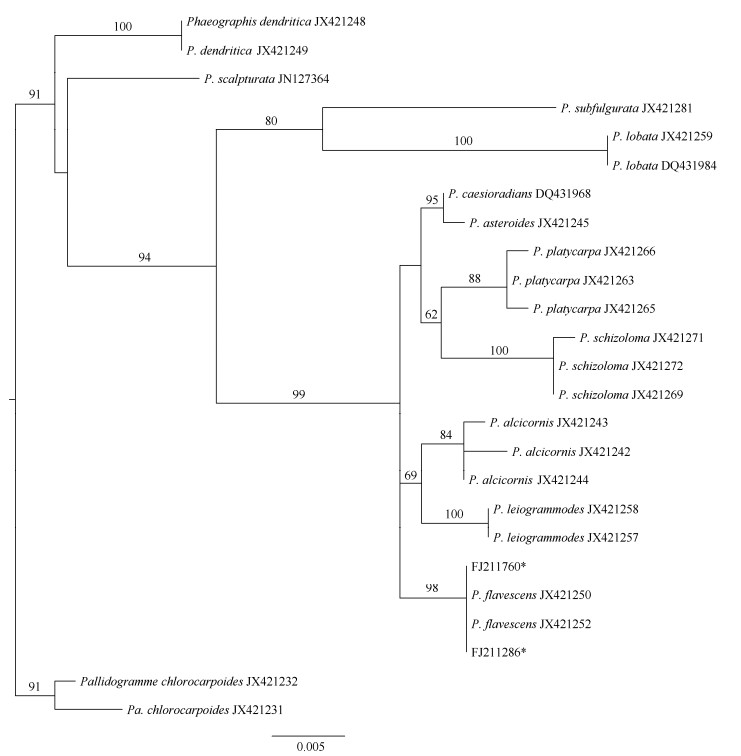
构建系统发育树 通过SeqMan对原始序列进行拼接处理,选择与黑文衣属亲缘关系较近的灰线衣属Pallidogramme为外类群,在NCBI网站上下载所需的23条相关序列。将上述序列在BioEdit v. 7.0.5中利用最大似然法(Maximum-likelihood, ML)进行多序列比对及优化[14–15],在Cipres Science Gateway (http://www.phylo.org)使用RAxML-HPC BlackBox v. 8.2.12构建系统发育树[16–17],对各节点进行1 000次重复以评价自展支持值,获得的系统发育树文件在FigTree v. 1.4.2中查看和编辑(图 1)。
|
图 1 基于SSU序列构建的黑文衣属系统发育树 Fig. 1 Phylogenetic tree of Phaeographis based on SSU sequences |
变黄黑文衣 图 2

|
图 2 Phaeographis flavescens (L.W. Chen FJ211760)。A: 地衣体和子囊器; B: 子囊盘横切面; C: 子囊; D: 子囊孢子。标尺: A=1.0 mm; B=200 μm; C=20 μm; D=20 μm Fig. 2 Phaeographis flavescens (L.W. Chen FJ211760). A: Thallus with ascomata; B: Cross section of apothecium; C: Ascus; D: Ascospores. Bars: A=1.0 mm; B=200 μm; C=20 μm; D=20 μm |
Phaeographis flavescens Dal-Forno & Eliasaro, Mycotaxon 112: 16(2010)
Type: Brazil, Paraná: Pontal do Paraná. Pontal do Sul, 28. II. 2008, M. Dal-Forno 433 (Holotype UPCB).
地衣体壳状,树皮生,表面浅黄绿色,无光泽,光滑。
子囊盘弯曲,多分支,长0.5~1 mm,宽0.4~ 0.5 mm,聚生于假子座中,假子座圆形至不规则卵圆形;盘缘黑色,相邻线盘之间有小缝隙;盘唇不明显,张开;盘面较宽,平坦,黑褐色,覆有白色粉霜;盘被未炭化,褐色,厚8~18 μm;囊层被黑色,厚15~20 μm;子囊层无色,清晰状,厚80~90 μm; 囊层基黄色,厚30~38 μm;侧丝具有横隔,顶端分支,宽1.0~1.5 μm;子囊棒状,含8个子囊孢子; 子囊孢子褐色,卵圆形,横隔透镜型,(4~)6胞室, 大小19~25.5 μm×6~7 μm,I+紫红色。
化学反应:K+浅黄色,C–,KC+浅黄色,P–;含有斑点酸(TLC)。
基物:树皮。
研究标本:云南:西双版纳,勐海县,哈尼文化园,海拔1 190 m,2015年12月14日,贾泽峰YN15061 (LCUF)。福建:武夷山,桐木村,三港,海拔720 m,2021年10月22日,贾泽峰FJ211286 (LCUF);武夷山国家公园科技楼附近,海拔700 m,2021年10月24日,贾泽峰FJ211741 (LCUF),陈乐雯,FJ211759、FJ211760、FJ211761、FJ211763、FJ211764、FJ211765、FJ211766 (LCUF)。
世界分布:巴西[18];中国福建、云南。
讨论:根据分子数据分析,该种与Phaeographis属其他物种明显分开,且与P. flavescens聚为一独立分支,支持值高达98%,综合以上特征鉴定为P. flavescens。本研究标本与模式标本(Brazil)特征基本一致,但假子座颜色相对更浅,呈白色;另外,本研究只检测出斑点酸,而模式标本描述中还含有其他微量未知酸。其分类特征类似于P. neotricosa Redinger.,后者子囊盘灰白色,弯曲,不规则分支,聚集为星状,孢子4~6室,但地衣化学物质不同, 含有新三锥酸[19]。该种形态学特征与Sarcographa intricans (Nyl.) Müll. Arg.相似,不同之处在于后者子囊盘呈放射状或大量不规则分支,线盘较细长, 盘面在发育后期常发生汇合,从而形成较宽的中部区域;I+红褐色,含降斑点酸[20–21]。该种与S. cuyabensis Redinger.也较相似,不同之处在于后者子囊孢子较小,(12~)15~18 μm[22]。
| [1] |
STAIGER B, KALB K, GRUBE M. Phylogeny and phenotypic variation in the lichen family Graphidaceae (Ostropomycetidae, Ascomycota)[J]. Mycol Res, 2006, 110(7): 765-772. DOI:10.1016/j.mycres.2006.05.003 |
| [2] |
WIJAYAWARDENE N N, HYDE K D, RAJESHKUMAR K C, et al. Notes for genera: Ascomycota[J]. Fung Diver, 2017, 86: 1-594. DOI:10.1007/s13225-017-0386-0 |
| [3] |
STAIGER B. Die flechten familie Graphidaceae studien in richtungeiner natürlicheren gliederung[J]. Bibliotheca Lichenol, 2002, 85: 1-526. |
| [4] |
LÜCKING R. Foliicolous Lichenized Fungi: Flora Neotropica Monograph 103 [M]. New York: The New York Botanical Garden Press, 2008: 1–867.
|
| [5] |
WANG X H, SHI G B, JIA Z F. Phaeographis fujianensis, a new species of lichen[J]. Mycosystema, 2013, 32(1): 128-130. 王晓华, 师广波, 贾泽峰. 黑文衣属地衣一新种——福建黑文衣[J]. 菌物学报, 2013, 32(1): 128-130. DOI:10.13346/j.mycosystema.2013.01.016 |
| [6] |
LI J, MIAO X L, JIA Z F. Additional materials for the genus Phaeographis from China[J]. J Fungal Res, 2014, 12(2): 79-82. DOI:10.13341/j.jfr.2014.2008 |
| [7] |
JIA Z F, WEI J C. Flora lichenum Sinicorum, Vol. 13 Ostropales (I) Graphidaceae (1)[M]. Beijing: Science Press, 2016: 1-210. 贾泽峰, 魏江春. 中国地衣志, 第13卷厚顶盘目(I) 文字衣科(1)[M]. 北京: 科学出版社, 2016: 1-210. |
| [8] |
JIA Z F, LÜCKING R. Resolving the genus Phaeographina Müll. Arg. in China[J]. MycoKeys, 2017, 21: 13-32. DOI:10.3897/mycokeys.21.11986 |
| [9] |
JIA Z F, LÜCKING R. Resolving the species of the lichen genus Graphina Müll. Arg. in China, with some new combinations[J]. MycoKeys, 2017, 25: 13-29. DOI:10.3897/mycokeys.25.13154 |
| [10] |
WEI J C. An enumeration of lichens in China[M]. Beijing: China Forestry Publishing House, 2020: 1-606.
|
| [11] |
CULBERSON C F. Improved conditions and new data for identification of lichen products by standardized thin-layer chromatographic method[J]. J Chromatogr A, 1972, 72(1): 113-125. DOI:10.1016/0021-9673(72)80013-X |
| [12] |
ORANGE A, JAMES P W, WHITE F J. Microchemical methods for the identification of lichens[J]. British Lichen Soc, London, 2001, 1-101. |
| [13] |
ZOLLER S, SCHEIDEGGER C, SPERISEN C. PCR primers for the amplification of mitochondrial small subunit ribosomal DNA of lichenforming ascomycetes[J]. Lichenologist, 1999, 31(5): 511-516. DOI:10.1006/lich.1999.0220 |
| [14] |
THOMPSON J D, HIGGINS D G, GIBSON T J. CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position specific gap penalties and weight matrix choice[J]. Nucl Acid Res, 1994, 22(22): 1673-1680. DOI:10.1093/nar/22.22.4673 |
| [15] |
HALL T A. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucl Acid Sym, 1999, 41(2): 95-98. DOI:10.1021/bk-1999-0734.ch008 |
| [16] |
MILLER M A, PFEIFFER W, SCHWARTZ T. Creating the CIPRES Science Gateway for inference of large phylogenetic trees [C]// Proceedings of the Gateway Computing Environments Workshop (GCE), LA: New Orleans, 2010: 1–8.
|
| [17] |
STAMATAKIS A. RAxML version 8: A tool for phylogenetic analysis and post-analysis of large phylogenies[J]. Bioinformatics, 2014, 30(9): 1312-1313. DOI:10.1093/bioinformatics/btu033 |
| [18] |
DAL-FORNO M, ELIASARO S. Two new species of Graphidaceae (lichenized Ascomycota) from Brazil[J]. Mycotaxon, 2010, 112(1): 15-20. DOI:10.5248/112.15 |
| [19] |
REDINGER K. Die Graphidineen der ersten Regnell'schen Expedition nach Brasilien 1892–94. Ⅲ. Graphis und Phaeographis, nebst einem Nachtrage Zu Graphina[J]. Ark. Bot, 1935, 27A(3): 1-103. |
| [20] |
BUNGARTZ F, LÜCKING R, APTROOT A. The family Graphidaceae (Ostropales, Lecanoromycetes) in the Galapagos Islands[J]. Nova Hedwig, 2010, 90(1/2): 1-44. DOI:10.1127/0029-5035/2010/0090-0001 |
| [21] |
ARCHER A W. The lichen genera Cyclographina, Diplogramma, Glyphis, Gymnographa, Medusulina, Sarcographa and Sarcographina (Graphidaceae) in Australia[J]. Telopea, 2004, 10(2): 589-605. |
| [22] |
REDINGER K. Die Graphidineen der ersten Regnell'schen Expedition nach Brasilien 1892–94. I. Glyphis, Medusulina und Sarcographa[J]. Ark Bot, 1933, 25A(13): 1-20. |
 2023, Vol. 31
2023, Vol. 31



