2. 中国林业科学研究院热带林业研究所, 广州 510520
2. Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China
木麻黄(Casuarinas equisetifolia)是热带和亚热带沿海地区海岸防护林和农田防护林建设的主要树种,也是困难立地植被恢复的重要先锋树种,具有重要的生态、社会和经济效益[1]。在我国华南沿海地区,木麻黄在防风固沙和植被恢复等方面发挥着不可替代的作用,庇护着沿岸人民的生命和财产安全[2]。然而,木麻黄青枯病对我国海岸防护林的生态安全构成了重大威胁,导致沿海木麻黄防护林出现许多“断带”和“林窗”,甚至大面积死亡。青枯病由土壤传播的细菌性病原菌青枯雷氏菌(Ralstonia solanacearum)引起的,传播快、死亡率高,是世界范围内最难防治的重大病害之一[3]。自木麻黄青枯病被发现以来,在青枯菌分离[4]、致病机理[5]和抗病机制[6]等方面做了一些相关研究,且大都以木麻黄无性系为研究材料。在家系层次选育能扩大抗病性的遗传基础,仅有部分研究依据木麻黄的保存率和枯萎情况进行家系初步选育[4],而在抗病选育的基础问题上如抗病遗传变异规律的揭示、家系抗病育种机理等方面未见系统性研究报道。
选育抗病品种是解决木麻黄青枯病的主要途径之一,而丰富的木麻黄基因资源能为选育抗病新品种提供广阔的遗传基础。选择合适的抗病性指标是植物抗病选育能否成功的关键。受到病原菌侵袭后,植物的生理和生化性状会立即产生应激响应, 通过改变防御物质合成量来抵御病原菌的入侵或繁殖,其中防御酶系统变化是病原菌作用于寄主植物后的明显反应之一[7]。因此研究植物体内的防御酶变化规律是评价植物抗病性的重要因子。另外, 研究表明植物的次生代谢物质与抗病性密切相关, 在受到病原菌侵袭后次生代谢物会迅速合成以减轻病原菌造成的危害[8]。木麻黄感染青枯病后,总酚和类黄酮等次生代谢物质能大量合成并直接发挥免疫作用,降低体内的活性氧(ROS)浓度以保护植物细胞免受伤害[9]。因此,有必要深入探讨次生代谢物质及其合成关键酶在不同遗传材料之间的差异特征,为抗性种质材料的筛选提供理论支持。
本课题组在大量引种的基础上已经开展了木麻黄种源层次的研究,初步选出了一些抗病种源。本研究以短枝木麻黄26个家系为材料,以小枝中超氧化物歧化酶、过氧化氢酶、苯丙氨酸解氨酶、多酚氧化物酶活性,以及总酚、类黄酮含量为评价性状,探讨木麻黄响应青枯病的家系遗传变异规律,旨在筛选和挖掘优良木麻黄抗青枯病家系,为木麻黄抗病育种材料的选育和推广提供科学依据。
1 材料和方法 1.1 试验地概况试验地位于广东省徐闻县湛江国营防护林场, 位于20°28′20″ N,110°31′41″ E,属于热带海洋性季风气候。全年阳光充足,年均温23.3 ℃,年均降水量1 364 mm,全年无霜冻。土壤为滨海沙土,土壤肥力低。前茬为木麻黄无性系林,青枯病爆发后砍伐清理。
1.2 材料来源短枝木麻黄(Casuarina equisetifolia)种源家系试验林营建于2015年5月,试验设计采用完全随机区组设计,6次重复,5株小区。因一些重复中部分小区缺失,只利用了其中4个重复的家系材料进行试验。参试家系分别来自于福建厦门(家系号219、220、221、222、223、224、226、227、228)、广东电白(家系号192、194、195、198、201、202、203)和海南岛东(家系号205、206、207、208、210、211、213、214、216、218)。
1.3 青枯病菌液的制备参考许秀玉等[4]方法,野外收集并经过致病力测试后,挑选致病力强的菌株在TTC培养基(2,2,3-三苯基四唑氯琼脂培养基)上活化培养48 h后,挑选单菌落接种到CPG液体培养基(蛋白胨10 g/L, 水解酪蛋白1 g/L,葡萄糖5 g/L)中,30 ℃下摇床培养28~36 h。培养液于2 795×g离心15 min,将青枯菌滤液稀释成3×108 cfu/mL(平板计数法)的悬浮液用于人工接种试验。
1.4 取样和处理方法于2020年6月对参试家系进行取样,每植株选择2枝长约40 cm的1 a生褐梗小枝,一枝插到青枯菌悬液中进行接种培养[4],另一枝插到清水中作为对照。每家系采集40枝(2×5×4)褐梗小枝,26个家系共采集1 040条。待褐梗小枝开始出现萎蔫现象时,分别从处理和对照的绿色小枝(木麻黄的叶已退化为小齿状,依靠绿色小枝进行光合作用)上截取2 cm嫩枝,–80 ℃保存用于后续的生理生化响应测定。待处理的褐梗小枝的萎蔫程度表现明显差异时(约25 d,根据预实验判断,部分无性系小枝已枯萎死亡,部分无性系小枝可保持健康生长),根据短枝木麻黄枝条的萎蔫数量,计算植株的相对病害强度,并做病情指数分析[10]。
1.5 性状测定和数据处理木麻黄褐梗小枝接种青枯病菌后的病情指数分级标准为:0级为完全无萎蔫;1级为 < 20%幼苗出现萎蔫;2级为20%~40%幼苗出现萎蔫;3级为40%~60%幼苗出现萎蔫;4级为 > 60%幼苗出现萎蔫;5级为完全萎蔫或死亡。相对病害强度(RDI)=萎蔫分枝数/分枝总数;病情指数(DI)=∑(各级萎蔫株数×该萎蔫级值)/(调查总株数×最高级值)×100。
按陈建勋等[11]的方法提取和测定样品的生理生化指标,包括超氧化物歧化酶(superoxide dismutase, SOD, U/g)、过氧化氢酶(catalase, CAT, U/g)、苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL, U/g)和多酚氧化酶(polyphenol oxidase, PPO, U/g)的活性。按王翠颖等[12–13]的方法提取和测定总酚(total phenolics, TP, mg/100 g FW)和类黄酮(flavonoid, Flav, mg/100 g FW)的含量。重复测定3次,取平均值。
性状间的相关系数为:
利用SPSS和Excel软件对试验数据进行处理和统计分析。方差分析模型:Yij=Bi+Fj+BFij+Eij, 式中, Yij为方差分析模型,Bi为区组效应,Fj为家系效应,BFij为区组与家系的交互效应值,Eij为误差项效应。
将6个性状的均值进行标准化处理,采用指数选择函数对参试的木麻黄家系进行综合评价, I=
接种青枯菌后,各家系表现出不同的染病特征(图 1, 2)。部分家系(如206、218号等)有大量小枝枯萎变黄,甚至出现整株死亡现象,而部分家系(如207、208号等)植株无明显变化,整体正常生长, 绝大多数小枝呈绿色,偶见小枝萎蔫但未变黄。26个短枝木麻黄家系小枝接种青枯病后, 病情指数和相对病害强度在家系间均存在极显著差异(P < 0.01), 家系间平均病情指数为8.84~58.24,平均相对病害强度为0.2456~0.7787。
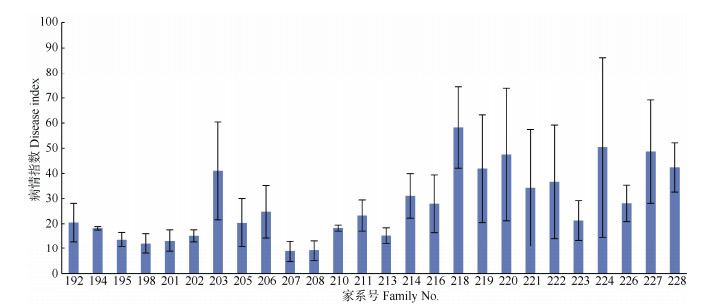
|
图 1 家系的病情指数 Fig. 1 Disease index of families |

|
图 2 家系的相对病害强度 Fig. 2 Relative disease intensity of families |
26个短枝木麻黄家系的SOD、CAT、PAL、PPO活性分别为327.84、16.93、179.89和19.83 U/g, TP和Flav含量分别为966.11和108.55 mg/100 g FW, 其变异系数分别为22.33%、33.73%、50.39%、33.48%、52.05%和42.96% (表 1)。方差分析表明, PAL和PPO活性在家系间的差异达极显著水平, SOD和CAT活性、TP和Flav含量在家系间的差异均达显著水平, 说明参试家系受到青枯病菌侵染后的生理生化响应强度呈显著差异,具有较大的选择潜力。
| 表 1 木麻黄生理生化性状的方差分析 Table 1 Variation analysis of physiological and biochemical traits of Casuarina equisetifolia |
短枝木麻黄26个家系的生理生化性状间的相关分析表明(表 2),SOD与CAT、TP、Flav间呈显著正相关,相关系数为0.604 7~0.671 6。CAT与PAL存在显著的正相关关系。PAL、PPO、TP、Flav性状间呈显著或极显著正相关关系,相关系数为0.574 7~ 0.884 9。这表明木麻黄感染青枯病后,过氧化氢酶、合成防御物质的关键酶和次生代谢物质含量均相应增加,协同响应病原菌的侵袭。
| 表 2 生理生化性状间及其与病情特征相关性分析 Table 2 Correlation analysis between physiological and biochemical traits and disease characteristics |
从表 2可见,木麻黄家系褐梗小枝接种青枯病菌后,家系相对病害强度和病情指数与6个生理生化性状均呈显著或极显著的负相关关系,相关系数为–0.810 7~ –0.559 0, 其中相对病害强度和病情指数分别与TP和Flav呈极显著的负相关关系。这说明短枝木麻黄在青枯病原菌感染后或抵御其侵入过程中体内产生的防御酶或次生代谢物质越多,该家系的相对病害强度或病情指数越低,对青枯病的抗性越强。因此,对短枝木麻黄开展抗青枯病选育,可以将上述6个生理生化响应参数作为抗病性选育的重要指标,再结合其他性状进行联合选择,可取得较好的选择效果。
2.4 抗病家系选择将数据标准化后进行综合评价并排序(表 3),若按照30%的入选率可选出8个抗青枯病家系(201、206、198、207、202、213、208和195号)。这8个入选抗病家系相对病害强度和病情指数比总体均值分别低25.94%和28.93%;SOD、CAT、PAL、PPO、TP和Flav比总体均值分别高11.90%、13.50%、24.77%、12.71%、25.68%和18.76%。
| 表 3 优良家系的筛选及性状表现 Table 3 Selection of superior families and their traits |
短枝木麻黄不同家系接种青枯病菌后的生长状况呈现显著差别,说明它们对青枯病的抗性差异较大,开展抗病选育具有较大的选择潜力。在开展选育工作时,抗病性指标的选择是不可忽视的。本研究以病情特征、防御酶系统、次生代谢物质及其合成关键酶为基础,分析了不同家系在受到侵袭后的差异性特征,在此基础上进行了抗病家系筛选, 为木麻黄响应青枯病的抗性机制提供了理论依据。
受到病原菌侵袭后,植物体内ROS物质快速积累,这些物质的大量产生会造成植物过氧化伤害。研究表明木麻黄青枯病在干旱年份的病情发展较快,病情最严重的地方是干旱的沙丘地和保水力差的粗砂地[14],在干旱胁迫下,木麻黄膜质过氧化严重而造成不可逆的细胞损伤,同时青枯菌在植株体内迅速增殖并由根侵入导管分子,形成侵填体堵塞导管[15],使植株无法有效运输水分而枯萎死亡。SOD和CAT等防御酶能够起到清除活性氧物质的作用,可有效降低病原菌引起的细胞过氧化伤害。有研究表明桉树可以通过大量表达SOD来提高抗病性,樟树为了增强抗逆性会积累CAT[16]。本研究中,筛选出的优良抗病家系的SOD和CAT活性显著高于参试家系的均值,这表明抗病短枝木麻黄家系受到青枯菌侵袭后,能显著提高SOD和CAT活性来清除积累的活性氧物质,以减轻病原菌对植株的伤害,这与朱金方等[17]的研究结果一致。
PPO和PAL是植物次生代谢途径的关键酶,与植物抗病性密切相关,参与调控酚类物质、类黄酮、木质素等抗菌物质的合成[18],其活性变化可以作为衡量植物抗病性的重要生理生化特征。美洲黑杨(Populus deltoides)的抗病无性系接种病原菌后, PAL和PPO活性大幅升高,且酶活性绝对值明显高于抗病性弱的品系[19]。青杨(P. cathayana)受到病原菌侵袭后,能通过提高根茎叶PPO活性降低溃疡病的发病率,也可通过提高PAL酶活性增强次生代谢物质的合成,进而提高杨树抗病性[20]。本研究所选抗病家系的PPO和PAL活性较高,能有效抑制青枯菌的入侵和繁殖,减轻病原菌对木麻黄的伤害。
总酚包括许多类物质,在植物抗病方面发挥着重要的作用,类黄酮也与植物抗病密切相关。植物体内的生物碱、蒽酮、黄酮和皂苷等物质能显著抑制真菌的菌丝生长和孢子萌发,为评价植物抗病强弱的关键指标[21]。研究表明总酚和类黄酮物质合成量的提高能使转基因杨树对黑斑病的抗性明显增强[22],本研究也获得类似的结果。本研究中26个木麻黄家系受青枯病侵染后,它们体内总酚和类黄酮含量差异显著或极显著,相关性分析表明次生代谢物质含量高的家系对青枯病的抗性显著提高,植株受到病原菌侵袭后依然正常生长,因此这2种次生代谢物可以作为短枝木麻黄抗青枯病选育的重要指标。
短枝木麻黄不同家系接种青枯病病原菌后病情特征和生理生化响应指标存在着显著差异,说明它们对青枯病的抗性差异较大,具有较大的选择潜力。基于生理生化响应指标的综合评价,筛选出了8个优良家系,这些家系的6个生理生化响应指标显著高于群体均值,且在褐梗枝条接种青枯病菌试验中表现的病害程度低,萎蔫枝条少,生长基本不受影响。后续可以结合生长速度、干形等性状进行综合选择,从这8个家系中选择出优良单株进行无性繁殖形成无性系, 进一步在青枯病发病区开展田间抗病性测定和验证试验,最终获得抗病无性系在生产中广泛使用。
| [1] |
ZHANG Y, ZHONG C L, HAN Q, et al. Reproductive biology and breeding system in Casuarina equisetifolia (Casuarinaceae): Implication for genetic improvement[J]. Aust J Bot, 2016, 64(2): 120-128. DOI:10.1071/BT15184 |
| [2] |
ZHONG C L, MANSOUR S, NAMBIAR-VEETIL M, et al. Casuarina glauca: A model tree for basic research in actinorhizal symbiosis[J]. J Biosci, 2013, 38(4): 815-823. DOI:10.1007/s12038-013-9370-3 |
| [3] |
SHE X M, YU L, LAN G B, et al. Identification and genetic characterization of Ralstonia solanacearum species complex isolates from Cucurbita maxima in China[J]. Front Plant Sci, 2017, 8: 1794. DOI:10.3389/fpls.2017.01794 |
| [4] |
XU X Y, ZHANG W Q, HUANG Y H, et al. Comparison of identification methods of bacterial wilt resistance in Casuarinaceae and screening of resistant germplasm resources[J]. J S China Agric Univ, 2017, 38(4): 87-94. 许秀玉, 张卫强, 黄钰辉, 等. 木麻黄青枯病抗性鉴定方法比较及抗病种质筛选[J]. 华南农业大学学报, 2017, 38(4): 87-94. DOI:10.7671/j.issn.1001-411X.2017.04.015 |
| [5] |
IMAZAKI I. Studies on the mechanisms of pathogenicity in soil-borne plant pathogens[J]. J Gen Plant Pathol, 2015, 81(6): 478-479. DOI:10.1007/s10327-015-0610-2 |
| [6] |
SELVAKESAVAN R K, DHANYA N N, THUSHARA P, et al. Intraspecies variation in sodium partitioning, potassium and proline accumulation under salt stress in Casuarina equisetifolia Forst[J]. Symbiosis, 2016, 70(1/2/3): 117-127. DOI:10.1007/s13199-016-0424-9 |
| [7] |
FU R T, WANG J, CHEN C, et al. Effects of mycotoxins of Ustilaginoidea virens on physiological-biochemical characteristics of different resistant rice varieties[J]. Chin J Ecol, 2021, 40(9): 2793-2801. 伏荣桃, 王剑, 陈诚, 等. 稻曲病菌毒素对不同抗病水稻品种生理生化特性的影响[J]. 生态学杂志, 2021, 40(9): 2793-2801. DOI:10.13292/j.1000-4890.202109.021 |
| [8] |
HASSANEIN R A, HASHEM H A, FAHMY A H, et al. Protection against fusarium head blight: Important defense mechanisms studied in three regenerated Egyptian wheat cultivars[J]. J Stress Physiol Biochem, 2016, 12(3): 18-43. |
| [9] |
WEI Y C, ZHANG Y, ZHONG C L, et al. Changes in phenols contents in Casuarina equisetifolia provenances with different resistibility infected by Ralstonia solanacearum[J]. J Trop Subtrop Bot, 2019, 27(3): 309-314. 魏永成, 张勇, 仲崇禄, 等. 不同抗性短枝木麻黄种源苗木接种青枯病菌后酚类物质含量的变化[J]. 热带亚热带植物学报, 2019, 27(3): 309-314. DOI:10.11926/jtsb.3983 |
| [10] |
GUO Q, LIANG Z C. Resistance strains selecting and control measures of Casuarina equisetifolia against bacterial wilt[J]. For Sci Technol, 1986(4): 7-9. 郭权, 梁子超. 木麻黄抗青枯病品系的筛选技术和综合防治措施[J]. 林业科技通讯, 1986(4): 7-9. DOI:10.13456/j.cnki.lykt.1986.04.004 |
| [11] |
CHEN J X, WANG X F. Experimental Guidance of Plant Physiology[M]. Guangzhou: South China University of Technology Press, 2002: 15-24. 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002: 15-24. |
| [12] |
WANG C Y, SUN S, WANG J. Relationship between tannin content from Casuarina equisetifolia and their resistance to Ralstonia solanacearum[J]. Shandong Chem Ind, 2015, 44(3): 77. 王翠颖, 孙思, 王军. 木麻黄抗感青枯病品系单宁含量差异[J]. 山东化工, 2015, 44(3): 77. DOI:10.3969/j.issn.1008-021X.2015.03.024 |
| [13] |
WANG C Y, SUN S, ZHOU E X, et al. Purification of total flavonoids from Casuarina equisetifolia by macroporous adsorption resin & inhibition of total flavonoids on Ralstonia solanacearum[J]. Prot For Sci Technol, 2012(1): 11-14. 王翠颖, 孙思, 周而勋, 等. 大孔吸附树脂纯化木麻黄总黄酮及对青枯菌的抑制[J]. 防护林科技, 2012(1): 11-14. DOI:10.3969/j.issn.1005-5215.2012.01.005 |
| [14] |
SUN Z, ZHANG Y, MA H B. Causes and prevention strategies on the outbreak of Casuarina equisetifolia bacterial wilt in western Guangdong Province[J]. J Temp For Res, 2020, 3(3): 6-10. 孙战, 张勇, 马海宾. 粤西木麻黄青枯病成灾原因及防治策略[J]. 温带林业研究, 2020, 3(3): 6-10. DOI:10.3969/j.issn.2096-4900.2020.03.002 |
| [15] |
VASSE J, FREY P, TRIGALET A. Microscopic studies of intercellular infection and protoxylem invasion of tomato roots by Pseudomonas solanacearum[J]. Mol Plant-Microbe Interact, 1995, 8(2): 241-251. DOI:10.1094/MPMI-8-0241 |
| [16] |
ZHANG H N, LU X H, JIN Z N, et al. Effects of drought on physiological characteristics of seedlings of four species grown on rare earth mill tailings at high temperatures[J]. Acta Ecol Sin, 2019, 39(7): 2426-2434. 张海娜, 鲁向晖, 金志农, 等. 高温条件下稀土尾砂干旱对4种植物生理特性的影响[J]. 生态学报, 2019, 39(7): 2426-2434. DOI:10.5846/stxb201804180882 |
| [17] |
ZHU J F, LIU J T, LU Z H, et al. Effects of salt stress on physiological characteristics of Tamarix chinensis Lour. seedlings[J]. Acta Ecol Sin, 2015, 35(15): 5140-5146. 朱金方, 刘京涛, 陆兆华, 等. 盐胁迫对中国柽柳幼苗生理特性的影响[J]. 生态学报, 2015, 35(15): 5140-5146. DOI:10.5846/stxb201312182981 |
| [18] |
DING L N, YANG G X. Research advances in the mechanism and signal transduction of plant disease resistance[J]. Biotechnol Bull, 2016, 32(10): 109-117. 丁丽娜, 杨国兴. 植物抗病机制及信号转导的研究进展[J]. 生物技术通报, 2016, 32(10): 109-117. DOI:10.13560/j.cnki.biotech.bull.1985.2016.10.013 |
| [19] |
LIU L L, CHEN Z J, CAO Z M, et al. The resistant mechanism of poplar varieties to Melamposora larici-populina[J]. J NW For Univ, 2020, 35(1): 171-176. 刘莉丽, 陈祖静, 曹支敏, 等. 杨树对落叶松-杨栅锈菌抗性生理机制研究[J]. 西北林学院学报, 2020, 35(1): 171-176. DOI:10.3969/j.issn.1001-7461.2020.01.26 |
| [20] |
ZHANG Y. Effects of arbuscular mycorrhizal fungi inoculation on resistance of Populus cathayana to canker disease[D]. Yangling: Northwest Agricultral & Forest University, 2021. 张钰. 接种丛枝菌根真菌对青杨抗溃疡病的影响[D]. 杨凌: 西北农林科技大学, 2021. doi: 10.27409/d.cnki.gxbnu.2021.001530. |
| [21] |
KWODAGA J K, SOWLEY E N K, BADⅡ B K. Antifungal activity of plant extracts against Colletotrichum gloeosporioides (Penz.) the causative agent of yam anthracnose disease[J]. Arch Phytopathol Plant Prot, 2019, 52(1/2): 218-233. DOI:10.1080/03235408.2019.1604303 |
| [22] |
JIA Z C. Collaborative mechanism of genes and endogenous genes LAR3 resistance in Populus[D]. Chongqing: Southwest University, 2011. 贾之春. 外源抗病基因和单宁代谢合成关键酶基因LAR3在毛白杨中协同抗病机理研究[D]. 重庆: 西南大学, 2011. |
 2023, Vol. 31
2023, Vol. 31



