2. 福建省农业科学院农业生态研究所, 福州 350003
2. Agriculture Ecology Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China
柠檬香茅(Cymbopogon citratus)又称柠檬草、香茅草及香茅等,为禾本科(Gramineae)香茅属多年生密丛型具香味草本[1]。广泛分布于热带及南亚热带等地[2],中国福建、广东、广西、云南等地有栽培。柠檬香茅具有浓郁的柠檬香气,可提取香茅精油[3–5]。香茅精油主要成分为挥发性萜类(单萜)物质[6–7],具有杀菌消炎,平喘止咳,舒筋活络,抒解抑郁及提振心情等功效[8–10]。萜类也叫萜烯类或类异戊二烯类化合物,为自然界中种类极为丰富的次生代谢产物,数量多达55 000多种[11–12]。萜类在植物初生和次生代谢中均起重要调节作用,都是从五碳原子(C5)的异戊二烯单元IPP (异戊烯二磷酸)及其异构体DMAPP (二甲基烯丙基二磷酸)合成而来, 再形成C10单萜、C15倍半萜、C20二萜、C30三萜及C40类胡萝卜素等化合物[13–14]。萜类化合物有来源于细胞质中的法尼基焦磷酸的甲羟戊酸途径(MVA途径)和质体中牻牛儿焦磷酸的甲基赤藓醇磷酸途径(MEP途径) 2种, 其中单萜、二萜和类胡萝卜素来源于MEP途径, 倍半萜和三萜来源于MVA途径[15–16]。萜类化合物种类繁多,其生物合成所涉及相关酶基因也多种多样[17–19]。
香茅为喜阳植物,光照充分环境下生长更为旺盛,阴凉条件下其生物产量明显降低,但目前并未见遮阴环境下香茅萜类成分及其含量差异研究。有大量关于香茅精油(挥发性单萜)提取及其成分测定等研究报道[20–22],然而香茅种类繁多, 不同种类香茅所含挥发性单萜成分差异明显[23–24]。即使同一种类香茅由于不同提取方式或检测手段不同,导致其所含挥发性单萜具体成分及含量存在差异[25–27]。此外,还未见香茅萜类形成相关合成酶基因的研究报道。本试验以大田自然生长柠檬香茅为研究对象, 以同环境生长但覆盖60%遮阳网为对照,通过代谢组检测萜类具体成分,同时,结合转录组测序,分析萜类合成代谢相关酶基因,为进一步进行香茅萜类生物合成及其基因工程等研究打下良好基础。
1 材料和方法 1.1 材料试验材料柠檬香茅(Cymbopogon citratus)为福建省漳州地区野生种,于2021年3月中旬分株种植于穴盘,其中一半放置大田阳光照射充足处,另一半放置大田覆盖遮光率60%的遮阳网。6月中旬取不同环境下生长的2组植株嫩叶各6份,及时放入液氮并转至–80 ℃冰箱保存备用。
1.2 代谢组检测及萜类成分筛选取光照和遮阴下生长的香茅嫩叶各3份,经真空冷冻干燥(冻干机:Scientz-100 F)后研磨(MM 400研磨仪, Retsch)成粉末状;称取100 mg粉末溶解于0.6 mL 70%甲醇提取液,4 ℃下放置10 h,期间涡旋4~6次;离心取上清液用微孔滤膜过滤,滤液保存于进样瓶中,用于超高效液相色谱串联质谱(UPLC-MS/MS)检测分析[28]。基于百迈客科技有限公司数据库MWDB (metware database),根据二级谱信息对6个样品中的萜类成分进行定性和定量分析,萜类化合物相对含量取3份的平均值。
1.3 转录组测序及萜类合成酶筛选采用Trizol法提取香茅嫩叶总RNA,获得cDNA后进行Illumina HiSeqTM 2500转录组测序及数据分析[28]。经KEGG数据库注释获得单萜、二萜、倍半萜和三萜代谢途径具体合成酶基因信息。
1.4 差异表达基因的qRT-PCR验证光照(标号:阳1-1)及遮阴(标号:阴1-1)样本经转录组测序获得的总RNA,用超微量核酸蛋白测定仪(scandrop100)测定OD值。检测合格后采用Aidlab公司反转录试剂盒(TUREscript 1st Stand cDNA Synthesis Kit)进行反转录,根据反转录试剂盒中反应体系和反应条件合成光照及遮阴香茅cDNA, 以其为模板,进行4个差异表达明显的萜类合成酶基因(根据转录组测序结果中FPKM值)进行qRT-PCR检测,每个基因检测3次,取平均值。具体基因及其引物序列见表 1。
| 表 1 荧光定量PCR分析的5个基因及其引物 Table 1 qRT-PCR primers for 5 selected genes |
根据代谢组检测光照及遮阴下生长的柠檬香茅代谢产物进行萜类成分及其相对含量分析。结果表明,柠檬香茅含萜类23种,包括单萜、倍半萜和四萜各4种,二萜8种,三萜3种。遮阴下二萜类的银杏内酯C和四萜类虾青素相对含量更高,而其他萜类成分相对含量在不同光照环境下影响不大,尤其是作为香茅精油主要成分的挥发性单萜相对含量差异不明显。4种挥发性单萜相对含量由高到低依次为α-罗勒烯、脱氢马钱素四乙酸酯、橙花醇和α-蒎烯(表 2)。
| 表 2 23种萜类化合物及其相对含量 Table 2 23 terpenes and relative content |
转录组测序后经KEGG数据库注释,进行单萜、二萜以及倍半萜和三萜等合成酶基因信息分析。
2.2.1 单萜生物合成酶基因信息单萜生物合成酶包括羧基吲哚合成酶的9个家族基因、新薄荷醇脱氢酶的13个家族基因、芳樟醇合成酶和荆芥内酯单氧化酶各1个基因(表 3)。不同光照下,羧基吲哚合成酶基因和荆芥内酯单氧化酶相对表达量均很低,芳樟醇合成酶相对表达量均较高,而新薄荷醇脱氢酶的13个家族基因相对表达量相差显著,其中c102703.0基因在光照下的表达量显著低于遮阴环境。
| 表 3 编码4类单萜生物合成酶的24个基因 Table 3 24 genes encoding 4 kinds of monoterpene synthetase |
二萜生物合成酶包括赤霉素2β-双加氧酶的26个家族基因、贝壳杉烯合成酶的5个家族基因、异贝壳杉烯羟化酶、莫米内酯-α合成酶及赤霉素20氧化酶各3个家族基因、贝壳杉烯酸单加氧酶及三甲基十三碳四烯合成酶各2个家族基因、二烯11-羟化酶、共丙基二磷酸合成酶、二烯氧化酶及荆芥内酯合成酶各1个基因(表 4)。对比光照环境,遮阴下赤霉素2β-双加氧酶(c102697.0和c99152.1)、贝壳杉烯合成酶(c100000.0和c100759.0)、莫米内酯-α合成酶(c102803.0)和贝壳杉烯酸单加氧酶(c96273.0)等6个二萜生物合成酶基因的相对表达量显著提高。
| 表 4 编码11类二萜生物合成酶的48个基因 Table 4 48 genes encoding 11 kinds of diterpene synthetases |
倍半萜和三萜生物合成酶包括大根香叶烯合成酶的16个家族基因、蓍醇B合成酶的15个家族基因、橙花叔醇合成酶的13个家族基因、法呢基二磷酸法呢基转移酶的4个家族基因、前萘二烯加氧酶的3个家族基因、法尼醇脱氢酶的2个家族基因、羽扇豆醇合成酶、无环倍半萜合成酶、β-法尼烯合成酶、β-大蒈烯合成酶以及马兜铃烯1,3-二羟基酶各1个基因(表 5)。大根香叶烯合成酶、蓍醇B合成酶及橙花叔醇合成酶等虽含有大量家族基因, 但大多数基因在光照及遮阴环境下相对表达量均很低,且不存在差异表达极显著基因。前萘二烯加氧酶(c64786.0)在光照环境下相对表达量更高,而法尼醇脱氢酶(c91185.0)在光照环境下相对表达量正好相反。
| 表 5 编码12类倍半萜和三萜生物合成酶的58个基因 Table 5 58 genes encoding 12 kinds of sesquiterpenes and triterpenes biosynthesis enzymes |
对比光照和遮阴下柠檬香茅的转录组测序结果,挑选FPKM值差异明显的4个参与萜类合成的酶基因进行qRT-PCR检测,结果表明,4个萜类合成酶基因在光照及遮阴下的表达趋势与转录组的FPKM值结果一致,但2种检测结果差异表达倍数存在差异。前萘二烯加氧酶(C64786.0)基因在光照环境下表达量更高,而其他3个合成酶基因在遮阴环境下表达更高(图 1)。
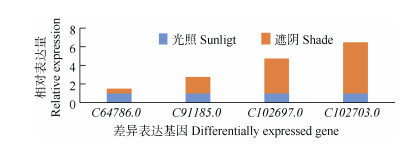
|
图 1 4个差异表达基因的qRT-PCR验证 Fig. 1 Verification of 4 differential expressed genes by qRT-PCR |
香茅种类繁多,不同品种香茅提取的精油中挥发性萜类(单萜)物质差异明显[29],柠檬香茅精油的挥发性萜类主要为开链单萜有机物柠檬醛(香叶醛和橙花醛)等;而爪哇香茅(Cymbopogon winterianus)提取精油所含挥发性萜类主要为无环单萜香茅醛及香叶醇等。此外,同品种柠檬香茅在不同地域栽培,其精油单萜类成分及含量同样差异明显[1]。前人研究香茅萜类挥发性成分大多通过提取精油,导致具体萜类成分及含量差异较大。本研究首次通过代谢组检测光照和遮阴下柠檬香茅萜类成分及相对含量,其4种挥发性单萜相对含量依次为α-罗勒烯 > 脱氢马钱素四乙酸酯 > 橙花醇 > α-蒎烯, 这4种单萜相对含量在光照和遮阴下均差异不明显。这与之前的研究结果[1]不同,可能与同一品种在不同地域栽培有关,或者是分析方法不同,提取精油过程中的高温加热发生了化学反应,从而导致柠檬香茅中单萜类化合物发生变化。本研究进一步对单萜生物合成酶基因进行分析,柠檬香茅单萜有4类合成酶共24个基因,这些家族基因的相对表达量大多在不同环境下均极低,且差异不显著。此外,只有1个新薄荷醇脱氢酶(c102703.0)基因相对表达量在光照下显著低于遮阴环境。
除挥发性单萜外,本研究还检测到柠檬香茅中有19种倍半萜、二萜、三萜及四萜等萜类化合物,除二萜类的银杏内酯C和四萜类虾青素相对含量在遮阴下更高外,其他萜类成分相对含量在不同光照下的影响不大。在11类二萜生物合成酶的38个基因中,有2个赤霉素2β-双加氧酶基因(c102697.0和c99152.1)、2个贝壳杉烯合成酶基因(c100000.0和c100759.0)、1个莫米内酯-α合成酶基因(c102803.0)和1个贝壳杉烯酸单加氧酶基因(c96273.0)等6个基因相对表达量在遮阴下显著提高。结合转录组和代谢组研究结果,遮阴环境下生长的柠檬香茅中二萜类成分银杏内酯C相对含量更高,这与其6个合成酶基因相对表达量显著提高成正比。不同光照环境下柠檬香茅的倍半萜和三萜具体成分和含量差异不大,但其合成酶中前萘二烯加氧酶基因(c64786.0)在光照环境下相对表达量更高, 而法尼醇脱氢酶基因(c91185.0)正好相反。
有报道光照能够提高葡萄(Vitis vinifera)的香茅醇及橙花醇等萜类含量及其相关基因的表达量[30], 而本研究中遮阴提高了柠檬香茅中银杏内酯C和虾青素等2个萜类化合物含量及其相关的8个基因的表达量,这可能是因为光照等适宜环境能促进植物中某些重要萜类成分的生成,而某些萜类成分的提高是因为植物在遮阴等逆境胁迫后作为响应的防御信号。
本研究采用代谢组结合转录组进行柠檬香茅萜类化合物及其合成酶基因分析,柠檬香茅中有4类共23种萜类化合物,是由27类合成酶共131个基因编码而来;有2种萜类化合物相对含量在遮阴环境明显升高,其对应的6类合成酶8个基因的相对表达量也明显提高,此外还有1个合成酶基因在遮阴环境下相对表达量明显下降,这些为进一步进行香茅萜类生物合成及其基因工程等研究打下良好基础。
| [1] |
QIU S L. Citronella Resources and Their Utilization[M]. Beijing: China Agricultural Science and Technology Press, 2019: 1-172. 邱珊莲. 香茅资源及其利用[M]. 北京: 中国农业科学技术出版社, 2019: 1-172. |
| [2] |
MACEDO I T F, DE OLIVEIRA L M B, RIBEIRO W L C, et al. Anthelmintic activity of Cymbopogon citratus against Haemonchus contortus[J]. Rev Bras Parasitol Vet, 2015, 24(3): 268-275. DOI:10.1590/S1984-29612015059 |
| [3] |
LI M L, LIU B M, BERNIGAUD C, et al. Lemongrass (Cymbopogon citratus) oil: A promising miticidal and ovicidal agent against Sarcoptes scabiei[J]. PLoS Negl Trop Dis, 2020, 14(4): e0008225. DOI:10.1371/journal.pntd.0008225 |
| [4] |
DA SILVA L C, DE SOUZA PERINOTTO W M, SÁ F A, et al. In vitro acaricidal activity of Cymbopogon citratus, Cymbopogon nardus and Mentha arvensis against Rhipicephalus microplus (Acari: Ixodidae)[J]. Exp Parasitol, 2020, 216: 107937. DOI:10.1016/j.exppara.2020.107937 |
| [5] |
HACKE A C M, MIYOSHI E, MARQUES J A, et al. Anxiolytic properties of Cymbopogon citratus (DC.) stapf extract, essential oil and its constituents in zebrafish (Danio rerio)[J]. J Ethnopharmacol, 2020, 260: 113036. DOI:10.1016/j.jep.2020.113036 |
| [6] |
BRÜGGER B P, MARTÍNEZ L C, PLATA-RUEDA A, et al. Bioactivity of the Cymbopogon citratus (Poaceae) essential oil and its terpenoid constituents on the predatory bug, Podisus nigrispinus (Heteroptera: Pentatomidae)[J]. Sci Rep, 2019, 9(1): 8358. DOI:10.1038/s41598-019-44709-y |
| [7] |
WANI A R, YADAV K, KHURSHEED A, et al. An updated and comprehensive review of the antiviral potential of essential oils and their chemical constituents with special focus on their mechanism of action against various influenza and coronaviruses[J]. Microb Pathog, 2021, 152: 104620. DOI:10.1016/j.micpath.2020.104620 |
| [8] |
BAYALA B, BASSOLE I H N, MAQDASY S, et al. Cymbopogon citratus and Cymbopogon giganteus essential oils have cytotoxic effects on tumor cell cultures identification of citral as a new putative anti-proliferative molecule[J]. Biochimie, 2018, 153: 162-170. DOI:10.1016/j.biochi.2018.02.013 |
| [9] |
BASERA P, LAVANIA M, AGNIHOTRI A, et al. Analytical investigation of Cymbopogon citratus and exploiting the potential of developed silver nanoparticle against the dominating species of pathogenic bacteria[J]. Front Microbiol, 2019, 10: 282. DOI:10.3389/fmicb.2019.00282 |
| [10] |
DA ROCHA L O, DA SILVA LEMOS G C, VIEIRA I J C, et al. Chemical characterization and in vitro biological activity of Cymbopogon citratus extracts against Haemonchus spp. and Trichostrongylus spp. nematodes from sheep[J]. Parasitology, 2020, 147(13): 1559-1568. DOI:10.1017/S0031182020001432 |
| [11] |
LIU Q. Isolation of Cymbopogon citratus (DC.) stapf endophytic bacteria and their affect on the citral production in host[D]. Changsha: Hunan University, 2017: 6. 柳倩. 香茅草内生产香细菌的分离及其对宿主产柠檬醛的影响[D]. 长沙: 湖南大学, 2017: 6. |
| [12] |
PU X J, DONG X M, LI Q, et al. An update on the function and regulation of methylerythritol phosphate and mevalonate pathways and their evolutionary dynamics[J]. J Integr Plant Biol, 2021, 63(7): 1211-1226. DOI:10.1111/jipb.13076 |
| [13] |
CHRISTIANSON D W. Structural and chemical biology of terpenoid cyclases[J]. Chem Rev, 2017, 117(17): 11570-11648. DOI:10.1021/acs.chemrev.7b00287 |
| [14] |
PICHERSKY E, RAGUSO R A. Why do plants produce so many terpenoid compounds?[J]. New Phytol, 2018, 220(3): 692-702. DOI:10.1111/nph.14178 |
| [15] |
CHEN X X, ZHANG C Q, LINDLEY N D. Metabolic engineering strategies for sustainable terpenoid flavor and fragrance synthesis[J]. J Agric Food Chem, 2020, 68(38): 10252-10264. DOI:10.1021/acs.jafc.9b06203 |
| [16] |
MOSER S, PICHLER H. Identifying and engineering the ideal microbial terpenoid production host[J]. Appl Microb Biotechnol, 2019, 103(14): 5501-5516. DOI:10.1007/s00253-019-09892-y |
| [17] |
PRAMASTYA H, SONG Y, ELFAHMI E Y, et al. Positioning Bacillus subtilis as terpenoid cell factory[J]. J Appl Microb, 2021, 130(6): 1839-1856. DOI:10.1111/jam.14904 |
| [18] |
AGATONOVIC-KUSTRIN S, KUSTRIN E, GEGECHKORI V, et al. Anxiolytic terpenoids and aromatherapy for anxiety and depression[M]// GUEST P C. Reviews on New Drug Targets in Age-Related Disorders. Cham: Springer, 2020: 283–296. doi: 10.1007/978-3-030-42667-5_11.
|
| [19] |
SCHEMPP F M, DRUMMOND L, BUCHHAUPT M, et al. Microbial cell factories for the production of terpenoid flavor and fragrance compounds[J]. J Agric Food Chem, 2018, 66(10): 2247-2258. DOI:10.1021/acs.jafc.7b00473 |
| [20] |
AJAYI E O, SADIMENKO A P, AFOLAYAN A J. GC-MS evaluation of Cymbopogon citratus (DC) Stapf. oil obtained using modified hydrodistillation and microwave extraction methods[J]. Food Chem, 2016, 209: 262-266. DOI:10.1016/j.foodchem.2016.04.071 |
| [21] |
SHAH G, SHRI R, PANCHAL V, et al. Scientific basis for the therapeutic use of Cymbopogon citratus Stapf. (lemon grass)[J]. J Adv Pharm Technol Res, 2011, 2(1): 3-8. DOI:10.4103/2231-4040.79796 |
| [22] |
KIEŁTYKA-DADASIEWICZ A, LUDWICZUK A, TARASEVIČIENĖ Ž, et al. Chemical and nutritional compounds of different parts of lemongrass (Cymbopogon citratus (DC) Stapf.) cultivated in temperate climate of Poland[J]. J Oleo Sci, 2021, 70(1): 125-133. DOI:10.5650/jos.ess20171 |
| [23] |
DE OLIVEIRA E SILVA F, SOARES J C M, VALDEZ A, et al. Cymbopogon citratus protects erythrocytes from lipid peroxidation in vitro[J]. Cardiovasc Hematol Agents Med Chem, 2022, 20(2): 166-169. DOI:10.2174/1871525719666210906122948 |
| [24] |
KUMAR P, MISHRA S, MALIK A, et al. Housefly (Musca domestica L.) control potential of Cymbopogon citratus Stapf. (Poales: Poaceae) essential oil and monoterpenes (citral and 1,8-cineole)[J]. Parasitol Res, 2013, 112(1): 69-76. DOI:10.1007/s00436-012-3105-5 |
| [25] |
CHANTHAI S, PRACHAKOLL S, RUANGVIRIYACHAI C, et al. Influence of extraction methodologies on the analysis of five major volatile aromatic compounds of citronella grass (Cymbopogon nardus) and lemongrass (Cymbopogon citratus) grown in Thailand[J]. J AOAC Int, 2012, 95(3): 763-772. DOI:10.5740/jaoacint.11-335 |
| [26] |
MACHADO M, PIRES P, DINIS A M, et al. Monoterpenic aldehydes as potential anti-Leishmania agents: Activity of Cymbopogon citratus and citral on L. infantum, L. tropica and L. major[J]. Exp Parasitol, 2012, 130(3): 223-231. DOI:10.1016/j.exppara.2011.12.012 |
| [27] |
FERIOTTO G, MARCHETTI N, COSTA V, et al. Chemical composition of essential oils from Thymus vulgaris, Cymbopogon citratus, and Rosmarinus officinalis, and their effects on the HIV-1 tat protein function[J]. Chem Biodiv, 2018, 15(2): e1700436. DOI:10.1002/cbdv.201700436 |
| [28] |
ZHANG S P, QIU S L, HUANG H M, et al. Transcriptome and metabolome analyses of flavonoids metabolism in leaf, stem and root of Portulaca oleracea L.[J]. Acta Bot Boreali-Occid Sin, 2021, 41(2): 254-261. 张少平, 邱珊莲, 黄惠明, 等. 基于转录组和代谢组分析马齿苋根茎叶中类黄酮代谢[J]. 西北植物学报, 2021, 41(2): 254-261. DOI:10.7606/j.issn.1000-4025.2021.02.0254 |
| [29] |
SONG X C, LI D X, REN Y F, et al. Research progress on applying of essential oil of Cymbopogon plant to control agricultural pest[J]. China Plant Protect, 2018, 38(7): 25-33. 宋星陈, 李冬雪, 任亚峰, 等. 香茅属植物精油在农业病虫害控制中的应用研究进展[J]. 中国植保导刊, 2018, 38(7): 25-33. DOI:10.3969/j.issn.1672-6820.2018.07.004 |
| [30] |
SONG J Q, SMART R, WANG H, et al. Effect of grape bunch sunlight exposure and UV radiation on phenolics and volatile composition of Vitis vinifera L. cv. Pinot noir wine[J]. Food Chem, 2015, 173: 424-431. DOI:10.1016/j.foodchem.2014.09.150 |
 2023, Vol. 31
2023, Vol. 31


