机体内活性氧成分与抗氧化系统之间平衡失调所引起的一系列适应性的反应称为氧化应激(oxidative stress, OS)[1]。通常,正常代谢产生的活性氧(reactive oxygen species, ROS)可以被细胞内源性抗氧化系统清除[2-3]。然而,过度的环境压力(如紫外线辐射和化学物质等)会导致异常的活性氧产生,从而导致多种疾病(如癌症、炎症、糖尿病、阿尔茨海默病和衰老等)[4]。因此,具有较强的活性氧清除能力和低毒性或无毒性的抗氧化成分可能是开发针对氧化应激相关疾病的理想治疗剂。由于天然化合物具有生物活性高、无毒的优点,从陆地和海洋生物中分离生物活性化合物引起了广泛的关注[5-7]。海藻含有多种独特新颖的活性成分如:多酚化合物、甾醇类化合物、不饱和脂肪酸和多糖等[6, 8],具有多种生物活性如:抗癌、降压、消炎、抗氧化以及抗糖尿病等[5, 9-11],已被广泛应用于医药、化妆品以及药妆品等领域。海藻多糖含量尤其丰富,通常由海藻酸盐、卡拉胶和岩藻多糖组成[12]。海藻多糖由于其独特的理化性质,如高含量的岩藻糖、半乳糖、糖醛酸和硫酸盐等,具有很强的生物活性[13-14]。已有报道,从海藻中分离的多糖具有较好的抗氧化活性[15-16]。
马尾藻属(Sargassum)是墨角藻目、墨角藻科中物种最丰富的属之一,全球公认的物种共有354种[17-18]。铜藻(S. horneri)为马尾藻属一种典型的大型可食用褐藻,其主要分布在中国暖温带海域浅海区域,其既可以为海藻工业提供优质的原料,又可以在食品、医药和饲料等行业中发挥较高的经济价值。据研究报道,从铜藻中分离的多糖具有抗炎、光保护以及抗衰老等多种生物活性[19-21]。Fernando等[19]利用乙醇分级沉淀法从铜藻中分离的多糖对UVB诱导的人角质形成细胞(HaCaT)具有较好的紫外线防护作用。Sanjeewa等[21]从铜藻中分离的多糖对脂多糖诱导的RAW264.7细胞和斑马鱼胚胎所产生炎症反应具有保护作用。已有研究表明从铜藻中分离的多糖对DPPH自由基、·OH自由基以及
铜藻(Sargassum horneri)于2020年10月采自浙江省枸杞岛;人表皮角质形成细胞(HaCaT)购自上海信裕生物科技有限公司。
Nicolet iS5傅里叶变换红外光谱仪(美国Thermo Scientific公司)、CO2培养箱(上海跃进医疗器械有限公司)、TS2RFL倒置显微镜(日本Nikon公司)、F97荧光分光光度计(上海棱光技术有限公司)、UV-1800型紫外分光光度计(日本岛津公司)、iMark酶标仪(美国Bio-Rad公司)等。
1.2 SHP的制备将新鲜的铜藻用自来水清洗3遍,将水脱干, 在60 ℃烘箱中烘干备用,然后用超微粉碎机粉碎, 过80目筛得到藻粉。称取藻粉20 g,采用95%酒精浸泡72 h以脱脂脱色。滤渣烘干后按照1:20加蒸馏水,90 ℃煮4 h,用500目的纱布过滤得到滤液, 然后将滤渣重复煮1次,合并2次滤液,抽滤过滤掉滤渣,加热浓缩至100 mL,加入4倍体积95%乙醇,于4 ℃冰箱静置24 h,10 989×g离心得沉淀。最后沉淀经无水乙醇、丙酮和乙醚洗涤3次以脱水干燥,平均得到1.93 g的SHP粉末。
1.3 SHP的红外光谱表征称取10 mg干燥的SHP样品,利用Nicolet iS5傅里叶变换红外光谱仪对SHP进行结构表征,采用KBr压片法进行测定[28]。
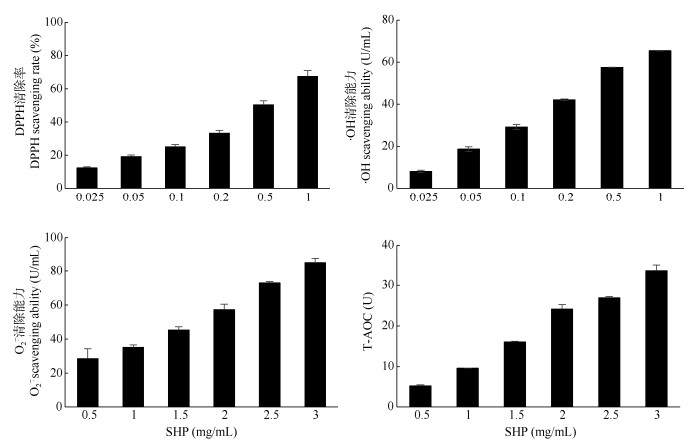
1.4 SHP的体外抗氧化作用将SHP配制成体积浓度为0.025、0.05、0.1、0.2、0.5、1 mg/mL,参照DPPH自由基和羟自由基测定试剂盒(南京建成生物工程研究所)说明书检测SHP溶液的DPPH自由基和羟自由基的清除能力;根据超氧阴离子自由基和总抗氧化能力试剂盒(南京建成生物工程研究所)说明书测定SHP溶液(0.5、1、1.5、2、2.5、3 mg/mL)对超氧阴离子自由基清除能力和总抗氧化能力。
1.5 SHP对HaCaT细胞的保护作用HaCaT细胞的培养将HaCaT细胞分别培养于含10%胎牛血清及含1%抗生素的高糖DMEM培养基中,置于5% CO2、37 ℃细胞培养箱内培养,根据细胞生长的状况,每2~3 d将旧的细胞培养基全部更换成新鲜的细胞培养基,当细胞达到80%~ 90%融合度时用0.25%的胰蛋白酶进行消化传代, 然后取处于对数生长期的细胞进行实验。
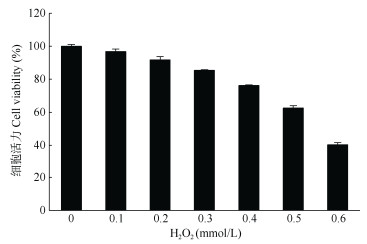
H2O2损伤模型的确定 选择对数生长期的HaCaT细胞制成1×105 cells/mL的细胞悬液, 以每孔100 μL接种于96孔板中,每组设6个复孔,置于5% CO2、37 ℃细胞培养箱内培养,24 h后待细胞状态稳定后,分别加入终浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mmol/L的H2O2继续孵育24 h。用CCK-8试剂盒(上海碧云天技术有限公司)检测细胞存活率,选择细胞存活率接近50%的H2O2浓度作为最佳作用浓度。细胞存活率(%)=(A药物-A空白)/(A对照-A空白)×100%, 式中,A药物为实验组吸光度值,A空白为空白组吸光度值;A对照为对照组吸光度值。
SHP对HaCaT细胞的毒性 将HaCaT细胞制成1×105 cells/mL的细胞悬液, 接种于96孔板中, 每孔100 μL,每组设置6个复孔,在细胞培养箱孵育24 h后, 用含有不同浓度的SHP培养基(0、25、50、75、100、150、200、500 μg/mL)处理细胞,继续孵育24 h后,用CCK-8法测定SHP对细胞的安全剂量。
SHP对H2O2诱导的HaCaT细胞活力的保护作用 取处于对数生长期的HaCaT细胞,用胰酶消化并制备单细胞悬液,以细胞密度为1×105 cells/mL接种于96孔板,每孔100 μL,放置于5% CO2、37 ℃细胞培养箱内培养。待细胞贴壁后,向多糖保护组加入等体积的SHP (25、50和100 μg/mL), 孵育1 h后,多糖保护组和H2O2损伤组分别使用含H2O2 (终浓度为0.5 mmol/L)的培养基处理HaCaT细胞,而空白对照组加入等体积的培养基。每组设6个复孔,孵育24 h后,用CCK-8法测定细胞活力。空白对照组:不加H2O2,不加SHP; H2O2损伤组:加H2O2损伤,不加SHP; 多糖保护组: 加SHP预保护1 h后加H2O2。
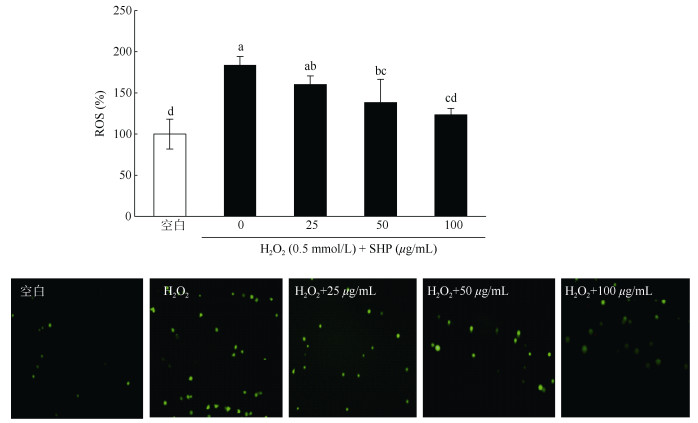
SHP对H2O2诱导的HaCaT细胞ROS的清除作用 将HaCaT细胞以1×105 cells/mL的密度接种于6孔板,每孔加入2 mL,并设立空白对照组、H2O2损伤组和多糖保护组。处理结束后,各孔加入终浓度为10 μg/mL的DCFH-DA,在细胞培养箱中孵育30 min,每隔5 min摇晃1次,以便于探针与细胞充分接触,且全程避光操作。孵育结束后,用预热的培养基清洗2次,然后收集细胞于荧光显微镜下拍照并用荧光分光光度计测定细胞内的荧光强度。将空白对照组的荧光强度设置为100%,其他组与空白对照组荧光强度相比,以计算其他组细胞内的荧光强度。
SHP对细胞内的丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的影响 将细胞接种到6孔板,每孔加入2 mL,设立空白对照组、H2O2损伤组和多糖保护组。处理结束后移除原培养基,并用PBS轻轻漂洗2遍,然后用细胞刮板轻轻刮取,离心并倒去上清液,加200 μL双蒸水,利用反复冻融法破碎细胞,离心后取上清液,参照SOD和MDA的试剂盒(南京建成生物工程研究所)说明书进行测定。
1.6 数据处理采用SPSS 25.0软件进行数据统计分析,采用单因素方差分析(ANOVA)进行显著性分析。P < 0.05表示有显著差异;P < 0.01表示有极显著差异。
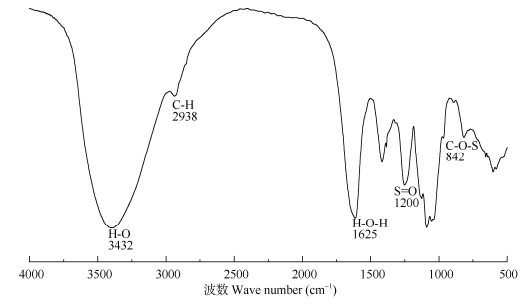
2 结果和分析 2.1 SHP的红外光谱表征通过红外光谱仪对SHP进行简单表征(图 1), 在3 432 cm–1处的吸光度是O-H特征伸缩振动峰, 在2 938 cm–1处的吸光度是C-H特征伸缩振动峰; 在1 625 cm–1处的特征峰为H-O-H,这表明样品中存在水分。此外,在1 200 cm–1处的吸收峰表示S=O的伸缩振动,即硫酸盐的强烈伸缩振动,而在842 cm–1处的吸收峰为C-O-S的不对称伸缩振动,即硫酸盐的弯曲振动。
|
图 1 SHP的红外光谱 Fig. 1 FT-IR spectra of SHP |
采用DPPH、·OH、
|
图 2 SHP的自由基清除能力 Fig. 2 Free radical scavenging ability of SHP |
H2O2诱导的细胞损伤模型建立 用终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6和0.7 mmol/L的H2O2处理HaCaT细胞相同时间后,采用CCK-8法检测HaCaT细胞的活力变化。由图 3可见,HaCaT细胞活力与H2O2浓度呈负相关,即随H2O2浓度增加,细胞活力迅速下降,当H2O2为0.5 mmol/L时,HaCaT细胞的活力为62.56%,与空白对照达极显著差异(P < 0.01)。因此选用0.5 mmol/L H2O2作为HaCaT细胞的损伤浓度。
|
图 3 H2O2对HaCaT细胞活力的影响 Fig. 3 Effect of H2O2 on HaCaT cell viability |
SHP对HaCaT细胞的毒性 采用CCK-8法分析SHP对HaCaT细胞的毒性(图 4),当SHP为25~100 μg/mL时,HaCaT细胞活性与空白对照没有显著差异(P > 0.05)。但当SHP浓度大于100 μg/mL时, 细胞活力明显下降,可能是高浓度SHP对HaCaT细胞产生了细胞毒性。因此在后续实验中选用25、50、100 μg/mL 3个剂量来探究SHP对H2O2诱导HaCaT细胞氧化应激的保护作用。

|
图 4 SHP对HaCaT细胞活力的影响 Fig. 4 Effect of SHP on HaCaT cell viability |
SHP对H2O2诱导的HaCaT细胞活力的保护作用 与空白对照相比,0.5 mmol/L H2O2处理的HaCaT细胞活力极显著下降(P < 0.01),为(56.85± 2.63)%;而25、50、100 μg/mL SHP处理的HaCaT细胞活力呈剂量依赖性增加,分别为(62.75± 1.96)%、(70.62±3.30)%、(80.57±2.91)% (图 5)。这表明SHP预处理后对H2O2诱导的HaCaT细胞活力具有一定的保护作用,SHP可以有效的减弱H2O2诱导的HaCaT细胞氧化应激损伤。

|
图 5 SHP对H2O2诱导的HaCaT细胞氧化损伤的影响。柱上不同字母表示差异显著(P < 0.05)。 Fig. 5 Effect of SHP on H2O2-induced oxidative damage in HaCaT cell. Different letters upon column indicate significant differences at 0.05 level. |
SHP对H2O2诱导的HaCaT细胞内ROS的清除作用 由图 6可见,与空白对照相比,H2O2诱导的HaCaT细胞荧光强度明显增强,说明HaCaT细胞内ROS含量极显著增强(P < 0.01)。但0和25 μg/mL SHP对H2O2诱导的HaCaT细胞内ROS水平没有显著差异。然而当SHP浓度达50和100 μg/mL时,HaCaT细胞内ROS水平呈极显著降低(P < 0.01)。同时在荧光显微镜下观察的荧光图像也得到了相似的结果,说明一定浓度范围的SHP可以有效清除细胞内ROS。
|
图 6 SHP对H2O2诱导的HaCaT细胞内ROS生成的影响。A: 荧光分光光度计结果; B: 荧光图像。柱上不同字母表示差异显著(P < 0.05)。 Fig. 6 Effect of SHP on H2O2-induced intracellular ROS generation in HaCaT cells. A: Fluorescence spectrophotometer result; B: Fluorescence images. Different letters upon column indicate significant differences at 0.05 level. |
SHP对MDA含量和SOD活性的影响 与空白对照相比,H2O2诱导的HaCaT细胞SOD活力显著降低(P < 0.01),MDA含量显著升高(P < 0.01), 但25、50、100 μg/mL SHP处理的HaCaT细胞SOD活力呈剂量依赖性增加,MDA含量呈剂量依赖性显著降低(P < 0.05)(表 1)。这说明SHP可以显著降低H2O2诱导的HaCaT细胞内MDA含量,从而使细胞避免受到氧化应激损伤。
| 表 1 SHP对HaCaT细胞内SOD活力和MDA含量的影响 Table 1 Effects of SHP on SOD activity and MDA content in HaCaT cell |
与陆生植物栖息环境相比,海藻具有独特新颖的分子结构以及生理生化性质,其中多糖类物质依然是近年来众多学者的研究热点,广泛应用于各个领域[29-31]。本研究采用水提法提取铜藻多糖不仅成本低廉而且易于操作,容易实现多糖的规模化生产。红外光谱结果显示出SHP的结构特征,2 938 cm–1处的吸收带是C-H的伸缩振动特征峰,说明多糖的存在[32],1 260和814 cm–1处的峰是S=O和C-O-S的不对称伸缩振动,表明SHP中含有硫酸盐基团[33], 因此可以推测SHP是硫酸多糖[34]。本研究通过测定SHP对DPPH自由基、超氧阴离子自由基、羟自由基以及总抗氧化能力来探究SHP的抗氧化活性,结果表明SHP在体外具有一定的抗氧化能力,并且其抗氧化能力呈现出一定的浓度依赖性。
近年来,利用H2O2建立细胞氧化损伤模型被广泛应用于评价天然化合物对氧化应激的保护作用[1, 19, 21, 28],特别是利用多糖作为天然的抗氧化剂已经引起了众多学者的广泛关注。Wang等[1]从羊栖菜(Hizikia fusiforme)中分离的多糖可以显著降低H2O2诱导的Vero细胞内ROS水平、细胞凋亡等,其对细胞氧化损伤具有明显的保护作用。郭子叶等[35]研究表明浒苔多糖可以降低H2O2对HSF细胞的氧化损伤,提高细胞的自由基清除能力,并且减少细胞的脂质过氧化作用。由于H2O2可能会诱导细胞死亡,因此细胞存活率也是衡量H2O2诱导氧化应激的理想指标,因此本研究通过不同浓度的诱导优化最终选用0.5 mmol/L H2O2作为诱导HaCaT细胞的最优氧化应激模型,并利用该模型对SHP进行了体外抗氧化研究。本实验结果表明,SHP可以呈剂量依赖性地提高H2O2诱导的HaCaT细胞的存活率。除此之外,细胞内积累过量的ROS将会导致脂质过氧化、蛋白质氧化以及DNA损伤等,最终导致细胞死亡[36]。本研究结果还表明,H2O2诱导的HaCaT细胞内的ROS水平明显高于对照, 而当添加SHP时, H2O2诱导的HaCaT细胞内ROS水平呈剂量依赖性减弱,细胞存活率增加也支持这一观点。
在正常情况下,细胞具有内源性抗氧化系统, 其通过产生超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶来保护细胞避免遭受ROS的损伤[37]。SOD是抗氧化酶防御系统中第一道也是最重要的一道防线,其可以清除细胞内ROS,特别是超氧阴离子自由基,防止脂质过氧化,从而提升生物体的抗氧化能力[38]。本实验结果表明,H2O2诱导的HaCaT细胞的抗氧化酶SOD活力与空白对照组相比显著下降,表明HaCaT细胞在H2O2诱导下产生大量的自由基,从而抗氧化酶SOD活性得到抑制、氧化应激程度加深[39]。然而,在经过SHP预处理后其细胞的SOD活力呈剂量依赖性增加,表明减弱了细胞氧化应激损伤程度。脂质过氧化在生物系统中被认为是一种毒理学现象,其会导致各种病理状况,而H2O2会增强细胞系统中的脂质过氧化[40-41]。MDA是公认的脂质过氧化作用的最终分解产物, 其含量的多少反映了细胞损伤的程度,从而可以间接地反映细胞氧化应激的受损程度[42]。本研究结果表明,SHP呈剂量依赖性降低了H2O2诱导的HaCaT细胞中MDA含量。因此SHP可以阻止过氧自由基的积累,保护HaCaT细胞免受H2O2诱导的细胞损伤。在本研究中,SHP能够显著提高H2O2诱导氧化损伤的HaCaT细胞SOD活力,可以有效清除细胞内ROS,阻止脂质过氧化,并且显著降低细胞内MDA的含量,从而对H2O2诱导HaCaT细胞氧化应激起到保护作用。以上试验结果证实了SHP具有保护细胞免受H2O2诱导的氧化应激的抗氧化潜力。
本研究采用自由基清除和细胞实验证实SHP具有较好的体外抗氧化作用,表明SHP具有作为天然抗氧化剂的潜力,可以用来增强对氧化应激的保护作用,以评估SHP作为化妆品和功能性食品成分的应用。从铜藻中提取的多糖作为褐藻多糖的一种,具有良好的对氧化应激损伤的保护作用,那么褐藻多糖可能也具有较好的体外抗氧化活性,并且由于绿色天然无毒的优点,因此褐藻多糖作为原料开发新型的功能性化妆品具有广阔的前景,同时将其应用到氧化应激等相关疾病的防治也具有一定的可能性。褐藻多糖的抗氧化活性可能与硫酸根含量、分子量、结构组成和溶解度有关,这还需进一步的探究。
| [1] |
WANG L, OH J Y, KIM H S, et al. Protective effect of polysaccharides from celluclast-assisted extract of Hizikia fusiforme against hydrogen peroxide-induced oxidative stress in vitro in Vero cells and in vivo in zebrafish[J]. Int J Biol Macromol, 2018, 112: 483-489. DOI:10.1016/j.ijbiomac.2018.01.212 |
| [2] |
WANG L, JO M J, KATAGIRI R, et al. Antioxidant effects of citrus pomace extracts processed by super-heated steam[J]. LWT Food Sci, 2018, 90: 331-338. DOI:10.1016/j.lwt.2017.12.024 |
| [3] |
FERNANDO I P S, KIM M, SON K T, et al. Antioxidant activity of marine algal polyphenolic compounds: A mechanistic approach[J]. J Med Food, 2016, 19(7): 615-628. DOI:10.1089/jmf.2016.3706 |
| [4] |
KIM Y S, HWANG J W, SUNG S H, et al. Antioxidant activity and protective effect of extract of Celosia cristata L.flower on tert-butyl hydroperoxide-induced oxidative hepatotoxicity[J]. Food Chem, 2015, 168: 572-579. DOI:10.1016/j.foodchem.2014.07.106 |
| [5] |
WANG L, PARK Y J, JEON Y J, et al. Bioactivities of the edible brown seaweed, Undaria pinnatifida: A review[J]. Aquaculture, 2018, 495: 873-880. DOI:10.1016/j.aquaculture.2018.06.079 |
| [6] |
THOMAS N V, KIM S K. Beneficial effects of marine algal compounds in cosmeceuticals[J]. Mar Drugs, 2013, 11(1): 146-164. DOI:10.3390/md11010146 |
| [7] |
WEI S Y, CAI C E, HE P M, et al. Application of algae bioactive substances in cosmetics[J]. Chin J Mar Drugs, 2021, 40(3): 71-78. 魏双艳, 蔡春尔, 何培民, 等. 藻类生物活性物质在化妆品中的应用[J]. 中国海洋药物, 2021, 40(3): 71-78. DOI:10.13400/j.cnki.cjmd.2021.03.010 |
| [8] |
GUILLERME J B, COUTEAU C, COIFFARD L. Applications for marine resources in cosmetics[J]. Cosmetics, 2017, 4(3): 35. DOI:10.3390/cosmetics4030035 |
| [9] |
FERNANDO I P S, JAYAWARDENA T U, SANJEEWA K K A, et al. Anti-inflammatory potential of alginic acid from Sargassum horneri against urban aerosol-induced inflammatory responses in keratinocytes and macrophages[J]. Ecotoxicol Environ Saf, 2018, 160: 24-31. DOI:10.1016/j.ecoenv.2018.05.024 |
| [10] |
FERNANDO I P S, SANJEEWA K K A, KIM H S, et al. Apoptotic and antiproliferative properties of 3β‐hydroxy‐Δ5‐steroidal congeners from a partially purified column fraction of Dendronephthya gigantea against HL‐60 and MCF‐7 cancer cells[J]. J Appl Toxicol, 2018, 38(4): 527-536. DOI:10.1002/jat.3559 |
| [11] |
WANG L, LEE W W, OH J Y, et al. Protective effect of sulfated polysaccharides from celluclast-assisted extract of Hizikia fusiforme against ultraviolet B-induced skin damage by regulating NF-κB, AP-1, and MAPKs signaling pathways in vitro in human dermal fibroblasts[J]. Mar Drugs, 2018, 16(7): 239. DOI:10.3390/md16070239 |
| [12] |
LEE W W, KANG N, KIM E A, et al. Radioprotective effects of a polysaccharide purified from Lactobacillus plantarum-fermented Ishige okamurae against oxidative stress caused by gamma ray-irradiation in zebrafish in vivo model[J]. J Funct Foods, 2017, 28: 83-89. DOI:10.1016/j.jff.2016.11.004 |
| [13] |
SARAVANA P S, CHO Y N, PATIL M P, et al. Hydrothermal degradation of seaweed polysaccharide: Characterization and biological activities[J]. Food Chem, 2018, 268: 179-187. DOI:10.1016/j.foodchem.2018.06.077 |
| [14] |
SEEDEVI P, MOOVENDHAN M, SUDHARSAN S, et al. Isolation and chemical characteristics of rhamnose enriched polysaccharide from Grateloupia lithophila[J]. Carbohydr Polym, 2018, 195: 486-494. DOI:10.1016/j.carbpol.2018.05.002 |
| [15] |
HE J Z, RU Q M, DONG D D, et al. Chemical characteristics and antioxidant properties of crude water soluble polysaccharides from four common edible mushrooms[J]. Molecules, 2012, 17(4): 4373-4387. DOI:10.3390/molecules17044373 |
| [16] |
KIM S Y, KIM E A, KIM Y S, et al. Protective effects of polysaccharides from Psidium guajava leaves against oxidative stresses[J]. Int J Biol Macromol, 2016, 91: 804-811. DOI:10.1016/j.ijbiomac.2016.05.111 |
| [17] |
LIU F, LIU X F, WANG Y, et al. Insights on the Sargassum horneri golden tides in the Yellow Sea inferred from morphological and molecular data[J]. Limnol Oceanogr, 2018, 63(4): 1762-1773. DOI:10.1002/lno.10806 |
| [18] |
MATTIO L, PAYRI C E. 190 years of Sargassum taxonomy, facing the advent of DNA phylogenies[J]. Bot Rev, 2011, 77(1): 31-70. DOI:10.1007/s12229-010-9060-x |
| [19] |
FERNANDO I P S, DIAS M K H M, MADUSANKA D M D, et al. Human keratinocyte UVB-protective effects of a low molecular weight fucoidan from Sargassum horneri purified by step gradient ethanol precipitation[J]. Antioxidants, 2020, 9(4): 340. DOI:10.3390/antiox9040340 |
| [20] |
WEN Z S, XIANG X W, JIN H X, et al. Composition and antiinflammatory effect of polysaccharides from Sargassum horneri in RAW264.7 macrophages[J]. Int J Biol Macromol, 2016, 88: 403-413. DOI:10.1016/j.ijbiomac.2016.02.025 |
| [21] |
SANJEEWA K K A, FERNANDO I P S, KIM S Y, et al. In vitro and in vivo anti-inflammatory activities of high molecular weight sulfated polysaccharide; containing fucose separated from Sargassum horneri: Short communication[J]. Int J Biol Macromol, 2018, 107: 803-807. DOI:10.1016/j.ijbiomac.2017.09.050 |
| [22] |
SHAO P, CHEN X X, SUN P L. Improvement of antioxidant and moisture-preserving activities of Sargassum horneri polysaccharide enzymatic hydrolyzates[J]. Int J Biol Macromol, 2015, 74: 420-427. DOI:10.1016/j.ijbiomac.2014.12.021 |
| [23] |
YANG Y Y. Comprehensive application of four algae in cosmetics[D]. Shanghai: Shanghai Ocean University, 2016. 杨亚云. 四种大型海藻在化妆品上综合应用研究[D]. 上海: 上海海洋大学, 2016. |
| [24] |
ZHANG Y, ZHANG M S, SHI Y P, et al. Comparison on antioxidant activity of polysaccharide fraction from Sargassum horneri in vitro[J]. Food Res Dev, 2018, 39(6): 12-18. 张玉, 张绵松, 史亚萍, 等. 铜藻活性组分多糖的体外抗氧化性研究[J]. 食品研究与开发, 2018, 39(6): 12-18. |
| [25] |
GU L X, LIU L J, HE S T, et al. Study on water extraction technology and antioxidative activity of polysaccharides from Sargassum herneri[J]. J Anhui Agric Sci, 2014, 42(29): 10139-10141. 顾丽霞, 刘丽佳, 何淑婷, 等. 铜藻多糖水提法工艺优化及其抗氧化活性研究[J]. 安徽农业科学, 2014, 42(29): 10139-10141. DOI:10.13989/j.cnki.0517-6611.2014.29.038 |
| [26] |
PARK N H, PARK J S, KANG Y G, et al. Soybean extract showed modulation of retinoic acid-related gene expression of skin and photoprotective effects in keratinocytes[J]. Int J Cosmet Sci, 2013, 35(2): 136-142. DOI:10.1111/ics.12014 |
| [27] |
FENG B, WU Y, ZHAO Y, et al. Study of cosmetological efficacy of Dendrobium nobile prescriptions at cell theoretical level[J]. China Surfact Deterg Cosmet, 2014, 44(10): 568-571. 冯冰, 吴越, 赵亚, 等. 金钗石斛复方在细胞水平的美容功效研究[J]. 日用化学工业, 2014, 44(10): 568-571. DOI:10.13218/j.cnki.csdc.2014.10.127 |
| [28] |
JAYAWARDENA T U, WANG L, SANJEEWA K K A, et al. Antioxidant potential of sulfated polysaccharides from Padina boryana; protective effect against oxidative stress in in vitro and in vivo zebrafish model[J]. Mar Drugs, 2020, 18(4): 212. DOI:10.3390/md18040212 |
| [29] |
HEO S J, JEON Y J. Evaluation of diphlorethohydroxycarmalol isolated from Ishige okamurae for radical scavenging activity and its protective effect against H2O2-induced cell damage[J]. Proc Biochem, 2009, 44(4): 412-418. DOI:10.1016/j.procbio.2008.12.005 |
| [30] |
HEO S J, JEON Y J. Protective effect of fucoxanthin isolated from Sargassum siliquastrum on UV-B induced cell damage[J]. J Photochem Photobiol B, 2009, 95(2): 101-107. DOI:10.1016/j.jphotobiol.2008.11.011 |
| [31] |
KIM H S, WANG L, JAYAWARDENA T U, et al. High-performance centrifugal partition chromatography (HPCPC) for efficient isolation of diphlorethohydroxycarmalol (DPHC) and screening of its antioxidant activity in a zebrafish model[J]. Proc Biochem, 2020, 88: 189-196. DOI:10.1016/j.procbio.2019.09.027 |
| [32] |
OLASEHINDE T A, MABINYA L V, OLANIRAN A O, et al. Chemical characterization, antioxidant properties, cholinesterase inhibitory and anti-amyloidogenic activities of sulfated polysaccharides from some seaweeds[J]. Bioact Carbohydr Diet Fibre, 2019, 18: 100182. DOI:10.1016/j.bcdf.2019.100182 |
| [33] |
YE Y H, JI D S, YOU L J, et al. Structural properties and protective effect of Sargassum fusiforme polysaccharides against ultraviolet B radiation in hairless Kun Ming mice[J]. J Funct Foods, 2018, 43: 8-16. DOI:10.1016/j.jff.2018.01.025 |
| [34] |
ZHANG R, ZHANG X X, TANG Y X, et al. Composition, isolation, purification and biological activities of Sargassum fusiforme polysaccharides: A review[J]. Carbohydr Polym, 2020, 228: 115381. DOI:10.1016/j.carbpol.2019.115381 |
| [35] |
GUO Z Y, CAI C E, GENG Z L, et al. Study on potential use of crude polysaccharides from Ulva prolifera in cosmetic[J]. Chin J Mar Drugs, 2014, 33(2): 57-62. 郭子叶, 蔡春尔, 耿中雷, 等. 浒苔粗多糖化妆品开发潜力研究[J]. 中国海洋药物, 2014, 33(2): 57-62. DOI:10.13400/j.cnki.cjmd.2014.02.010 |
| [36] |
SHARMA P, JHA A B, DUBEY R S, et al. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions[J]. J Bot, 2012, 2012: 217037. DOI:10.1155/2012/217037 |
| [37] |
LÜ H L. Free radicals and human aging[J]. Sci Technol Inf, 2011(8): 253. 吕慧玲. 自由基与人类衰老[J]. 科技资讯, 2011(8): 253. DOI:10.16661/j.cnki.1672-3791.2011.08.200 |
| [38] |
CHEN Y, SUN Z, ZHOU Z G. Anti-aging effects of algae-derived bioactive substances[J]. Nat Prod Res Dev, 2017, 29(5): 893-901. 陈勇, 孙诤, 周志刚. 藻源活性物质的抗皮肤衰老作用[J]. 天然产物研究与开发, 2017, 29(5): 893-901. DOI:10.16333/j.1001-6880.2017.5.030 |
| [39] |
ÇIMEN M Y B. Free radical metabolism in human erythrocytes[J]. Clin Chim Acta, 2008, 390(1/2): 1-11. DOI:10.1016/j.cca.2007.12.025 |
| [40] |
YOKOZAWA T, LIU Z W, CHEN C P. Protective effects of Glycyrrhizae radix extract and its compounds in a renal hypoxia (ischemia)-reoxygenation (reperfusion) model[J]. Phytomedicine, 2000, 6(6): 439-445. DOI:10.1016/S0944-7113(00)80072-0 |
| [41] |
LEE J H, KO J Y, OH J Y, et al. Evaluation of phlorofucofuroeckol-A isolated from Ecklonia cava(Phaeophyta) on anti-lipid peroxidation in vitro and in vivo[J]. Algae, 2015, 30(4): 313-323. DOI:10.4490/algae.2015.30.4.313 |
| [42] |
ZHOU Y H, YU J P, LIU Y F, et al. Effects of Ginkgo biloba extract on inflammatory mediators (SOD, MDA, TNF-α, NF-κBp65, IL-6) in TNBS-induced colitis in rats[J]. Mediat Inflamm, 2006, 2006: 092642. DOI:10.1155/MI/2006/92642 |
 2023, Vol. 31
2023, Vol. 31


