2. 华南国家植物园, 广州 510650;
3. 中国科学院大学, 北京 100049;
4. 南方海洋科学与工程广东省实验室(广州), 广州 511458
2. South China National Botanical Garden, Guangzhou 510650, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China
中国的热带珊瑚岛广泛分布于南海地区,是我国建设海洋强国和推进实施“一带一路”战略的重要支撑点,其战略地位十分重要。热带珊瑚岛多是由珊瑚砂堆积而成,具有高盐、贫瘠、高温、强光、强碱和季节性干旱等极端生境特点[1]。植被是海岛生态系统的基本组成要素,同时也是陆地生态系统的主体,具有支持、调节、文化、供给等重要的生态系统服务功能[2]。由于环境极端且地理位置远离陆地,热带珊瑚岛植被极易在自然和人为因素的干扰下退化,且退化后恢复或重建困难[3]。因此,选取热带珊瑚岛适生植物物种是进行热带珊瑚岛植被构建与恢复的关键[2]。
植物功能性状指能强烈影响生态系统功能以及可以反映出植物对环境动态响应的核心属性,且这些属性是大多数植物常见的性状[4]。植物在环境动态的影响下,基因型会产生相应变化,进而导致性状发生改变以应对异质环境,这种能力即是性状可塑性[5–6]。植物的性状可塑性是植物在与环境相互作用过程中表现出的一种适应能力,使得植物能够在异质环境中通过一定程度地改变性状以最大程度减小环境带来的不利影响,保证自身在环境中的生长发育[7]。植物功能性状的变化反映了植物对环境胁迫的适应策略,同时也可以作为植物抗逆性鉴定的重要依据[8]。在干旱、贫瘠、高温和强光等复合性胁迫生境中,植物为了提高光合效率、减少水分蒸腾以及减轻强光灼伤,通常表现出较低的比叶面积、较大的叶片厚度,以及排列较紧密、厚度较高的栅栏组织与海绵组织[9–10]。为应对热带珊瑚岛高温和强光伤害,植物叶片通常表现出较低的叶绿素含量以减少强光伤害[11]。植物受到高温和干旱胁迫时,细胞内自由基累积过多加速膜脂过氧化, 抗氧化酶系统和非酶类抗氧化物质能够还原活性氧物质,减少对细胞的伤害[12]。同时,脯氨酸(Pro)作为细胞内渗透调节物质之一,调节细胞渗透压以应对干旱胁迫[13]。丙二醛(MDA)是植物细胞质膜过氧化分解的最终产物,是鉴别植物受逆境伤害的指标之一[14]。
目前,关于热带珊瑚岛的植被建设主要集中在环境评估[15–16]、植被群落动态[1, 17–19]和资源调查[16]等方面,而基于功能性状分析热带珊瑚岛先锋建群木本植物对逆境胁迫的适应策略的研究还不多[10, 20–21]。为此,本研究以海南省文昌市苗圃(以下称文昌)和由苗圃移栽至热带珊瑚岛(以下称海岛)的夹竹桃(Nerium indicum)、黄金香柳(Melaleuca bracteata)、桑树(Morus alba)和银叶树(Heritiera littoralis)等4种木本植物为对象,从形态解剖学特征和生理学特征等方面,分析该4种植物对海岛生境的适应能力及其适应策略,为解决我国南海地区热带珊瑚岛植被快速构建工程中物种单一和定居受限等难题提供一定的科学指导。
1 材料和方法 1.1 研究地概况本研究苗圃位于海南省文昌市(110°45′ E,19° 31′ N),热带海洋性季风气候,年均气温24 ℃,年均降水量1 800 mm,土壤基质为滨海沉积物沙积土。热带珊瑚岛位于海南省三沙市,属热带海洋性气候,年均气温28 ℃,年均降水量2 800 mm,蒸发量大且每年10月至翌年4月都是旱季[10]。土壤基质为高盐碱磷质石灰土,养分含量低且保水能力差[22]。
1.2 材料本研究以前期西沙群岛植被调查为基础[1, 23], 参照《热带珊瑚岛礁植被恢复工具种图谱》[2],选取4种木本植物:夹竹桃(Nerium indicum)、黄金香柳(Melaleuca bracteata)、桑树(Morus alba)和银叶树(Heritiera littoralis)作为研究对象。于2015年5月将4种植物由文昌苗圃移植至热带珊瑚岛,除移植时使用少量客土以保证植株存活率外无任何人工护理。2017年3月,每种植物分别在文昌苗圃和热带珊瑚岛选取株高接近且长势健康的植株,采集近顶部或近枝顶长势良好且接近成熟的叶片,放入冰盒保存并带回实验室备用。
1.3 比叶面积与叶片干物质含量每种植物在两地分别采集不同植株上长势良好的3片叶子,用LI-3000叶面积仪(LI-COR,美国)测量新鲜叶片的叶面积(LA),用分析天平称取新鲜叶片的质量(FW),然后将叶片置于65 ℃烘箱中烘干,用分析天平称量干质量(DW)。叶片比叶面积(SLA)=LA/DW,干物质含量(LDMC)=DW/FW[24]。
1.4 解剖学特征指标每种植物在两地各选3株植株,每株采集长势良好的2片叶子,徒手制作切片[25]。将切片置于显微镜(Leica DM 4000B)下,每片叶选取3个清晰视野(n=18), 利用软件Image-J (https://imagej.en.softonic.com)记录叶片、栅栏组织、海绵组织的厚度,计算栅栏组织与海绵组织厚度之比[26]。
1.5 叶绿素含量每种植物分别在两地采集不同植株上长势良好的3片叶子,每片叶子取0.5 g,剪碎放入研钵中, 加入10 mL 80%丙酮研磨成浆,加入5 mL乙醇过滤, 滤液使用80%的丙酮定容至25 mL,使用分光光度计分别在663和645 nm波长处测定吸光度,采用Arnon公式[27]计算叶绿素a和叶绿素b含量:Chl a= 12.27×OD663–2.52×OD645; Chl b=20.10×OD645–4.92× OD663。
1.6 抗氧化酶活性和总抗氧化能力超氧化物歧化酶(SOD)活性的测定 每种植物分别在两地采集不同植株上长势良好的3片叶子, 每片叶子取0.1 g,采用氮蓝四唑法[27]测定, 使用分光光度计测定560 nm处的吸光值,以抑制NBT光化还原的50%定义为1个酶还原单位(U/g FW)。
过氧化物酶(POD)活性的测定 每种植物分别在两地采集不同植株上长势良好的3片叶子,每片叶子取0.1g,采用愈创木酚显色法,以每min内A470变化0.5作为1个酶活力单位(U/g FW) [27]。
过氧化氢酶(CAT)活性的测定 每种植物分别在两地采集不同植株上长势良好的3片叶子,每片叶子取0.1 g,采用紫外吸收法以1 g叶片1 min催化1 nmol H2O2反应作为1个酶活力单位(U/g FW) [27]。
总抗氧化能力(T-AOC)的测定 每种植物分别在两地采集不同植株上长势良好的3片叶子,每片叶子取0.1 g,采用FRAP法[28],检测蓝色产物Fe2+-TPTZ在593 nm处的吸光值,计算T-AOC,单位为U/g FW。
脯氨酸(Pro)含量的测定 每种植物分别在两地采集不同植株上长势良好的3片叶子,每片叶子取0.2 g,采用磺基水杨酸法,测定520 nm处吸光值,计算Pro含量,单位为μg/g FW[29]。
丙二醛(MDA)含量的测定 每种植物分别在两地采集不同植株上长势良好的3片叶子,每片叶子取0.5 g叶片,采用硫代巴比妥酸法[30],测定532和600 nm处的吸光值,计算MDA含量,单位为nmol/g FW。
1.7 数据处理采用Excel 2016整理数据,使用SPSS 22.0软件进行数据的统计分析,用OriginPro 2017进行作图。
2 结果和分析 2.1 形态解剖学特征比叶面积、叶片厚度和干物质含量 由图 1可见,海岛桑树的比叶面积显著高于文昌,其余3种植物在两地间无显著差异。4种植物的叶片厚度在两地间均存在显著差异,海岛的银叶树、黄金香柳和夹竹桃叶片厚度显著大于文昌,而文昌桑树的叶片厚度显著高于海岛。海岛的黄金香柳叶干物质含量比文昌显著增高,而其余3种植物在两地间则没有显著差异。
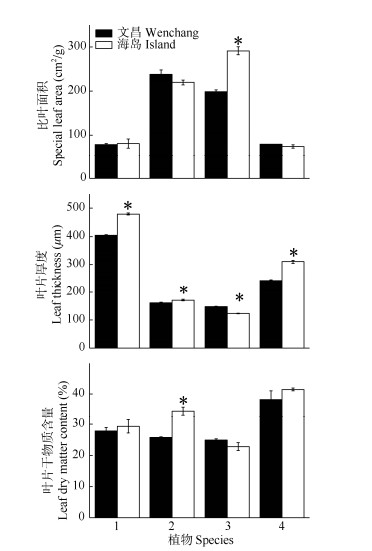
|
图 1 4种木本植物的比叶面积、叶片厚度、叶片干物质含量。1: 夹竹桃; 2: 黄金香柳; 3: 桑树; 4: 银叶树; *: P < 0.05; n=3。下同 Fig. 1 Special leaf area, leaf thickness, leaf dry matter content of four woody species. 1: Nerium indicum; 2: Melaleuca bracteata; 3: Morus alba; 4: Heritiera littoralis; *: P < 0.05; n=3; The same below |
栅栏组织和海绵组织厚度 由图 2可见,夹竹桃和桑树的栅栏组织厚度在两地间存在显著差异,海岛的夹竹桃栅栏组织厚度显著大于文昌, 而桑树则相反,其余两种植物则无明显差异。夹竹桃和银叶树的海绵组织厚度在两地间也存在显著差异,且均为海岛的显著增高,其余两种无显著差异。除夹竹桃外,文昌的黄金香柳、桑树和银叶树的栅栏组织与海绵组织厚度之比均显著高于海岛。
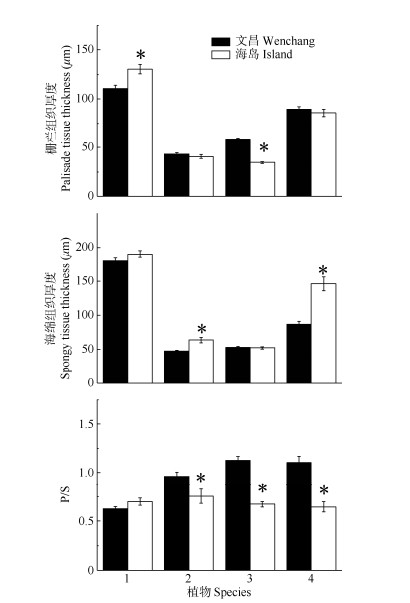
|
图 2 4种木本植物的栅栏组织(P)和海绵组织厚度(S)及其比率(P/S)。n=18 Fig. 2 Palisade tissue thickness (P), spongy tissue thickness (S) and P/S of four woody species. n=18 |
抗氧化能力 由图 3可见,海岛4种植物的SOD活性均显著高于文昌。海岛夹竹桃和银叶树的POD活性显著小于文昌,其余两种植物则无显著差异。文昌夹竹桃和银叶树的CAT活性显著高于海岛,而黄金香柳和桑树则相反。海岛夹竹桃、黄金香柳和银叶树的T-AOC显著高于文昌,而桑树却相反。
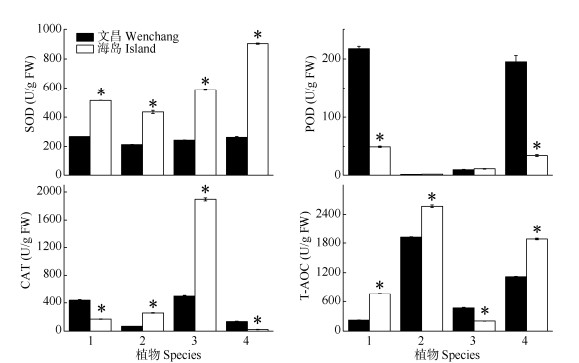
|
图 3 4种木本植物的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和总抗氧化能力(T-AOC) Fig. 3 Activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) and total antioxidant capacity (T-AOC) of four woody species |
叶绿素、脯氨酸和丙二醛含量 由图 4可见,海岛夹竹桃和桑树叶片的叶绿素含量显著高于文昌;而海岛黄金香柳和银叶树则显著低于文昌。海岛黄金香柳、桑树和银叶树的Pro含量比文昌显著增高,而夹竹桃则相反。4种植物的叶片MDA含量均表现为海岛显著高于文昌。
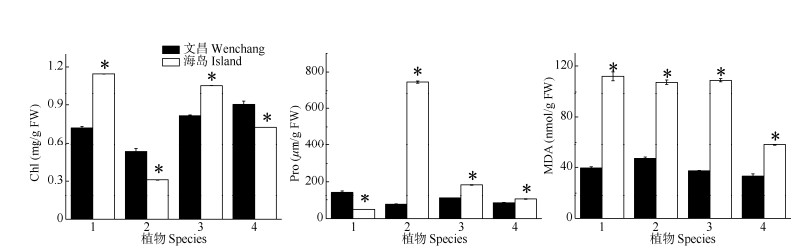
|
图 4 4种木本植物的叶绿素(Chl)、游离脯氨酸(Pro)和丙二醛(MDA)含量 Fig. 4 Contents of chlorophyll (Chl), proline (Pro) and malondialdehyde (MDA) of four woody species |
干旱胁迫下,植物通常减小叶面积并降低蒸腾作用,从而减少水分散失[31];增加叶片厚度,有效提升叶片储水能力[32]。厚且排列紧密的栅栏组织有利于提高植物对光能的利用效率,减轻强光对叶肉细胞的灼伤[5]。较低的比叶面积可以避免强光辐射和降低蒸腾失水[33]。本研究结果类似,热带珊瑚岛极端生境中夹竹桃、黄金香柳和银叶树的叶片厚度显著增大,夹竹桃的栅栏组织厚度显著增大,黄金香柳和银叶树的海绵组织厚度显著增大,保护叶肉细胞免受干旱和高光胁迫。
干旱胁迫、盐胁迫以及强光胁迫都会使得叶片超氧阴离子、过氧化氢和膜脂过氧化产物的积累, 从而抑制植物体叶绿素的合成、加速叶绿素的衰解,导致叶片内叶绿素含量下降[34–36]。在强光胁迫下,叶绿素含量的降低可以反过来减少或避免植物光合系统受到过剩光能的伤害[11]。叶绿素含量升高可以使植物叶片在承受更多伤害的代价下,吸收和转化更多的光能,获取更高的补偿能力[37–38]。在对热带珊瑚岛生境的适应过程中,黄金香柳和银叶树的叶绿素含量显著降低,表明这2种植物通过降低叶绿素含量、减少受到的强光伤害以适应热带珊瑚岛生境;夹竹桃和桑树的叶绿素含量表现为显著升高,说明这两种植物通过提高自身光合碳同化潜力来适应热带珊瑚岛生境。
高温、干旱、盐碱等胁迫都会引起植物细胞代谢失调,造成活性氧物质的增多和积累,从而引起植物细胞膜脂过氧化,产生MDA[34, 39–40]。SOD将超氧阴离子转化为毒性较低的过氧化氢,过氧化氢则进一步被CAT和POD分解[12]。本研究结果表明, 与文昌苗圃生境同种植物相比,热带珊瑚岛生境的这4种植物的SOD活性都显著增大,说明这4种植物在抗氧化方面对热带珊瑚岛生境具有一定的调整适应能力。之前的研究表明,热带珊瑚岛适生植物长春花(Catharanthus roseus)、狗牙根(Cynodon dactylon)、大叶相思(Acacia auriculiformis)、木麻黄(Casuarina equisetifolia)亦在对热带珊瑚岛生境的适应过程中显著提高了SOD活性[11, 21],说明在适应热带珊瑚岛生境胁迫过程中, 植物叶片SOD清除超氧阴离子具有重要意义。在POD和CAT活性响应上,4种植物表现出种间差异。与文昌苗圃生境相比, 热带珊瑚岛生境的黄金香柳和桑树的POD活性未表现出显著差异,CAT活性则显著提高;夹竹桃和银叶树的POD和CAT活性都显著降低。在总抗氧化能力上,热带珊瑚岛的夹竹桃、黄金香柳和银叶树的T-AOC都显著提高, 表现出在抗氧化方面对热带珊瑚岛生境较好的适应性。这说明夹竹桃和银叶树叶片的POD和CAT要比SOD对热带珊瑚岛生境胁迫更为敏感,热带珊瑚岛生境胁迫一定程度抑制了夹竹桃和银叶树通过POD和CAT清除过氧化氢的能力,以及夹竹桃和银叶树倾向于通过非酶类抗氧化物质清除过氧化氢。另一方面说明,同样处于热带珊瑚岛生境下的黄金香柳和桑树具有维持和提升通过POD和CAT来清除过氧化氢的能力。一些非酶类抗氧化物质如类黄酮,可以直接清除超氧阴离子、过氧化氢和氢氧根离子等活性氧物质[41],主要定位于液泡, 而超氧阴离子不能从叶绿体扩散至液泡,比较稳定的过氧化氢则可以穿过生物膜[42]。这意味着植物在处理过氧化氢上比在处理超氧阴离子上具有更多的“可选择”途径,可帮助解释这些植物在适应热带珊瑚岛生境过程中, 在SOD活性响应方面的相对一致性以及在POD和CAT活性响应方面的种间差异。
两地间4种植物的T-AOC和3种抗氧化酶活性的变化趋势表明,除该3种抗氧化酶以外的抗氧化途径在夹竹桃、黄金香柳和银叶树占较大比重, 且随对热带珊瑚岛生境的适应过程明显增加。非酶类抗氧化物质在其中起着重要作用,尤其在清除过氧化氢方面[42]。部分非酶类抗氧化物质的优势在于合成成本较低,且能获得较高的防御收益,如类黄酮和甘露醇这样仅由C、H、O组成的化合物[43]。夹竹桃、黄金香柳和银叶树可能通过对这些途径的侧重选择适应热带珊瑚岛贫瘠生境。Pro是植物在胁迫生境中的主要渗透调节物质之一[13]。在一定范围内,植物受到的渗透胁迫程度越高,Pro积累越明显[44–45]。与文昌生境的夹竹桃相比,热带珊瑚岛生境的夹竹桃Pro含量显著下降,可能由于夹竹桃植株内Pro合成所需的相关酶活性在热带珊瑚岛生境胁迫下受到了抑制[46]。热带珊瑚岛生境的黄金香柳、桑树和银叶树与文昌生境同种植物相比,Pro含量都显著增高,表明黄金香柳、桑树和银叶树面对热带珊瑚岛胁迫生境能够对渗透胁迫做出良好响应以适应干旱环境。MDA是膜脂过氧化最终产物,其含量可作为指示植物受氧化胁迫程度的指标[40]。与文昌生境相比,热带珊瑚岛生境4种植物的MDA含量都显著提高,这表明热带珊瑚岛生境对这4种植物具有一定程度的氧化胁迫伤害,膜系统结构受到了一定的破坏。
桑树作为4种植物中唯一的落叶木本,对海岛生境的响应与其他3种植物有较大差异。有研究表明,短的叶寿命或落叶性是植物对干旱等胁迫的一种适应方式[47],且落叶可将叶片中的有害物质带离植株。本研究中桑树的叶片在形态结构以及生理生化的响应变化上整体呈现出叶片寿命变短的倾向(如比叶面积增大、叶片厚度降低、T-AOC降低), 因此推测海岛生境胁迫对桑树的叶片具有较大程度的伤害,导致叶片寿命变短,同时桑树可能将叶片构件寿命的变短作为一种适应策略,减小生境胁迫对植物体的伤害。即桑树可能利用落叶行为来适应海岛生境。具体的相关机制仍需进一步实验探索以证实。
3.2 4种植物的适应性策略探讨本研究中4种植物对热带珊瑚岛生境的适应策略存在差异。基于所测指标,4种植物对热带珊瑚岛生境的适应策略可分为2类,一类如夹竹桃和桑树,通过提升叶绿素含量来增加营养吸收能力、补偿能力,在受到胁迫伤害后能够较快恢复[48],代价是承受较多强光伤害,最终表现为“提高碳同化潜力-承受更高伤害”策略;另一类如黄金香柳和银叶树,叶绿素含量受环境胁迫影响后降低,对胁迫中受损的补偿能力下降,转而将资源分配于此时合成成本相对较低且防御收益较大的抗逆性物质(如抗坏血酸、类黄酮、脯氨酸等),提高自身对胁迫的抵抗能力[49],代价是碳同化潜力降低、生长较慢,最终表现为“提高抵抗力-降低碳同化潜力”策略。
前人[50–51]研究表明,具有较高异地定殖能力的植物通常有较高的资源获取能力以及较低的叶片结构投入。从该角度,本研究的4种植物中偏向“提高碳同化潜力-承受更高伤害”适应策略的夹竹桃和桑树较适合作为先锋物种进行植被构建与修复。在鄱阳湖沙化土地修复中,夹竹桃便作为前期引入物种应用[52],桑树在国内的防沙治沙、水土保持、盐碱地治理以及石漠化治理中亦发挥重要作用[53]。
综上,本研究中的4种木本植物都能够在热带珊瑚岛生境中生存并完成生活史,对热带珊瑚岛生境具有一定的适应性。在对热带珊瑚岛的适应策略方面,黄金香柳和银叶树呈现为“提高抵抗力-降低碳同化潜力”策略;夹竹桃和桑树呈现出“提高碳同化潜力-承受更高强光伤害”策略,或可作为先锋物种应用于热带珊瑚岛植被的构建与恢复。本研究为热带珊瑚岛植被修复工具种的预筛选和功能分类提供了一定的参考依据,但热带珊瑚岛适生植物适应策略的分类及适应策略差异与工具种功能分类的关系,还有待进一步研究。
| [1] |
REN H, JIAN S G, ZHANG Q M, et al. Plants and vegetation on South China Sea Islands[J]. Ecol Environ Sci, 2017, 26(10): 1639-1648. 任海, 简曙光, 张倩媚, 等. 中国南海诸岛的植物和植被现状[J]. 生态环境学报, 2017, 26(10): 1639-1648. DOI:10.16258/j.cnki.1674-5906.2017.10.001 |
| [2] |
JIAN S G, REN H. Atlas on Tool Species for Vegetation Restoration on Tropical Coral Islands[M]. 简曙光, 任海. 热带珊瑚岛礁植被恢复工具种图谱[M]. 北京: 中国林业出版社, 2017: 2-119. |
| [3] |
LI P, HUANG Z L. A study on vegetation restoration for the degenerated sloping grassland in Nan'ao Island[J]. Trop Geogr, 2007, 27(1): 21-24. 南澳岛退化草坡的植被恢复研究[J]. 热带地理, 2007, 27(1): 21-24. DOI:10.3969/j.issn.1001-5221.2007.01.005 |
| [4] |
WEIHER E, WERF A, THOMPSON K, et al. Challenging Theophrastus: A common core list of plant traits for functional ecology[J]. J Veg Sci, 1999, 10(5): 609-620. DOI:10.2307/3237076 |
| [5] |
BRADSHAW A D. Evolutionary significance of phenotypic plasticity in plants[J]. Adv Genet, 1965, 13: 115-155. DOI:10.1016/S0065-2660(08)60048-6 |
| [6] |
BRADSHAW A D. Unravelling phenotypic plasticity: Why should we bother?[J]. New Phytol, 2006, 170(4): 644-648. DOI:10.1111/j.1469-8137.2006.01761.x |
| [7] |
HU Q P, GUO Z H, LI C Y, et al. Advance at phenotypic plasticity in plant responses to abiotic factors[J]. Sci Silv Sin, 2008, 44(5): 135-142. 植物表型可塑性对非生物环境因子的响应研究进展[J]. 林业科学, 2008, 44(5): 135-142. DOI:10.3321/j.issn:1001-7488.2008.05.025 |
| [8] |
GUI Z, GAO J M. Influence of 6 alfalfa varieties on free proline content and SOD activity in salt stress[J]. J Tianjin Agric Univ, 2007, 14(4): 18-21. 盐胁迫对6个苜蓿品种脯氨酸含量和超氧化物歧化酶活性的影响[J]. 天津农学院学报, 2007, 14(4): 18-21. DOI:10.3969/j.issn.1008-5394.2007.04.005 |
| [9] |
DONG J F, LI C H, LIU G H, et al. Analysis of drought resistance by leaf anatomical structure of six species of sandy willows[J]. J Desert Res, 2009, 29(3): 480-484. 内蒙古6种沙生柳树叶片解剖结构的抗旱性分析[J]. 中国沙漠, 2009, 29(3): 480-484. |
| [10] |
LUO Q, LIU H, WU G L, et al. Using functional traits to evaluate the adaptability of five plant species on tropical coral islands[J]. Acta Ecol Sin, 2018, 38(4): 1256-1263. 基于功能性状评价5种植物对热带珊瑚岛环境的适应性[J]. 生态学报, 2018, 38(4): 1256-1263. DOI:10.5846/stxb201612152597 |
| [11] |
TONG S H, LIU N, WANG J, et al. Ecological and physiological adaptabilities of Catharanthus roseus to tropical coral island[J]. Guihaia, 2020, 40(3): 384-394. 长春花(Catharanthus roseus)对热带珊瑚岛生理生态适应性研究[J]. 广西植物, 2020, 40(3): 384-394. DOI:10.11931/guihaia.gxzw201902010 |
| [12] |
ZHANG Y F, YIN B. Influences of salt and alkali mixed stresses on antioxidative activity and MDA content of Medicago sativa at seedling stage[J]. Acta Prat Sin, 2009, 18(1): 46-50. 混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J]. 草业学报, 2009, 18(1): 46-50. DOI:10.3321/j.issn:1004-5759.2009.01.007 |
| [13] |
DOBRA J, MOTYKA V, DOBREV P, et al. Comparison of hormonal responses to heat, drought and combined stress in tobacco plants with elevated proline content[J]. J Plant Physiol, 2010, 167(16): 1360-1370. DOI:10.1016/j.jplph.2010.05.013 |
| [14] |
ZHAO F B, WANG L Q, JI G H, et al. Effects of NaCl stress on plant biology indicators and MDA content of 3 submerged plants[J]. Environ Pollut Control, 2012, 34(10): 40-44. 盐胁迫对3种沉水植物生物学指标及叶片中丙二醛含量的影响[J]. 环境污染与防治, 2012, 34(10): 40-44. DOI:10.15985/j.cnki.1001-3865.2012.10.001 |
| [15] |
ZHANG L, LIU Z W, JIANG D Q. Ecological investigation of the vegetation in the paracel islands[J]. Chin Agric Sci Bull, 2011, 27(14): 181-186. 西沙群岛植被生态调查[J]. 中国农学通报, 2011, 27(14): 181-186. |
| [16] |
XIONG H S. Reef area navigation environment safety evaluation research [D]. Dalian: Dalian Maritime University, 2014. 熊海生. 岛礁区通航环境安全评估研究[D]. 大连: 大连海事大学, 2014. |
| [17] |
CASTILLA-BELTRÁN A, DUARTE I, DE NASCIMENTO L, et al. Using multiple palaeoecological indicators to guide biodiversity conservation in tropical dry islands: The case of São Nicolau, Cabo Verde[J]. Biol Conserv, 2020, 242: 108397. DOI:10.1016/j.biocon.2019.108397 |
| [18] |
TSANG Y P, TINGLEY R W, HSIAO J, et al. Identifying high value areas for conservation: Accounting for connections among terrestrial, freshwater, and marine habitats in a tropical island system[J]. J Nat Conserv, 2019, 50: 125711. DOI:10.1016/j.jnc.2019.125711 |
| [19] |
WANG B S, PENG S L, GUO L, et al. Diversity of tropical forest landscape types in Hainan Island, China[J]. Acta Ecol Sin, 2007, 27(5): 1690-1695. DOI:10.3321/j.issn:1000-0933.2007.05.003 |
| [20] |
LI J, LIU N, REN H, et al. Ecological adaptability of seven plant species to tropical coral island habitat[J]. Ecol Environ, 2016, 25(5): 790-794. 7种植物对热带珊瑚岛环境的生态适应性[J]. 生态环境学报, 2016, 25(5): 790-794. DOI:10.16258/j.cnki.1674-5906.2016.05.009 |
| [21] |
LIN Y X, LIU H, HE P C, et al. Physiological and biochemical responses of three species to environment stresses of tropical coral islands[J]. J Trop Subtrop Bot, 2017, 25(6): 562-568. 三种适生植物对热带珊瑚岛胁迫生境的生理生化响应[J]. 热带亚热带植物学报, 2017, 25(6): 562-568. DOI:10.11926/jtsb.3755 |
| [22] |
WANG X H, LIU N, REN H, et al. Ecological and biological characteristics of Pisonia grandis[J]. Guihaia, 2017, 37(12): 1489-1497. 抗风桐(Pisonia grandis)的生态生物学特征[J]. 广西植物, 2017, 37(12): 1489-1497. DOI:10.11931/guihaia.gxzw201709003 |
| [23] |
TONG Y, JIAN S G, CHEN Q, et al. Vascular plant diversity of the Paracel Islands, China[J]. Biodiv Sci, 2013, 21(3): 364-374. 中国西沙群岛植物多样性[J]. 生物多样性, 2013, 21(3): 364-374. DOI:10.3724/SP.J.1003.2013.11222 |
| [24] |
CORNELISSEN J H C, LAVOREL S, GARNIER E, et al. A handbook of protocols for standardized and easy measurement of plant functional traits worldwide[J]. Aust J Bot, 2003, 51(4): 335-380. DOI:10.1071/bt02124 |
| [25] |
ZHANG S M, LIU H Y, CHENG J J, et al. Free-hand section techniques for clear observation of cell structures of millet (Setaria italica) and rice (Oyrza sativa) leaves[J]. Genom Appl Biol, 2015, 34(7): 1527-1530. 快速徒手切片法观察谷子和水稻叶片显微结构[J]. 基因组学与应用生物学, 2015, 34(7): 1527-1530. DOI:10.13417/j.gab.034.001527 |
| [26] |
REN H, PENG S L, SUN G C, et al. The ecological comparison of Psychotria rubra and Rhodomyrtus tomentosa in south China[J]. Chin J Plant Ecol, 1997, 21(4): 386-392. 广东中部两种常见灌木的生态学比较[J]. 植物生态学报, 1997, 21(4): 386-392. |
| [27] |
LI H S, SUN Q, ZHAO S J, et al. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 1-278. 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 1-278. |
| [28] |
FANG M, WANG Y F, GONG Z Y. Study on antioxidant activities of fifty kinds of fruits and thirty-three kinds of vegetables[J]. Food Sci, 2008, 29(10): 97-100. 15种水果和33种蔬菜的抗氧化活性研究[J]. 食品科学, 2008, 29(10): 97-100. DOI:10.3321/j.issn:1002-6630.2008.10.015 |
| [29] |
ZHANG D Z, WANG P H, ZHAO H X. Determination of the content of free proline in wheat leaves[J]. Plant Physiol Commun, 1990, 4: 62-65. 测定小麦叶片游离脯氨酸含量的方法[J]. 植物生理学通讯, 1990, 4: 62-65. DOI:10.13592/j.cnki.ppj.1990.04.030 |
| [30] |
LIN Z F, LI S S, LIN G Z, et al. Superoxide dismutase activity and lipid peroxidation in relation to senescence of rice leaves[J]. Acta Bot Sin, 1984, 26(6): 605-615. 水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J]. 植物学报, 1984, 26(6): 605-615. |
| [31] |
YE L H, HUANG X L, XUE L. Effects of drought on leaf traits and drought-resistant physiology of trees[J]. World For Res, 2014, 27(1): 29-34. 干旱对树木叶片性状及抗旱生理的影响[J]. 世界林业研究, 2014, 27(1): 29-34. DOI:10.13348/j.cnki.sjlyyj.2014.01.006 |
| [32] |
SU H, LI Y G, LAN Z J, et al. Leaf-level plasticity of Salix gordejevii in fixed dunes compared with lowlands in Hunshandake Sandland, north China[J]. J Plant Res, 2009, 122(6): 611-622. DOI:10.1007/s10265-009-0249-1 |
| [33] |
REICH P B, WALTERS M B, ELLSWORTH D S, et al. Relationships of leaf dark respiration to leaf nitrogen, specific leaf area and leaf life-span: A test across biomes and functional groups[J]. Oecologia, 1998, 114(4): 471-482. DOI:10.1007/s004420050471 |
| [34] |
YANG S H, JI J, WANG G. Effects of salt stress on plants and the mechanism of salt tolerance[J]. World Sci-Technol Res Devlop, 2006, 28(4): 70-76. 盐胁迫对植物的影响及植物的抗盐机理[J]. 世界科技研究与发展, 2006, 28(4): 70-76. DOI:10.16507/j.issn.1006-6055.2006.04.012 |
| [35] |
TENG Z H, ZHI L, ZONG X F, et al. Effects of high temperature on chlorophyll fluorescence, active oxygen resistance activity, and grain quality in grain-filling periods in rice plants[J]. Acta Agron Sin, 2008, 34(9): 1662-1666. 高温胁迫对水稻灌浆结实期叶绿素荧光、抗活性氧活力和稻米品质的影响[J]. 作物学报, 2008, 34(9): 1662-1666. DOI:10.3724/SP.J.1006.2008.01662 |
| [36] |
JIAO D M, LI X, HUANG X Q, et al. The relationship among photoinhibition, photooxidation and early aging at later developmental stages in different high yield varieties[J]. Sci Agric Sin, 2002, 35(5): 487-492. 不同高产水稻品种生育后期叶片光抑制、光氧化和早衰的关系[J]. 中国农业科学, 2002, 35(5): 487-492. DOI:10.3321/j.issn:0578-1752.2002.05.005 |
| [37] |
ZHAO Y J, WENG B Q, WANG Y X, et al. Plant physio-ecological responses to drought stress and its research progress[J]. Fujian Sci Technol Rice Wheat, 2009, 27(2): 45-50. 植物对干旱胁迫的生理生态响应及其研究进展[J]. 福建稻麦科技, 2009, 27(2): 45-50. DOI:10.3969/j.issn.1008-9799.2009.02.022 |
| [38] |
HAVAUX M, TARDY F. Thermostability and photostability of photosystem Ⅱ in leaves of the chlorina-f2 barley mutant deficient in lightharvesting chlorophyll a/b protein complexes[J]. Plant Physiol, 1997, 113(3): 913-923. DOI:10.1104/PP.113.3.913 |
| [39] |
CHEN P Q, YU S L, ZHAN Y N, et al. A review on plant heat stress physiology[J]. Chin Agric Sci Bull, 2006, 22(5): 223-227. 植物在高温胁迫下的生理研究进展[J]. 中国农学通报, 2006, 22(5): 223-227. DOI:10.3969/j.issn.1000-6850.2006.05.060 |
| [40] |
ZHANG H M, WANG M Y, HOU J H. Effects of drought stress upon the contents of hydrogen peroxide and MDA and the activities of SOD and CAT in maize[J]. J Inner Mongolia Inst Anim Husb, 1993, 14(4): 92-95. 干旱对玉米过氧化氢、MDA含量及SOD、CAT活性的影响[J]. 内蒙古农牧学院学报, 1993, 14(4): 92-95. |
| [41] |
YAMASAKI H, HESHIKI R, IKEHARA N. Leaf-goldenning induced by high light in Ficus microcarpa L. f., a tropical fig[J]. J Plant Res, 1995, 108(2): 171-180. DOI:10.1007/BF02344341 |
| [42] |
DU X M, YIN W X, ZHAO Y X, et al. The production and scavenging of reactive oxygen species in plants[J]. Chin J Biotechnol, 2001, 17(2): 121-125. 植物中活性氧的产生及清除机制[J]. 生物工程学报, 2001, 17(2): 121-125. DOI:10.3321/j.issn:1000-3061.2001.02.003 |
| [43] |
WANG X F, GAO W Q, LIU J F, et al. Plant defensive strategies and environment-driven mechanisms[J]. Chin J Ecol, 2015, 34(12): 3542-3552. 植物防御策略及其环境驱动机制[J]. 生态学杂志, 2015, 34(12): 3542-3552. DOI:10.13292/j.1000-4890.2015.0333 |
| [44] |
LU J J, DUO L A, LIU X J. Changes in SOD and POD activity and free proline content of Lolium perenne and Festuca elata leaves under different levels of salt stress[J]. Bull Bot Res, 2004, 24(1): 115-119. 盐胁迫下两草种SOD和POD及脯氨酸动态研究[J]. 植物研究, 2004, 24(1): 115-119. DOI:10.3969/j.issn.1673-5102.2004.01.027 |
| [45] |
LUO J X, MA L, CHAI C J, et al. Effect of drought stress on growth and MDA and proline of Cotoneaster hjelmqvistii[J]. Tianjin Agric Sci, 2009, 15(1): 1-4. 干旱胁迫对海姆维斯蒂栒子生长及丙二醛和脯氨酸含量的影响[J]. 天津农业科学, 2009, 15(1): 1-4. |
| [46] |
HONG Z L, LAKKINENI K, ZHANG Z M, et al. Removal of feedback inhibition of Δ1-pyrroline-5-carboxylate synthetase results in increased proline accumulation and protection of plants from osmotic stress[J]. Plant Physiol, 2000, 122(4): 1129-1136. DOI:10.1104/pp.122.4.1129 |
| [47] |
ZHANG L, LUO T X. Advances in ecological studies on leaf lifespan and associated leaf traits[J]. Chin J Plant Ecol, 2004, 28(6): 844-852. 植物叶寿命及其相关叶性状的生态学研究进展[J]. 植物生态学报, 2004, 28(6): 844-852. DOI:10.17521/cjpe.2004.0110 |
| [48] |
SHEARMAN R C, BEARD J B. Turfgrass wear tolerance mechanisms: Ⅲ. Physiological, morphological, and anatomical characteristics asso-ciated with turfgrass wear tolerance[J]. Agron J, 1975, 67(2): 215-218. DOI:10.2134/agronj1975.00021962006700020011x |
| [49] |
ROSENTHAL G A, BERENBAUM M R, Herbivores. Their Inter-actions with Secondary Plant Metabolites[M]. San Diego: Academic Press, 1992, 2nd ed: 1-468.
|
| [50] |
OSUNKOYA O O, BAYLISS D, PANETTA F D, et al. Leaf trait coordination in relation to construction cost, carbon gain and resourceuse efficiency in exotic invasive and native woody vine species[J]. Ann Bot, 2010, 106(2): 371-380. DOI:10.1093/aob/mcq119 |
| [51] |
LEISHMAN M R, HASLEHURST T, ARES A, et al. Leaf trait relationships of native and invasive plants: Communityand global-scale comparisons[J]. New Phytol, 2007, 176(3): 635-643. DOI:10.1111/j.1469-8137.2007.02189.x |
| [52] |
MA Y J. Study on the characteristics of soil bacterial communities under different vegetation restoration methods in desertificated land of Poyang Lake [D]. Nanchang: Jiangxi Normal University, 2020. 马永杰. 鄱阳湖沙化土地不同植被恢复方式下的土壤细菌群落特征研究[D]. 南昌: 江西师范大学, 2020. |
| [53] |
ZHANG C, XIONG J W, SHU Y, et al. Research progress of Morus alba L. and its ecological functions[J]. CS For Inventory Plan, 2016, 35(3): 53-56. 桑树及其生态功能的研究进展[J]. 中南林业调查规划, 2016, 35(3): 53-56. DOI:10.16166/j.cnki.cn43-1095.2016.03.012 |
 2023, Vol. 31
2023, Vol. 31


