2. 沈阳农业大学, 沈阳 110866
2. College of Bioscience and Biotechnology, Shenyang Agricultural University, Shenyang 110866, China
西双版纳位于具有山原地貌和热带季风气候特点的大陆东南亚热带北缘,气候季节性干旱和低温是西双版纳有别于典型热带雨林地区的2个主要特征,虽然如此,该区却有典型的热带雨林,并且大量的附生植物终年常绿不衰[1]。该区干季(11—4月)降雨仅约为全年的13%,但此季节雾较多[2],雾对该地区雨林的形成可能有重要意义[3–4]。不过西双版纳地区每日流落到地面的雾水仅0.39 mm[5], 难以透过枯落层进入土壤被植物根系吸收,但植物可以通过叶片角质层直接吸收雾水[6–7]。角质层是水分进出叶片的主要屏障:一方面当植物遇到水分胁迫时,气孔关闭,角质层蒸腾速度决定了植物散失到空气中水分的量,角质层是防止非可控失水的重要屏障[8];另一方面,雾露水可以经过角质层进入叶片[7, 9],角质层透性又能决定叶片吸收雾露水的多少,所以角质层透性研究在生态学上有重要的意义。附生植物附着在岩石或其它植物体上,干季无法从土壤中吸收水分,基质中水分又非常有限,因此易受水分胁迫,但是它们却能终年常绿不衰,必然有其特殊的适应策略,附生植物叶片可能具有强的保水能力或强的吸收利用雾水能力。本文比较研究了附生与非附生植物叶片水分进出角质层的透性,通过比较不同植物叶片通过角质层蒸腾失水与角质层吸水速率来探讨不同类型植物适应干季的策略及雾对不同植物的作用。我们假设:1) 附生植物叶片通过角质层吸水与角质层蒸腾失水的比值要高于非附生植物叶片;2) 温度可能会影响角质层的吸水与蒸腾失水速率,对于探讨雾水对附生植物的生态学效应具有重要意义。
1 材料和方法 1.1 研究区概况试验在中国科学院西双版纳热带植物园进行, 位于21°56ʹ N,101°15ʹ E,海拔约600 m,属北热带季风气候,年均降雨量为1 557 mm,年均气温21.5 ℃。与世界热带雨林分布的主要地区相比,西双版纳纬度偏北、海拔偏高、气候偏干,表现为热量偏低、年和日温差偏大、降雨偏少和降雨季节变化明显。该区一年中有明显的干季(11—翌年4月)和雨季(5—10月)之分,干季降水量仅约为全年的13%, 但此季节几乎天天有雾。
1.2 研究材料选取该区常见的4种附生(半附生)植物和4种非附生植物为材料,附生植物为兰科(Orchidaceae)的贝母兰(Coelogyne occultata)和掌唇兰(Staurochilus dawsonianus);半附生植物为实蕨科(Bolbitidaceae)的附着实蕨(Bolbitis scandens)和天南星科(Araceae)的爬树龙(Rhaphidophora decursiva)。非附生植物为鸭跖草科(Commelinaceae)的穿鞘花(Amischotolype hispida)、爵床科(Acanthaceae)的野靛棵(Mananthes patentiflora)、竹芋科(Marantaceae)的柊叶(Phrynium capitatum)、藤黄科(Guttiferae)的大叶藤黄(Garcinia xanthochymus)。
1.3 角质层分离和透性测定按王博轶等[10]的方法分离植物叶片角质层。为了减小气孔对角质层透性测定的影响,只收集分离后的叶片上表皮角质层[11];为了减小分离过程对角质层透性的影响,将分离后的角质层在聚乙烯塑料盒中保存3个月后再进行透性测定[12]。按Schonherr等[13]的方法测定角质层透性,该法操作简便,精度与同位素法相当。许多研究证实分离的角质层对水分透性可以较准确地反映叶片角质层蒸腾速率[14–15],同时角质层也是雾、露水进入叶片的主要通道[7, 9]。为比较不同类型植物角质层蒸腾和吸水速率的差异,角质层透性测定分2种方法:一为模拟角质蒸腾,蓄水池(5 mL)盛蒸馏水位于下方,角质层内表面朝向蒸馏水,角质层上方为盛满硅胶的干燥器, 即水蒸气-角质层-干燥空气密闭系统,硅胶质量的增加反映角质层蒸腾失水速率(PT: transpiration rate of water loss,单位面积单位时间失水量)[14–15];二为模拟叶片通过角质层吸水,蓄水器位于角质层外表面上方,下方为干燥器,即蒸馏水-角质层-干燥空气系统,硅胶质量的增加反映叶片通过角质层吸水的速率(PA: absorption rate,单位面积单位时间透水量)。PA与PT的比值R (ratio, 吸/失水能力比)具有重要意义,因为相同条件下R值大说明该植物叶片吸水能力高于蒸腾失水能力,我们把R值高低作为衡量植物吸水效率的指标。有研究表明温度可能会影响角质层的透性[16],为了与该区干季气温尽量保持一致,测定PT与PA时设定了20 ℃与30 ℃共2个温度[17]。本文的数据均为4~6片叶角质层的平均值±标准误。
试验数据利用SPSS 12.0进行统计分析,同种植物20 ℃与30 ℃下PT (PA)的差异及相同温度下同种植物PT和PA差异均采用独立样本t检验(independent t test)。相同温度下PT (PA)的种间差异采用单因素方差分析(One-Way Annova)。
1.4 叶片水势的日变化试验在8种植物都有分布的中国科学院西双版纳热带植物园沟谷雨林中进行。试验从7:30开始, 19:30结束,每隔2 h用SKPM-1400压力室测定1次叶片的水势(ψw),每种植物每次测定3片叶。
2 结果和分析 2.1 角质层透性的差异除贝母兰、掌唇兰和大叶藤黄外,30 ℃下各植物的PT、PA都显著高于20 ℃的(图 1, 2)。20 ℃下大叶藤黄的PT最高,野靛稞、附着实蕨、爬树龙的次之,但与大叶藤黄差异不显著;贝母兰、柊叶较低,掌唇兰和穿鞘花的居中。30 ℃时野靛稞的PT最高,附着实蕨、爬树龙次之,但三者的差异不显著;其次是穿鞘花和柊叶,二者比掌唇兰和柊叶略高,贝母兰最低。PA的变化与PT稍有不同,30 ℃下附着实蕨、爬树龙最高,野靛稞次之,其余植物PA差异不显著;20 ℃下附着实蕨、爬树龙PA也最高,柊叶次之,其余植物PA差异不显著。总体而言,附生植物和非附生植物的PT没有显著差异,但附生植物的PA要显著高于非附生植物。
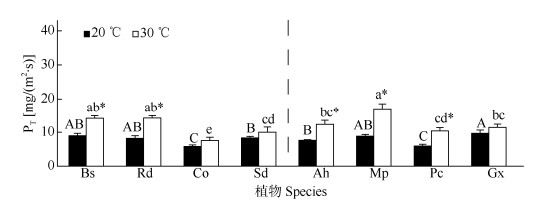
|
图 1 植物的角质层蒸腾失水速率(PT)。柱上不同大写和小写字母表示差异显著;*: P < 0.05; Bs: 附着实蕨; Rd: 爬树龙; Co: 贝母兰; Sd: 掌唇兰; Ah: 穿鞘花; Mp: 野靛棵; Pc: 柊叶; Gx: 大叶藤黄。下同 Fig. 1 Transpiration rate of water loss (PT) of cuticle membrane of plants. Different capital and small letters upon column indicate significant differences at 0.05 level; *: P < 0.05; Bs: Bolbitis scandens; Rd: Rhaphidophora decursiva; Co: Coelogyne occulata; Sd: Staturchilus dawsonianus; Ah: Amischotolupe hispida; Mp: Mananthes patentiflora; Pc: Phrynium capitatum; Gx: Garcinia xanthochymus. The same below |
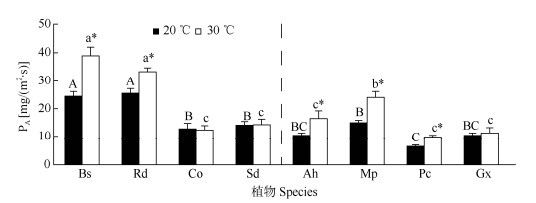
|
图 2 植物叶片的角质层吸水速率(PA) Fig. 2 Absorption rate (PA) from cuticle membrane of plant leaves |
植物叶片通过角质层吸水与失水的比值(R)在20 ℃与30 ℃下的变化趋势基本一致,爬树龙和附着实蕨最高,贝母兰和掌唇兰次之,而柊叶和大叶藤黄最低(图 3)。从总体上看,附生植物的R值要高于非附生植物。

|
图 3 植物叶片的吸水效率(R) Fig. 3 Water absorption efficiency of different plant leaves |
7:30-9:30各植物叶片的ψw变化不大,之后降低,13:30光强和温度最高时ψw最低,之后又升高(图 4)。掌唇兰、贝母兰的ψw一直较高,日变化较小,但爬树龙和附着实蕨的ψw日波动较大。非附生植物大叶藤黄叶片的ψw始终大于-0.2 Mpa,波动较小,而其余3种非附生植物的ψw日变化幅度较大。
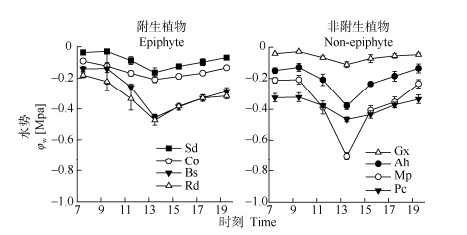
|
图 4 植物叶片水势的日变化 Fig. 4 Diurnal changes in water potential of plant leaves |
水分子进出叶片角质层有2条途径,一是通过脂类物质形成的通道,二是通过角质层一些特殊的极小的极性小孔[18–19]。本研究中,相同条件下多数植物的PA与PT有较大的差异,这可能一方面由于叶片内外水分梯度差异造成的,另一方面可能是因为水分子从外界进入叶片和从叶片散失到大气中的路径不同所致。不同植物角质层对水分的透性差异较大,但角质层透性与其厚度无直接关系,并非厚度越大,透性越小,如穿鞘花角质层最厚,但其角质层透性并非最低,这与前人[15, 18, 20–21]的报道类似。这可能是因为不同植物角质层中角质与蜡质的成分、比例以及分布格局并不相同,造成不同的角质层其物理及化学性质不同,以致相同条件下不同植物角质层透性差异较大[15, 22–24]。虽然附生与非附生植物的PT没有显著差异,但总体上附生植物的PA要显著高于非附生植物,说明附生植物叶片角质层吸水能力强于非附生植物。
多数植物叶片角质层的PA和PT随温度升高而显著升高,与前人[8, 25]的研究结果相似,可能是因为温度升高一方面使水分子扩散加剧,而另一方面也可以影响角质层结构[16, 19, 22]。但贝母兰、掌唇兰、大叶藤黄20 ℃时的PT、PA与30 ℃时的差异均不显著,表明不同植物角质层组成及结构可能不同,其透性(PA和PT)对温度响应也不一致,Schreiber[16]也曾报道类似现象,认为可能与不同植物温度适应范围不同有关。虽然,温度升高了大多数植物的PA和PT,但各植物的R值在20 ℃和30 ℃下并没有太大的差异,这说明虽然不同物种的透性对温度的响应不一致,但对同一物种而言,温度对PA、PT的影响大致相当。
附生植物是热带雨林中的一个特殊类群,他们附着在岩石或其它植物树干上,干季无法从土壤中吸收水分,基质中水分又非常有限,因此易受水分胁迫,但是他们却能终年常绿不衰,必然有其特殊的适应策略。本研究中所有附生植物的叶片角质层吸水速率与失水速率的比值(R)在20 ℃与30 ℃都高于非附生植物,说明附生植物叶片比非附生植物叶片具有高的吸水效率,这有助于干季附生植物比非附生植物能够更加有效的吸收雾、露水,缓解干旱胁迫。其中,附着实蕨和爬树龙角质层的PA显著高于其余6种植物,但PT仅显著高于贝母兰和柊叶,说明叶片不仅具有较强的吸收水分的能力,同时还具有较强保水能力[26],有利于二者干季快速、高效地吸收雾、露水。非附生植物柊叶在20 ℃与30 ℃下PT、PA和R都较低,其叶片水分利用策略可能主要是保水型(叶片吸收水分虽然少,但蒸腾失水更少)。另外一种非附生植物大叶藤黄20 ℃下角质层蒸腾失水高于其它植物,角质层吸水又较少, 但测得其日间水势与所试其它植物相比却一直较高,这可能与其生活型有关,大叶藤黄属乔木具有较发达的根系,能够吸收大量地下水,20 ℃下叶片蒸腾散失少量水分可能对其本身水分状况影响不大,但30 ℃下相对失水较少,说明高温下保水能力较强。此外,附生植物的生物量分配与非附生植物差别较大,多数附生植物叶生物量分数通常比非附生植物高很多[27],一方面利于其弱光下增加同化物积累,另一方面也便于增加吸收雾及露水的量。
西双版纳地区干季多雾[2],雾可使气温降低[5],湿度增大,日间光强减弱,减小蒸腾失水,同时雾还可以降低上午光强,避免夜晚及上午低温结合强光给本区植物造成的伤害[28–29]。由于干季几乎无雨,叶片吸收雾水以及保水能力的高低对附生植物干季能否存活可能具有至关重要的作用,雾水对附生植物而言意义更大。最近,有研究表明雾水是西双版纳地区附生植物干季重要的水资源[30], 叶片吸收雾水的能力对附生植物抵御干季水分亏缺具有重要的意义[31–32]。本研究也表明附生植物叶片通过角质层吸水与失水的比值比非附生植物高,说明附生植物叶片能够更有效利用雾、露水,这与角质层特性密切相关。相同条件下不同植物角质层透性差异较大,可能与其物理及化学结构密切相关[22–23], 如果能够人工调控植物角质层对水分进出的透性, 将会提高植物抗逆性,所以今后对角质层的化学成分分析、物理结构特点以及其透性调控机制的研究意义重大。
| [1] |
ZHU H. A comparative study of phytosociology between Shorea chinensis forest of Xishuangbanna and other closer forest types[J]. Acta Bot Yunnan, 1993, 15(1): 34-46. 朱华. 望天树林与相近类型植被结构的比较研究[J]. 云南植物研究, 1993, 15(1): 34-46. |
| [2] |
GONG D N, WANG J H. Survey on climate in Xishuangbanna Nature Reserve[M]// Comprehensive Investigation Team of Xishuangbanna Nature Reserve. A Comprehensive Survey Collection of Xishuangbanna Nature Reserve. Kunming: Yunnan Science and Technology Press, 1987: 44–56. 龚德能, 王建浩. 西双版纳自然保护区气候考察报告[M]// 西双版纳自然保护区综合考察团. 西双版纳自然保护区综合考察报告集. 昆明: 云南科技出版社, 1987: 44–56. |
| [3] |
LIU W J, ZHANG K Y, ZHANG G M, et al. Canopy interceptive effect of dew and fog resources from dry season tropical rainforest in Xishuangbana[J]. Resour Sci, 2001, 23(2): 75-80. 刘文杰, 张克映, 张光明, 等. 西双版纳热带雨林干季林冠雾露水资源效应研究[J]. 资源科学, 2001, 23(2): 75-80. DOI:10.3321/j.issn:1007-7588.2001.02.017 |
| [4] |
LIU W J, LI H M, DUAN W P. An analysis of the dew resource in the Xishuangbanna area[J]. J Nat Resour, 1998, 13(1): 40-44. 刘文杰, 李红梅, 段文平. 西双版纳地区露水资源分析[J]. 自然资源学报, 1998, 13(1): 40-44. DOI:10.3321/j.issn:1000-3037.1998.01.007 |
| [5] |
LIU W J, ZENG J M, WANG C M, et al. On the relationship between forests and occult precipitation (dew and fog precipitation)[J]. J Nat Resour, 2001, 16(6): 571-575. 刘文杰, 曾觉民, 王昌命, 等. 森林与雾露水关系研究进展[J]. 自然资源学报, 2001, 16(6): 571-575. DOI:10.3321/j.issn:1000-3037.2001.06.016 |
| [6] |
GRAMMATIKOPOULOS G, MANETAS Y. Direct absorption of water by hairy leaves of Phlomis fruticosa and its contribution to drought avoidance[J]. Can J Bot, 1994, 72(12): 1805-1811. DOI:10.1139/b94-222 |
| [7] |
YATES D J, HUTTLEY L B. Foliar uptake of water by wet leaves of Sloanea woollsii, an Australian subtropical rainforest tree[J]. Aust J Bot, 1995, 43(2): 157-167. DOI:10.1071/BT9950157 |
| [8] |
RIEDERER M, SCHREIBER L. Protecting against water loss: Analysis of the barrier properties of plant cuticles[J]. J Exp Bot, 2001, 52(363): 2023-2032. DOI:10.1093/jexbot/52.363.2023 |
| [9] |
KERSTIENS G. Cuticular water permeability and its physiological significance[J]. J Exp Bot, 1996, 47(12): 1813-1832. DOI:10.1093/jxb/47.12.1813 |
| [10] |
WANG B Y, FENG Y L. Enzymatic isolation of leaf cuticles of Garcinia xanthochymus[J]. Chin J Ecol, 2004, 23(3): 141-143. 王博轶, 冯玉龙. 大叶藤黄叶片角质层的酶分离技术[J]. 生态学杂志, 2004, 23(3): 141-143. |
| [11] |
NIEDERL S, KIRSCH T, RIEDERER M, et al. Co-permeability of 3H-labeled water and 14C-labeled organic acids across isolated plant cuticles: investigating cuticular paths of diffusion and predicting cuticular transpiration[J]. Plant Physiol, 1998, 116(1): 117-123. DOI:10.1104/pp.116.1.117 |
| [12] |
GEYER U, SCHÖNHERR J. The effect of the environment on the permeability and composition of Citrus leaf cuticles[J]. Planta, 1990, 180(2): 147-153. DOI:10.1007/BF00193989 |
| [13] |
SCHÖNHERR J, LENDZIAN K. A simple and inexpensive method of measuring water permeability of isolated plant cuticular membranes[J]. Zeitsch Pflanzenphysiol, 1981, 102(4): 321-327. DOI:10.1016/s0044-328x(81)80203-6 |
| [14] |
KIRSCH T, KAFFARNIK F, RIEDERER M, et al. Cuticular permeability of the three tree species Prunus iaurocerasus L., Ginkgo biloba L. and Juglans regia L. : Comparative investigation of the transport properties of intact leaves, isolated cuticles and reconstituted cuticular waxes[J]. J Exp Bot, 1997, 48(5): 1035-1045. DOI:10.1093/jxb/48.5.1035 |
| [15] |
SCHREIBER L, RIEDERER M. Ecophysiology of cuticular transpiration: Comparative investigation of cuticular water permeability of plant species from different habitats[J]. Oecologia, 1996, 107(4): 426-432. DOI:10.1007/BF00333931 |
| [16] |
SCHREIBER L. Effect of temperature on cuticular transpiration of isolated cuticular membranes and leaf discs[J]. J Exp Bot, 2001, 52(362): 1893-1900. DOI:10.1093/jexbot/52.362.1893 |
| [17] |
LIU Y H, ZHANG Y P, MA Y X, et al. Temperature property in dry and warm season in Xishuangbanna Ecological Station[J]. Res Trends Resour Ecol Network, 2001, 12(2): 29-31. 刘玉洪, 张一平, 马友鑫, 等. 西双版纳生态站冬(干暖)季气温特征[J]. 资源生态环境网络研究动态, 2001, 12(2): 29-31. |
| [18] |
BAUR P, MARZOUK H, SCHONHERR J. Estimation of path lengths for diffusion of organic compounds through leaf cuticles[J]. Plant Cell Environ, 1999, 22(3): 291-299. DOI:10.1046/j.1365-3040.1999.00429.x |
| [19] |
SCHREIBER L, SKRABS M, HARTMANN K, et al. Effect of humidity on cuticular water permeability of isolated cuticular membranes and leaf disks[J]. Planta, 2001, 214(2): 274-282. DOI:10.1007/s004250100615 |
| [20] |
LENDZIAN K J, KERSTIENS G. Sorption and transport of gases and vapors in plant cuticles [M]// WARE G W. Reviews of Environmental Contamination and Toxicology: Continuation of Residue Reviews. New York, NY: Springer, 1991, 121: 65–128. doi: 10.1007/978-1-4612-3196-7_2.
|
| [21] |
SANTIER S, CHAMEL A. Reassessment of the role of cuticular waxes in the transfer of organic molecules through plant cuticles[J]. Plant Physiol Biochem, 1998, 36(3): 225-231. DOI:10.1016/S0981-9428(97)86879-9 |
| [22] |
BAUR P, BUCHHOLZ A, SCHONHERR J. Diffusion in plant cuticles as affected by temperature and size of organic solutes: Similarity and diversity among species[J]. Plant Cell Environ, 1997, 20(8): 982-994. DOI:10.1111/j.1365-3040.1997.tb00675.x |
| [23] |
BURGHARDT M, RIEDERER M. Ecophysiological relevance of cuticular transpiration of deciduous and evergreen plants in relation to stomatal closure and leaf water potential[J]. J Exp Bot, 2003, 54(389): 1941-1949. DOI:10.1093/jxb/erg195 |
| [24] |
SCHÖNHERR J, RIEDERER M. Desorption of chemicals from plant cuticles: Evidence for asymmetry[J]. Arch Environ Contam Toxicol, 1988, 17(1): 13-19. DOI:10.1007/BF01055148 |
| [25] |
BAUR P, SCHÖNHERR J. Temperature dependence of the diffusion of organic compounds across plant cuticles[J]. Chemosphere, 1995, 30(7): 1331-1340. DOI:10.1016/0045-6535(95)00033-5 |
| [26] |
HELBSING S, RIEDERER M, ZOTZ G. Cuticles of vascular epiphytes: Efficient barriers for water loss after stomatal closure[J]. Ann Bot, 2000, 86(4): 765-769. DOI:10.1006/anbo.2000.1239 |
| [27] |
ZHENG Y L, FENG Y L. Fog water absorption by the leaves of epiphytes and non-epiphytes in Xishuangbanna[J]. Chin J Appl Ecol, 2006, 17(6): 977-981. 郑玉龙, 冯玉龙. 西双版纳地区附生与非附生植物叶片对雾水的吸收[J]. 应用生态学报, 2006, 17(6): 977-981. DOI:10.3321/j.issn:1001-9332.2006.06.005 |
| [28] |
FENG Y L, CAO K F, FENG Z L, et al. Effects of nocturnal chilling temperature on photosynthesis in seedlings of two tropical tree species grown under different light intensities[J]. J Plant Physiol Mol Biol, 2002, 28(6): 433-440. 冯玉龙, 曹坤芳, 冯志立, 等. 夜间低温对不同光强下生长的两种热带树苗光合作用的影响[J]. 植物生理与分子生物学学报, 2002, 28(6): 433-440. DOI:10.3321/j.issn:1671-3877.2002.06.004 |
| [29] |
WARREN C R, HOVENDEN M J, DAVIDSON N J, et al. Cold hardening reduces photoinhibition of Eucalypts nitens and E. pauciflora at frost temperatures[J]. Oecologia, 1998, 113(3): 350-359. DOI:10.1007/s004420050386 |
| [30] |
WU Y, SONG L, LIU W Y, et al. Fog water is important in maintaining the water budgets of vascular epiphytes in an Asian Tropical Karst Forests during the dry season[J]. Forests, 2018, 9(5): 260. DOI:10.3390/f9050260 |
| [31] |
LIU W J, WANG P Y, LI J T, et al. Plasticity of source-water acquisition in epiphytic, transitional and terrestrial growth phases of Ficus tinctoria[J]. Ecohydrology, 2014, 7(6): 1524-1533. DOI:10.1002/eco.1475 |
| [32] |
ZHANG S B, DAI Y, HAO G Y, et al. Differentiation of water-related traits in terrestrial and epiphytic Cymbidium species[J]. Front Plant Sci, 2015, 6: 260. DOI:10.3389/fpls.2015.00260 |
 2023, Vol. 31
2023, Vol. 31

