2. 华南国家植物园, 广州 510650;
3. 南方海洋科学与工程广东省实验室(广州), 广州 511458;
4. 中国科学院大学, 北京 100049
2. South China National Botanical Garden, Guangzhou 510650, China;
3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou, 511458, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
2020年9月22日,习近平总书记在第七十五届联合国大会一般性辩论上提出:“中国将提高自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。碳中和,即在一段时间内,二氧化碳(CO2)的排放量与移除量二者两相抵消,实现CO2的净零排放。碳达峰和碳中和战略目标的提出,是统筹国际、国内大局做出的重大决策,一方面体现了中国在全球气候治理和构建人类命运共同体上的决心与担当,另一方面有助于社会主义生态文明建设,满足了人们对“绿水青山”的憧憬与向往。滨海蓝碳生态系统主要包括红树林、盐沼湿地和海草床等,其固碳潜力巨大,其具有的高碳埋藏速率有助于减缓和应对气候变暖,是基于自然的减缓气候变化的解决方案之一[1]。在全球范围内,滨海蓝碳生态系统的面积约为1.85×108 hm2,其储碳量超过3×104 Tg[2]。因此,有效评估滨海湿地的碳汇能力、固碳速率和碳埋藏来源,是制定减排增汇措施的重要手段,是我国实现碳中和目标的重要基础[3]。
1 滨海蓝碳的定义及分类滨海湿地是一类介于陆地和海洋生态系统间的独特生态系统,包含了海陆交互作用下被水体浸没的沿海低地、潮间带滩地等,如红树林、盐沼、海草床,其森林-河流-海洋复合生态系统的特殊交互作用孕育了丰富的湿地资源和多样的生态环境[4–5]。由滨海湿地生态系统捕获的碳,被称为滨海蓝碳,这部分碳可长时间封存(几十年到千年),对减缓气候变化意义重大[6–7]。
滨海蓝碳生态系统相较陆地生态系统而言,其优势在于迅速高效的固碳速率,以及长久持续的固碳能力[8]。滨海湿地中死亡的植物残体与凋落物会沉积到土壤中,但是与陆地生态系统不同:水平方向往复的海水潮汐运动在抑制有机质分解的同时, 也向海水输入了大量的碳[溶解态有机碳(dissolved organic carbon, DOC)、溶解态无机碳(dissolved inorganic carbon, DIC)和颗粒有机碳(particle organic carbon, POC)等][9];随着海平面的上升,滨海湿地中的沉积物在垂直方向上不断增加而被埋藏到更深层土壤,由于有机质在厌氧环境下难以降解, 其在百年到上千年尺度上保持相对稳态而不会释放回大气中,从而实现持续稳定的碳储存[1]。此外, 由于海水中大量硫酸根离子的存在,能够有效抑制滨海湿地中的甲烷(CH4)排放[10]。滨海湿地的这些特性相对于陆地生态系统固碳具有明显的优势,其单位面积的碳埋藏速率是陆地森林系统的几十到几百倍[11]。长期来看,滨海湿地生态系统比陆地生态系统具备更强的固碳能力和生态系统服务功能[3],是应对气候变化问题的重要碳汇(图1)。
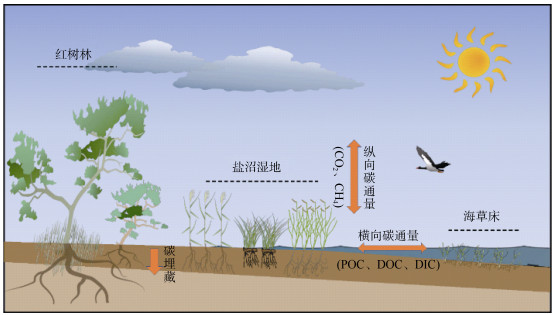
|
图 1 滨海湿地生态系统的碳循环过程,主要包括横向碳通量和纵向碳通量 Fig. 1 Carbon cycle processes in coastal wetland ecosystems, mainly including the lateral carbon flux, and vertical carbon flux |
滨海蓝碳按照来源可分为内源性碳和外源性碳:内源性碳指的是由滨海湿地生态系统内的植物进行光合作用,从大气或海洋中将CO2固定转换成植物有机碳,因周期性的潮汐运动而分解缓慢, 成为稳定储存在沉积物中的有机碳,这部分碳的产生与沉积位置相同[12];除了内源性碳, 由于滨海湿地经常受到海岸洋流、潮汐以及地表径流等水文过程的扰动影响,来源于临近生态系统的沉积物和有机碎屑被滨海湿地中的植物冠层或根系捕获并固定, 沉积成为滨海湿地碳库的一部分,这部分产生和沉积位置不同的碳被称为外源性碳[12]。这两部分碳的输入,使滨海湿地比陆地生态系统拥有更丰富的碳来源,因此滨海湿地成为地球上的高密度碳汇之一,其单位面积的固碳能力远高于其他陆地生态系统[2,13]。滨海湿地土壤沉积物中有机碳的不断累积, 及受到抑制的CH4产生与排放,有助于减缓全球气候变暖的严峻形势[14]。因此,滨海蓝碳生态系统所具有的碳储量大、碳封存速率高、固碳能力稳定等特性对于全球碳循环至关重要,其碳汇功能的可持续发展和利用应得到更大程度的重视[15]。
2 盐沼湿地碳汇盐沼湿地作为“滨海蓝碳”生态系统之一,主要指海岸沿线受海洋潮汐周期性或间歇性影响的被盐沼植物覆盖的咸水或淡咸水淤泥质滩涂,是地球上的高生产力生态系统之一[5,16]。盐沼湿地具有很高的固碳能力,能够捕获和储存大量的碳,其碳埋藏速率为168 g C/(m2·a),比陆地森林生态系统高约40倍[17–18]。据估计,我国海岸带蓝碳生态系统的年碳埋藏量为0.349~0.835 Tg,其中盐沼湿地约占80%, 远高于红树林和海草床,是我国蓝碳碳汇的主要贡献者[19]。
盐沼湿地是中国面积最大的滨海湿地,但由于调查难度高、精度低,导致现有对我国盐沼湿地面积的估算存在较大差异[20]。根据2009—2013年全国第二次湿地资源调查结果,中国盐沼湿地的面积为3.43×105 hm2。而另一项基于Sentinel-1时间序列数据的研究,估算出中国盐沼湿地的总面积为1.27×105 hm2[22],总体估算精度达到87%。Mao等[23]开发了基于对象和层次的混合分类方法和湿地遥感分类系统,将混合方法与湿地分类系统应用于Landsat 8 Operational Land Imager数据,得到总体分类精度为95%的中国湿地地图,估算出中国盐沼湿地面积为2.98×105 hm2 (表1)。可见,我国的盐沼湿地面积大、分布广,其储碳和固碳能力在蓝碳生态系统中也是最强的[21]。
| 表 1 中国盐沼湿地分布面积估算及其主要优势物种 Table 1 Distribution of salt marshes and dominate species in China |
盐沼湿地的碳循环过程主要包括三部分(图2):
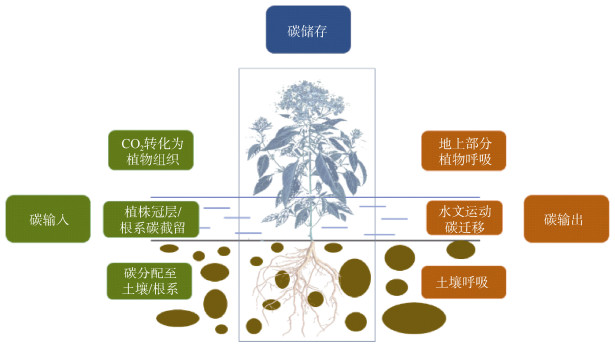
|
图 2 盐沼湿地的碳循环过程,主要包括碳输入、碳输出和碳储存 Fig. 2 Carbon cycles in salt marshes, including carbon inputs, carbon outputs, and carbon preservation |
(1) 碳输入:包括光合碳固定,湿地植物通过光合作用将大气中的CO2转化为生物碳,固定到生态系统中[24];植物碳分配,植物将叶片等地上器官固定的碳分配至根系和土壤,以维持养分吸收与生长代谢的需求,同时抵御环境胁迫和更好地适应盐沼环境[25];植物碳截留,潮汐等水文活动带来的大量凋落物、碎屑态碳、DOC以及POC,其中部分碳在退潮时被植物的冠层和根系所截获而不断沉积在盐沼湿地生态系统中,成为土壤碳库重要组成成分[26]。已有研究对我国黄河与辽河流域的颗粒态碳沉积速率进行了区域尺度的定量分析,结果表明:颗粒态无机碳的沉积速率明显高于颗粒态有机碳的沉积,沉积活动受到人类活动的极大影响[27], 但有机碳仍是人们关注的主要部分。然而针对全国乃至全球的大尺度研究,尤其是对盐沼湿地内各个碳组分及其对碳沉积相对贡献的系统研究,仍然十分缺乏。
(2) 碳输出:主要是生态系统内部生物代谢活动(植物、动物与微生物)产生的以CO2/CH4等形式排放到大气的纵向碳损失,以及地表径流、潮汐等机械搬运导致的DOC、POC等形式的横向碳迁移[28]。
盐沼湿地中孕育着各种底栖动物和微生物,它们作为湿地生态系统的重要组成部分,取食或利用浮游生物、底栖藻类和有机碎屑等,在湿地生态系统物质循环中起到凋落物粉碎、有机质分解、污染物代谢等作用[29]。除水文运动带走的部分碳损失外,在底栖动物和微生物共同参与下发生的矿化分解是非常关键的碳损失途径。研究表明,我国盐沼湿地有机碳损失量即使仅占埋藏量的十分之一,也将超过整个海草床所贡献的碳汇量(0.012 Tg C/a)[19]。目前,国内外学者已经使用多种技术手段,如13C或14C同位素标记等,对陆地生态系统的土壤碳矿化过程、机制及关键微生物开展了研究[30–32]。但是盐沼湿地中的相关研究比较滞后,已有的数据主要集中在生物地球化学参数、基础微生物等指标的测定分析[33],在机制机理层面的探讨缺乏深度。目前转录组测序、功能基因芯片、宏基因组测序等新兴的微生物测定技术的快速发展和应用,为深入挖掘和解析盐沼湿地中养分循环的关键过程及其关键调控微生物提供了有力手段和技术支持[34–36]。
(3) 碳储存:植物地上部分通过叶片的光合作用将CO2封存在自身组织体内;植物代谢死亡的副产物(如枯死枝干、凋落物等)以及外源性截留碳, 随着碳埋藏活动不断沉积在根系与土壤附近,成为几十年上千年长期封存的稳定土壤碳库[37]。在未来全球气候变暖和海平面上升的背景下,盐沼湿地对碳具有更迅速的捕获能力和更高效的封存速率[38],其碳汇功能在减缓全球气候变化、实现“碳达峰”和“碳中和”目标方面扮演着重要角色。
2.2 碳储量盐沼湿地在我国分布广泛,跨越温带、亚热带及热带多个气候区域,在沿海的辽宁、山东到广东、广西各省区均有分布[39]。植物和土壤碳库是盐沼湿地碳库的主要组成部分,尤其以土壤碳库为主。盐沼湿地生态系统的植物生长繁衍的速度快,能在短时间内积累大量的生物量[40]。一般来说,在高潮带盐沼中,地上植物生物量占总碳库的比重较高;而低潮带和中潮带盐沼中,地下根系和土壤是碳储量的主要部分,土壤碳库的储碳量通常占整个盐沼生态系统碳库的80%以上[41]。
2.2.1 植物碳库盐沼植被作为植物碳库的主要来源,在生态系统物质循环中发挥着重要作用,其在盐沼上生长、沉积和掩埋过程的快速迭代也使滨海湿地成为全球碳库的重要组成部分[42–43]。我国盐沼湿地类型众多,主要的植物群落有柽柳(Tamarix chinensis)、芦苇(Phragmites australis)、碱蓬(Suaeda salsa)、海三棱藨草(Scirpus mariqueter)和互花米草(Spartina alterniflora)等[44]。
盐沼湿地中的植物是该生态系统碳循环的起点,通过光合作用植物将大气中的CO2转化为多糖等光合产物,由叶片从枝干向下运输,分配到植物体各个组织器官。在生态系统碳循环过程中,植物会通过调节碳在不同部位的分配模式来满足自身生长与繁殖的需求或者应对周边环境变化,从而间接影响生物地球化学循环[45]。气候条件、土壤性质、微生物活性和植物物种组成及其生长发育状况等条件均会影响其光合作用的产物分配,改变植物对地上和地下部分的碳输入。借助碳同位素标记技术研究表明, 互花米草将33%新固定的碳投入到植株的茎中, 这远高于芦苇,同时在地下碳分配过程中,互花米草的根部转移速率同样高于芦苇[46],这表明互花米草在向地下进行碳输入的过程中更具优势。
不同植物群落之间碳含量及固碳能力差异较大,同时受到环境因素的影响,相似植物群落在不同区域的盐沼湿地,其生物量、碳分配和吸收能力也会有一定程度的差异。有研究表明,闽江河口湿地属于亚热带季风气候,湿地植被因良好的水热条件而具有高生产力,但其不同植物群落的平均生物量仍存在差异,表现为互花米草群落>芦苇群落>茳芏群落[47]。同时,在主要植物群落类型相同的情况下,辽河三角洲盐沼湿地植被的储碳、固碳能力高于崇明东滩[48]。由于盐沼湿地的植物组成、空间分布及其环境因子的变异较大,系统地对不同区域盐沼湿地的碳固定、分配和周转过程进行评估,对于理解和精确评估盐沼湿地碳汇功能及模型构建具有重要意义。
2.2.2 土壤碳库土壤是盐沼湿地碳收支的核心,也是其中最大的有机碳库[49]。植物生长代谢过程的副产物受到淹水厌氧环境的限制,分解和转化速率十分缓慢,以腐殖质等有机形式不断沉积,形成稳定难分解的土壤沉积碳[50]。同时由于长期处于水文运动的环境中,潮汐和河流中携带的外源性碳也是其碳输入的重要来源之一,主要包括海水中各种藻类和其他生物死亡残体以及从河流上游运输而来的各类颗粒有机质[28]。在我国黄河口以及长江口的滨海湿地的沉积速率远超过其他非河口地区[51],其主要原因就是河水的搬移作用携带了大量的陆源性碳在河口地区沉积下来,成为盐沼湿地土壤有机碳的重要部分[52]。
然而土壤沉积过程复杂多变,且受到多因子调控(如植物组成、土壤结构、潮汐运动等),这部分土壤碳库的微小变化会极大地调节生态系统碳收支平衡,成为制约盐沼湿地碳汇潜力的重要因素[53]。Fu等[21]对我国盐沼湿地的碳储量进行了估算,我国的总碳储量和单位面积碳储量分别为(7.5±0.6) Tg和(81.1±9.1) Mg C/hm2。总体而言,我国盐沼湿地的单位面积碳储量较低,在蓝碳增汇方面具有较大的提升潜力。表2对我国盐沼湿地的主要植被类型及其土壤碳储量结果进行了汇总,其中对湿地土壤碳储量的研究大多只涉及到土壤有机碳库的测定, 对于碳库中不同组分与动态变化,如DOC、POC、微生物碳(microbial biomass carbon, MBC)等的研究较少,在这方面的工作还需加强。
| 表 2 我国主要盐沼湿地土壤有机碳库储量 Table 2 Soil organic carbon storage of major salt marshes in China |
来源于生态系统内部或外部的碳沉积到滨海湿地中,其中一部分经生物生理活动代谢生成二氧化碳(CO2)和甲烷(CH4)被排放到大气中,一部分随着潮汐运动以DOC、DIC、POC等形式被水流运输, 剩下的碳则被埋藏在沉积物中,成为滨海湿地土壤碳库的重要组成部分[52]。这部分沉积碳处于厌氧环境中,分解、迁移和转化的速率十分缓慢,且随着有机质的不断沉积,旧的有机质被不断埋藏而长久地留存在湿地土壤碳库中[72]。
2.3.1 碳沉积速率湿地碳埋藏速率通常通过沉积速率与沉积物碳密度计算而来。沉积物中放射性核素的含量被广泛应用于确定河口、海岸及陆架区域沉积物年龄, 揭示沉积过程和判断物质来源等。Fu等[21]认为我国盐沼湿地的碳埋藏速率为7~955 g C/(m2·a),均值与中位数分别为201和154 g C/(m2·a),存在着较大的变异。目前,针对沉积物碳密度有统一的测定方法,而在测定碳沉积速率方面存在较大差异。
测定碳沉积速率常用的天然核素为210Pb,其半衰期为22.3 a,核素大约经过7个半衰期后强度即衰减到初始值的1%,难以被仪器准确检测,所以210Pb的定年上限约为150年。通过210Pb随沉积物深度变化的规律与分布特征,对百年尺度内的平均沉积速率进行计算,以获得某一土层的相对年龄[73]。除天然核素外,人类核试验等活动还产生了137Cs等人工核素,137Cs半衰期为30.17 a,在沉积物中的垂直分布通常会出现峰值,对应特定的核爆年份, 因此有重要的计年意义[74–75]。这两种方法在国内外现代沉积记录研究中得到了广泛应用[76],但这两种方法在原理上截然不同,前者以大气中222Rn衰变而散落并在沉积物中蓄积的非平衡态210Pbex的衰变为基础,后者则以人为活动释放后通过大气扩散而散落并在沉积物垂直剖面中蓄积的137Cs比活度峰的位置为时标[77]。无论是210Pb还是137Cs计年法都是在沉积物样品未受扰动的情况下才能真实地反映沉积速率,但这种条件在多动力环境扰动下的盐沼湿地是难以达到的。因此,若要得到最接近真实的结果,一般需要将137Cs与210Pb的计年结果相互印证[78]。近年来,结合使用多种放射性元素,在不同时期对断面或沉降板进行重复测量,以便更为精确地计算海岸带的沉积速率[79–80]。
此外,美国地质调查局建立了地面高程-水平标志层监测系统(surface elevation table-marker horizon, SET-MH),可用于监测年际间地表高程变化和垂直沉积速率[81]。SET-MH系统主要由2部分组成,SET用于监测高程的变化,通过测量臂上前后两次测量针的高度差值,计算出单位时间内地表高程变化速率;MH用于监测表层垂直沉积速率,在监测的样方内布设1个人工标记层, 间隔一定时间后切取标记层的沉积物样品, 计算单位时间内的垂直沉积速率[82]。通过该监测系统对特定区域进行长时间多次重复测定, 可准确地计算出该区域沉积物的埋藏速率与碳库的变化[83]。
现今我国对盐沼湿地碳沉积速率的测定主要采用210Pb-137Cs同位素计年法,缺乏多方法结合验证的测定,同时针对大尺度且系统的沉积速率测定数据十分匮乏。研究的热点仍集中于单一站点、不同植被类型的碳沉积与埋藏能力比较(表3)。近年来, 我国逐步建立约30个SET监测站点,然而在我国海岸线仍然需要布设更多、更为密集的SET监测体系,以实现规范统一的碳埋藏测定。
| 表 3 我国主要盐沼湿地碳沉积速率 Table 3 Major C burial rates of salt marshes in China |
解析滨海湿地埋藏碳的来源所使用的方法主要是C/N比值法、稳定同位素组成法和生物标记物法[52, 87]。
一般而言,水生植物含有较高的蛋白质和脂类,其C/N为4~10,而陆生维管植物和挺水植物富含纤维素和木质素,其C/N大于20。通过对沉积物中碳氮比的测定可以粗略地区分其碳的来源[88]。随着研究的不断深入,单一的C/N值来判断碳来源的方法已经无法满足研究需要,结合C/N值及其同位素丰度与机器学习(随机森林、支持向量机、神经网络等)来细分碳来源的方法已经越来越普遍地用来对不同来源的碳进行区分和定量分析[21,89–90]。
沉积物中有机质δ13C和δ15N丰度与有机质来源紧密相关。根据光合作用机理的不同,植物大致可分为C3、C4和CAM等3种类型。C3植物的δ13C为–37‰~–24‰,C4植物为–16‰~–10‰。在我国盐沼湿地中,互花米草和芦苇是C4植物,而盐地碱蓬是C3植物。因此,通过对滨海湿地地上植被和周围水体主要植物体δ13C的测定可以区分其沉积物中内源有机碳的来源[91]。除了δ13C同位素丰度,δ15N丰度也被经常用于解析有机质的来源, 典型陆地植物的δ15N为0~11‰,海草为6‰~12‰, 海洋中藻类为0~4‰[21,92]。因此,综合利用碳、氮稳定性同位素丰度和C/N值不仅区分了盐沼湿地沉积物中碳的陆源性与海源性输入,而且可以细分碳来源的具体植被类型,从而实现更精准的碳来源解析[52]。
生物标志物是环境和地质体中记载着原始生物母质分子结构信息的有机化合物,因其长久稳定性被广泛用于研究碳的来源和转化特征[93]。常用的生物标志物种类包括脂类、糖类、氨基酸和氨基糖等。
正构烷烃是一种在沉积物研究中运用较为广泛的生物标志物,其广泛分布于低等细菌藻类与高等植物等不同类型的生物体中,来源不同生物体的正构烷烃,碳数组成与分布特征不同[88,93]。一般来说,C25以下的正构烷烃没有明显的奇偶优势,其中低碳数(n<20)的正构烷烃主要来源于低等生物, 包括细菌和藻类,而C21-C25的正构烷烃主要来源于苔藓和水生植物[94]。长链(C26-C33)正构烷烃具有奇碳数优势,主要来源于陆生高等植物表层蜡质,以C27、C29、C31和C33最丰富,其中C27和C29为木本植物的主要指征峰,C31和C33为草本植物的主要指征峰[95]。此外,通过各个峰度计算的碳优势指数(CPI)、低碳数与高碳数链长比值(L/H)、平均碳链长度(ACL)等指标可以用来探究沉积物有机质内源菌藻,水生植物,草本植物以及木本植物的相对贡献[96–97];同时这些指数也可以指示脂类化合物的分解程度,一般CPI随有机质的降解而降低,ACL则随有机质的降解而升高[98]。
此外,木质素相较于脂肪酸、正构烷烃等生物标志物具有更加稳定的分子结构和对微生物降解作用的抗降解性,我们将其视为植物来源的土壤稳定碳组分[99–100]。木质素在土壤、河流中广泛存在,其主要通过水文运动的迁移作用完成陆地碳库向海洋碳库的输送[101–102]。因此,通过测定土壤中的木质素含量,可准确地示踪陆源有机物的植物来源,以及在不同介质中的迁移和埋藏过程[103]。目前,土壤木质素测定的基本原理是在高温和碱性条件下通过氧化铜催化水解木质素使其形成4类单环酚类单体,主要包括香草基(V)、丁香基(S)和肉桂基(C)的醛、酮和酸的酚类单体[104]。V系列单体在维管束植物中广泛存在,被子植物消解后的S系列单体相对更多;而在植物叶片和草类植物消解后, 主要得到的是C系列单体[103,105–106]。通常土壤样品中木质素总量(V+S+C)与SOC的相对比可以表征木质素来源的碳在土壤有机碳库中的相对积累情况[100]。V系列酸单体与醛单体的比值(Ad/Al)V来指示土壤中木质素的降解程度,其值越大表明木质素的降解程度越高;一般而言,新鲜植物组织为0.1~0.3, 高度降解的木质素大于0.6[99,107]。同时,利用不同系列的比值可以判断植物来源:用S系列单体与V系列单体的比值来区分被子植物(S/V为0.4~5.2)和裸子植物(S/V约为0),C系列单体与V系列单体的比值来区分木本组织(C/V<0.05)和草本组织(C/V> 0.2)[103,108]。
与正构烷烃和木质素主要表征有机质的植物来源不同,氨基糖是土壤中微生物残体碳的主要标记物,将氨基糖进行换算之后可以得到微生物残体碳及其对土壤有机碳的相对贡献。氨基糖是微生物细胞壁的重要成分, 相对于其他细胞质成分,氨基糖能在土壤中更稳定而保存更长时间[109–110]。这使得氨基糖被广泛应用于研究微生物残体对土壤有机碳和各种微环境流通量的贡献[109,111–112]。土壤中常见的氨基糖包括氨基葡萄糖(GluN)、氨基半乳糖(GlaN)、甘露糖胺(ManN)和胞壁酸(MurN),占土壤有机碳含量的2%~5%[93]。土壤中的胞壁酸只来源于细菌, 而氨基葡萄糖则主要来自真菌,因此常用GluN/MurN评价真菌和细菌残体在土壤有机质转化过程中的相对贡献[113]。
运用C/N值、稳定同位素组成和生物标记物等方法来解析陆地生态系统碳来源中获得了广泛的应用,同时随着气相/液相色谱与稳定同位素质谱联用等仪器和方法的发展, 现有的技术手段将生物标志物的简单含量分析发展到对各个单体化合物的稳定同位素分析[114–115]。多种方法的结合可以有效解析盐沼湿地沉积物中有机碳的来源及其转化过程,是当前盐沼湿地碳循环研究的热点方向[52]。
2.4 碳通量 2.4.1 纵向非CO2温室气体通量盐沼湿地作为陆地与海洋的过渡区域,其在储存和埋藏大量碳的同时排放CO2、CH4和N2O等温室气体[116]。Abdul‐Aziz等[10]研究表明,气候变化与人类活动的影响导致盐沼湿地微生物活动加强, 加快了这一高生产力碳汇系统以CO2/CH4形式的碳损失。中国的盐沼湿地由于其跨越的地理范围广, 在气候条件、水文状况等方面的不同,加上受到人类活动的影响不一致,因此各个区域的盐沼湿地温室气体通量存在着巨大的时空变异[117–118]。同时,土壤理化性质(土壤温、湿度、pH、氮磷养分等)和植物生长状况也会对温室气体通量的排放产生极大影响[119]。根据估算,中国盐沼湿地的温室气体通量分别为12.8~ 310 mg CO2/(m2·h)、23.6~986 μg CH4/(m2·h)和1.58~ 110 μg N2O/(m2·h)[120–122]。总体来看,Li等[121]认为中国盐沼湿地的温室气体排放具有沿纬度梯度由高纬度向低纬度增加的规律,且与气温表现出强相关性。Tong等[123]整理了中国主要滨海湿地温室气体排放的年均排放量(表4),对中国滨海湿地温室气体排放进行了系统的梳理。然而,温室气体排放具有较大的时空异质性,从机制机理上研究温室气体通量的产生与变化仍需加强。
2.4.2 横向碳通量水平方向上,盐沼湿地在潮汐作用的影响下,以DOC、DIC和POC等形式向沿岸进行横向碳通量的输送。盐沼湿地输出的碳,不仅会影响河口及周边海域碳分布,还是盐沼湿地生态系统中碳通量的流失过程之一。盐沼湿地内的植被是有机物的主要来源之一,植物生长代谢和植物组织降解过程中会产生大量的有机物,它们在潮水的淋洗作用下进入周边的河口或海域[124–125]。同时,随着潮水的淹没,沉积物孔隙水中的大量有机物迅速转移到上覆水中;在退潮时,潮差增大,流速显著增加,对沉积物的冲刷增强,大量的DOC随之被带走[126–128]。
相较于纵向的温室气体通量排放,横向的碳通量受到的关注比较少,且测定技术比较复杂。张晓慧等[129]采用原位连续观测法,九段沙和西湿地潮沟向外输出的DOC通量分别为(60.7±2.4)和(64.6± 1.4) g C/(m2·a), 输出的DIC通量分别为(619.0±8.0)和(497.0±15.0) g C/(m2·a)。同时,植被覆盖类型的不同也会极大地改变横向碳通量。Gao等[130]报道原生的芦苇盐沼湿地在总的横向碳通量上属于碳源,向外输出的碳为209.0 g C/(m2·a),而在互花米草主导的盐沼湿地为横向碳汇[–31.0 g C/(m2·a)]。总的来看,国内针对横向碳通量的研究非常少,仅集中于长江口附近的湿地[131–132],而研究证明盐沼湿地横向碳通量输送是湿地流失的关键碳通量[133]。因此,未来需要加强对我国其他地区盐沼湿地的横向碳通量的定量研究和机制探讨。
2.5 外来物种入侵互花米草原产于北美东海岸及墨西哥湾,因其对气候和环境具有极强的适应性和耐受性,加之人类活动促进其传播,因此广泛分布于不同地理气候范围的盐沼湿地[134]。作为典型的盐生植物,互花米草叶片上广布盐腺与气孔,对于盐碱和淹水环境具有极强的耐受能力[135];同时,其通过有性或无性的方式皆可进行繁殖,具有强悍且迅速的繁殖能力[134]。互花米草1979年首次被引进我国,之后便在我国沿海地区迅速扩张。据统计,1990—2015年,我国被入侵面积增加了5.02×104 hm2[136]。
互花米草的生长期长、净光合速率高,其入侵可以增加植物生物量,提高生态系统固碳能力[137]。在黄河三角洲、盐城和上海九段沙湿地的研究结果表明:与原生植被相比,在互花米草入侵后,土壤有机碳含量与碳储量均增加,且随着入侵时间的延长表现出累积效应[138–140]。在一些地区,互花米草的入侵在增强碳汇功能的同时,也增加了碳的输出。例如,在漳江口,互花米草入侵红树林湿地之后,虽然显著降低了CO2通量,但显著增加了CH4和N2O通量的排放[141]。总体而言,互花米草入侵使盐沼湿地原本的碳循环发生了变化,一方面凭借其较高的光合速率和生物量,加速碳沉积,增强了生态系统的固碳能力[142–143];另一方面受到多种因素的交互影响,增加了CH4等温室气体通量的排放[144]。此外,互花米草的入侵也会改变原有的底栖生物、微生物群落等结构,这也可能对碳循环产生直接或间接的影响[142–144]。因此,对于互花米草入侵对盐沼湿地碳汇功能的影响缺乏定论,相关的定量分析、系统归纳与机理性研究仍比较匮乏。
3 问题与展望 3.1 存在问题盐沼湿地因其具有较高的碳埋藏速率和较低的温室气体排放而成为缓解全球变暖的有效蓝色碳汇,近年来已经在全球范围内引发了广泛的关注。我国的盐沼湿地类型多、面积广,虽开展了许多研究,但仍然存在着一定的不足。
1. 大多数研究在站点尺度开展,区域和全国尺度上的研究较少;现有的盐沼湿地研究主要仍集中于某个站点的生物物质循环过程研究,对多站点、多流域的联网研究十分缺乏,制约了对盐沼湿地碳循环过程的整体理解。
2. 缺乏对多因子及其交互作用对盐沼湿地物质循环调控的研究;近年来全球气候变化背景下的滨海湿地引发了众多学者和研究团队的关注,通过气候变化的模拟实验得到了前沿性的结论,但是模拟实验仍然聚焦于某1~2个环境因子,对多因子及其交互作用的模拟以及盐沼湿地响应的研究匮乏。
3. 观测的系统性不足,缺乏统一的标准;已有针对盐沼湿地的研究数据很多,但是其中大量数据的采样信息不完整、测定方法不明确、衡量标准不一致等问题给数据的整合分析带来了诸多困难,导致现有数据库内容不全面,影响了我国对盐沼湿地碳收支的真实准确估算。
4. 对CO2、CH4和N2O通量的观测不够;由于人类活动导致的土地利用变化、近海口富营养化等问题会加速盐沼湿地的碳释放,促进CO2、CH4气体的排放,加剧温室效应。但是已有的研究主要集中在碳储量及其变化上,对于长时间、多位点进行温室气体通量监测仍然缺乏足够的重视,对于盐沼湿地的温室气体机制机理性的研究不够深入。
5. 对横向碳通量研究缺乏重视,已有站点的研究表明,盐沼湿地横向溶解态碳的通量能够占到净生态系统碳交换量的50%以上[129],足以体现横向碳通量在盐沼湿地生态系统的重要作用。然而, 国内对横向碳通量的定量研究、来源解析、机制机理等方面缺乏深入的探讨,在未来研究中亟需加强。
3.2 展望盐沼湿地单位面积的固碳速率高,在全球碳循环中起着重要的作用,并对全球气候变化有着巨大的影响。然而我国的盐沼湿地因工业发展、渔业养殖、捕捞等活动遭到巨大破坏,因此急需加强和加深对我国盐沼湿地的科学研究,保护其生态系统结构与服务功能的完整性,加强盐沼湿地的恢复与重建,增强其蓝碳碳汇功能,在保护自然的同时受惠于碳汇增益。
在未来,亟需建立健全国家海岸带生态系统监测和研究网络,制定量化沉积物碳储量和碳埋藏速率的标准化方法,加强区域和全国尺度上碳埋藏速率和碳储量及其影响因素的系统性分析;解析滨海湿地生态系统结构与服务功能变化的机理;引入基因芯片、转录组测序等新兴方法, 精确定位盐沼湿地碳循环过程的关键调控微生物; 推动盐沼湿地蓝碳进入碳交易市场,以经济杠杆带动蓝碳生态系统的保护和发展;加强对潮汐影响下盐沼湿地与邻近生态系统之间横向通量交换的研究,量化外源性碳对盐沼湿地固碳功能的相对贡献。通过进一步加强对盐沼湿地生态系统生物地球化学循环的研究,深入理解我国盐沼湿地的蓝碳碳汇机制,厘清我国盐沼湿地碳汇能力,让盐沼湿地蓝碳为我国的碳达峰与碳中和战略做出更大贡献。
| [1] |
MCLEOD E, CHMURA G L, BOUILLON S, et al. A blueprint for blue carbon: Toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Front Ecol Environ, 2011, 9(10): 552-560. DOI:10.1890/110004 |
| [2] |
MACREADIE P I, COSTA M D P, ATWOOD T B, et al. Blue carbon as a natural climate solution[J]. Nat Rev Earth Environ, 2021, 2(12): 826-839. DOI:10.1038/s43017-021-00224-1 |
| [3] |
WANG F M, TANG J W, YE S Y, et al. Blue carbon sink function of Chinese coastal wetlands and carbon neutrality strategy[J]. Bull Chin Acad Sci, 2021, 36(3): 241-251. 王法明, 唐剑武, 叶思源, 等. 中国滨海湿地的蓝色碳汇功能及碳中和对策[J]. 中国科学院院刊, 2021, 36(3): 241-251. DOI:10.16418/j.issn.1000-3045.20210215101 |
| [4] |
MITSCH W J, GOSSELINK J G. Wetlands[M]. 5th ed. Hoboken: John Wiley & Sons, Inc., 2015.
|
| [5] |
MILTON G R, PRENTICE R C, FINLAYSON C M. Wetlands of the world[M]//FINLAYSON C M, MILTON G R, PRENTICE R C, et al. The Wetland Book: II. Distribution, Description, and Conservation. Dordrecht: Springer, 2018: 3–16.
|
| [6] |
DUARTE C M, MIDDELBURG J J, CARACO N. Major role of marine vegetation on the oceanic carbon cycle[J]. Biogeosciences, 2005, 2(1): 1-8. DOI:10.5194/bg-2-1-2005 |
| [7] |
CHEN L Z, PAN L H, QIU G L. Coastal blue carbon sink in China under the influence of human activity[J]. J Guangxi Acad Sci, 2021, 37(3): 186-194. 陈鹭真, 潘良浩, 邱广龙. 中国滨海蓝碳及其人为活动影响[J]. 广西科学院学报, 2021, 37(3): 186-194. DOI:10.13657/j.cnki.gxkxyxb.20210927.006 |
| [8] |
ZHANG Y, ZHAO M X, CUI Q, et al. Processes of coastal ecosystem carbon sequestration and approaches for increasing carbon sink[J]. Sci China Earth Sci, 2017, 60(5): 809-820. 张瑶, 赵美训, 崔球, 等. 近海生态系统碳汇过程、调控机制及增汇模式[J]. 中国科学:地球科学, 2017, 60(5): 809-820. DOI:10.1007/s11430-016-9010-9 |
| [9] |
TANG J W, YE S F, CHEN X C, et al. Coastal blue carbon: Concept, study method, and the application to ecological restoration[J]. Sci China Earth Sci, 2018, 61(6): 637–646. doi: 10.1007/s11430-017-9181-x. 唐剑武, 叶属峰, 陈雪初, 等. 海岸带蓝碳的科学概念、研究方法以及在生态恢复中的应用[J]. 中国科学: 地球科学, 2018, 48(6): 661–670. doi: 10.1360/N072017-00341. |
| [10] |
ABDUL‐AZIZ O I, ISHTIAQ K S, TANG J W, et al. Environmental controls, emergent scaling, and predictions of greenhouse gas (GHG) fluxes in coastal salt marshes[J]. J Geophys Res Biogeosci, 2018, 123(7): 2234-2256. DOI:10.1029/2018JG004556 |
| [11] |
CHEN X C, GAO R F, HUANG X C, et al. Basic views and technological methods of salt marsh restoration and its progresses in implementation[J]. Mar Environ Sci, 2016, 35(3): 467-472. 陈雪初, 高如峰, 黄晓琛, 等. 欧美国家盐沼湿地生态恢复的基本观点、技术手段与工程实践进展[J]. 海洋环境科学, 2016, 35(3): 467-472. DOI:10.13634/j.cnki.mes.2016.03.023 |
| [12] |
HOWARD J, HOYT S, ISENSEE K, et al. Coastal Blue Carbon: Methods for Assessing Carbon Stocks and Emissions Factors in Mangroves, Tidal Salt Marshes, and Seagrasses[M]. Arlington, Virginia, USA: Conservation International, Intergovernmental Oceanographic Commission of UNESCO, International Union for Conservation of Nature, 2014.
|
| [13] |
DUARTE C M, LOSADA I J, HENDRIKS I E, et al. The role of coastal plant communities for climate change mitigation and adaptation[J]. Nat Clim Change, 2013, 3(11): 961-968. DOI:10.1038/nclimate1970 |
| [14] |
MOOMAW W R, CHMURA G L, DAVIES G T, et al. Wetlands in a changing climate: Science, policy and management[J]. Wetlands, 2018, 38(2): 183-205. DOI:10.1007/s13157-018-1023-8 |
| [15] |
ALONGI D M. Carbon balance in salt marsh and mangrove ecosystems: A global synthesis[J]. J Mar Sci Eng, 2020, 8(10): 767. DOI:10.3390/jmse8100767 |
| [16] |
SCHUERCH M, SPENCER T, TEMMERMAN S, et al. Future response of global coastal wetlands to sea-level rise[J]. Nature, 2018, 561(7722): 231-234. DOI:10.1038/s41586-018-0476-5 |
| [17] |
WANG F M, LU X L, SANDERS C J, et al. Tidal wetland resilience to sea level rise increases their carbon sequestration capacity in United States[J]. Nat Commun, 2019, 10(1): 5434. DOI:10.1038/s41467-019-13294-z |
| [18] |
WANG F M, SANDERS C J, SANTOS R I, et al. Global blue carbon accumulation in tidal wetlands increases with climate change[J]. Natl Sci Rev, 2021, 8(9): 140-150. DOI:10.1093/nsr/nwaa296 |
| [19] |
ZHOU C H, MAO Q Y, XU X, et al. Preliminary analysis of C sequestration potential of blue carbon ecosystems on Chinese coastal zone[J]. Sci Sin Vit, 2016, 46(4): 475-486. 周晨昊, 毛覃愉, 徐晓, 等. 中国海岸带蓝碳生态系统碳汇潜力的初步分析[J]. 中国科学:生命科学, 2016, 46(4): 475-486. DOI:10.1360/N052016-00105 |
| [20] |
MENG W Q, FEAGIN R A, HU B B, et al. The spatial distribution of blue carbon in the coastal wetlands of China[J]. Estuar Coast Shelf Sci, 2019, 222: 13-20. DOI:10.1016/j.ecss.2019.03.010 |
| [21] |
FU C C, LI Y, ZENG L, et al. Stocks and losses of soil organic carbon from Chinese vegetated coastal habitats[J]. Glob Change Biol, 2021, 27(1): 202-214. DOI:10.1111/gcb.15348 |
| [22] |
HU Y K, TIAN B, YUAN L, et al. Mapping coastal salt marshes in China using time series of Sentinel-1 SAR[J]. ISPRS J Photogramm, 2021, 173: 122-134. DOI:10.1016/j.isprsjprs.2021.01.003 |
| [23] |
MAO D H, WANG Z M, DU B J, et al. National wetland mapping in China: A new product resulting from object-based and hierarchical classification of Landsat 8 OLI images[J]. ISPRS J Photogramm, 2020, 164: 11-25. DOI:10.1016/j.isprsjprs.2020.03.020 |
| [24] |
SOUSA A I, LILLEBø A I, PARDAL M A, et al. Productivity and nutrient cycling in salt marshes: Contribution to ecosystem health[J]. Estuar Coast Shelf Sci, 2010, 87(4): 640-646. DOI:10.1016/j.ecss.2010.03.007 |
| [25] |
WANG B, GONG J R, ZHANG Z H, et al. Nitrogen addition alters photosynthetic carbon fixation, allocation of photoassimilates, and carbon partitioning of Leymus chinensis in a temperate grassland of Inner Mongolia[J]. Agric For Meteorol, 2019, 279: 107743. DOI:10.1016/j.agrformet.2019.107743 |
| [26] |
CHMURA G L, ANISFELD S C, CAHOON D R, et al. Global carbon sequestration in tidal, saline wetland soils[J]. Glob Biogeosci Cycles, 2003, 17(4): 1111. DOI:10.1029/2002GB001917 |
| [27] |
YE S, LAWS E A, YUKNIS N, et al. Carbon sequestration and soil accretion in coastal wetland communities of the Yellow River Delta and Liaohe Delta, China[J]. Estuar Coasts, 2015, 38(6): 1885-1897. DOI:10.1007/s12237-014-9927-x |
| [28] |
XIONG Y M, LIAO B W, WANG F M. Mangrove vegetation enhances soil carbon storage primarily through in situ inputs rather than increasing allochthonous sediments[J]. Mar Pollut Bull, 2018, 131: 378-385. DOI:10.1016/j.marpolbul.2018.04.043 |
| [29] |
HU Z Y, BAO Y X, CHENG H Y, et al. Research progress on ecology of natural wetland zoobenthos in China[J]. Chin J Ecol, 2009, 28(5): 959-968. 胡知渊, 鲍毅新, 程宏毅, 等. 中国自然湿地底栖动物生态学研究进展[J]. 生态学杂志, 2009, 28(5): 959-968. |
| [30] |
HILLAIRE-MARCEL C, KIM S T, LANDAIS A, et al. A stable isotope toolbox for water and inorganic carbon cycle studies[J]. Nat Rev Earth Environ, 2021, 2(10): 699-719. DOI:10.1038/s43017-021-00209-0 |
| [31] |
EHLERINGER J R, BUCHMANN N, FLANAGAN L B. Carbon isotope ratios in belowground carbon cycle processes[J]. Ecol Appl, 2000, 10(2): 412-422. DOI:10.1890/1051-0761(2000)010[0412:CIRIBC]2.0.CO;2 |
| [32] |
GE T D, WANG D D, ZHU Z K, et al. Tracing technology of carbon isotope and its applications to studies of carbon cycling in terrestrial ecosystem[J]. Chin J Plant Ecol, 2020, 44(4): 360-372. 葛体达, 王东东, 祝贞科, 等. 碳同位素示踪技术及其在陆地生态系统碳循环研究中的应用与展望[J]. 植物生态学报, 2020, 44(4): 360-372. DOI:10.17521/cjpe.2019.0208 |
| [33] |
DOROSKI A A, HELTON A M, VADAS T M. Greenhouse gas fluxes from coastal wetlands at the intersection of urban pollution and saltwater intrusion: A soil core experiment[J]. Soil Biol Biochem, 2019, 131: 44-53. DOI:10.1016/j.soilbio.2018.12.023 |
| [34] |
BOWEN J L, CRUMP B C, DEEGAN L A, et al. Salt marsh sediment bacteria: Their distribution and response to external nutrient inputs[J]. ISME J, 2009, 3(8): 924-934. DOI:10.1038/ismej.2009.44 |
| [35] |
COOMBS J M. Microbial communities in salt marsh systems and their responses to anthropogenic pollutants[M]//HURST C J. Understanding Terrestrial Microbial Communities. Cham: Springer, 2019: 243–287.
|
| [36] |
LEADBEATER D R, OATES N C, BENNETT J P, et al. Mechanistic strategies of microbial communities regulating lignocellulose deconstruction in a UK salt marsh[J]. Microbiome, 2021, 9(1): 48. DOI:10.1186/s40168-020-00964-0 |
| [37] |
XU X, LIU H, LIU Y Z, et al. Human eutrophication drives biogeographic salt marsh productivity patterns in China[J]. Ecol Appl, 2020, 30(2): e02045. DOI:10.1002/eap.2045 |
| [38] |
KIRWAN M L, MUDD S M. Response of salt-marsh carbon accumulation to climate change[J]. Nature, 2012, 489(7417): 550-553. DOI:10.1038/nature11440 |
| [39] |
GUAN D M. Coastal Wetlands in China[M]. Beijing: Chinese Marine Press, 2012. 关道明. 中国滨海湿地[M]. 北京: 海洋出版社, 2012. |
| [40] |
PENK M R, PERRIN P M, WALDREN S. Above- to belowground vegetation biomass ratio in temperate North-East Atlantic saltmarshes increases strongly with soil nitrogen gradient[J]. Ecosystems, 2020, 23(3): 648-661. DOI:10.1007/s10021-019-00428-z |
| [41] |
ELSEY-QUIRK T, SELISKAR D M, SOMMERFIELD C K, et al. Salt marsh carbon pool distribution in a Mid-Atlantic Lagoon, USA: Sea level rise implications[J]. Wetlands, 2011, 31(1): 87-99. DOI:10.1007/s13157-010-0139-2 |
| [42] |
KEARNEY W S, FAGHERAZZI S. Salt marsh vegetation promotes efficient tidal channel networks[J]. Nat Commun, 2016, 7: 12287. DOI:10.1038/ncomms12287 |
| [43] |
BAAIJ B M, KOOIJMAN J, LIMPENS J, et al. Monitoring impact of salt-marsh vegetation characteristics on sedimentation: An outlook for nature-based flood protection[J]. Wetlands, 2021, 41(6): 76. DOI:10.1007/s13157-021-01467-w |
| [44] |
GU J, LUO M, ZHANG X, et al. Losses of salt marsh in China: Trends, threats and management[J]. Estuar Coast Shelf Sci, 2018, 214: 98-109. DOI:10.1016/j.ecss.2018.09.015 |
| [45] |
HAN G X, LI J Y, QU W D. Effects of nitrogen input on carbon cycle and carbon budget in a coastal salt marsh[J]. Chin J Plant Ecol, 2021, 45(4): 321-333. 氮输入对滨海盐沼湿地碳循环关键过程的影响及机制[J]. 植物生态学报, 2021, 45(4): 321-333. DOI:10.17521/cjpe.2020.0353 |
| [46] |
ZHANG P, NIE M, LI B, et al. The transfer and allocation of newly fixed C by invasive Spartina alterniflora and native Phragmites australis to soil microbiota[J]. Soil Biol Biochem, 2017, 113: 231-239. DOI:10.1016/j.soilbio.2017.06.003 |
| [47] |
WANG W Q, WANG C, SARDANS J, et al. Flood regime affects soil stoichiometry and the distribution of the invasive plants in subtropical estuarine wetlands in China[J]. Catena, 2015, 128: 144-154. DOI:10.1016/j.catena.2015.01.017 |
| [48] |
CAO L, SONG J M, LI X G, et al. Research progresses in carbon budget and carbon cycle of the coastal salt marshes in China[J]. Acta Ecol Sin, 2013, 33(17): 5141-5152. 中国滨海盐沼湿地碳收支与碳循环过程研究进展[J]. 生态学报, 2013, 33(17): 5141-5152. DOI:10.5846/stxb201206030803 |
| [49] |
SPENCER T, SCHUERCH M, NICHOLLS R J, et al. Global coastal wetland change under sea-level rise and related stresses: The DIVA wetland change model[J]. Glob Planet Change, 2016, 139: 15-30. DOI:10.1016/j.gloplacha.2015.12.018 |
| [50] |
SANDERMAN J, HENGL T, FISKE G J. Soil carbon debt of 12 000 years of human land use[J]. Proc Natl Acad Sci USA, 2017, 114(36): 9575-9580. DOI:10.1073/pnas.1706103114 |
| [51] |
YE S, LAWS E A, YUKNIS N, et al. Carbon sequestration and its controlling factors in the temperate wetland communities along the Bohai Sea, China[J]. Mar Fresh Res, 2018, 69(5): 700-713. DOI:10.1071/MF17120 |
| [52] |
XIA S, SONG Z, LI Q, et al. Distribution, sources, and decomposition of soil organic matter along a salinity gradient in estuarine wetlands characterized by C∶N ratio, δ13C-δ15N, and lignin biomarker[J]. Glob Change Biol, 2021, 27(2): 417-434. DOI:10.1111/gcb.15403 |
| [53] |
DIAO H Y, WANG A Z, YUAN F H, et al. Environmental effects on carbon isotope discrimination from assimilation to respiration in a coniferous and broad-leaved mixed forest of northeast China[J]. Forests, 2020, 11(11): 1156. DOI:10.3390/f11111156 |
| [54] |
WAN S A, LIU X T, MOU X J. Vertical distribution characteristics of carbon and nitrogen contents in soils of 4 types of wetlands in Shuangtai River Estuary[J]. Wetland Sci, 2017, 15(4): 629-634. 双台河口四种类型湿地土壤中的碳、氮含量垂直分布特征[J]. 湿地科学, 2017, 15(4): 629-634. DOI:10.13248/j.cnki.wetlandsci.2017.04.023 |
| [55] |
LUO X X, ZHANG S S, DUN M. Spatial distribution and seasonal dynamics characteristics of carbon, nitrogen and phosphorus in the Liaohe estuary wetlands[J]. Period Ocean Univ China, 2010, 40(12): 97-104. 辽河口湿地碳、氮、磷空间分布及季节动态特征[J]. 中国海洋大学学报, 2010, 40(12): 97-104. DOI:10.3969/j.issn.1672-5174.2010.12.014 |
| [56] |
LU W Z, LIU C A, ZHANG Y, et al. Carbon fluxes and stocks in a carbonate-rich chenier plain[J]. Agric For Meteorol, 2019, 275: 159-169. DOI:10.1016/j.agrformet.2019.05.023 |
| [57] |
WANG Q D, SONG J M, LI X G, et al. Environmental evolution records reflected by radionuclides in the sediment of coastal wetlands: A case study in the Yellow River Estuary wetland[J]. J Environ Rad, 2016, 162–163: 87-96. DOI:10.1016/j.jenvrad.2016.05.015 |
| [58] |
BAI J H, ZHANG G L, ZHAO Q Q, et al. Depth-distribution patterns and control of soil organic carbon in coastal salt marshes with different plant covers[J]. Sci Rep, 2016, 6(1): 34835. DOI:10.1038/srep34835 |
| [59] |
YU J B, DONG H F, LI Y Z, et al. Spatiotemporal distribution characteristics of soil organic carbon in newborn coastal wetlands of the Yellow River Delta Estuary[J]. CLEAN Soil Air Water, 2014, 42(3): 311-318. DOI:10.1002/clen.201100511 |
| [60] |
ZI Y Y, XI M, KONG F L, et al. Temporal and spatial distribution of soil organic carbon and its storage in the coastal wetlands of Jiaozhou Bay, China[J]. Chin J Appl Ecol, 2016, 27(7): 2075-2083. 胶州湾滨海湿地土壤有机碳时空分布及储量[J]. 应用生态学报, 2016, 27(7): 2075-2083. DOI:10.13287/j.1001-9332.201607.004 |
| [61] |
HOU X J, YIN P, DING X, et al. Carbon storage capacity in the Daguhe wetland, Jiaozhou Bay of Qingdao[J]. Mar Geol Front, 2012, 28(11): 17-26. 青岛胶州湾大沽河口滨海湿地的碳埋藏能力[J]. 海洋地质前沿, 2012, 28(11): 17-26. DOI:10.16028/j.1009-2722.2012.11.009 |
| [62] |
XIE W X, ZHU K J, CUI Y Q, et al. Spatial distribution of soil carbon and nitrogen in Jiaozhou Bay estuarine wetlands[J]. Acta Pratacult Sin, 2014, 23(6): 54-60. 胶州湾河口湿地土壤有机碳及氮含量空间分布特征研究[J]. 草业学报, 2014, 23(6): 54-60. DOI:10.11686/cyxb20140607 |
| [63] |
LIU J E, HAN R M, SU H R, et al. Effects of exotic Spartina alterniflora on vertical soil organic carbon distribution and storage amount in coastal salt marshes in Jiangsu, China[J]. Ecol Eng, 2017, 106: 132-139. DOI:10.1016/j.ecoleng.2017.05.041 |
| [64] |
YANG R M. Interacting effects of plant invasion, climate, and soils on soil organic carbon storage in coastal wetlands[J]. J Geophys Res Biogeosci, 2019, 124(8): 2554-2564. DOI:10.1029/2019JG005190 |
| [65] |
ZANG Z. Analysis of intrinsic value and estimating losses of “blue carbon” in coastal wetlands: A case study of Yancheng, China[J]. Ecos Health Sus, 2019, 5(1): 216-225. DOI:10.1080/20964129.2019.1673214 |
| [66] |
WANG D, ZHANG R, XIONG J, et al. Contribution of invasive species Spartina alterniflora to soil organic carbon pool in coastal wetland: Stable isotope approach[J]. Chin J Plant Ecol, 2015, 39(10): 941-949. 互花米草入侵对滨海湿地土壤碳库的贡献——基于稳定同位素的研究[J]. 植物生态学报, 2015, 39(10): 941-949. DOI:10.17521/cjpe.2015.0091 |
| [67] |
ZHANG Y L, DU J Z, ZHAO X, et al. A multi-proxy study of sedimentary humic substances in the salt marsh of the Changjiang Estuary, China[J]. Estuar Coast Shelf Sci, 2014, 151: 295-301. DOI:10.1016/j.ecss.2014.10.007 |
| [68] |
BU N S, QU J F, LI G, et al. Reclamation of coastal salt marshes promoted carbon loss from previously-sequestered soil carbon pool[J]. Ecol Eng, 2015, 81: 335-339. DOI:10.1016/j.ecoleng.2015.04.051 |
| [69] |
JIN B S, LAI D Y F, GAO D Z, et al. Changes in soil organic carbon dynamics in a native C4 plant-dominated tidal marsh following Spartina alterniflora invasion[J]. Pedosphere, 2017, 27(5): 856-867. DOI:10.1016/S1002-0160(17)60396-5 |
| [70] |
HE T, SUN Z G, HU X Y, et al. Effects of Spartina alterniflora invasion on spatial and temporal variations of total sulfur and inorganic sulfur fractions in sediments of salt marsh in the Min River estuary, southeast China[J]. Ecol Indic, 2020, 113: 106253. DOI:10.1016/j.ecolind.2020.106253 |
| [71] |
WANG H, SUN Z G, LI J B, et al. Spatial variations of soil carbon and nitrogen contents in Phragmites australis and Cyperus malaccensis marsh in the Minjiang River estuary[J]. Chin J Ecol, 2018, 37(4): 1102-1110. 闽江口典型芦苇湿地与短叶茳芏湿地土壤碳氮含量的空间分布特征[J]. 生态学杂志, 2018, 37(4): 1102-1110. DOI:10.13292/j.1000-4890.201804.033 |
| [72] |
STAGG C L, SCHOOLMASTER D R, KRAUSS K W, et al. Causal mechanisms of soil organic matter decomposition: Deconstructing salinity and flooding impacts in coastal wetlands[J]. Ecology, 2017, 98(8): 2003-2018. DOI:10.1002/ecy.1890 |
| [73] |
SANCHEZ-CABEZA J A, RUIZ-FERNÁNDEZ A C. 210Pb sediment radiochronology: An integrated formulation and classification of dating models[J]. Geochim Cosmochim Acta, 2012, 82: 183-200. DOI:10.1016/j.gca.2010.12.024 |
| [74] |
XIA P, MENG X W, LI Z, et al. Sedimentary records of mangrove evolution during the past one hundred years based on stable carbon isotope and pollen evidences in Maowei, SW China[J]. J Ocean Univ China, 2016, 15(3): 447-455. DOI:10.1007/s11802-016-2687-4 |
| [75] |
BELLUCCI L G, FRIGNANI M, COCHRAN J K, et al. 210Pb and 137Cs as chronometers for salt marsh accretion in the Venice Lagoon- Links to flooding frequency and climate change[J]. J Environ Rad, 2007, 97(2/3): 85-102. DOI:10.1016/j.jenvrad.2007.03.005 |
| [76] |
GAO S P, WANG J B, XU B Q, et al. Application and problems of 210Pb and 137Cs dating techniques in lake sediments[J]. J Lake Sci, 2021, 33(2): 622-631. 210Pb和137Cs定年技术在湖泊沉积物中的应用与问题[J]. 湖泊科学, 2021, 33(2): 622-631. DOI:10.18307/2021.0226 |
| [77] |
SHARMA P, GARDNER L R, MOORE W S, et al. Sedimentation and bioturbation in a salt marsh as revealed by 210Pb, 137Cs, and 7Be studies12[J]. Limnol Oceanogr, 1987, 32(2): 313-326. DOI:10.4319/lo.1987.32.2.0313 |
| [78] |
PECK E K, WHEATCROFT R A, BROPHY L S. Controls on sediment accretion and blue carbon burial in tidal saline wetlands: Insights from the oregon coast, USA[J]. J Geophys Res Biogeosci, 2020, 125(2): e2019JG005464. DOI:10.1029/2019JG005464 |
| [79] |
DREXLER J Z, DAVIS M J, WOO I, et al. Carbon sources in the sediments of a restoring vs. historically unaltered salt marsh[J]. Estuar Coasts, 2020, 43(6): 1345-1360. DOI:10.1007/s12237-020-00748-7 |
| [80] |
HE B, DAI M, HUANG W, et al. Sources and accumulation of organic carbon in the Pearl River Estuary surface sediment as indicated by elemental, stable carbon isotopic, and carbohydrate compositions[J]. Biogeosciences, 2010, 7(10): 3343-3362. DOI:10.5194/bgd-7-2889-2010 |
| [81] |
LYNCH J C, HENSEL P, CAHOON D R. The surface elevation table and marker horizon technique: A protocol for monitoring wetland elevation dynamics [R]. California: U. S. Department of the Interior, 2015. doi: 10.13140/RG.2.1.5171.9761
|
| [82] |
CHEN L Z. Application of surface elevation table for carbon budget assessments in coastal blue carbon ecosystems[J]. Oceanol Limnol Sin, 2022, 53(2): 261-268. 地表高程监测在滨海蓝碳碳收支评估中的应用[J]. 海洋与湖沼, 2022, 53(2): 261-268. DOI:10.11693/hyhz20210800177 |
| [83] |
CHEN L Z, LIN Q L, KRAUSS K W, et al. Forest thinning in the seaward fringe speeds up surface elevation increment and carbon accumulation in managed mangrove forests[J]. J Appl Ecol, 2021, 58(9): 1899-1909. DOI:10.1111/1365-2664.13939 |
| [84] |
XIA T. The effects of vegetation succession and human activities on the material circulation of salt marshes [D]. Nanjing: Nanjing University, 2019. 夏添. 植被演替与人类活动对盐沼物质循环的影响 [D]. 南京: 南京大学, 2019. |
| [85] |
JIANG Y F, DU J Z, ZHANG J, et al. The determination of sedimentation rates in various vegetational zones of Chongming tidal flat of the Changjiang Estuary[J]. Acta Oceanol Sin, 2012, 34(2): 114-121. 长江口崇明东滩不同植被带沉积速率研究[J]. 海洋学报, 2012, 34(2): 114-121. |
| [86] |
LIU Z Y, PAN S M, YIN Y, et al. Reconstruction of the historical deposition environment from 210Pb and 137Cs records at two tidal flats in China[J]. Ecol Eng, 2013, 61: 303-315. DOI:10.1016/j.ecoleng.2013.09.029 |
| [87] |
FENG X J, WANG Y Y, LIU T, et al. Biomarkers and their applications in ecosystem research[J]. Chin J Plant Ecol, 2020, 44(4): 384-394. 生物标志物及其在生态系统研究中的应用[J]. 植物生态学报, 2020, 44(4): 384-394. DOI:10.17521/cjpe.2019.0139 |
| [88] |
LAI S, WAN H B, TANG F, et al. Characteristics and source analysis of organic carbon buried in sediments of Fuxian Lake[J]. China Environ Sci, 2020, 40(3): 1246-1256. 抚仙湖沉积物有机碳埋藏特征及来源解析[J]. 中国环境科学, 2020, 40(3): 1246-1256. DOI:10.3969/j.issn.1000-6923.2020.03.036 |
| [89] |
ALONSO-HERNÁNDEZ C M, FANELLI E, DIAZ-ASENCIO M, et al. Carbon and nitrogen isotopes to distinguish sources of sedimentary organic matter in a Caribbean estuary[J]. Isotopes Environ Health Studies, 2020, 56(5/6): 654-672. DOI:10.1080/10256016.2020.1819263 |
| [90] |
YU F L, ZONG Y Q, LLOYD J M, et al. Bulk organic δ13C and C/N as indicators for sediment sources in the Pearl River delta and estuary, southern China[J]. Estuar Coast Shelf Sci, 2010, 87(4): 618-630. DOI:10.1016/j.ecss.2010.02.018 |
| [91] |
HUANG M, GE C D, ZUO P, et al. The contribution of Spartina introduction on organic matter source and its effects on carbon burial in tidal flats[J]. J Nanjing Univ (Nat Sci), 2018, 54(3): 655-664. 米草引种对潮滩沉积物有机质的贡献及碳埋藏的影响[J]. 南京大学学报(自然科学版), 2018, 54(3): 655-664. DOI:10.13232/j.cnki.jnju.2018.03.021 |
| [92] |
SAMPER-VILLARREAL J, LOVELOCK C E, SAUNDERS M I, et al. Organic carbon in seagrass sediments is influenced by seagrass canopy complexity, turbidity, wave height, and water depth[J]. Limnol Oceanogr, 2016, 61(3): 938-952. DOI:10.1002/lno.10262 |
| [93] |
YAO P, YIN H Z, YAO Q Z, et al. Composition of n-alkanes in soils of the Yellow River Estuary wetlands and their potential as organic matter source indicators[J]. Environ Sci, 2012, 33(10): 3457-3465. 黄河口湿地土壤中正构烷烃分子指标及物源指示意义[J]. 环境科学, 2012, 33(10): 3457-3465. DOI:10.13227/j.hjkx.2012.10.012 |
| [94] |
WANG X C, CHEN R F, BERRY A. Sources and preservation of organic matter in Plum Island salt marsh sediments (MA, USA): Longchain n-alkanes and stable carbon isotope compositions[J]. Estuar Coast Shelf Sci, 2003, 58(4): 917-928. DOI:10.1016/j.ecss.2003.07.006 |
| [95] |
TANNER B R, UHLE M E, MORA C I, et al. Comparison of bulk and compound-specific δ13C analyses and determination of carbon sources to salt marsh sediments using n-alkane distributions (Maine, USA)[J]. Estuar Coast Shelf Sci, 2010, 86(2): 283-291. DOI:10.1016/j.ecss.2009.11.023 |
| [96] |
KUMAR M, BOSKI T, GONZÁLEZ-VILA F J, et al. Characteristics of organic matter sources from Guadiana Estuary salt marsh sediments (SW Iberian Peninsula)[J]. Cont Shelf Res, 2020, 197: 104076. DOI:10.1016/j.csr.2020.104076 |
| [97] |
KUMAR M, BOSKI T, GONZÁLEZ-VILA F J, et al. Discerning natural and anthropogenic organic matter inputs to salt marsh sediments of Ria Formosa lagoon (South Portugal)[J]. Environ Sci Pollut Res, 2020, 27(23): 28962-28985. DOI:10.1007/s11356-020-09235-9 |
| [98] |
ZOU Y M, WANG C Y, LIU X L, et al. Spatial distribution, compositional pattern and source apportionment of n-alkanes in surface sediments of the Bohai Sea, Yellow Sea, and East China Sea and implications of carbon sink[J]. Mar Pollut Bull, 2022, 178: 113639. DOI:10.1016/j.marpolbul.2022.113639 |
| [99] |
HEDGES J I, KEIL R G, BENNER R. What happens to terrestrial organic matter in the ocean?[J]. Org Geoch, 1997, 27(5/6): 195-212. DOI:10.1016/S0146-6380(97)00066-1 |
| [100] |
BAHRI H, DIGNAC M F, RUMPEL C, et al. Lignin turnover kinetics in an agricultural soil is monomer specific[J]. Soil Biol Biochem, 2006, 38(7): 1977-1988. DOI:10.1016/j.soilbio.2006.01.003 |
| [101] |
BIANCHI T S, MITRA S, MCKEE B A. Sources of terrestriallyderived organic carbon in lower Mississippi River and Louisiana shelf sediments: Implications for differential sedimentation and transport at the coastal margin[J]. Mar Chem, 2002, 77(2/3): 211-223. DOI:10.1016/S0304-4203(01)00088-3 |
| [102] |
GORDON E S, GOÑI M A. Controls on the distribution and accumulation of terrigenous organic matter in sediments from the Mississippi and Atchafalaya River margin[J]. Mar Chem, 2004, 92(1/2/3/4): 331-352. DOI:10.1016/j.marchem.2004.06.035 |
| [103] |
JEX C N, PATE G H, BLYTH A J, et al. Lignin biogeochemistry: From modern processes to quaternary archives[J]. Quat Sci Rev, 2014, 87: 46-59. DOI:10.1016/j.quascirev.2013.12.028 |
| [104] |
THEVENOT M, DIGNAC M F, RUMPEL C. Fate of lignins in soils: A review[J]. Soil Biol Biochem, 2010, 42(8): 1200-1211. DOI:10.1016/j.soilbio.2010.03.017 |
| [105] |
HEDGES J I, ERTEL J R. Characterization of lignin by gas capillary chromatography of cupric oxide oxidation products[J]. Anal Chem, 1982, 54(2): 174-178. DOI:10.1021/ac00239a007 |
| [106] |
WIT F, MÜLLER D, BAUM A, et al. The impact of disturbed peatlands on river outgassing in Southeast Asia[J]. Nat Commun, 2015, 6(1): 10155. DOI:10.1038/ncomms10155 |
| [107] |
DITTMAR T, KATTNER G. The biogeochemistry of the river and shelf ecosystem of the Arctic Ocean: A review[J]. Mar Chem, 2003, 83(3/4): 103-120. DOI:10.1016/S0304-4203(03)00105-1 |
| [108] |
TAREQ S M, TANAKA N, OHTA K. Biomarker signature in tropical wetland: Lignin phenol vegetation index (LPVI) and its implications for reconstructing the paleoenvironment[J]. Sci Total Environ, 2004, 324(1/2/3): 91-103. DOI:10.1016/j.scitotenv.2003.10.020 |
| [109] |
JOERGENSEN R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biol Fertil Soils, 2018, 54(5): 559-568. DOI:10.1007/s00374-018-1288-3 |
| [110] |
ENGELKING B, FLESSA H, JOERGENSEN R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biol Biochem, 2007, 39(8): 2111-2118. DOI:10.1016/j.soilbio.2007.03.020 |
| [111] |
GLASER B, TURRIÓN M B, ALEF K. Amino sugars and muramic acid-Biomarkers for soil microbial community structure analysis[J]. Soil Biol Biochem, 2004, 36(3): 399-407. DOI:10.1016/j.soilbio.2003.10.013 |
| [112] |
AMELUNG W, BRODOWSKI S, SANDHAGE-HOFMANN A, et al. Combining biomarker with stable isotope analyses for assessing the transformation and turnover of soil organic matter[J]. Adv Agron, 2008, 100: 155-250. DOI:10.1016/S0065-2113(08)00606-8 |
| [113] |
YUAN Y, LI Y, MOU Z J, et al. Phosphorus addition decreases microbial residual contribution to soil organic carbon pool in a tropical coastal forest[J]. Glob Change Biol, 2021, 27(2): 454-466. DOI:10.1111/gcb.15407 |
| [114] |
TIPPLE B J, BERKE M A, DOMAN C E, et al. Leaf-wax n-alkanes record the plant-water environment at leaf flush[J]. Proc Natl Acad Sci USA, 2013, 110(7): 2659-2664. DOI:10.1073/pnas.1213875110 |
| [115] |
FOGEL M L, GRIFFIN P L, NEWSOME S D. Hydrogen isotopes in individual amino acids reflect differentiated pools of hydrogen from food and water in Escherichia coli[J]. Proc Natl Acad Sci USA, 2016, 113(32): E4648-E4653. DOI:10.1073/pnas.1525703113 |
| [116] |
KAYRANLI B, SCHOLZ M, MUSTAFA A, et al. Carbon storage and fluxes within freshwater wetlands: A critical review[J]. Wetlands, 2010, 30(1): 111-124. DOI:10.1007/s13157-009-0003-4 |
| [117] |
CHEN Q F, MA J J, LIU J H, et al. Characteristics of greenhouse gas emission in the Yellow River Delta wetland[J]. Int Biodeter Biodegr, 2013, 85: 646-651. DOI:10.1016/j.ibiod.2013.04.009 |
| [118] |
TONG C, WANG W Q, ZENG C S, et al. Methane (CH4) emission from a tidal marsh in the Min River estuary, southeast China[J]. J Environ Sci Health Part A, 2010, 45(4): 506-516. DOI:10.1080/10934520903542261 |
| [119] |
HU H, WANG D Q, LI Y J, et al. Greenhouse gases fluxes at Chongming Dongtan Phragmites australis wetland and the influencing factors[J]. Res Environ Sci, 2014, 27(1): 43-50. 崇明东滩芦苇湿地温室气体排放通量及其影响因素[J]. 环境科学研究, 2014, 27(1): 43-50. DOI:10.13198/j.issn1001-6929.2014.01.07 |
| [120] |
CHEN Y P, CHEN G C, YE Y. Coastal vegetation invasion increases greenhouse gas emission from wetland soils but also increases soil carbon accumulation[J]. Sci Total Environ, 2015, 526: 19-28. DOI:10.1016/j.scitotenv.2015.04.077 |
| [121] |
LI X F, SARDANS J, HOU L J, et al. Climatic temperature controls the geographical patterns of coastal marshes greenhouse gases emissions over China[J]. J Hydrol, 2020, 590: 125378. DOI:10.1016/j.jhydrol.2020.125378 |
| [122] |
YUAN J J, DING W X, LIU D Y, et al. Exotic Spartina alterniflora invasion alters ecosystem-atmosphere exchange of CH4 and N2O and carbon sequestration in a coastal salt marsh in China[J]. Glob Change Biol, 2015, 21(4): 1567-1580. DOI:10.1111/gcb.12797 |
| [123] |
HU M J, SARDANS J, YANG X Y, et al. Patterns and environmental drivers of greenhouse gas fluxes in the coastal wetlands of China: A systematic review and synthesis[J]. Environ Res, 2020, 186: 109576. DOI:10.1016/j.envres.2020.109576 |
| [124] |
SCHIEBEL H N, GARDNER G B, WANG X C, et al. Seasonal export of dissolved organic matter from a New England salt marsh[J]. J Coast Res, 2018, 34(4): 939-954. DOI:10.2112/JCOASTRES-D-16-00196.1 |
| [125] |
WANG X C, LITZ L, CHEN R F, et al. Release of dissolved organic matter during oxic and anoxic decomposition of salt marsh cordgrass[J]. Mar Chem, 2007, 105(3/4): 309-321. DOI:10.1016/j.marchem.2007.03.005 |
| [126] |
WANG Y, ZHANG D, SHEN Z Y, et al. Characterization and spacial distribution variability of chromophoric dissolved organic matter (CDOM) in the Yangtze Estuary[J]. Chemosphere, 2014, 95: 353-362. DOI:10.1016/j.chemosphere.2013.09.044 |
| [127] |
WEISHAAR J L, AIKEN G R, BERGAMASCHI B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environ Sci Technol, 2003, 37(20): 4702-4708. DOI:10.1021/es030360x |
| [128] |
KOMADA T, SCHOFIELD O M E, REIMERS C E. Fluorescence characteristics of organic matter released from coastal sediments during resuspension[J]. Mar Chem, 2002, 79(2): 81-97. DOI:10.1016/S0304-4203(02)00056-7 |
| [129] |
ZHANG X H. The lateral flux and its influencing factors of dissolved carbon in tidal creeks of coastal wetlands around the Yangtze estuary [D]. Shanghai: East China Normal University, 2021. 张晓慧. 长江口滨海湿地潮沟溶解态碳横向通量过程及影响因子 [D]. 上海: 华东师范大学, 2021. |
| [130] |
GAO Y, CHEN J Q, ZHANG T T, et al. Lateral detrital C transfer across a Spartina alterniflora invaded estuarine wetland[J]. Ecol Process, 2021, 10(1): 70. DOI:10.1186/s13717-021-00340-2 |
| [131] |
GAO Y, OUYANG Z T, SHAO C L, et al. Field observation of lateral detritus carbon flux in a coastal wetland[J]. Wetlands, 2018, 38(3): 613-625. DOI:10.1007/s13157-018-1005-x |
| [132] |
YUAN Y Q, LI X Z, XIE Z L, et al. Annual lateral organic carbon exchange between salt marsh and adjacent water: A case study of east headland marshes at the Yangtze Estuary[J]. Front Mar Sci, 2022, 8: 809618. DOI:10.3389/fmars.2021.809618 |
| [133] |
ZHANG X H, CAO F, HUANG Y, et al. Variability of dissolved organic matter in two coastal wetlands along the Changjiang River Estuary: Responses to tidal cycles, seasons, and degradation processes[J]. Sci Total Environ, 2022, 807: 150993. DOI:10.1016/j.scitotenv.2021.150993 |
| [134] |
ZUO P, ZHAO S H, LIU C A, et al. Distribution of Spartina spp. along China’s coast[J]. Ecol Eng, 2012, 40: 160-166. DOI:10.1016/j.ecoleng.2011.12.014 |
| [135] |
DAEHLER C C, STRONG D R. Status, prediction and prevention of introduced cordgrass Spartina spp. invasions in Pacific estuaries, USA[J]. Biol Cons, 1996, 78(1/2): 51-58. DOI:10.1016/0006-3207(96)00017-1 |
| [136] |
MAO D H, LIU M Y, WANG Z M, et al. Rapid invasion of Spartina alterniflora in the coastal zone of Mainland China: Spatiotemporal patterns and human prevention[J]. Sensors, 19(10): 2308. doi: 10.3390/s19102308.
|
| [137] |
YANG W, AN S Q, ZHAO H, et al. Impacts of Spartina alterniflora invasion on soil organic carbon and nitrogen pools sizes, stability, and turnover in a coastal salt marsh of eastern China[J]. Ecol Eng, 2016, 86: 174-182. DOI:10.1016/j.ecoleng.2015.11.010 |
| [138] |
LIAO C Z, LUO Y Q, JIANG L F, et al. Invasion of Spartina alterniflora enhanced ecosystem carbon and nitrogen stocks in the Yangtze Estuary, China[J]. Ecosystems, 2007, 10(8): 1351-1361. DOI:10.1007/s10021-007-9103-2 |
| [139] |
ZHANG G L, BAI J H, JIA J, et al. Soil organic carbon contents and stocks in coastal salt marshes with Spartina alterniflora following an invasion chronosequence in the Yellow River Delta, China[J]. Chin Geogr Sci, 2018, 28(3): 374-385. DOI:10.1007/s11769-018-0955-5 |
| [140] |
HUANG L D, ZHANG Y H, SHI Y M, et al. Comparison of phosphorus fractions and phosphatase activities in coastal wetland soils along vegetation zones of Yancheng National Nature Reserve, China[J]. Estuar Coast Shelf Sci, 2015, 157: 93-98. DOI:10.1016/j.ecss.2014.09.027 |
| [141] |
GAO G F, LI P F, SHEN Z J, et al. Exotic Spartina alterniflora invasion increases CH4 while reduces CO2 emissions from mangrove wetland soils in southeastern China[J]. Sci Rep, 2018, 8(1): 9243. DOI:10.1038/s41598-018-27625-5 |
| [142] |
GAO G F, LI P F, ZHONG J X, et al. Spartina alterniflora invasion alters soil bacterial communities and enhances soil N2O emissions by stimulating soil denitrification in mangrove wetland[J]. Sci Total Environ, 2019, 653: 231-240. DOI:10.1016/j.scitotenv.2018.10.277 |
| [143] |
FU S J, CAI L Z, CAO J, et al. Nematode responses to the invasion of exotic Spartina in mangrove wetlands in Southern China[J]. Estuar Coasts, 2017, 40(5): 1437-1449. DOI:10.1007/s12237-017-0208-3 |
| [144] |
LIN L A, LIU W W, ZHANG M P, et al. Different height forms of Spartina alterniflora might select their own rhizospheric bacterial communities in southern coast of China[J]. Microb Ecol, 2019, 77(1): 124-135. DOI:10.1007/s00248-018-1208-y |
 2022, Vol. 30
2022, Vol. 30



