2. 陕西步长制药有限公司, 西安 710075
2. Shaanxi Buchang Pharmaceutical Co., Ltd., Xi'an 710075, China
秦岭龙胆(Gentiana apiata)为龙胆科(Gentianaceae) 龙胆属植物,别名太白龙胆、茱苓草。药用全草, 民间以未开花及开花两种方式应用。其味苦,性寒, 具有调经活血、清热燥湿、保肝明目、泻肝定惊等功效,临床主要治疗月经不调,痛经,头晕失眠,小便不利,淋症,崩漏,白带,痢疾,腹痛。有研究结果表明,秦岭龙胆主要含有三萜、黄酮、环烯醚萜、有机酸、生物碱、多糖及挥发油等化学成分[1]。其中,多糖作为龙胆中最主要的功效成分之一,具有抗氧化、抗肿瘤、降血糖、降血脂、保肝、免疫调节、抗病毒、抗炎等疗效[2–5]。中药疗效与功效成分含量呈量效关系,药材采收期不同,其功效成分的含量也会有所差异,从而极大影响疗效;其次,中药提取方法不同,其功效成分及其含量也会有所差异。因此,对秦岭龙胆开花前后多糖含量进行比较并对其提取工艺及抗氧化活性进行研究,除了可以确定药材的采收期,提高药物疗效及多糖提取率外,对其多糖的抗氧化活性研究,可为秦岭龙胆的开发利用提供依据,也为其开发成药品、食品、保健品提供理论参考。
1 材料和方法 1.1 仪器和试剂葡萄糖对照品(中国食品药品检定研究院, 110833-201803, 纯度≥99.8%);紫外可见分光光度计(TU-1810, 北京普希通用仪器有限责任公司);离心机(Anke, TDL-60B, 上海安亭科学仪器厂);1, 1-二苯基-2-三硝基苯肼(DPPH)、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、二丁基羟基甲苯(BHT)、维生素C (Vc)、无水乙醇、丙酮、苯酚、浓硫酸、石油醚均为分析纯。
1.2 方法材料 试验材料均采自陕西省眉县太白山脉,经陕西国际商贸学院医药学院雷国莲教授鉴定为秦岭龙胆(Gentiana apiata)的全草。分别取秦岭龙胆未开花和开花药材去除杂质,于60 ℃烘箱烘干后粉碎过80目筛,取适量粉末置于索氏提取器中, 加入石油醚进行脱脂处理后,放置阴凉通风处,干燥备用。
多糖的提取 取脱脂干燥的样品,加水煎煮,滤液浓缩后加入无水乙醇冷藏放置过夜,高速离心后沉淀用无水乙醇和丙酮洗涤,干燥后即为粗多糖。
葡萄糖标准曲线绘制 参照吕晓帆等[6]的方法。精密称量10 mg葡萄糖对照品,蒸馏水定容于100 mL容量瓶中,即得0.1 mg/mL葡萄糖标准溶液。移液管移取配制好的葡萄糖标准溶液2、4、6、8、10 mL,分别置于10 mL容量瓶中,蒸馏水定容至刻度,混匀,分别得0.02、0.04、0.06、0.08、0.10 mg/mL的标准溶液,分别移取配制好的葡萄糖标准溶液和蒸馏水1 mL置具塞试管中,再加入5%的苯酚溶液1 mL和浓硫酸5 mL摇匀,以蒸馏水为空白对照,将具塞试管于100 ℃水浴锅中加热反应20 min后,置于冷水浴中冷却至室温,用紫外分光光度计测定波长480 nm下的吸光度,以葡萄糖浓度(C, mg/mL)为横坐标,吸光度(A)为纵坐标绘制标准曲线,并获得回归方程。
多糖提取率的计算 将提取的粗多糖样品溶解并定容于容量瓶中摇匀,即得供试品溶液,用移液管移取供试品溶液,用苯酚-硫酸法显色后用紫外分光光度法测定其吸光度。根据回归方程计算多糖含量,多糖提取率(%)=多糖含量/秦岭龙胆质量× 100%。
单因素实验 采用控制变量法,在其他条件固定的情况下,考察提取时间、料液比、醇沉比、离心转速对秦岭龙胆多糖提取率的影响。称取5份相同质量脱脂后的秦岭龙胆开花前后的药材粉末, 试验时固定3个因素,考察另1个因素的变化对多糖提取率的影响,最终得到最佳提取时间、料液比、醇沉比、离心转速。
响应面分析法 在单因素分析的基础上,确定响应面设计的自变量,以多糖提取率为变量,选取提取时间、料液比、醇沉比、离心转速4因素进行响应曲面分析,每次实验平行重复3次,取平均值。数据处理采用Design-Expert 8.0.6统计软件分析,并对最终分析结果进行验证,以获得最佳提取工艺方案。
1.3 抗氧化活性研究参照胡文兵等[7]的方法,多糖样品用蒸馏水溶解配制成0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL的溶液。称取适量的Vc、BHT配制成相同浓度梯度的对照品溶液。
DPPH自由基清除率的测定 参照Zhang等[8]的方法。称取DPPH用无水乙醇配制成0.04 mg/mL的溶液。取不同浓度的供试品溶液2.0 mL和DPPH自由基溶液2.0 mL,在室温下充分混合均匀,避光反应30 min,在517 nm波长下测定混合溶液的吸光度(Ai),样品溶液和无水乙醇溶液的吸光度(Aj), 无水乙醇和DPPH溶液的吸光度(A0),无水乙醇为空白对照,以Vc和BHT溶液做阳性对照。DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100%。
ABTS+清除率的测定 参照Ha等[9]的方法。称取ABTS配制成10 mmol/L的溶液,加入4 mmol/L的过硫酸钾溶液混合摇匀,避光放置10 h,获得ABTS+原液。取不同浓度供试品溶液0.1 mL,与ABTS+原液3.9 mL混合,室温下避光反应6 min, 在734 nm波长处测定吸光度(A1),供试品与无水乙醇混合溶液的吸光度(A2),无水乙醇为空白对照, 以VC和BHT溶液做阳性对照。ABTS+清除率(%)=[1-(A1)/A2]×100%。
1.4 统计学分析所有数据采用SPSS 17.0软件处理,采用邓肯氏法进行显著性分析,P < 0.05为显著差异。所有试验重复3次,结果以平均值±标准差表示。
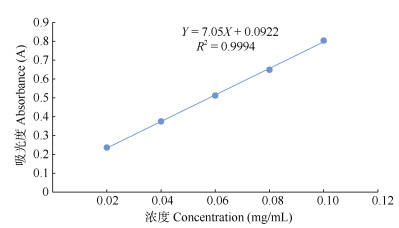
2 结果和分析 2.1 标准曲线绘制结果由图 1可见,葡萄糖浓度为0.02~0.10 mg/mL时,线性关系良好,其回归方程为Y=7.05X+0.0922,相关系数R2=0.999 4。
|
图 1 葡萄糖标准曲线 Fig. 1 Standard curve of glucose |
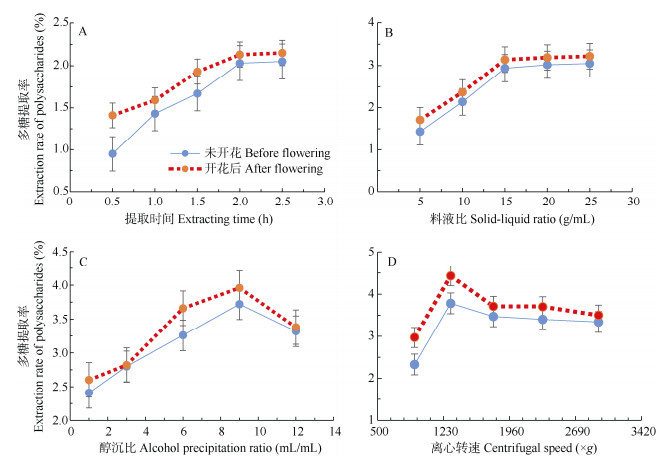
提取时间的影响 固定料液比、醇沉比和离心转速,考察提取时间(0.5、1.0、1.5、2.0、2.5 h)对多糖提取率的影响。从图 2: A可见,随提取时间的延长多糖提取率增加,提取时间大于2 h后提取率增加缓慢,可能是提取2 h后多糖的溶解达到相对饱和或已基本提取完全,故选择最佳提取时间为2 h。
|
图 2 提取时间(A)、料液比(B)、醇沉比(C)、离心转速(D)对多糖提取率的影响 Fig. 2 Effects of extraction time (A), solid-liquid ratio (B), alcohol precipitation ratio (C) and centrifugal speed (D) on extraction rate of polysaccharides |
料液比的影响 固定醇沉比和离心转速,提取2 h,考察不同料液比(1:5、1:10、1:15、1:20、1:25)对多糖提取率的影响。从图 2: B可见, 提取率在料液比小于1:15时快速增加,1:15之后增加缓慢,可能多糖在料液比1:15时几乎完全溶解。故选择料液比为1:15为最佳。
醇沉比的影响 固定离心转速,提取2 h和料液比1:15,考察醇沉比(1:1、1:3、1:6、1:9、1:12)对多糖提取率的影响。从图 2: C可见,醇沉比小于1:9时与提取率成正相关,此后多糖的提取率随醇沉比增加而下降,可能是随醇浓度的增加多糖溶解度降低,有利于多糖沉淀,但当醇沉浓度过高时,多糖会包裹一些杂质沉淀析出,导致多糖不纯使提取率下降。故选择醇沉比1:9为最佳。
离心转速的影响 在提取2 h,料液比1:15和醇沉比1:9条件下,考察离心转速(909、1 309、1 782、2 328、2 946×g)对多糖提取率的影响。从图 2: D可见,多糖提取率在离心转速1 309×g达到最大,此后多糖提取率随离心转速的增加反而下降, 可能是1 309×g时多糖基本沉降完全。故选择离心转速1 309×g为最佳。
从单因素实验结果还可看出,秦岭龙胆开花后的多糖含量高于未开花的,故药材以开花后采收最佳。因此本文对秦岭龙胆药材的多糖提取工艺进行考察时,只对开花后药材用响应面法进行优化。
2.3 响应面法优化依据Box-Behnken响应曲面法对秦岭龙胆开花药材多糖提取工艺进行优化。以多糖提取率(Y)为响应值,设计实验方案(表 1), 共29组试验(表 2)。应用Design-Expert 8.0.6 Trial软件分析,得到多元二次回归模型方程:Y=–32.822+0.405A+1.118B+0.311C+0.015D+0.039AB–0.041AC+ 1.650×10–4AD–2.333×10–3BC–1.600×10–4BD+ 2.700×10–4CD+0.365A2–0.021B2–0.052C2–2.436×10–6D2,式中,Y为多糖提取率,A为提取时间,B为料液比,C为醇沉比,D为离心转速。
| 表 1 因素水平 Table 1 Factor level |
| 表 2 Box-Behnken设计方案及结果 Table 2 Experimental design of response surface methodology |
方差分析表明(表 3),回归方程的P < 0.0001, F= 58.67 > 0.05,说明二次多项式方程极显著。F失拟项=4 > 0.05,失拟项不显著[10]。可见,响应值与自变量间的多元回归关系显著,可以很好的用该模型表示,最佳提取工艺条件可利用该模型确定。模型的调整确定系数RAdj2=0.966 5,说明96.65%的响应值变化能够用该模型解释。此外,从表 3可见,各因素的一次项对响应值均有显著作用,说明提取时间、料液比、醇沉比、离心转速对多糖提取率均有影响;交互因素只有料液比和离心转速(BD)、醇沉比和离心转速(CD)之间的影响较显著。这表明各因素与响应值间并非单纯的线性关系。一次项P反映出各因素对响应值的影响,为提取时间(A) > 离心转速(D) > 料液比(B) > 醇沉比(C)。
| 表 3 方差分析 Table 3 Variance analysis |
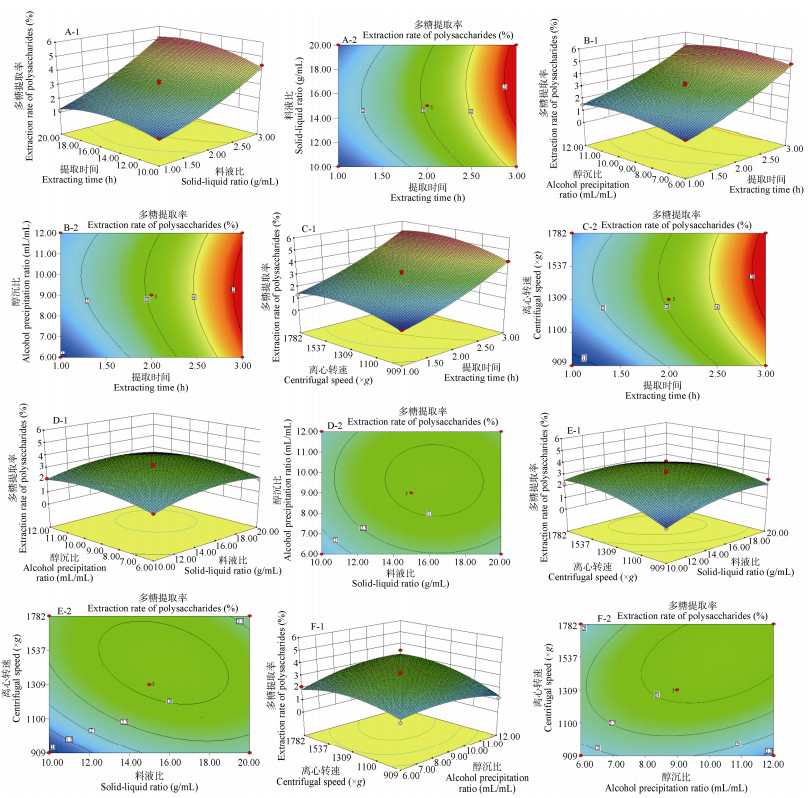
图 3为各因素对秦岭龙胆开花药材多糖提取率影响的响应面图和等高线图,可见4个因素的最适范围及其交互作用,最佳提取时间为2~3 h;最佳料液比为1:14~1:16;最佳醇沉比为1:8~1:10;最佳离心转速为1 309~1 537×g。由图 3: E, F可见,等高线近似椭圆,曲面图较陡峭,说明料液比和离心转速及醇沉比和离心转速之间的交互作用较显著,与表 3方差分析结果相吻合。
|
图 3 各因素响应面与等高线分析图 Fig. 3 Response surface and contour plot analysis diagram of factors |
根据Design-Expert软件对模型方程计算求解回归方程,最终得到秦岭龙胆开花药材多糖的最佳提取工艺为提取时间3 h,料液比1:16,醇沉比1:10,离心转速1 537×g,预测多糖的提取率为5.42%。在此条件下平行验证操作3次,取平均值,多糖提取率约为5.13%,比理论值仅下降0.29%,说明该模型可信度高,可较好反映秦岭龙胆多糖的提取条件,用于多糖提取率预测。
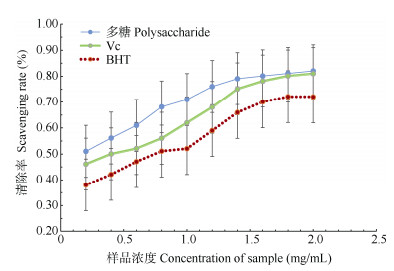
2.4 抗氧化活性分析DPPH自由基清除率 从图 4可见,不同浓度秦岭龙胆多糖溶液对DPPH自由基的清除率有显著差异,随浓度的升高对DPPH清除率呈增加趋势(P < 0.05)。多糖浓度大于1.4 mg/mL时,多糖对DPPH的清除率仍然呈缓慢上升趋势,且其清除率均大于标准品VC和BHT (P < 0.05),说明秦岭龙胆多糖对DPPH自由基有很好的清除作用。
|
图 4 多糖对DPPH的清除率 Fig. 4 Scavenging rate of polysaccharide to DPPH |
ABTS+的清除率 从图 5可见,不同浓度多糖溶液对ABTS自由基清除率有显著差异,且清除率随多糖浓度的增加而逐渐增大(P < 0.05),当多糖溶液浓度大于1.4 mg/mL时,对ABTS+的清除率呈缓慢上升趋势(P < 0.05),且秦岭龙胆多糖对ABTS+的清除率均高于VC和BHT (P < 0.05),表明秦岭龙胆多糖对ABTS+也具有清除能力。
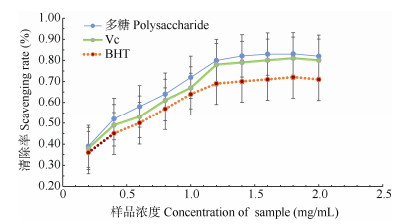
|
图 5 秦岭龙胆多糖对ABTS+的清除率 Fig. 5 Scavenging rate of polysaccharide to ABTS+ |
秦岭龙胆民间应用有开花和未开花2种,本研究表明,开花药材中多糖含量高于未开花药材,故采收药材时应在待开花后,以极大地提高药效。由于秦岭龙胆的多糖类化合物亲水性较强,故本研究选择水提醇沉法结合高速离心,以提高多糖的提取效率。与传统的水提醇沉法相比,本研究具有节约溶剂、缩短提取时间、减少能耗等优点,符合绿色环保的现代化提取理念,而且在提取多糖的过程中采用传统煎煮法与现代高速离心法相融合,并对提取工艺进行了优化,获得较高的提取率。
植物中广泛存在多种多糖类化合物,且具有明显的抗氧化作用,多为中草药中的有效活性成分, 目前在医药与食品领域应用广泛[11–12]。有研究表明, 多糖的抗氧化作用主要是通过内源性抗氧化应激通路Nrf2-ARE通路,调节编码下游抗氧化酶基因的表达,阻断自由基链式反应,从而减少自由基的生成,消除过多自由基,从根源上防治疾病的产生[13–14]。本研究对秦岭龙胆多糖抗氧化研究结果也显示,秦岭龙胆多糖具有显著的抗氧化活性,且随剂量的增加抗氧化性逐渐增加,比对照品VC和BHT的抗氧化性强,可作为抗氧剂使用。
近年来,随着对中药疗效作用要求的进一步提高,对中药提取工艺的研究越来越广泛且越来越受重视,然而在提取工艺研究上还存在一些问题,例如提取秦岭龙胆以多糖提取率为指标,其提取方法不同,结果差异也较大,提取次数、提取温度及粉碎度等都会影响提取率,提取工艺不同其化学组分、含量也不统一,因而提取次数对秦岭龙胆多糖提取率及化学组分造成的差异还有待于进一步研究。
| [1] |
WANG N. Qualitative analysis of chemical components in Gentiana apiata[J]. J Qinghai Univ, 2004, 22(6): 1-2. 秦岭龙胆化学成分的定性分析[J]. 青海大学学报(自然科学版), 2004, 22(6): 1-2. DOI:10.3969/j.issn.1006-8996.2004.06.001 |
| [2] |
FU J, LÜ Y, CHENG Z Y. Optimization in pectinase-assisted extraction process of polysaccharides from Gentiana scabra and their antioxidant activity[J]. Chem Bioeng, 2020, 37(9): 33-37. 龙胆多糖的果胶酶法提取工艺及抗氧化活性研究[J]. 化学与生物工程, 2020, 37(9): 33-37. DOI:10.3969/j.issn.1672-5425.2020.09.007 |
| [3] |
ZHANG B X, SUN J Z, JIANG Y J, et al. Liver protecting effect of total polysaccharides and total iridoid glycosides from wine-processed Gentiana scabra Bge.[J]. CS Pharm, 2019, 17(7): 1001-1005. 酒龙胆中总多糖和总环烯醚萜苷保肝作用的研究[J]. 中南药学, 2019, 17(7): 1001-1005. DOI:10.7539/j.issn.1672-2981.2019.07.005 |
| [4] |
GONG J N, YUN C Y, YANG Y J. Optimization of refinement of polysaccharide from Gentiana scabra Bunge through macroporous adsorption resin AB-8[J]. J Guizhou Norm Univ (Nat Sci), 2018, 36(2): 39-43. AB-8大孔吸附树脂纯化龙胆多糖的工艺优化[J]. 贵州师范大学学报(自然科学版), 2018, 36(2): 39-43. DOI:10.3969/j.issn.1004-5570.2018.02.007 |
| [5] |
GONG J N, WEI Y J, YANG Z Y. Extraction optimization and antioxidant activity of gentian polysaccharides by response surface methodology[J]. China Brew, 2017, 36(8): 134-138. 响应面优化龙胆多糖的提取工艺及抗氧化性研究[J]. 中国酿造, 2017, 36(8): 134-138. DOI:10.11882/j.issn.0254-5071.2017.08.029 |
| [6] |
LÜ X F, ZHOU X H, WANG Y, et al. Component analysis of Dendrobium phalaenopsis anthocyanin extract and its antioxidant activity and irritation in vitro[J]. J Trop Subtrop Bot, 2021, 29(4): 374-381. 秋石斛花青素提取液成分分析及其体外抗氧化活性和刺激性研究[J]. 热带亚热带植物学报, 2021, 29(4): 374-381. DOI:10.11926/jtsb.4327 |
| [7] |
HU W B, YANG Z W, CHEN H, et al. Optimization of ultrasonic and enzyme-assisted extraction of polysaccharides from Cyclocarya paliurus by plackett-burman and box-behnken experiment and analysis of its structure[J]. Nat Prod Res Dev, 2017, 29(4): 671-679. Plackett-Burman和Box-Behnken试验设计优化超声波-酶法提取青钱柳多糖工艺及结构初探[J]. 天然产物研究与开发, 2017, 29(4): 671-679. DOI:10.16333/j.1001-6880.2017.4.024 |
| [8] |
ZHANG R, MA C J, WEI Y L, et al. Isolation, purification, structural characteristics, pharmacological activities, and combined action of Hedyotis diffusa polysaccharides: A review[J]. Int J Biol Macromol, 2021, 183: 119-131. DOI:10.1016/j.ijbiomac.2021.04.139 |
| [9] |
HA S J, KIM M J, PARK J, et al. Erythorbyl laurate suppresses TNF-α-induced adhesion of monocytes to the vascular endothelium[J]. J Funct Foods, 2021, 80: 104428. DOI:10.1016/j.jff.2021.104428 |
| [10] |
YANG B Y, YE L P, LIN L L, et al. Ultrasonic condition optimization for anthocyanin extraction from purple cabbage by using response surface methodology (RSM)[J]. J Trop Subtrop Bot, 2014, 22(4): 373-382. 响应面法优化超声辅助提取紫色小白菜花青苷的工艺研究[J]. 热带亚热带植物学报, 2014, 22(4): 373-382. DOI:10.3969/j.issn.1005-3395.2014.04.008 |
| [11] |
QIU S M. Study on medicinal and edible plant extracts and antioxidant properties [D]. Qingdao: Qingdao University, 2014. 邱书梅. 药食两用植物提取物及抗氧化性能的研究[D]. 青岛: 青岛大学, 2014. |
| [12] |
GAO J. Natural antioxidants and synergistic effects[J]. J Food Saf Qual, 2020, 11(6): 1859-1864. 天然抗氧化剂及其协同作用[J]. 食品安全质量检测学报, 2020, 11(6): 1859-1864. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.06.030 |
| [13] |
WANG L X, XIE Y H, ZHANG G G. Application of phytogenic antioxidants and its mechanisms[J]. Chin J Anim Nutri, 2017, 29(5): 1481-1488. 植物源性抗氧化剂的应用及其作用机制[J]. 动物营养学报, 2017, 29(5): 1481-1488. DOI:10.3969/j.issn.1006-267x.2017.05.005 |
| [14] |
ZHAO C Y, WANG X L, PENG Y. Role of Nrf2 in neurodegenerative diseases and recent progress of its activators[J]. Acta Pharm Sin, 2015, 50(4): 375-384. Nrf2在神经退行性疾病中的作用及激活剂的研究进展[J]. 药学学报, 2015, 50(4): 375-384. DOI:10.16438/j.0513-4870.2015.04.012 |
 2022, Vol. 30
2022, Vol. 30


