2. 四川新绿色药业科技发展有限公司, 四川 彭州 611930
2. Sichuan Neo-Green Pharmaceutical Technology Development Co. Ltd., Pengzhou 611930, Sichuan, China
云南重楼(Paris polyphylla var. yunnanensis)是重楼属的多年生草本植物,又名滇重楼,与七叶一枝花(P. polyphylla var. chinensis)共同作为中药重楼的法定基原,收载于《中国药典》[1]。云南重楼主产于我国西南地区,随着重楼栽培产业的发展,因其优良的药材质量,成为主要的栽培种源[2]。中药材DNA条形码研究表明云南重楼种内遗传变异丰富, ITS序列存在明显的单核苷酸多态性(single nucleotide polymorphism, SNP)[3–4],并由此划分为2种基因型(YN-Ⅰ和YN-Ⅱ)。为了避免2种基因型并存导致真伪鉴定结果出现“假阴性”,开发了同时鉴别2种基因型的多重PCR鉴别体系[4]。
然而,目前尚无报道云南重楼ITS序列的SNP现象是否会引起植株在化学成分构成上的分化,进而在种内衍生出不同的化学型?研究这一问题对于丰富云南重楼种质资源多样性具有重要意义,并可能发现具有筛选价值的分子遗传标记。同时,根据2018年国家药品监督管理局发布的《中药材生产质量管理规范》(征求意见稿)的要求,中药材的优良品种选育,禁用人工选育的多倍体或者单倍体品种、种间杂交品种和转基因品种。因此,从云南重楼野生种群的自然变异类群中优选良种,将是未来重楼育种的主要途径,探索ITS区的SNP现象与药材质量的关联性将为实现这一目标提供重要参考。
本研究对云南重楼YN-Ⅰ和YN-Ⅱ型植株进行田间观察,发现形态学特征并无明显的分化[4]。为进一步了解是否会引起植株化学型的分化,进而影响药材质量,本研究收集了云南重楼不同产区的样品,根据其ITS序列的SNP特征进行基因型的鉴别,然后对不同基因型的7种甾体皂苷类成分(重楼皂苷Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ、H、薯蓣皂苷)进行测定,分析基因型与甾体皂苷构成的相关性,探讨其对药材质量的影响,为云南重楼的质量控制和良种选育提供科学依据。
1 材料和方法 1.1 材料云南重楼样本共37份,分别于2019—2021年采自云南、贵州、四川3省的主产区,根据采集年月编号凭证标本,样本详细信息见(表 1)。样品经成都中医药大学尹鸿翔副教授进行原植物鉴定,根据李恒系统,均符合云南重楼的特征(图 1);再经ITS序列同源性比对鉴定为云南重楼(Paris polyphylla var. yunnanensis),凭证标本藏于成都中医药大学标本馆(CDCM)。
| 表 1 云南重楼样品 Table 1 Samples of Paris polyphylla var. yunnanensis |

|
图 1 云南重楼。A: YN-Ⅰ型;B: YN-Ⅱ型。 Fig. 1 Paris polyphylla var. yunnanensis. A: YN-Ⅰ genotype; B: YN-Ⅱ genotype. |
Legend Micro 21R离心机(美国Thermo); BSA 124S分析天平(Sartorius科学仪器有限公司); MK-10干式恒温器(杭州奥盛仪器有限公司);PCR仪(杭州博日科技有限公司);DDY-12电泳系统(北京六一仪器厂);激光成像仪Typhoon 7000 (通用电气医疗集团生命科技部);微量紫外-分光光度仪(Thermo Nanodrop 2000)。Agilent technologies 1200series高效液相色谱仪(DAD检测器),色谱柱COSMOSIL Cholester RP-C18 (4.6 mm×250 mm, 5 μm),BP121S电子分析天平(万分之一),ULUP-I-10T优普超纯水机(成都超纯有限公司),SB-5200D超声波清洗器(宁波新艺超声设备有限公司),SHZ-DⅢ型循环水式多用真空泵(上海一科仪器有限公司),BCD-202D型冰箱(北京海信电器),DTF-100A型手提式高速万能粉碎机(温岭市林大机械有限公司),DZKW-4型电子恒温水浴锅(北京中兴伟业仪器有限公司), 101-3-BS型电热恒温鼓风干燥箱(上海跃进医疗器械有限公司)。
琼脂糖(广州赛国生物科技有限公司),Goldview Ⅰ型核酸染色剂(北京索莱宝科技有限公司),Easy Taq DNA聚合酶,10×EasyTaq Buffer (Mg2+ plus) (北京全式金生物技术有限公司), DNA Marker-B, dNTPs Mixture Solution (生工生物工程股份有限公司),植物组织DNA提取试剂盒(成都福际生物技术有限公司),α-高聚淀粉酶(思科生物科技有限公司)。色谱纯乙腈(TEDIA),超纯水,分析纯乙醇为(Fisher), 重楼皂苷I (批号:111590-201604,纯度93.6%)、Ⅱ (批号: 111591-201103, 纯度93.4%)、Ⅵ (批号:111592-201604, 纯度98.0%)、Ⅶ (批号: 111593-201604, 纯度94.0%)均购自于中国食品药品检定研究院;薯蓣皂苷(批号:19057-60-4)购于上海甄准生物科技有限公司。重楼皂苷H (纯度98.3%)、Ⅴ (纯度97.1%)由本课题组制备[5]。
1.3 单核苷酸多态性分析参照张开元等[4]的方法,采用ITS序列通用性引物ITS-4/ITS-L对37份样本进行扩增,扩增产物送成都擎科梓熙生物科技有限公司测序,利用Megalign软件对测序结果进行校对与分析,找出具有稳定差异的SNP位点,然后进行基因分型。
1.4 甾体皂苷构成特征分析采用李朋等[5]的方法,对37份样品的7种甾体皂苷含量进行测定,平行测定3次,取平均值,完成定性、定量对比分析。根据《中国药典》一部重楼项下含量测定标准[1]进行合格率评价。
1.5 聚类分析和主成分分析采用SPSS 25.0基于平均联结(组间)谱系图法对样本的甾体皂苷构成特征进行聚类分析(CA),采用SIMCA-P 15.0软件进行主成分分析(PCA)。
2 结果和分析 2.1 SNP和基因型划分采用Megalign软件对37份样本的ITS序列进行校对,扩增的ITS序列包含ITS1、5.8s rDNA和ITS2等3个片段。SNP有40个位点,其中ITS1区有SNP位点18个,5.8s rDNA区1个,ITS2区21个。40个位点均为双等位多态性,其中发生碱基转换的有32个,碱基颠换的有8个(表 2)。依据SNP位点多样性可以划分为2种基因型,分别编号为YN-Ⅰ和YN-Ⅱ,其中YN-Ⅰ型有19份(1~19号),YN-Ⅱ型18份(20~37号)。
| 表 2 云南重楼ITS区的SNP位点特征 Table 2 SNP characteristics of ITS of P. polyphylla var. yunnanensis |
以7种甾体皂苷对照品的进样量(μg)为横坐标,色谱峰峰面积(A)为纵坐标,绘制对照品的标准曲线,拟合回归方程。7种甾体皂苷色谱峰面积的RSD为0.316 5%~1.261 4%,表明方法的精密度良好; 重复性试验的RSD为0.613 6%~2.115 5%,表明重复性良好;且对照品和供试品溶液中7种甾体皂苷在24 h内基本稳定;7种甾体皂苷的平均加样回收率为99.71%~99.60%,均符合测定要求。
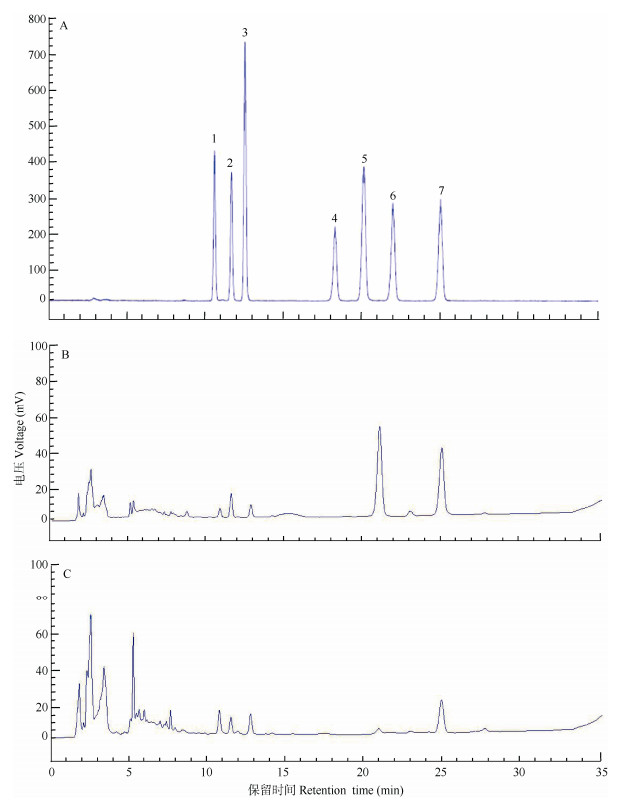
37份样品的测定结果见表 3,7种甾体皂苷对照品、YN-Ⅰ型和YN-Ⅱ型的HPLC特征见图 2。根据2020年版《中国药典》一部重楼项下规定,重楼皂苷Ⅰ、Ⅱ、Ⅶ之和不少于0.6%评价合格率。从表 3可见,重楼皂苷Ⅰ、Ⅱ、Ⅵ、Ⅶ、H和薯蓣皂苷等6种甾体皂苷在云南重楼中广泛分布,但重楼皂苷V较稀少,37份样品中仅有8份出现。除样品1、2、3、4、5、6、24、28、31和34外,其余27个样品均达到《中国药典》的含量标准,整体合格率达72.97%,其中YN-Ⅰ型的合格率为68.42%, YN-Ⅱ型为77.78%。YN-Ⅰ型的药典指标成分总含量平均为1.070%,YN-Ⅱ型为0.93%; YN-Ⅰ型的7种甾体皂苷总含量平均为1.65%,YN-Ⅱ型为1.32%。以基因型为影响因素,进行单因素方差分析(One-Way ANOVA),结果表明YN-Ⅰ型和YN-Ⅱ型的药典指标成分含量无显著差异(P > 0.05),但7种甾体皂苷总含量有显著差异(P < 0.05),说明2类基因型的甾体皂苷构成存在一定的分化。
| 表 3 样品的甾体皂苷成分含量 Table 3 Steroid saponin contents in samples |
|
图 2 云南重楼和对照品HPLC图。A: 7种甾体皂苷对照品; B: YN-Ⅰ型; C: YN-Ⅱ型; 1: 重楼皂苷Ⅶ; 2: 重楼皂苷H; 3: 重楼皂苷VI; 4: 重楼皂苷II; 5: 薯蓣皂苷; 6: 重楼皂苷I; 7: 重楼皂苷V。 Fig. 2 HPLC chromatograms of P. polyphylla var. yunnanensis and reference substance. A: 7 Steroidal saponins; B: YN-Ⅰ; C: YN-Ⅱ; 1: Polyphyllin Ⅶ; 2: Polyphyllin H; 3: Polyphyllin VI; 4: Polyphyllin II; 5: Dioscin; 6: Polyphyllin I; 7: Polyphyllin V. |
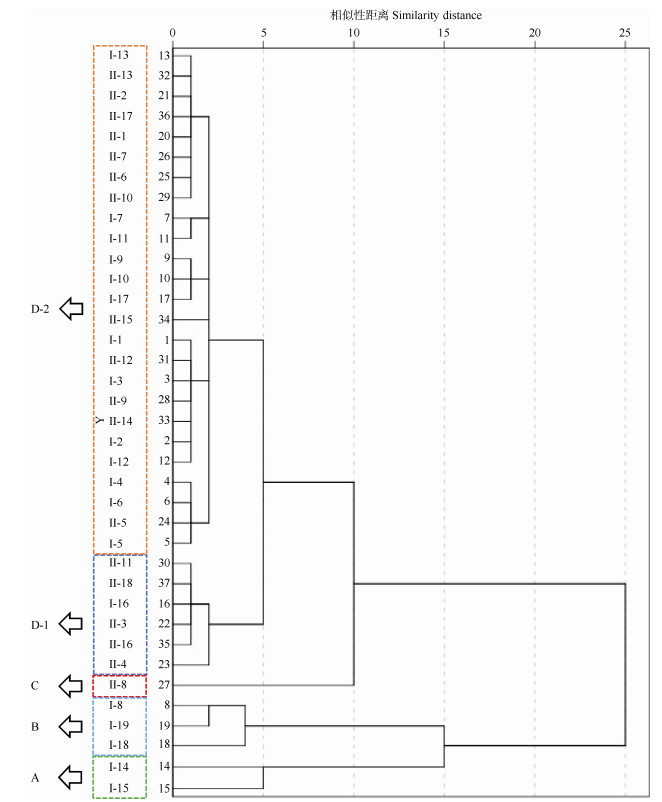
采用SPSS 25.0软件对37批样品的甾体皂苷构成特征进行聚类分析,构建树状聚类图(图 3)。当相似性距离为5~10时,37个样品聚为4支,其中Ⅰ-14、Ⅰ-15聚为第1支(A);Ⅰ-8、Ⅰ-18、Ⅰ-19聚为第2支(B);Ⅱ-8独立成第3支(C);其余31个样品聚为第4支(D)。第4支成员众多,当相似性距离 < 5时明显分为2个亚支,Ⅰ-16、Ⅱ-3、Ⅱ-4、Ⅱ-11、Ⅱ-16和Ⅱ-18聚为一亚支(D-1),其中YN-Ⅰ型1个和YN-Ⅱ型5个;其余25个样品聚为另一亚支(D-2),包括YN-Ⅰ型13个和YN-Ⅱ型12个。可见,不同基因型的样品可以聚类到同一分支中(如D-1和D-2)。
|
图 3 基于甾体皂苷特征的聚类图 Fig. 3 Dendrogram based on steroid saponin characters |
产地对甾体皂苷构成特征具有一定程度的影响,A支的Ⅰ-14、Ⅰ-15均来自贵州六枝;Ⅱ-8是唯一的单独产地样品(四川德昌),独立成C支;Ⅰ-4、Ⅰ-5、Ⅰ-6和Ⅱ-5虽然分属2个基因型,但均来自贵州长顺而聚在一起。
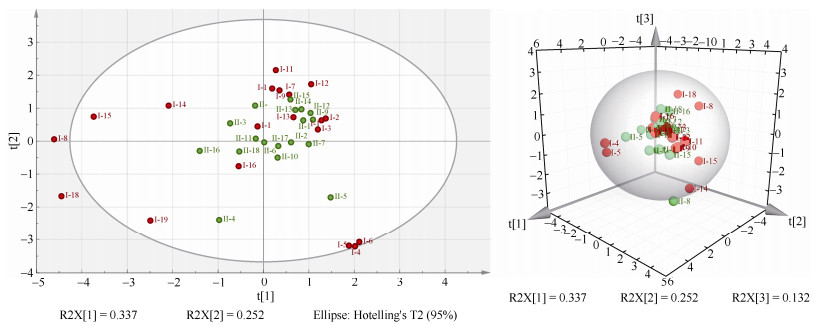
2.4 主成分分析采用SIMCA-P 15.0软件对37份样品的甾体皂苷含量进行主成份分析(PCA),标定了3个主成份, 分别绘制了基于2个主成分的二维得分图(图 4: A)和基于3个主成分的三维投影图(图 4: B)。从图 4可见,37个样品的甾体皂苷成分构成特征虽无明显的基因型分化,但仍然表现出一定程度的影响,图 3中聚在一起的Ⅰ-4、Ⅰ-5、Ⅰ-6和Ⅱ-5等4份样品在图 4: A中出现了分化,前三者仍然聚为一簇,但和Ⅱ-5明显分离。另外,YN-Ⅰ样品的离散度较高,而YN-Ⅱ样品的聚集度更好,其中Ⅰ-8号和Ⅰ-18号样品在Hotelling’s T2 (95%)下甚至表现为强异常值;这一特征也进一步在图 4: B的三维投影图中得到体现。
|
图 4 主成分分析。A: 二维得分图; B: 三维投影图。 Fig. 4 Principal component analysis. A: Two dimensional drawing; B: Three dimensional drawing. |
同时,地理位置对甾体皂苷构成特征同样表现出一定影响,在图 4: A中,Ⅰ-1、Ⅰ-2和Ⅰ-3号样品(均来自贵州兴义)明显聚集,Ⅰ-4、Ⅰ-5和Ⅰ-6号样品(均来自贵州长顺)明显聚集,和图 3的聚类分析结果一致;Ⅱ-12、Ⅱ-13和Ⅱ-14 (均来自云南宣威)明显聚集,在图 4: B中,单一产地样品Ⅱ-8 (四川德昌)明显偏离其他样品,也和图 3的聚类结果一致。
3 结论和讨论重楼栽培种的种内甾体皂苷特征被相继报道[5–6], 对云南重楼的种内变异研究涉及了分子遗传标记、形态学特征及其与甾体皂苷类成分的关联性[7–11], 然而遗传多样性与甾体皂苷特征的相关性却未见报道。本研究首次报道了云南重楼ITS序列的SNP特征和甾体皂苷类成分的相关性。结果表明,重楼皂苷Ⅴ的分布稀少,与吴钰颖等[12]的报道相似,这应该是重楼皂苷V没有纳入《中国药典》含量指标的原因之一。2个基因型在《中国药典》合格率上有一定差异,YN-Ⅱ型 > YN-Ⅰ型,但是7种甾体皂苷总含量上YN-Ⅰ型却显著大于YN-Ⅱ型。二者在这两项指标的不同反差提示,YN-Ⅱ型在甾体皂苷合成与累积方面个体差异小,更加稳定一致。PCA分析表明,YN-Ⅱ样品的聚集度更好,YN-Ⅰ样品的离散度更高,也印证了上述推测。究其原因,虽然绝大多数SNP存在于非编码区(ITS1和ITS2),但5.8S rDNA区的SNP却可能会影响核糖体的转运功能,进而影响甾体皂苷累积的稳定性。这是否对已知的甾体皂苷合成途径及关键酶基因的表达产生影响,如甲羟戊酸途径(MVA)[13–14]、鲨烯合酶(SQS)[15]、鲨烯环氧酶(SE)[16]、甲羟戊酸焦磷酸脱羧酶(MVD)[17]、环阿屯醇合酶(CAS)[18]、细胞色素P450单加氧酶[19]等, 还需要进一步验证。另外,参考华重楼基因组结构[20]对2类基因型的叶绿体基因组进行分析,探讨光合作用效率是否影响皂苷合成也是一个探索方向,在云南重楼良种选育的遗传标记筛选中具有独特价值。
相对于基因型,地理位置对甾体皂苷构成特征具有更明显的影响,出现了3类现象:(1) 产地相同的样品聚在一起,甚至单独产地样品独立成一支(如Ⅱ-8);(2) 不同产地样品聚在一起;(3) 相同产地样品不聚在一起。究其原因,甾体皂苷作为次生代谢产物,其合成与累积也受到环境因子的调控, 相同的地理位置往往具有相似的生态环境,导致相似的化学特征,因此聚在一起,特殊生境的植株甚至独立成支。同理,不同产地的植株若小生境相似,也可能聚在一起;反之,产地相同但是小生境差异较大,植株化学特征则必然分化[21]。这提示,地理位置及其小生境对于甾体皂苷构成具有明显的影响,为保证重楼药材质量稳定,一定要选择生态适宜区并保持种植地的小生境一致。
综上,云南重楼YN-Ⅰ型和YN-Ⅱ型的甾体皂苷构成特征存在一定程度分化,但药典指标成分仍无显著性差异,二者在生产、监管和临床使用上不必区分对待。YN-Ⅱ型植株甾体皂苷累积的个体差异小,其SNP标记对于云南重楼的良种选育具有明显意义。虽然YN-Ⅰ型的合格率较低,但是平均总皂苷含量更高,在重楼总皂苷的生产中可作为优良的提取原料。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China[M]. Beijing: China Medical Science Press, 2020: 271-272. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 271-272. |
| [2] |
LI H, SU B, ZHANG Z Y, et al. An assessment on the rarely medical Paris plants in China with exploring the future development of its plantation[J]. J W China For Sci, 2015, 44(3): 1-7. 中国重楼资源现状评价及其种植业的发展对策[J]. 西部林业科学, 2015, 44(3): 1-7. DOI:10.16473/j.cnki.xblykx1972.2015.03.001 |
| [3] |
LIU Q, FAN X L, YANG L, et al. Screening and evaluation of three excellent Paris resources from mountain area of Sichuan Basin[J]. Chin Trad Herb Drugs, 2019, 50(2): 526-534. 四川盆周山地重楼属植物药用资源的筛选及评价[J]. 中草药, 2019, 50(2): 526-534. DOI:10.7501/j.issn.0253-2670.2019.02.035 |
| [4] |
ZHANG K Y, RAO W X, YIN X M, et al. Multiplex PCR system for the identification of paridis rhizoma's legal origins and its closely related species from genus Paris[J]. Nat Prod Res Dev, 2018, 30(12): 2193-2202. 重楼法定基原与其同属近缘种的多重PCR鉴别体系研究[J]. 天然产物研究与开发, 2018, 30(12): 2193-2202. DOI:10.16333/j.1001-6880.2018.12.025 |
| [5] |
LI P, XUE D, WEN F Y, et al. Description and supplement of morphology and the characteristics of saponin components of Paris forrestii (Takht) H. Li[J]. Lishizhen Med Mat Med Res, 2016, 27(1): 200-202. 长柱重楼形态描述补充及其皂苷类成分特征[J]. 时珍国医国药, 2016, 27(1): 200-202. DOI:10.3969/j.issn.1008-0805.2016.01.079 |
| [6] |
WEN F Y, YIN H X, CHEN C, et al. Chemical characteristics of saponins from Paris fargesii var. brevipetala and cytotoxic activity of its main ingredient, paris saponin H[J]. Fitoterapia, 2012, 83(4): 627-635. DOI:10.1016/j.fitote.2012.01.003 |
| [7] |
LI L Y, LI S P, YANG B, et al. Morphological variations of Paris polyphylla var. yunnansensis in different population[J]. Chin J Chin Mat Med, 2010, 35(22): 2959-2962. 滇重楼不同居群形态变异研究[J]. 中国中药杂志, 2010, 35(22): 2959-2962. DOI:10.4268/cjcmm20102205 |
| [8] |
ZHANG K Y. The fluorescent visual identification of two genotypes of Paris polyphylla var. yunnanensis and the study of their chemical characteristics correlation [D]. Chengdu: Chengdu University of TCM, 2018: 11–32. 张开元. 两种基因型云南重楼的荧光可视化真伪鉴定及化学特征相关性研究[D]. 成都: 成都中医药大学, 2018: 11–32. |
| [9] |
CHEN Z S Z, TIAN B, CAI C T. Genetic diversity of Paris polyphylla var. yunnanensis by SSR marker[J]. Chin Trad Herb Drugs, 2017, 48(9): 1834-1838. 基于SSR分子标记的滇重楼遗传多样性研究[J]. 中草药, 2017, 48(9): 1834-1838. DOI:10.7501/j.issn.0253-2670.2017.09.021 |
| [10] |
LI G, WANG Y F, TANG L, et al. Phenotypic trait variation, principal component, correlation and path analysis of Paris polyphylla var. yunnanensis[J]. J Chin Med Mat, 2015, 38(7): 1339-1342. 滇重楼表型性状变异、主成分、相关及通径分析[J]. 中药材, 2015, 38(7): 1339-1342. DOI:10.13863/j.issn1001-4454.2015.07.001 |
| [11] |
WANG Q, DING Y, YANG M, et al. Correlation analysis of quality, origin and phenotypic characters of Paris polyphylla var. yunnanensis[J]. Chin J Chin Mat Med, 2019, 44(15): 3203-3212. 滇重楼品质与产地和表型性状相关性分析[J]. 中国中药杂志, 2019, 44(15): 3203-3212. DOI:10.19540/j.cnki.cjcmm.20190527.102 |
| [12] |
WU Y Y, JIN L, MA Y J, et al. A comparative study on the fingerprint of Paris polyphylla var. polyphylla and Paris polyphylla var. yunnanensis from different origins in Dali and seven main steroidal saponins by HPLC[J]. Chin Pharm J, 2020, 55(11): 875-882. 大理不同产地多叶重楼与云南重楼HPLC指纹图谱及7种主要甾体皂苷成分的比较研究[J]. 中国药学杂志, 2020, 55(11): 875-882. DOI:10.11669/cpj.2020.11.004 |
| [13] |
CHEN L, ZHANG J B. Biosynthesis of steroidal saponins[J]. Nat Prod Res Dev, 2007, 19(2): 316-320. 甾体皂甙的生物合成[J]. 天然产物研究与开发, 2007, 19(2): 316-320. DOI:10.3969/j.issn.1001-6880.2007.02.037 |
| [14] |
HUANG X X, GAO W Y, MAN S L, et al. Advances in studies on saponins in plants of Paris L. and their biosynthetic approach[J]. Chin Trad Herb Drugs, 2009, 40(3): 483-489. 重楼属药用植物皂苷类化学成分及其生源途径的研究进展[J]. 中草药, 2009, 40(3): 483-489. DOI:10.3321/j.issn:0253-2670.2009.03.044 |
| [15] |
GAO F, LUO X P, TAO L, et al. Molecular cloning of squalene synthase gene form Paris polyphylla and its expression in Escherich coli[J]. Chin J Chin Mat Med, 2013, 38(13): 2086-2091. 滇重楼鲨烯合酶基因PpSQS的克隆及在大肠杆菌中的表达[J]. 中国中药杂志, 2013, 38(13): 2086-2091. DOI:10.4268/cjcmm20131310 |
| [16] |
XU Y, ZHAO S, DONG X, et al. Cloning and expression of squalene epoxidase from Paris polyphylla var. yunnanensis[J]. Chin Trad Herb Drugs, 2017, 48(9): 1839-1844. 滇重楼鲨烯环氧酶基因的克隆及原核表达研究[J]. 中草药, 2017, 48(9): 1839-1844. DOI:10.7501/j.issn.0253-2670.2017.09.022 |
| [17] |
YANG L, FAN X L, LIU Q, et al. Molecular cloning and analysis of pyrophospomevalonate decarboxylase gene from Paris polyphylla var. yunnanensis[J]. Chin Trad Herb Drugs, 2019, 50(6): 1435-1441. 滇重楼甲羟戊酸焦磷酸脱羧酶基因的分子克隆与分析[J]. 中草药, 2019, 50(6): 1435-1441. DOI:10.7501/j.issn.0253-2670.2019.06.027 |
| [18] |
YUAN M Q, DING C B, TAO L, et al. Cloning and sequence analysis of cycloartenol synthase gene from Paris polyphylla var. yunnanensis[J]. Chin Trad Herb Drugs, 2012, 43(11): 2250-2256. 滇重楼环阿屯醇合酶基因的克隆及序列分析[J]. 中草药, 2012, 43(11): 2250-2256. |
| [19] |
YIN Y, GAO L H, ZHANG X N, et al. A cytochrome P450 monooxygenase responsible for the C-22 hydroxylation step in the Paris polyphylla steroidal saponin biosynthesis pathway[J]. Phytochemistry, 2018, 156: 116-123. DOI:10.1016/j.phytochem.2018.09.005 |
| [20] |
LI X J, YANG Z Y, HUANG Y L, et al. Complete chloroplast genome of the medicinal plant Paris polyphylla var. chinensis (Melanthiaceae)[J]. J Trop Subtrop Bot, 2015, 23(6): 601-613. 药用植物华重楼(黑药花科)叶绿体全基因组研究[J]. 热带亚热带植物学报, 2015, 23(6): 601-613. DOI:10.11926/j.issn.1005-3395.2015.06.001 |
| [21] |
LI H T, LUO X W, GUAN Y H, et al. Comparison between content of saponins of Paris polyphylla var. yunnanensis in different areas of Yunnan Province[J]. Chin J Chin Mat Med, 2014, 39(5): 803-806. 云南省不同地区滇重楼皂苷含量的对比及影响因子分析[J]. 中国中药杂志, 2014, 39(5): 803-806. DOI:10.4268/cjcmm20140509 |
 2022, Vol. 30
2022, Vol. 30


