2. 固原市六盘山林业局,宁夏 固原 756000
2. Liupanshan Forestry Bureau, Guyuan 756000, Ningxia, China
黄枝衣科(Teloschistaceae)隶属真菌界子囊菌门茶渍纲黄枝衣目,分布非常广泛, 是黄枝衣目中物种最多,分类学问题最为复杂的科。根据Arup等[1]联合形态及分子证据的最新研究,目前该科含39属, 约1 000多种。粉黄衣属(新拟)(Xanthomendoza)建立之初仅包含1种(X. mendozae),主要是依据皮层、髓层及分生孢子等形态特征[2]。Søchting等在2002年依据形态、化学和ITS序列分析,将石黄衣属(Xanthoria)的16种归并到粉黄衣属[3]。随后多基因联合分析的结果进一步支持粉黄衣属是个单系群,包含20余种[1, 4–5]。
在对采自宁夏地区石黄衣属200多份标本整理过程中,发现采自宁夏六盘山地区的石黄衣属地衣中混有粉黄衣属。采用形态特征和ITS分子数据对标本进行了鉴定,确认漫粉黄衣(新拟)(Xanthomendoza ulophyllodes)为中国首次发现,以及石黄衣属下的裂芽石黄衣(新拟)(Xanthoria calcicola)为中国新记录种。本文对2新记录种的形态特征及生境与分布进行了详细描述,并提供了图片。
1 材料和方法 1.1 材料标本采集于宁夏六盘山国家级自然保护区及贺兰山国家级自然保护区,存放在宁夏大学生命科学学院植物标本室(NXAC)。
1.2 方法形态观察 采用体视显微镜(OLYMPUS SZX16)进行形态结构观察,并利用奥林巴斯数码显微照相系统(OLYMPUS DP26)进行拍照。
总DNA提取、PCR扩增和DNA测序 DNA提取采用Biospin植物基因组DNA提取试剂盒从干燥的样本中获得。rDNA内部转录间隔区(ITS1-2)使用ITS1F[6]和ITS4[7]为引物经聚合酶链式反应(PCR)进行扩增,PCR混合物(25 μL)包含25 μg BSA、1 U Taq DNA聚合酶、dNTP (0.2 mmol/L)、引物(各0.5 μmol/L)和PCR缓冲液,用H2O补至25 μL。PCR反应程序:96 ℃预变性2 min,随后96 ℃变性10 s, 52 ℃退火10 s,60 ℃延伸30 s,共循环30次,最后60 ℃延伸4 min,扩增产物于4 ℃保存。产物经纯化鉴定后使用ABI3730XL自动测序仪进行测序。
1.3 序列分析和系统树构建根据双向测序结果,采用Sequencher 4.1.4软件拼接完整序列,并进行人工校正,通过BanKit在线提交序列至NCBI, 获得登录号为MN103183.1和MN103184.1。从GenBank下载近缘物种的相关序列(表 1),运用MUSCLE进行多序列比对,DAMBE进行序列饱和度分析,以Xanthoria parietina为外类群,利用MEGA X进行系统发育分析,以自展法(bootstrap)进行置信度检测,共循环1 000次,采用ML法(最大似然法)构建系统发育树。
| 表 1 供试标本信息及ITS序列登录号 Table 1 Voucher source information and GenBank accession No. of ITS sequences |
漫粉黄衣(新拟)(Xanthomendoza ulophyllodes)地衣体叶状,莲座状。地衣体上表面裂片边缘具有黄色粉芽堆,粉芽堆形成明显的新月形或联合成片,下表面地衣体白色,具有多量的白色假根。该种的形态特征, 如粉芽堆形状、丰富的假根, 很容易和Xanthomendoza fallax混淆,但漫粉黄衣的地衣体常上扬,粉芽常发生于裂片边缘或上表面,而后者的粉芽一般发生在裂片顶端上下皮层之间。
裂芽黄衣(新拟)(Xanthoria calcicola)地衣体近圆形或不规则形,叶状,紧密贴生于基物,仅边缘部位游离;边缘裂片放射状,橘黄色。裂芽黄衣与同属的Xanthoria aureola在形态上比较相似, 但是前者的地衣体中央具有圆柱状裂芽,罕见裂片化; 而后者地衣体上表面常为狭长重叠排列的小裂片。
2.2 分子鉴定从基因库下载石黄衣属形态相近、易混淆的Xanthomendoza fallax和具有粉芽的Xanthoria sorediata的ITS序列。利用DAMBE对建树序列饱和度检测分析表明, ITS序列碱基的转换和颠换与遗传距离呈线性关系, 碱基突变均未达到饱和,适用于进化树的构建(图 1)。
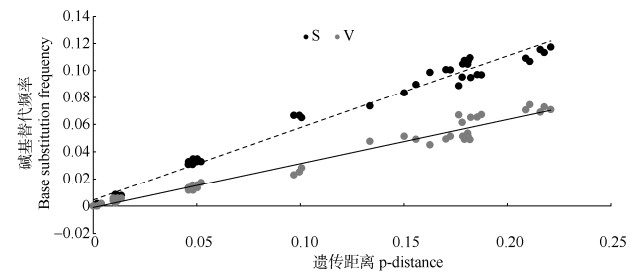
|
图 1 ITS rDNA序列饱和度分析。S: 转换; V: 颠换。 Fig. 1 ITS rDNA sequence saturation analysis. S: Transition; V: Transversion. |
用MEGA X软件基于ITS序列构建系统发育树(图 2)。石黄衣属和粉黄衣属形成明显的2支, 各自成为单系群的支持率达到100%。粉黄衣属可分成2亚支,样品Xa1、Xa2和Xanthomendoza ulophyllodes聚为1支,Xanthomendoza fallax为完全独立的1亚支, 说明通过ITS序列可以很好地鉴别这2种。
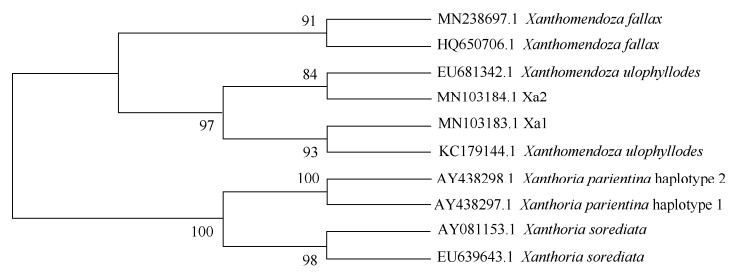
|
图 2 基于ITS序列采用最大似然法构建的系统发育树 Fig. 2 Phylogenetic tree based on ITS sequences by using maximum likelihood method (ML) |
粉黄衣属 新拟
Xanthomendoza S. Y. Kondr. & Kärnefelt, Progr. Probl. Lichenol. Nineties. Proc. Third Symp. Intern. Assoc. Lichenol., Biblthca Lichenol. 68: 26, 1997. Type: Xanthomendoza mendozae (Räsänen) S. Y. Kondr. & Kärnefelt, Progr. Probl. Lichenol. Nineties. Proc. Third Symp. Intern. Assoc. Lichenol., Biblthca Lichenol. 68: 26, 1997.
形态特征:地衣体叶状(除X. trachyphylla),具有明显的背腹性,亮黄色至橘黄色,粉芽有或无; 地衣体下表面具长短不一白色或黄色的假根;子囊盘圆盘状,茶渍型,无柄,盘面凹陷,橘黄色,盘缘明显;子囊棒状,子囊孢子无色,椭圆形,二极胞型; 分生孢子器有或缺乏,分生孢子杆状或狭椭圆型。
化学:含parietin (石黄酮)、少量teloschistin (黄枝醇)、fallacinal (拟石黄醛)、parietinic acid (石黄酸)和emodin (大黄素)[3]。
该属的形态分类特征主要是地衣体叶状,下表面具有离散的假根,有或无粉芽,子囊孢子狭椭圆形至椭圆形,分生孢子杆状。与石黄衣属的区别在于假根和分生孢子的形态[1, 4]。
生境与分布:常附生于树干及树枝,罕见于岩石;该属大部分物种分布于北半球的北美和欧亚大陆[8–10],中国新记录属。
漫粉黄衣 新拟图 3
Xanthomendoza ulophyllodes (Räsänen) Søchting, Kärnefelt & S.Y. Kondr., Mitt. Inst. Allg. Bot. Hamburg 30-32: 238, 2002.
≡ Xanthoria ulophyllodes Räsänen, Die Flecht. Estl. 1: 105, 1931.
形态特征:地衣体叶状,近圆形扩展,疏松固着于基物上;裂片浅裂,扁平,边缘波曲状,有时翘起,上表面呈黄绿色至黄色,在荫蔽的环境中, 往往变成黄绿色,无裂芽,下表面呈淡白色,有大量的白色假根,粉芽亮黄色至柠檬黄色,球状至粉末状,粉芽堆在裂片边缘或上表面形成明显的新月形或联合成片;子囊盘少见,呈小圆盘状,生于地衣体中央部分,盘面呈橙黄色,盘缘有时破裂生成粉芽堆;子囊棒状,子囊孢子无色,椭圆形,二极胞型。
生境与分布:附生于落叶松树干;欧洲[3, 8],北美洲[10],亚洲有分布[3],中国新记录种。
引证标本:中国,宁夏,六盘山国家级自然保护区,米冈山,2 218 m,树生,2017,17-0301; 野荷谷,2 241 m,树生,2017,17-0280。
裂芽石黄衣 新拟图 4
Xanthoria calcicola Oxner, Viznachnilk Lishainikiv: 302, 1937.
形态特征:地衣体叶状,橘黄色,紧贴于基物,裂片向着顶端逐渐加宽,1~7 mm宽,凸起,顶端圆钝;地衣体上表面有丰富的裂芽,以中心位置最为密集,裂芽直径0.7~1.0 mm,常单一,直立,呈顶端膨大的圆柱状或不规则球形。子囊盘常缺乏, 但有时也发生,散在,直径1.3~3.7 mm,茶渍型, 盘缘光滑或粗糙或有时具圆齿,盘面深橘黄色。
化学:含有丰富的parietin (石黄酮)、teloschistin (黄枝醇)和fallacinal (拟石黄醛),及少量的parietinic acid (石黄酸)和emodin (大黄素)[11]。
生境和分布:附生于岩石。该种在亚洲(蒙古、叙利亚、伊朗、土耳),欧洲及南美洲均报道有分布[12],中国新记录种。
引证标本:中国,宁夏,银川甘城子乡庙山湖, 1 218 m, 石生, 2010, 10-0010; 贺兰山苏峪口, 1 379.1 m, 石生, 2014,14-020-0168;贺兰山马莲沟,1 356.9 m, 石生, 2014, 14-01-0820, 14-020-0168; 贺兰山大水沟, 1 211.7 m, 石生, 14-02-0296。

|
图 3 漫粉黄衣。A: 生境;B: 粉芽堆。 Fig. 3 Xanthomendoza ulophyllodes. A: Habit; B: Soredia. |

|
图 4 裂芽黄衣。A: 生境; B: 裂芽。 Fig. 4 Xanthoria calcicola. A: Habit; B: Isidia. |
分子系统学研究表明, 石黄衣属是多系群,由几个支持度较高的支系组成,粉黄衣组(Xanthomendoza group)就是其中的1个支系[13–14],被建议作为1个独立的单系群粉黄衣属。进一步的化学证据也表明粉黄衣属含有其独特的蒽醌类成分,与石黄衣属不同。在形态方面,粉黄衣属在分生孢子形态及假根方面也有别于石黄衣属[3]。因此,从形态、化学和分子3方面的数据均证明粉黄衣属应作为1个单系群。然而我国目前还没有关于黄枝衣科的系统学研究报道,对于石黄衣属的认识依然还在沿用旧的分类体系[15]。
在本研究中,凭证标本的ITS序列与GenBank数据库中漫粉黄衣的序列进行比对,相似性在99%以上,石黄衣属(Xanthoria)的成员和粉黄衣属(Xanthomendoza)的成员各自构成1支, 且支持率很高(100%), 这和Arup等[1, 4–5]认为粉黄衣属为单系群的结论一致。漫粉黄衣(Xanthomendoza ulophyllodes)和同样具有粉芽的Xanthomendoza fallax及粉芽石黄衣(Xanthoria sorediata)各自形成了支持率较高的1支(90%以上),说明ITS的序列信息对于这些种的界定是有价值的。本研究确定了黄枝衣科1中国新记录属粉黄衣属(新拟)(Xanthomendoza)和2中国新记录种:漫粉黄衣(新拟)(Xanthomendoza ulophyllodes)和裂芽黄衣(新拟)(Xanthoria calcicola), 为黄枝衣科物种在国内的分布提供了新信息,同时为该科的后续研究提供基础资料。
| [1] |
ARUP U, SØCHTING U, FRÖDÉN P, et al. A new taxonomy of the family Teloschistaceae[J]. Nord J Bot, 2013, 31(1): 16-83. DOI:10.1111/j.1756-1051.2013.00062.x |
| [2] |
KONDRATYUK S, KÄRNEFELT I. Josefpoeltia and Xanthomendoza, two new genera in the Teloschistaceae (Lichenized Ascomycotina)[M]// TÜRK I, ZORER R. Progress Problems in Lichenology in the Nineties. Germany: Bibliotheca Lichenologica: 1997: 19-44.
|
| [3] |
SØCHTING U, KÄRNEFELT I, KONDRATYUK S, et al. Revision of Xanthomendoza (Teloschistaceae, Lecanorales) based on morphology, anatomy, secondary metabolites molecular data[J]. Mitt Inst Allg Bot Hamb, 2002, 30-32: 225-240. |
| [4] |
KIRK M P, CANNON P F, MINTER D W, et al. Ainsworth & Bisby’s Dictionary of the Fungi[M]. New York: Oxford University Press, 1996: 1-632.
|
| [5] |
GAYA E, HÖGNABBA F, HOLGUIN A, et al. Implementing a cumulative supermatrix approach for a comprehensive phylogenetic study of the Teloschistales (pezizomycotina, ascomycota)[J]. Mol Phylogenet Evol, 2012, 63(2): 374-387. DOI:10.1016/j.ympev.2012.01.012 |
| [6] |
GARDES M, BRUNS T D. ITS primers with enhanced specificity for basidiomycetes application to the idenification of mycorrhizae and rusts[J]. Mol Ecol, 1993, 2(2): 113-118. DOI:10.1111/j.1365-294x.1993.tb00005.x |
| [7] |
WHITE T, BRUNS T D, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]// INNIS M A, GELFAND D H, SNINSKY J J, et al. PCR Protocols: A Guide to Methods and Applications [M]. New York: Academic Press Inc, 1990: 315-322.
|
| [8] |
LINDBLOM L, BLOM H H, TIMDAL E. The genus Xanthomendoza in Norway[J]. Graph Scr, 2019, 31(7): 54-75. |
| [9] |
LEAVITTS D, LUMBSCH H T, CLAIR L S. Contrasting demographic histories of two species in the lichen-forming fungal genus Xanthomendoza (Teloschistaceae, Ascomycota)[J]. Bryologist, 2013, 116(4): 337-349. DOI:10.1639/0007-2745-116.4.337 |
| [10] |
BRODO I M, SHARNOFF S D, SHARNOFF S. Lichens of North America[M]. New Haven and London: Yale University Press, 2001: 1-616.
|
| [11] |
SØCHTING U. Two major anthraquinone chemosyndromes in Teloschistaceae[J]. Bibl Lichenol, 1997, 68: 135-144. |
| [12] |
KAZEMI S S, SAFAVI S R. Three new records of lichen species from Iran[J]. Iran J Bot, 2014, 20(2): 236-239. |
| [13] |
ARUP U, GRUBE M. Where does Lecanora demissa (Ascomycota, Lecanorales) belong?[J]. Lichenologist, 1999, 31(5): 419-430. DOI:10.1017/S0024282999000584 |
| [14] |
SØCHTING U, LUTZONI F. Molecular phylogenetic reassessment of the generic boundary between the genera Caloplaca and Xanthoria[J]. Mycol Res, 2003, 107(11): 1266-1276. DOI:10.1017/S0953756203008529 |
| [15] |
WEI J C. The Enumeration of Lichenized Fungi[M]. Beijing: China Forestry Publishing House, 2020: 471-472.
|
 2022, Vol. 30
2022, Vol. 30


