丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是一种广泛存在于自然界的内生菌根真菌, 能够与陆地上80%的植物形成互惠共生体[1]。AMF的菌丝能通过连接2株及2株以上的宿主根系,在生态环境中形成菌丝网络体,调节宿主营养成分的分配以及增强在生态环境中的竞争力[2]。此外AMF的根外菌丝体网络能扩大宿主根际区,从土壤中吸收必需的营养物质并将其转移到植物中[3]。有研究表明,AMF可以显著提高植株地上部、地下部和总生物量[4],同时AMF还可提高植株对N、P、K等养分元素的吸收[5]。然而AMF对养分元素的吸收能力因养分元素和植物不同而产生差异。与非菌根植物相比,菌根植物提高了植物对Ca、Mg、NH4+-N和P的吸收速率,而对K和NO3–-N的吸收速率没有影响[6]。Baslam等[7]报道接种AMF刺激了玉米(Zea mays)叶片对Zn的积累,提高了叶片的Cu含量,而且与非菌根植物莴苣(Lactuca sativa)相比, 菌根莴苣的Cu、Fe含量更高。AMF可提高茶树(Camellia sinensis)叶片中N、P、K、Ca、Zn和Fe含量,降低Mn和Cu含量[8]。
氮(N)是陆地生态系统中限制初级生产力的主要养分[9]。在农林经营管理过程中,施加氮肥是一种重要措施。氮肥的添加会影响AMF的根系侵染率和AMF群落组成[10],从而对植物的养分吸收产生影响。贺学礼等[11]的研究表明,AMF显著提高低氮添加下烟草(Nicotiana tabacum)叶中N、K、Fe含量,而在较高N水平添加下只提高了叶的P含量。王平等[12]研究了AMF对黄岑(Scutellaria baicalensis)养分元素吸收的影响,随氮添加量的增加黄岑对养分元素的吸收呈先增加后下降的趋势,而且地上部分与地下部分对养分元素的吸收存在较大差异。此外,不同形态氮对植物吸收不同养分元素的影响也存在差异,并且调节不同养分元素在植株不同组织器官中的分配,其作用效果因植株和营养元素而异[13], Liu等[14]研究了NO3–-N与NH4+-N对西瓜(Citrullus vulgaris)养分元素吸收的影响,当NH4+-N增加时西瓜的K、Ca和Mg含量降低,其体内的微量元素含量一般会增加。然而Yaghoub等[15]认为,相对于NO3–-N,NH4+-N能更有效地提高植株叶片的K、Mg、Ca、Fe和Zn含量。
杉木是我国亚热带地区主要的人工林树种,面积达1.096×107 hm2,约占我国人工林面积的21.4%[16]。杉木不仅分布面积广,而且还是AMF重要的宿主植物[13]。然而,目前有关AMF对杉木生长和养分吸收的研究比较少。由于森林植物对不同形态氮(NH4+- N、NO3–-N和可溶性有机氮)存在吸收偏好[17–19], 当前大多数对热带、亚热带地区阔叶树与针叶树的研究表明,该地区的树种偏好吸收NH4+-N,植物对NH4+- N的吸收量占总氮吸收量的55%~98%[16–17, 20–23]。并且,这些植物中受AMF侵染的树种对NH4+-N的吸收能力也要强于NO3–-N[13],这是否意味着,受AMF侵染的热带、亚热带森林植物在NH4+-N添加下对植物养分的吸收能力要强于NO3–-N处理仍有待进一步研究。
基于此,本研究以1 a生杉木幼苗为研究对象,通过接种AMF和添加不同形态的氮肥(NH4+-N、NO3–-N)来探究AMF和不同形态氮对杉木的生长和养分元素吸收的影响,以期为杉木优质壮苗培育和科学施肥管理提供数据支持和理论依据。
1 材料和方法 1.1 试验材料供试土壤 试验土壤来自福建省南平市西芹教学林场的杉木人工林土壤。土壤过2 mm筛, 经121 ℃高温灭菌2 h (间隔2 d重复1次),冷却以备用,灭菌后土壤的NH4+-N和NO3–-N分别为4.102和12.217 mg/kg,总碳、全磷和总氮含量分别为13.749、0.42和1.085 g/kg,有效磷含量为12.68 mg/kg, pH为4.54。
供试菌种 试验用的AMF为摩西球囊霉(Glomus mosseae, Gm),购买自北京农林科学院植物营养与资源研究所。用灭菌土壤种植玉米并接种AMF进行90 d的扩繁。清除玉米植株地上部分和表层土,将孢子、菌丝和侵染的根段混合物作为接种剂。接种剂的孢子数大约为100 cfu/g soil。
供试植物 杉木(Cunninghamia lanceolata)种子经10% NaClO消毒15 min,再用无菌水冲洗5次,备用。
1.2 试验设计采用随机区组设计,菌根处理设置为接种AMF (+A)和不接种AMF (-A)。氮肥添加设置添加NH4+- N (NH4+)、添加NO3–-N (NO3–)和空白对照(CK),合计6种处理,每种处理重复4次。2020年5月将高温灭菌土装入塑料花盆(底直径30 cm,高20 cm), 每个花盆装入风干灭菌土6 kg。参照张雪[24]的方法在每个花盆距离土壤表层10 cm处放置500 g菌种接种剂,对照则加入等量灭菌处理的接种剂,调节水分含量到60%。随后每盆播入3粒杉木种子,出苗后进行疏苗,每盆保留1株。杉木出苗4个月后(2020年9月)开始以溶液形式添加氮肥[(NH4)2SO4和KNO3],氮的添加量为10 mg N/kg。随后在2020年11月又进行1次氮肥添加,添加量与前一次相当。在整个试验期间,土壤水分含量保持在田间持水量的60%[24]。
1.3 方法处理7个月后,用直尺和游标卡尺测量幼苗的基径和株高。然后收获幼苗的根、茎、叶,每处理的根取一部分,放入4 ℃的冰箱保存,用于菌根侵染率的测定。剩下的根、茎、叶分别放进信封袋内,置于105 ℃烘箱杀青30 min,随后在70 ℃烘箱内烘48 h,用于测定植株含水量、养分元素和干质量。
养分元素的测定 采用快速消煮法[25]。称取0.3 g研磨烘干后的样品放入消煮管中,加入1 mL的蒸馏水和4 mL的H2SO4,反应结束后在电炉上进行消煮,在消煮过程中每次加2 mL H2O2,总量不得超过10 mL。消煮结束后,冷却并将其转移到100 mL的容量瓶,用蒸馏水定容,然后过滤,最后将过滤液放入ICP-OES (PE 0ptima 8000,美国)中进行K、Ca、Mg、Fe、Mn和Na的测定。P含量采用钼锑抗比色法显色并用分光光度计检测。C、N含量采用碳氮元素分析仪(Isoprime100 Isotope Ratio Mass Spectrometer, UK)进行测定。植株养分总含量(g)为根、茎和叶养分含量的总和。
根系侵染率的测定 采用醋酸墨水染色法[26]测定。将根剪成长度1 cm的小段放入烧杯,加入10%的KOH至没过根样,放入90 ℃的电热水浴锅中加热60 min,再用浓度为10%的KOH漂白1 h。经漂白处理后的根样用流水冲洗5 min,再用5%乙酸酸化5 min,把根样和5%醋酸墨水染色液于60 ℃水浴锅中染色30 min。染色后的根样放进清水中浸泡12 h以上进行脱色。最后将脱色处理后的根样挑出来放于载玻片上,滴加适量的甘油明胶剂,盖上盖玻片,用手指压扁,放到光学显微镜下进行观测。AMF根系侵染率(F)=(被侵染的根段数/镜检的总根段数)×100%。
1.4 数据分析用Excel 2010对数据进行处理和Origin 2019建库做图。利用SPSS 25.0软件的独立样本t检验对接种AMF与否的数据进行统计分析,以P<0.05表示差异显著,并用Duncan检验对接种和氮处理的数据进行多重比较。
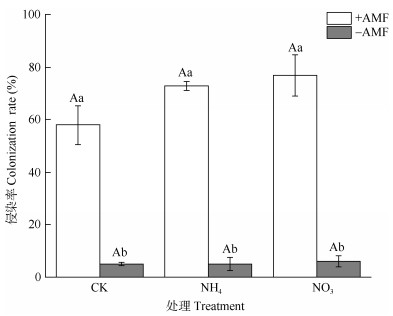
2 结果和分析 2.1 菌根侵染率状况从图 1和2可知,接种AMF后的幼苗均有较高的侵染率,均大于50%,但施氮肥处理和对照间均没有显著差异。有约5%的未接种AMF杉木幼苗检测出被侵染。
|
图 1 AMF与添加氮肥对幼苗侵染率的影响。CK: 对照; NH4: 铵态氮; NO3: 硝态氮。柱上不同大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。 Fig. 1 Effects of AMF and nitrogen addition on colonization rate of Chinese fir seedlings. CK: Control; NH4: Ammonium nitrogen; NO3: Nitrate nitrogen. Different capital and small letters upon column indicated significant difference at 0.01 and 0.05 levels, respectively. |

|
图 2 杉木根系的侵染情况。CK: 对照; NH4: 铵态氮; NO3: 硝态氮。 Fig. 2 Colonization of Chinese fir roots. CK: Control; NH4: Ammonium nitrogen; NO3: Nitrate nitrogen. |
从表 1可见,AMF使NH4+-N处理的杉木幼苗基径提高了(24±16)% (P<0.05),但对NO3–-N和CK的基径无显著影响。不同形态氮对基径加粗并无显著差异(P>0.05)。AMF显著提高了杉木幼苗的苗高(P<0.05),但不同形态氮对苗高增加无显著差异。接种AMF后添加NH4+-N的植株根、茎、叶和总质量均显著高于未接种AMF的。此外,施加NH4+-N和接种AMF的植株茎质量显著高于施加NO3–-N的。在CK和施加NO3–-N的植株中,接种AMF对根、茎、叶和总质量的影响虽不显著,但接种植株仍略高于未接种植株。
| 表 1 接种AMF和施肥对杉木幼苗生物量的影响 Table 1 Effects of inoculation AMF and fertilization on biomass of Chinese fir seedlings |
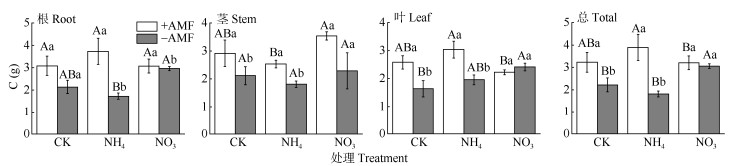
接种AMF总体上提高了施肥处理的组织C含量(除NO3–-N处理的茎、叶和CK的根外)(图 3)。接种AMF后,CK与NH4+-N处理的茎C含量提高了55%~58%,叶提高了45%~116%。接种AMF使NH4+-N处理的植株C含量提高了(115±64)%,CK处理提高了(46±40)%。植株和叶的C含量在添加NH4+-N处理下增幅较大,均显著高于NO3–-N处理。
|
图 3 AMF与施氮对杉木幼苗C含量的影响。CK: 对照; NH4: 铵态氮; NO3: 硝态氮。柱上不同大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。 Fig. 3 Effects of AMF and nitrogen addition on C content in Chinese fir seedlings. CK: Control; NH4: Ammonium nitrogen; NO3: Nitrate nitrogen. Different capital and small letters upon column indicated significant difference at 0.01 and 0.05 levels, respectively. |
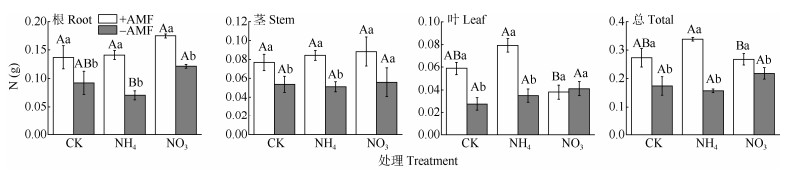
杉木幼苗的N含量在接种AMF后均显著增加(除NO3–-N处理的茎与叶外)(图 4)。接种AMF显著提高了NH4+-N处理的植株总N含量,增加了(116± 44)%,而且显著高于NO3–-N处理的[(23±19)%]。
|
图 4 AMF与施氮对杉木幼苗N含量的影响。CK: 对照; NH4: 铵态氮; NO3: 硝态氮。柱上不同大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。 Fig. 4 Effects of AMF and nitrogen addition on N content in Chinese fir seedlings. CK: Control; NH4: Ammonium nitrogen; NO3: Nitrate nitrogen. Different capital and small letters upon column indicated significant difference at 0.01 and 0.05 levels, respectively. |
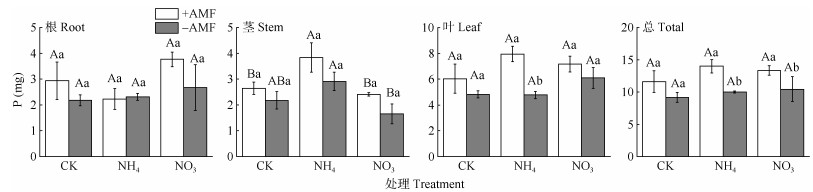
接种AMF后显著提高了植株的P含量(图 5)。接种植株添加NH4+-N后叶的P含量提高了(67± 25)%, 植株的总P含量显著增加(40±20)%,而添加NO3–-N处理的植株总P含量显著增加(28±14)%, 添加不同氮处理的P含量差异不显著。
|
图 5 AMF与施氮对杉木幼苗P含量的影响。CK: 对照; NH4: 铵态氮; NO3: 硝态氮。柱上不同大写和小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。 Fig. 5 Effects of AMF and nitrogen addition on P content in Chinese fir seedlings. CK: Control; NH4: Ammonium nitrogen; NO3: Nitrate nitrogen. Different capital and small letters upon column indicated significant difference at 0.01 and 0.05 levels, respectively. |
接种AMF显著提高了CK和NO3–-N处理的茎K含量(表 2),增加了65%~90%,并且显著提高了NH4+-N处理的叶K含量(164±74)%。就整体而言, 添加NH4+- N处理的植株K含量显著增加,增加了(65±13)%。
| 表 2 接种AMF和施肥对杉木K、Ca、Mg的影响 Table 2 Effects of inoculation AMF and fertilization on K, Ca, Mg of Chinese fir seedlings |
接种AMF显著提高了叶中Ca含量,提高了10%~65%,但对根和茎的Ca含量无显著影响(表 2)。接种AMF使CK和NH4+-N处理的植株Ca含量分别显著提高了(47±43)%和(49±8)%,且显著高于NO3–-N处理(P<0.05)。
接种AMF后,CK茎中Mg含量显著提高了(53±33)%,NH4+-N处理的叶Mg含量提高了(117± 62)% (表 2),且显著高于NO3–-N处理。NH4+-N处理的植株Mg含量增加了(71±18)%,显著高于NO3–- N处理。
2.5 幼苗的微量元素Fe、Mn、Na含量接种AMF使NO3–-N处理的根Fe含量显著高于CK与NH4+-N处理(表 3),NH4+-N处理的茎Fe含量显著增加了(48±20)%,CK和NH4+-N处理的叶Fe含量分别增加了(434±209)%和(133±95)%, 且NH4+-N处理的叶Fe含量显著高于NO3–-N处理。CK处理下接种植株的总Fe含量增幅最大[(115± 85)%],其次为NH4+-N处理[(94±57)%]。
| 表 3 接种AMF和施肥对杉木Fe、Mn、Na的影响 Table 3 Effects of inoculation AMF and fertilization on Fe, Mn, Na contents of Chinese fir seedlings |
接种AMF使NO3–-N处理的根、茎Mn含量显著提高了15%~25% (表 3)。NH4+-N处理的叶和植株Mn含量显著上升了77%~95%,且显著高于CK和NO3–-N处理。
接种AMF显著提高了茎和叶的Na含量,NH4+- N处理的增加了110%~190% (表 3)。此外,NH4+-N处理的茎Na含量显著高于CK处理,其叶Na含量显著高于NO3–-N处理。NH4+-N处理的植株Na含量增加了(114±76)%。
3 结论和讨论 3.1 AMF和不同形态氮对杉木根系侵染率的影响本研究结果表明,杉木幼苗接种AMF后根系侵染率均在50%以上,说明AMF能与杉木幼苗形成良好的菌根共生体,杉木是AMF重要的宿主植物,但NH4+-N、NO3–-N和对照CK间的AMF侵染率无显著差异,这与前人的研究结果一致。邓胤等[27]报道不同比例的NH4+-N和NO3–-N对玉米根系AMF侵染率没有显著影响,说明添加不同氮素形态对杉木幼苗-AMF共生体没有产生影响。但也有研究表明,添加NH4+-N会促进AMF的侵染, 这是因为相对于NO3–-N,AMF对NH4+-N具有偏爱性,NH4+-N处理的AMF有更高的C需求,同时也能获得更多的C含量[28]。本研究3种施肥处理间没有显著差异可能有2个原因,其一此次施氮含量未达最佳水平,有研究认为最佳施氮水平为0.05~ 0.2 g/kg[11–12],本研究的施氮水平较低,2次施肥合计0.02 g/kg; 其次是施肥到收获的时间只有4个月,生长期较短, 尚未对其侵染率产生显著影响。此外本研究中未接种AMF的个别植株出现菌根共生结构,出现了极低的侵染率,这与前人[27–28]的报道一致,并指出这种极低的侵染率是可接受的。
3.2 AMF和不同形态氮对杉木生长的影响干质量、基径和苗高是植物生长的重要指标, 对衡量植株生长状况具有重要意义[29]。本研究结果表明,接种AMF提高了杉木幼苗的总生物量,原因可能是植株接种AMF后,使根系分布范围扩大,根系分泌物会促进岩石的风化,加速营养物质从岩石中析出,进而提高了植株对土壤养分与水分的吸收,促进植株的生长[30]。此外,接种AMF还可以扩大植株的冠幅,促进植株的光合作用,提高植株的生物量[31]。本研究结果表明,接种AMF提高了植物器官和植株的C含量,表明AMF可以通过提高植物的光合作用来增加干物质的积累。
接种AMF均提高了施加氮肥对植株苗高和干质量的促进作用,且接种AMF,NH4+-N处理的植株干质量增幅要高于NO3–-N处理,可能与植株吸收氮形态的偏好有关,杉木是喜铵植物[21],因此, 在实际应用中施用NH4+-N更有利于植株生长。
3.3 AMF和不同形态氮对杉木N、P的影响接种AMF提高了植株的N含量,这是因为AMF对无机氮有转运吸收机制,但目前还不清楚是AMF直接吸收的氮素还是侵染后引起根系变化而间接吸收的氮素[32]。前人[33–34]采用同位素示踪技术与分室培养方法, 报道AMF菌丝能直接吸收无机氮(NO3–-N和NH4+-N),并转化为氨基酸供宿主吸收[35]。但相对于NO3–-N处理,接种AMF显著提高了NH4+- N处理的植株N含量,这是因为AMF对不同形态氮的吸收具有差异性。根外菌丝对NH4+-N的吸收能力高于NO3–-N,这是因为NO3–-N的移动性较强,容易发生转化,而NH4+-N移动性较弱容易固定吸收[36–37]。其次,吸收NH4+-N比NO3–-N更节能, 因为AMF能直接吸收NH4+-N,而AMF吸收NO3–-N后需要经硝酸还原酶还原成NO2–-N,再经过亚硝酸盐还原酶还原为NH4+-N[36]。还有1个原因可能是杉木长期生长于南方的酸性红壤中,土壤pH值较低限制了其硝化作用,从而在长期的进化过程中表现出对NH4+-N较强的吸收和应用能力以及较强的亲和力[38]。
本研究结果表明,接种AMF植株的P含量均增加,这是因为接种AMF后扩大了根系的范围, 形成巨大的根系网络系统,菌丝能延伸到根与根毛不能到达的地方,从而扩大植株对P的吸收范围。接种AMF的根质量均高于未接种,可以证明这一结论。其次,AMF根际分泌物中的有机酸、磷酸酶以及质子等可以改变土壤结构和理化性质,并且能与微生物相互作用降解土壤中的难溶性磷酸盐, 从而促进植株对P的吸收[39]。本研究结果表明, NH4+-N处理的叶与植株P含量显著增加,而NO3–-N处理的根和茎P含量增幅高于叶。2种施氮处理的植株总P含量均比CK显著增加,这与前人[40]研究结果相一致,表明氮能有效促进杉木幼苗对P的吸收。此外因为植株吸收NH4+-N后,叶片P的利用效率和P的再转运能力高于NO3–-N[41],说明NH4+-N有助于P向植株地上部转移,而NO3–-N处理有助于提高根和茎的P含量。
3.4 AMF和不同形态氮对杉木矿质元素吸收的影响本研究结果表明,AMF显著提高了对照植物的Ca、Mg、Fe含量和NH4+-N处理的K、Ca、Mg、Fe、Mn、Na和NO3–-N处理的K和Na含量,说明AMF对杉木幼苗矿质元素的吸收效应不同,且这种吸收效应受不同形态氮添加的影响[30]。接种AMF,CK植株的Fe含量增幅最显著,其次是Ca含量, 而Mn含量则降低;NH4+-N处理的Na含量增幅最显著,其次是Fe含量,而K含量增幅最低;NO3–-N处理的Na含量增幅最大,其次是K含量,而Mn含量最低。可见,AMF对微量元素Fe和Na的促进作用总体上要强于大量元素K和Ca。
通常认为氮形态对植株吸收矿质元素的影响主要是通过影响根际pH和阴阳离子间的平衡来实现的[42],Serna等[43]认为,添加NH4+-N会抑制K、Ca、Mg等元素的吸收,促进对P的吸收,而添加NO3–-N与之正好相反。NH4+-N刺激了阴离子的吸收,而减少了对阳离子吸收。本研究结果表明,接种AMF均促进了2种形态氮肥处理的杉木幼苗对K、Ca、Mg、Fe、Mn、Na的吸收,且NH4+-N处理的Ca、Mg、Mn和Na含量显著高于NO3–-N处理。这与前人[42]的研究结果不一致,可能是AMF对植物矿质元素的促进吸收能力强于NH4+-N的抑制能力。本研究中接种AMF降低了对照植株中Mn含量,与王平等[12]的研究结果一致,在低氮环境下接种AMF对Mn的吸收具有负效应,因为低氮环境下植株营养不足,影响矿质元素的吸收与重新分配[12]。
接种AMF与添加不同形态氮不仅影响杉木幼苗对各种养分元素的吸收,还可调节养分元素在不同器官组织的分布。在本研究结果表明,接种AMF的幼苗叶片,对照的Ca、Mg、Fe、Na含量,NH4+-N处理的K、Ca、Mg、Fe、Mn、Na含量,以及NO3–-N处理的Mg、Fe含量的增幅均高于茎和根,说明AMF有利于促进营养元素的吸收和增强向上转移的能力,将营养元素输送到最重要的器官组织,以满足植物光合作用的需要,表明丛枝菌根真菌具有调节养分元素重新分配的能力。
AMF的接种促进了杉木幼苗的生长及对矿质元素的吸收,与添加NO3–-N相比,添加NH4+-N的促进作用更显著,与根、茎相比,杉木叶中更容易富集这些矿质元素。从杉木优质壮苗培育与施肥的角度来看,接种AMF并施加NH4+-N肥有助于促进杉木的生长与养分吸收。
| [1] |
HARLEY J L, HARLEY E L. A check-list of mycorrhiza in the British flora: Addenda, errata and index[J]. New Phytol, 1987, 107(4): 741-749. DOI:10.1111/j.1469-8137.1987.tb00912.x |
| [2] |
SIMARD S W. The foundational role of mycorrhizal networks in self- organization of interior douglas-fir forests[J]. For Ecol Manag, 2009, 258(S1): S95-S107. DOI:10.1016/j.foreco.2009.05.001 |
| [3] |
RUFYIKIRI G, DECLERCK S, THIRY Y. Comparison of 233U and 33P uptake and translocation by the arbuscular mycorrhizal fungus Glomus intraradices in root organ culture conditions[J]. Mycorrhiza, 2004, 14(3): 203-207. DOI:10.1007/s00572-003-0258-1 |
| [4] |
CALL C A, DAVIES F T. Effects of vesicular-arbuscular mycorrhizae on survival and growth of perennial grasses in lignite overburden in Texas[J]. Agric Ecosyst Environ, 1988, 24(4): 395-405. DOI:10.1016/0167-8809(88)90119-3 |
| [5] |
CHANDRASEKARAN M. A meta-analytical approach on arbuscular mycorrhizal fungi inoculation efficiency on plant growth and nutrient uptake[J]. Agriculture, 2020, 10(9): 370. DOI:10.3390/agriculture10090370 |
| [6] |
RUFYIKIRI G, DECLERCK S, DUFEY J E, et al. Arbuscular mycorrhizal fungi might alleviate aluminium toxicity in banana plants[J]. New Phytol, 2000, 148(2): 343-352. DOI:10.1046/J.1469-8137.2000.00761.X |
| [7] |
BASLAM M, GARMENDIA I, GOICOECHEA N. Arbuscular mycorr- hizal fungi (AMF) improved growth and nutritional quality of green house-grown lettuce[J]. J Agric Food Chem, 2011, 59(10): 5504-5515. DOI:10.1021/jf200501c |
| [8] |
ZHAO Q H, SUN L T, WANG Y, et al. Effects of arbuscular mycorr- hizal fungi and nitrogen regimes on plant growth, nutrient uptake and tea quality in Camellia sinensis (L.) O. Kuntze[J]. Plant Physiol J, 2014, 50(2): 164-170. 丛枝菌根真菌和施氮量对茶树生长、矿质元素吸收与茶叶品质的影响[J]. 植物生理学报, 2014, 50(2): 164-170. DOI:10.13592/j.cnki.ppj.2014.02.007 |
| [9] |
VERESOGLOU S D, CHEN B D, RILLING M C, et al. Arbuscular mycorrhiza and soil nitrogen cycling[J]. Soil Biol Biochem, 2012, 46: 53-62. DOI:10.1016/j.soilbio.2011.11.018 |
| [10] |
HU J X, PENG S L, ZHANG D, et al. Effects of nitrogen addition on arbuscular mycorrhizal fungi community in poplar plantations at different ages[J]. Ecol Environ Sci, 2020, 29(9): 1768-1775. 氮添加对不同林龄杨树人工林丛枝菌根真菌群落的影响[J]. 生态环境学报, 2020, 29(9): 1768-1775. DOI:10.16258/j.cnki.1674-5906.2020.09.008 |
| [11] |
HE X L, WANG D X, ZHAO L L. Effect of am fungi on the growth and absorption of some mineral elements in tobacco leaf under different nitrogen levels[J]. Acta Agric Nucl Sin, 2006, 20(2): 154-158. AM真菌和施氮量对烟叶生长和部分矿质元素含量的影响[J]. 核农学报, 2006, 20(2): 154-158. DOI:10.3969/j.issn.1000-8551.2006.02.019 |
| [12] |
WANG P, HE X L, ZHAO L L, et al. Effects of AM fungi on the growth and microelement of Scuteliaria baiealensis Goorgi under different N-applied levels[J]. Acta Agric Boreali-Sin, 2012, 27(S1): 259-263. AM真菌和施氮量对黄芩幼苗生长和微量元素的影响[J]. 华北农学报, 2012, 27(S1): 259-263. DOI:10.3969/j.issn.1000-7091.2012.z1.052 |
| [13] |
LI S B, ZHOU L L, WU S P, et al. Effects of different nitrogen forms on nutrient uptake and distribution of Cunninghamia lanceolata plant- lets under drought stress[J]. Plant Nutri Fert Sci, 2020, 26(1): 152-162. 不同氮素形态对干旱胁迫杉木幼苗养分吸收及分配的影响[J]. 植物营养与肥料学报, 2020, 26(1): 152-162. DOI:10.11674/zwyf.19049 |
| [14] |
LIU N, ZHANG L, MENG X X, et al. Effect of nitrate/ammonium ratios on growth, root morphology and nutrient elements uptake of watermelon (Citrullus lanatus) seedlings[J]. J Plant Nutri, 2014, 37(11): 1859-1872. DOI:10.1080/01904167.2014.911321 |
| [15] |
NOROOZLO Y A, SOURI M K, DELSHAD M. Effects of soil appli- cation of amino acids, ammonium, and nitrate on nutrient accumulation and growth characteristics of sweet basil[J]. Commun Soil Sci Plant Anal, 2019, 50(22): 2864-2872. DOI:10.1080/00103624.2019.1689249 |
| [16] |
State Forestry Administration. Results of the 8th national forest resources inventory [J]. For Resour Manage, 2014, 1(1): 1–2. doi: 10. 13466/j.cnki.lyzygl.2014.01.001. 国家林业局. 第八次全国森林资源清查结果[J]. 林业资源管理, 2014, 1(1): 1–2. doi: 10.13466/j.cnki.lyzygl.2014.01.001. |
| [17] |
WU F, FANG F R, WU N, et al. Nitrate transporter gene expression and kinetics of nitrate uptake by Populus×canadensis 'Neva' in relation to arbuscular mycorrhizal fungi and nitrogen availability[J]. Front Microbiol, 2020, 11: 176. DOI:10.3389/fmicb.2020.00176 |
| [18] |
ZHANG Z L, LI N, XIAO J, et al. Changes in plant nitrogen acquisition strategies during the restoration of spruce plantations on the eastern Tibetan Plateau, China[J]. Soil Biol Biochem, 2018, 119: 50-58. DOI:10.1016/j.soilbio.2018.01.002 |
| [19] |
CDATA[DU D J. Soil nitrogen content and absorption characteristics of Chinese fir plantation at different forest stand ages [D]. Fuzhou: Fujian Agriculture and Forestry University, 2020. doi: 10.27018/d.cnki.gfjnu. 2020.000308. 杜大俊. 不同林龄杉木人工林土壤氮素含量及吸收特征研究[D]. 福州: 福建农林大学, 2020. doi: 10.27018/d.cnki.gfjnu.2020.000308. |
| [20] |
LI C C, LI Q R, QIAO N, et al. Inorganic and organic nitrogen uptake by nine dominant subtropical tree species[J]. IForest, 2015, 9(2): 253-258. DOI:10.3832/ifor1502-008 |
| [21] |
LIU M, LI C C, XU X L, et al. Organic and inorganic nitrogen uptake by 21 dominant tree species in temperate and tropical forests[J]. Tree Physiol, 2017, 37(11): 1515-1526. DOI:10.1093/treephys/tpx046 |
| [22] |
LIU M, XU F Z, XU X L, et al. Age alters uptake pattern of organic and inorganic nitrogen by rubber trees[J]. Tree Physiol, 2018, 38(11): 1685-1693. DOI:10.1093/treephys/tpy031 |
| [23] |
LIU Q Y, WANG H M, XU X L. Root nitrogen acquisition strategy of trees and understory species in a subtropical pine plantation in southern China[J]. Eur J For Res, 2020, 139(5): 791-804. DOI:10.1007/s10342-020-01284-6 |
| [24] |
ZHANG X. Research on effects of arbuscular mycorrhiza fungi on carbon and nitrogen balance in the rice field system [D]. Harbin: Harbin Institute of Technology, 2016. 张雪. 丛枝菌根真菌对稻田系统碳氮元素平衡的影响研究[D]. 哈尔滨: 哈尔滨工业大学, 2016. |
| [25] |
ZHANG S M. A rapid digesting method for determination of plant nitrogen, phosphorus and potassium simultaneously[J]. Acta Agric Univ Pekin, 1988, 14(3): 295-300. 植物氮、磷、钾联合测定的快速消煮法[J]. 北京农业大学学报, 1988, 14(3): 295-300. |
| [26] |
SHENG P P, LIU R J, LI M. Methodological comparison of obser- vation and colonization measurement of arbuscular mycorrhizal fungi[J]. Mycosystema, 2011, 30(4): 519-525. 丛枝菌根观察与侵染率测定方法的比较[J]. 菌物学报, 2011, 30(4): 519-525. DOI:10.13346/j.mycosys-tema.2011.04.002 |
| [27] |
DENG Y, SHEN H, LUO W Q, et al. Effects of AMF on key enzymes of nitrogen assimilation in maize under different ammonium to nitrate ratios[J]. Plant Nutri Fert Sci, 2009, 15(6): 1380-1385. 不同氮素形态比例条件下接种AMF对玉米氮同化关键酶的影响[J]. 植物营养与肥料学报, 2009, 15(6): 1380-1385. DOI:10.11674/zwyf.2009.0619 |
| [28] |
HE C X, ZHANG Z B, WANG H S, et al. Effects of different AMF strains inoculation on tomato growth and nutrient absorption during seedling stage[J]. China Veget, 2006, 1(1): 9-11. 丛枝菌根真菌对番茄苗期生长及矿质营养吸收的作用[J]. 中国蔬菜, 2006, 1(1): 9-11. DOI:10.3969/j.issn.1000-6346.2006.01.003 |
| [29] |
ZHANG Y J, WEN Z W. Root biomass of Pinus massoniana planta- tions under different planting densities[J]. Sci Silv Sin, 2011, 47(3): 75-81. 不同造林密度马尾松人工林的根系生物量[J]. 林业科学, 2011, 47(3): 75-81. DOI:10.11707/j.1001-7488.20110312 |
| [30] |
QU M H, YU Y C, LI S, et al. Advances in research on activation of mineral nutrients by arbuscular mycorrhizal fungi[J]. J Zhejiang Agric For Univ, 2019, 36(2): 394-405. 丛枝菌根真菌对矿质养分活化作用研究进展[J]. 浙江农林大学学报, 2019, 36(2): 394-405. DOI:10.11833/j.issn.2095-0756.2019.02.022 |
| [31] |
LI M, LIU R J, LI X L. Influences of arbuscular mycorrhizal fungi on growth and Fusarium-wilt disease of watermelon in field[J]. Acta Phytop Sin, 2004, 34(5): 472-473. 大田条件下丛枝菌根真菌对西瓜生长和枯萎病的影响[J]. 植物病理学报, 2004, 34(5): 472-473. DOI:10.13926/j.cnki.apps.2004.05.015 |
| [32] |
ZHANG L, WANG X J, WANG Q, et al. The role of the isotope tracer technique in ecological research of arbuscular mycorrhizal fungi[J]. Acta Ecol Sin, 2016, 36(10): 2787-2797. 同位素示踪技术在丛枝菌根真菌生态学研究中的应用[J]. 生态学报, 2016, 36(10): 2787-2797. DOI:10.5846/stxb201506241283 |
| [33] |
LI H, WANG C, LI X L, et al. Impact of the earthworm Aporrectodea trapezoides and the arbuscular mycorrhizal fungus Glomus intra- radices on 15N uptake by maize from wheat straw[J]. Biol Fert Soils, 2013, 49(3): 263-271. DOI:10.1007/s00374-012-0716-z |
| [34] |
VÁZQUEZ M M, BAREA J M, AZCÓN R. Impact of soil nitrogen concentration on Glomus spp.-Sinorhizobium interactions as affecting growth, nitrate reductase activity and protein content of Medicago sativa[J]. Biol Fert Soils, 2001, 34(1): 57-63. DOI:10.1007/s003740100373 |
| [35] |
WU Q S, ZOU Y N. Advances in research on arbuscular mycorr- hizas helping plants to absorb and transport N[J]. J Yangtze Univ (Nat Sci), 2009, 6(2): 65-67. 丛枝菌根帮助植物吸收和转运N的研究进展[J]. 长江大学学报(自然科学版), 2009, 6(2): 65-67. DOI:10.3969/j.issn.1673-1409(S).2009.02.018 |
| [36] |
JIN H R, ZHANG P H, JIANG D H. Study on mechanism of arbuscular mycorrhizal fungi absorbing and transporting nitrogen from different sources to the host plant with isotopic tracing[J]. Acta Pedol Sin, 2011, 48(4): 888-892. 同位素示踪研究丛枝菌根真菌吸收不同氮素并向寄主植物输运的机理[J]. 土壤学报, 2011, 48(4): 888-892. DOI:10.11766/trxb201004140137 |
| [37] |
HAWKINS H J, GEORGE E. Reduced 15N-nitrogen transport through arbuscular mycorrhizal hyphae to Triticum aestivum L. supplied with ammonium vs. nitrate nutrition[J]. Ann Bot, 2001, 87(3): 303-311. DOI:10.1006/anbo.2000.1305 |
| [38] |
WANG Y, YAO R L. Effects of different nitrogen forms and ratios on growth of tissue cultured seedlings in Pinus massoniana[J]. J CS Univ For Technol, 2021, 41(3): 18-24. 不同形态氮素配比对马尾松组培苗生长的影响[J]. 中南林业科技大学学报, 2021, 41(3): 18-24. DOI:10.14067/j.cnki.1673-923x.2021.03.003 |
| [39] |
XUE Y L, LI C Y, WANG C R, et al. Mechanisms of phosphorus uptake from soils by arbuscular mycorrhizal fungi[J]. J Soil Water Conser, 2019, 33(6): 10-20. 丛枝菌根真菌促进植物摄取土壤磷的作用机制[J]. 水土保持学报, 2019, 33(6): 10-20. DOI:10.13870/j.cnki.stbcxb.2019.06.002 |
| [40] |
LIU Z F, ZHANG G B, YU J H, et al. Effects of different nitrogen forms and their ratios on broccoli yield, quality, and nutrient absorption[J]. Chin J Appl Ecol, 2013, 24(7): 1923-1930. 氮肥形态及配比对花椰菜产量、品质和养分吸收的影响[J]. 应用生态学报, 2013, 24(7): 1923-1930. DOI:10.13287/j.1001-9332.2013.0427 |
| [41] |
LIU X C, WANG Y T, LIU S R, et al. Sex-specifically responsive strategies to phosphorus availability combined with different soil nitrogen forms in dioecious Populus cathayana[J]. J Plant Ecol, 2021, 14(4): 730-748. DOI:10.1093/jpe/rtab025 |
| [42] |
ZHANG D D, ZHANG Y Y. Research progress on the effects of nitrogen forms on the growth and quality of medicinal plants[J]. J Chin Med Mat, 2016, 39(3): 696-698. 氮形态对药用植物生长及品质影响的研究进展[J]. 中药材, 2016, 39(3): 696-698. DOI:10.13863/j.issn1001-4454.2016.03.057 |
| [43] |
SERNA M D, BORRAS R, LEGAZ F, et al. The influence of nitrogen concentration and ammonium/nitrate ratio on N-uptake, mineral composition and yield of Citrus[J]. Plant Soil, 1992, 147(1): 13-23. DOI:10.1007/BF00009366 |
 2022, Vol. 30
2022, Vol. 30


