2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
叶片构建成本是指植物合成叶片生物量所需的碳骨架、葡萄糖量和生物合成所需的化学能,表征植物叶片水平上的能量投资策略[1],同时也是研究叶片碳经济投资的重要指标[2]。通过将叶片构建成本与叶片光合速率、叶片氮、磷含量等叶片经济性状相结合,能够揭示不同生境下叶片资源获取与结构投资间的成本效益策略[3–5]。故叶片构建成本被广泛应用于探究不同生境下植物环境适应性、物种生存策略以及生物地理分布格局[6–8]。有研究表明,与本土物种相比,入侵种具有更低的叶片构建成本,更高的比叶面积和光合能力,在开阔生境中具有竞争优势,有利于其快速繁殖[9–11]。叶片构建成本在不同光照条件下也存在差异,低光照条件下,叶片通过降低防御成本来获取最大光合碳增益,其叶片构建成本较低且成本回报时间较短[4, 12–13]。此外,叶片构建成本还能用来评估植物对环境胁迫的抵抗力[14–15],以及植物响应干旱胁迫时的恢复能力[16]。
叶片机械抗性是衡量叶片保护光合组织免受非生物伤害(风、雨等)和生物伤害(虫食)等机械损伤而产生的相对碳投资的关键指标[17],包括叶片撕裂力、穿透力以及剪切力。叶片机械抗性的强弱取决于叶片结构的差异[18],如叶片密度[19–21]、角质层[22]、干物质含量[23]和细胞壁厚度[24]等。同时,叶片生长环境也会影响叶片机械抗性[25],He等[26]的研究表明耐阴树种的叶片机械抗性显著强于喜光树种。理论上,叶片机械抗性较高的植物,往往具有较高的叶片撕裂力和穿透力,同时光合碳增益较低。这可能与叶片氮元素在结构构建-光合作用中的分配机制有关,叶片向叶肉细胞壁分配的氮比例越大,可作用于光合作用的氮越少,从而导致光合氮利用效率和光合作用降低[27–28]。
同一森林不同演替阶段的植物可能表现出不同的生理生态特性[29–31],了解演替过程中的植物特性不仅有助于解释物种更替的形成机制,而且也可为森林管理和恢复重建提供指导[32]。随着森林演替的发展,优势树种叶片构建成本碳投资策略可能从叶片经济学谱的“快速偿还”端向“慢速偿还”端转变。即“快速偿还”端的资源获取型植物,具有较高的叶片光合速率、叶片氮、磷含量以及较低的叶片构建成本;而“慢速偿还”端的资源保守型植物则将更多资源投入到自身防御结构中,以提高叶片防御性能和延长叶片寿命[33–34]。另一方面,叶片机械抗性也与叶片经济学谱相耦合,叶片机械抗性越强,抵御外界物理胁迫能力越强,从而叶片寿命有所提高[35]。但在以往研究中,关于森林不同演替阶段优势树种叶片构建成本与机械抗性间直接联系的研究仍然有限,探究不同演替阶段优势树种叶片构建成本与机械抗性之间的联系,不仅能够揭示森林演替变化机制,还有助于了解优势树种生存策略。
本研究假设鼎湖山南亚热带森林中,演替晚期优势树种叶片比演替早期植物叶片更倾向于“慢速偿还”端的资源保守和更强的防御策略,叶片构建成本与机械抗性较高,而光合速率较低;同时,叶片构建成本与机械抗性存在协同关系。本研究选取中国南方鼎湖山亚热带常绿林中处于演替早期和晚期共14种优势树树种,测定叶片构建成本、叶片机械抗性(如叶片撕裂力和穿透力)、结构性状(叶片角质层厚度、比叶重和叶片密度等)和叶片光合速率、气孔导度等性状,探讨叶片构建成本与机械抗性的关系,为阐明不同森林演替阶段优势树种生存策略提供参考。
1 材料和方法 1.1 研究地点和植物材料本研究在广东省肇庆市中国科学院鼎湖山森林生态系统定位研究站(23°09′21″~23°11′30″ N, 112°30′39″~112°33′41″ E)中进行。鼎湖山属于南亚热带湿润季风气候,水热条件丰富,年均温20.9 ℃,最热月为7月(28.1 ℃);最冷月为1月(12.0 ℃), 年均降雨量为1 900 mm,年均蒸发量为1 115 mm, 年均相对湿度为81.5%。
演替早期阶段的森林(海拔200~300 m)受到人类长期干扰。优势树种为对光照要求较高的灌木、小乔木,如白楸(Mallotus paniculatus)等,冠层高度约2 m。土壤(0~10 cm) pH为4.29,有机质31.50 g/kg, 氮含量1.10 g/kg,磷含量0.40 g/kg,年均储水量(0~ 75 cm)为254.36 mm。
演替晚期阶段的森林(海拔200~300 m)为中国南方的顶级群落,主要优势树种为锥(Cryptocarya chinensis)和华润楠(Machilus chinensis)等,冠层高度15 m,盖度95%。土壤(0~10 cm) pH为3.89,有机质48.69 g/kg,氮含量1.76 g/kg,磷含量0.29 g/kg,年均储水量(0~75 cm)为381.03 mm。
根据前人[7]和鼎湖山长期群落调查结果[36],本研究从每个演替阶段森林中各选取7种常见和典型的优势树种(表 1),选取完全展开、健康成熟叶片进行相关性状的测定(表 2),记录树种个体的生活型、冠层和采样高度。
| 表 1 南亚热带森林不同演替阶段优势树种的基本特征 Table 1 Characteristics of dominant species in subtropical forest at different successional stages |
| 表 2 优势树种的叶片性状 Table 2 Leaf traits of dominant species |
每树种选取3~5株生长良好的植株,每株取20~30片完全展开的成熟叶片,去除叶柄用Li-Cor 3000A便携式叶面积仪测定叶片面积,并称叶片鲜质量,然后放置于70 ℃烘箱中烘72 h,再称干质量。叶片比叶重(leaf mass per area, LMA, g/cm2)为叶片干质量与面积的比值,叶片密度(leaf density, LD, g/cm3)=LMA/LT。
1.3 叶片构建成本和叶片N、P含量烘干保存的叶片经磨碎、过筛后,用于叶片N含量(Nmass, mg/g)、P含量(Pmass, mg/g)和叶片构建成本(leaf construction cost per area, CCarea, g Glu/m2)的测定。Nmass利用凯氏定氮法测定,Pmass利用原子吸收光谱法测定[37]。
叶片灰分含量根据样品在马弗炉中550 ℃完全燃烧4 h后测定,样品在全自动氧弹热量仪(Model 6400, Parr, IL, USA)完全燃烧后计算叶片去灰分热值,为干质量热值(CV)与单位质量去灰分含量的比值,即Hc=CV/(1-Ash)。叶片构建成本被定义为构建1 g叶片干物质所需的葡萄糖量,根据Williams等[1]提出的公式计算:CCmass=[(0.06968Hc–0.065) (1–Ash)+7.5(KN/14.0067)]/0.89, 式中,Hc为除去灰分的燃烧热值(kJ/g),Ash为灰分含量(g/g),N为全氮含量(g/g),K表示N的氧化还原状态(硝态N: +5; 氨态N: –3)。鼎湖山地区土壤的主要氮源是氨态氮[36],因此K取值–3。单位面积叶片构建成本为单位质量叶片构建成本(CCmass)与比叶重(LMA)的乘积,即
每物种选择3~5株成熟且健康植株,分别采集1~2根向阳枝条上10~20片成熟健康叶片,置于潮湿的密封塑料袋中保存。叶片撕裂力(force to tear, Ft, kN/m)为撕裂单位宽度的叶片所需要的最大的力[19], 取叶片中脉两侧长25 mm,宽5 mm的矩形样品[38],用数码测力计(±0.001 N, HA+DPI, 乐清, 中国)测定叶片撕裂力。叶片穿透力(force to punch, Fp, kN/m2)为穿透单位周长的叶片所需要的最大的力[19], 用测力计记录直径为0.6 mm的金属棒穿透叶片(避过中脉)所需的最大的力。
1.5 叶片厚度与角质层厚度每种植物选取3株成熟个体的3片成熟叶片, 进行叶片解剖结构分析。用0.1 mol/L磷酸缓冲液(pH=7.2)配制终浓度为2.5%戊二醛和2%多聚甲醛的固定液固定叶片,并制成宽约1 mm、长约2 mm的矩形样品,保存于4 ℃冰箱直至完全固定,再用树脂包埋,常温保存,用超薄切片机(UC6; Leica, Germany)制备厚度为0.5~1 µm的半薄切片和厚度为70~100 nm的超薄切片。对半薄切片和超薄切片分别使用甲基蓝和铅盐染色,在超景深数码体视镜(DVM6 a; Leica, Germany)和透射电子显微镜(Tecnai G2 Spirit BioTWIN; FEI, Czech)下观察并拍摄,最后用图片测量软件Image J测定半薄切片的叶片厚度(leaf thickness, LT, µm)和超薄切片的角质层厚度(cuticle thickness, Tc, µm)。
1.6 叶片寿命叶片寿命(leaf lifespan, LLS, wk)是通过长期实地观测来确定的。2013年生长季开始时(4月),每物种选取5棵健康成熟植株的50片新叶并标记, 每周记录叶片的生长和死亡情况直到2016年底。以叶片出现到凋落时间差的平均值为LLS[13]。
1.7 叶片光合速率和气孔导度每物种从3~5株成熟个体中选取9~15片成熟、向阳、健康叶片,用便携式光合仪(Li-6400, Li-Cor, Lincoln, NE, USA)测定叶片的最大光合速率[maxi-mum photosynthesis per area, Aarea, µmol/(m2·s)]和气孔导度[stomatal conductance per area, gsarea, mol/(m2·s)], 于晴天的上午9:00—11:00时进行,测定时光合有效辐射为1 500 µmol/(m2·s),CO2浓度为400 µmol/mol, 叶片温度设置为25 ℃,空气湿度为50%~75%,经过15 min的光诱导后开始测定。
1.8 数据分析单因素方差分析(One-Way Anova)用于检验不同演替阶段优势树种叶片性状间的差异;线性回归(linear regression)用于检验叶片性状间的相关性;主成分分析(PCA)用于检验叶片性状与不同演替阶段优势树种的更替机制的关联性。所有数据分析均在R统计软件(version 4.0.3)中进行。
2 结果和分析 2.1 叶片性状的差异与演替早期相比,演替晚期优势树种叶片的CCarea极显著升高(P < 0.001, 图 1: A),演替早期和晚期分别为83.95和143.51 g Glu/m2,演替晚期优势树种叶片的平均Ft和Fp分别为0.57 kN/m、0.38 kN/m2, 显著高于演替早期的0.30 kN/m和0.27 kN/m2 (图 1: B, C)。此外,演替晚期优势树种叶片的LLS (91.29周)极显著高于演替早期(20.29周)(P < 0.001, 图 1: D)。从演替早期到演替晚期,优势树种叶片的LMA、LD和Tc均呈现增长趋势(图 1: E; 表 2),分别增加了1.73、1.45和3.13倍。

|
图 1 南亚热带森林不同演替阶段优势树种叶片性状差异。*: P < 0.05;**: P < 0.01; ***: P < 0.001; CCarea、Ft、Fp、LLS、LMA和Aarea见表 2。 Fig. 1 Differences in leaf trait of dominant species from different successional stages of subtropical forests. *: P < 0.05;**: P < 0.01; ***: P < 0.001; CCarea, Ft, Fp, LLS, LMA and Aarea see Table 2. |
优势树种叶片的Aarea从演替早期到演替晚期呈显著下降趋势(P < 0.05, 图 1: F),分别为11.85和8.35 μmol/(m2·s),且演替早期叶片的gsarea极显著高于晚期(P < 0.001),分别为0.37和0.13 mol/(m2·s), 优势树种叶片的Nmass和Pmass也呈现同样的下降趋势(表 2)。
2.2 不同演替阶段叶片性状间关系相关分析结果表明(表 3),CCarea与Ft、Fp均呈显著正相关(P < 0.05),LLS与CCarea、Ft均呈显著正相关,Tc与CCarea和Ft也呈显著正相关,同时,LMA与CCarea和Fp呈显著正相关关系。此外,CCarea与gsarea、Pmass均呈显著负相关,而Aarea与gsarea、Nmass和Pmass均呈显著正相关,但与Fp呈显著负相关。
| 表 3 优势树种叶片性状间的相关分析 Table 3 Correlation of leaf traits of dominant species |
|
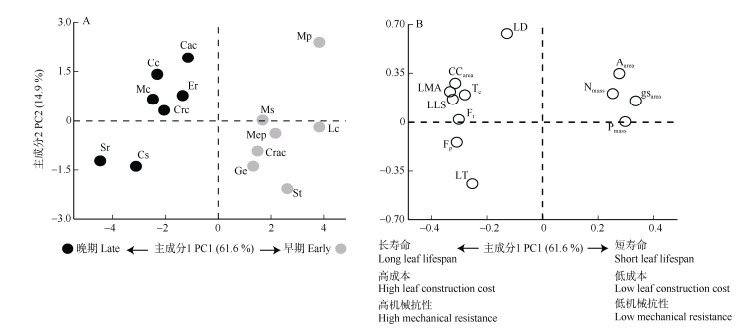
图 2 不同演替阶段优势树种叶片性状的主成分分析。A: 优势树种分布; B: 叶片性状分布。缩写见表 1。 Fig. 2 Principal component analysis of leaf traits of dominant species at different succession stages. A: Dominant species; B: Leaf traits. Abbreviation see Table 1. |
主成分分析结果表明,第一主轴的解释率为61.6%,演替早晚期优势树种主要沿第一主轴分布(图 3: A)。第一主轴与Aarea、gsarea、Nmass以及Pmass呈正相关,而与CCarea、Ft、LLS等性状呈负相关(图 3: B),与演替早期相比,演替晚期优势树种具有较高CCarea、Ft、Fp和较长LLS,而Aarea、gsarea和养分含量较低。
3 结论和讨论本研究分析了南亚热带森林演替早、晚期14种优势树种的叶片构建成本和机械抗性等相关性状的差异及其相关性,结果表明,演替晚期优势树种倾向于“慢速偿还”端的资源保守策略,具有较高CCarea、机械抗性(Ft和Fp)、LLS和LMA,Aarea、Nmass和Pmass较低,而演替早期的则相反。此外, 本研究结果还表明,CCarea与机械抗性存在协同关系,而Tc和LMA是其协同关系的重要生理结构基础, 高CCarea和高机械抗性的物种往往具有较厚细胞壁、高度发达的角质层以及厚壁组织,有利于延长LLS[28, 39]。
3.1 优势树种的叶片构建成本和机械抗性本研究结果表明,与演替早期相比,演替晚期植物叶片的碳获取策略倾向于“慢速偿还”端的资源保守策略。演替晚期植物无法快速获取资源,但叶片机械抗性较强且寿命较长,以长期的、低效的方式偿还叶片碳投资成本,表现为CCarea、LMA和LLS较高,但Aarea、Nmass和Pmass较低。随着森林演替进程,演替晚期优势树种CCarea、LMA和机械抗性(Ft和Fp)均显著高于演替早期,表明演替晚期优势树种对于叶片结构构建投入的碳成本增加,从而有利于叶片韧性的提高。这与Mason等[40]的研究结果一致,即叶片对于防御结构的高投资会推动叶片能量投资策略向资源保守型转变。同时,高CCarea的物种往往需要用更长的时间来偿还构建叶片所投入的成本[15, 41],故演替晚期优势树种表现出更长的LLS。相反,演替晚期优势树种具有较低的Aarea, 这是由于演替晚期优势树种具有较低的Nmass和Pmass, 且其LMA较高,不利于氮磷养分累积[42],从而无法为光合作用提供充足的养分支撑。此外, 与演替早期相比,演替晚期优势树种gsarea较低,通过叶片的水分和二氧化碳含量减少,从而导致Aarea下降[43]。
而演替早期优势树种倾向于“快速偿还”端的资源获取策略,能够快速进行碳同化并投资于新叶组织构建中,有利于快速获取光资源和养分,但对于单位面积叶片的碳投入较小,从而降低叶片机械抗性,使叶片易受到虫食和病原体等外界胁迫。这与Zhu等[7]对南亚热带森林不同演替阶段中优势树种叶片光合性状研究结论一致,即演替早期阶段优势树种拥有更高光合速率以及生长速率[6, 44]。这是在森林演替背景下,植物对于环境资源竞争加剧的结果,由于不同演替阶段的环境干扰程度以及养分资源显著不同[7, 45],优势植物采取了不同的适应性策略。演替晚期森林土壤的储水量和养分含量会增加,但随森林郁闭度的提高,林下植被对于光资源的竞争日益激烈,演替晚期优势树种通过改变优势树种的群落组成,并积极调整叶片投资,以平衡成本效益[8, 30],故其CCarea较高,但叶片资源利用效率和光合速率较低。而在开阔的演替早期森林中, 优势树种叶片光合速率较高,可在较短时间内吸收更多能量,为植物生长和群落构建提供机会[39, 46]。
3.2 叶片构建成本与机械抗性协同性本研究结果印证了CCarea与Ft、Fp的协同关系,进一步说明叶片防御能力越强,所需要投入的成本就越多[18]。随着森林演替进程,土壤养分和光辐照等环境资源的供应与植被生长养分需求间的不平衡逐渐扩大,在资源竞争激烈的条件下,演替晚期优势树种倾向于采取“慢速偿还”策略。虽然演替晚期优势树种叶片光能利用率较低,无法快速获取和积累大量环境资源[7],但通过增加对叶片骨架的能量投资来提高物理抗性,以满足持续获取资源完成自身长期生存和繁殖的需要[22]。而叶片机械抗性的提高不仅影响着叶片投入成本的多少,还能够间接影响叶片维护成本以及成本偿还时间的快慢,本研究发现LLS分别与CCarea和机械抗性(Ft和Fp)呈显著正相关关系,进一步证实了优势树种叶片在演替进程中对于自身防御能力的能量投资逐渐增多,有利于获取更长的生命周期。
同时,本研究结果表明,随着Tc的增加,CCarea和Ft也随之提高。由于叶片角质层作为叶片屏障作用的主要支撑,富含高能量的角质和蜡质,角质层越厚,所需要的构建成本越高[47]。Onoda等[22]的研究表明随高密度角质层的加厚,在增加叶片投资成本的基础上还能提高叶片抗撕裂性,有利于延长叶片寿命。另一方面,本研究中LMA与CCarea和叶片Ft、Fp呈显著正相关,这与前人的研究结果一致,LMA越高,叶肉细胞壁和叶片角质层所占叶片体积比例越大[48–49],植物对于构建叶片保卫结构或叶肉组织投入也越多,由此能够更好抵御虫食压力或失水胁迫[50]。这表明随着森林演替的进行,叶片对防御结构投入的能量逐渐增多,面对环境巨变或自然灾害时拥有更大的生存优势,能更好地抵御虫食或强风干扰。
主成分分析表明叶片构建成本与机械抗性共同作用于演替早晚期优势树种的叶片碳投资策略。第一主轴揭示了叶片碳投资在防御结构和光合结构上的权衡作用,演替晚期优势树种除了表现较低的Aarea、Nmass和Pmass以外,还表现出较高的CCarea、机械抗性(Ft和Fp)、LMA和LLS等典型的慢速偿还策略特征[33]。相比较而言,演替早期优势树种更倾向于快速积累资源提高竞争力的“快速偿还”策略。
本研究结果表明,随植物对环境资源的竞争愈发激烈,对叶片结构构建投资越多的植物,即拥有较高CCarea和叶片机械抗性(Ft和Fp)的植物,在森林演替进程中拥有更大的生存优势。本研究从叶片能量投资策略的角度出发,揭示了叶片构建成本与机械抗性的协同性,有助于进一步理解南亚热带森林群落的演替和物种适应环境的生理生态机制,为预测森林群落动态变化提供科学支撑。然而,由于演替晚期森林物种比较丰富,包括需光树种与耐阴树种,而本研究选取的14种森林优势树种均为耐阴树种,在代表性方面有一定的局限性。但本研究主要围绕不同森林演替阶段优势树种叶片构建成本与机械抗性间的协同性关系进行探究,需光树种如白楸,在演替晚期森林中多出现于开放的林窗和路边等光照条件较好的地方;而耐阴树种能够更好地适应演替晚期森林荫蔽的环境,故演替晚期森林的优势树种多为耐阴树种。因此,未来须在更多优势树种的基础上对森林演替阶段叶片构建成本与机械抗性的协同关系进行探究。
| [1] |
WILLIAMS K, PERCIVAL F, MERINO J, et al. Estimation of tissue construction cost from heat of combustion and organic nitrogen content[J]. Plant Cell Environ, 1987, 10(9): 725-734. DOI:10.1111/1365-3040.ep11604754 |
| [2] |
CAPLAN J S, WHEATON C N, MOZDZER T J. Belowground advan- tages in construction cost facilitate a cryptic plant invasion[J]. Aob Plants, 2014, 6: plu020. DOI:10.1093/aobpla/plu020 |
| [3] |
POORTER H, PEPIN S, RIJKERS T, et al. Construction costs, chemical composition and payback time of high- and low-irradiance leaves[J]. J Exp Bot, 2006, 57(2): 355-371. DOI:10.1093/jxb/erj002 |
| [4] |
COSTE S, ROGGY J C, SCHIMANN H, et al. A cost-benefit analysis of acclimation to low irradiance in tropical rainforest tree seedlings: Leaf life span and payback time for leaf deployment[J]. J Exp Bot, 2011, 62(11): 3941-3955. DOI:10.1093/jxb/err092 |
| [5] |
ZHU S D, CHEN Y J, CAO K F, et al. Interspecific variation in branch and leaf traits among three Syzygium tree species from different succe- ssional tropical forests[J]. Funct Plant Biol, 2015, 42(4): 423-432. DOI:10.1071/fp14201 |
| [6] |
NAVAS M L, DUCOUT B, ROUMET C, et al. Leaf life span, dynamics and construction cost of species from Mediterranean old- fields differing in successional status[J]. New Phytol, 2003, 159(1): 213-228. DOI:10.1046/j.1469-8137.2003.00790.x |
| [7] |
ZHU S D, SONG J J, LI R H, et al. Plant hydraulics and photo- synthesis of 34 woody species from different successional stages of subtropical forests[J]. Plant Cell Environ, 2013, 36(4): 879-891. DOI:10.1111/pce.12024 |
| [8] |
XIAO Y H, LIU S R, TONG F C, et al. Dominant species in subtropical forests could decrease photosynthetic N allocation to carboxylation and bioenergetics and enhance leaf construction costs during forest succession[J]. Front Plant Sci, 2018, 9: 117. DOI:10.3389/fpls.2018.00117 |
| [9] |
OSUNKOYA O O, BAYLISS D, PANETTA F D, et al. Leaf trait co-ordination in relation to construction cost, carbon gain and resource- use efficiency in exotic invasive and native woody vine species[J]. Ann Bot, 2010, 106(2): 371-380. DOI:10.1093/aob/mcq119 |
| [10] |
FENG Y L, LI Y P, WANG R F, et al. A quicker return energy-use strategy by populations of a subtropical invader in the non-native range: A potential mechanism for the evolution of increased competitive ability[J]. J Ecol, 2011, 99(5): 1116-1123. DOI:10.1111/j.1365-2745.2011.01843.x |
| [11] |
HEBERLING J M, FRIDLEY J D. Resource-use strategies of native and invasive plants in eastern north American forests[J]. New Phytol, 2013, 200(2): 523-533. DOI:10.1111/nph.12388 |
| [12] |
PONS T L, POORTER H. The effect of irradiance on the carbon balance and tissue characteristics of five herbaceous species differing in shade- tolerance[J]. Front Plant Sci, 2014, 5: 12. DOI:10.3389/fpls.2014.00012 |
| [13] |
ZHU S D, LI R H, SONG J, et al. Different leaf cost-benefit strategies of ferns distributed in contrasting light habitats of sub-tropical forests[J]. Ann Bot, 2016, 117(3): 497-506. DOI:10.1093/aob/mcv179 |
| [14] |
SUÁREZ N. Leaf construction cost in Avicennia germinans as affected by salinity under field conditions[J]. Biol Plantarum, 2005, 49(1): 111-116. DOI:10.1007/s10535-005-1116-0 |
| [15] |
ZHU S D, CAO K F. Contrasting cost-benefit strategy between lianas and trees in a tropical seasonal rain forest in southwestern China[J]. Oecologia, 2010, 163(3): 591-599. DOI:10.1007/s00442-010-1579-3 |
| [16] |
BARROS V, MELO A, SANTOS M, et al. Different resource-use strategies of invasive and native woody species from a seasonally dry tropical forest under drought stress and recovery[J]. Plant Physiol Biochem, 2020, 147: 181-190. DOI:10.1016/j.plaphy.2019.12.018 |
| [17] |
ENRICO L, DÍAZ S, WESTOBY M, et al. Leaf mechanical resistance in plant trait databases: Comparing the results of two common measu- rement methods[J]. Ann Bot, 2016, 117(1): 209-214. DOI:10.1093/aob/mcv149 |
| [18] |
WESTBROOK J W, KITAJIMA K, BURLEIGH J G, et al. What makes a leaf tough? Patterns of correlated evolution between leaf toughness traits and demographic rates among 197 shade-tolerant woody species in a neotropical forest[J]. Am Nat, 2011, 177(6): 800-811. DOI:10.1086/659963 |
| [19] |
ONODA Y, WESTOBY M, ADLER P B, et al. Global patterns of leaf mechanical properties[J]. Ecol Lett, 2011, 14(3): 301-312. DOI:10.1111/j.1461-0248.2010.01582.x |
| [20] |
KITAJIMA K, LLORENS A M, STEFANESCU C, et al. How cellulose- based leaf toughness and lamina density contribute to long leaf life- spans of shade-tolerant species[J]. New Phytol, 2012, 195(3): 640-652. DOI:10.1111/j.1469-8137.2012.04203.x |
| [21] |
MÉNDEZ-ALONZO R, EWERS F W, JACOBSEN A L, et al. Covariation between leaf hydraulics and biomechanics is driven by leaf density in Mediterranean shrubs[J]. Trees, 2019, 33(2): 507-519. DOI:10.1007/s00468-018-1796-7 |
| [22] |
ONODA Y, RICHARDS L, WESTOBY M. The importance of leaf cuticle for carbon economy and mechanical strength[J]. New Phytol, 2012, 196(2): 441-447. DOI:10.1111/j.1469-8137.2012.04263.x |
| [23] |
BLUMENTHAL D M, MUELLER K E, KRAY J A, et al. Traits link drought resistance with herbivore defence and plant economics in semi- arid grasslands: The central roles of phenology and leaf dry matter con- tent[J]. J Ecol, 2020, 108(6): 2336-2351. DOI:10.1111/1365-2745.13454 |
| [24] |
CHOONG M F, LUCAS P W, ONG J S Y, et al. Leaf fracture toughness and sclerophylly: Their correlations and ecological impli- cations[J]. New Phytol, 1992, 121(4): 597-610. DOI:10.1111/j.1469-8137.1992.tb01131.x |
| [25] |
ALVAREZ-CLARE S, KITAJIMA K. Physical defence traits enhance seedling survival of neotropical tree species[J]. Funct Ecol, 2007, 21(6): 1044-1054. DOI:10.1111/j.1365-2435.2007.01320.x |
| [26] |
HE P C, WRIGHT I J, ZHU S D, et al. Leaf mechanical strength and photosynthetic capacity vary independently across 57 subtropical forest species with contrasting light requirements[J]. New Phytol, 2019, 223(2): 607-618. DOI:10.1111/nph.15803 |
| [27] |
ONODA Y, HIKOSAKA K, HIROSE T. Allocation of nitrogen to cell walls decreases photosynthetic nitrogen-use efficiency[J]. Funct Ecol, 2004, 18(3): 419-425. DOI:10.1111/j.0269-8463.2004.00847.x |
| [28] |
ONODA Y, WRIGHT I J, EVANS J R, et al. Physiological and struc- tural tradeoffs underlying the leaf economics spectrum[J]. New Phytol, 2017, 214(4): 1447-1463. DOI:10.1111/nph.14496 |
| [29] |
BAZZAZ F A, PICKETT S T A. Physiological ecology of tropical succession: A comparative review[J]. Annu Rev Ecol Syst, 1980, 11: 287-310. DOI:10.1146/annurev.es.11.110180.001443 |
| [30] |
REICH P B, ELLSWORTH D S, UHL C. Leaf carbon and nutrient assimilation and conservation in species of differing successional status in an oligotrophic amazonian forest[J]. Funct Ecol, 1995, 9(1): 65-76. DOI:10.2307/2390092 |
| [31] |
NAVAS M L, ROUMET C, BELLMANN A, et al. Suites of plant traits in species from different stages of a Mediterranean secondary succession[J]. Plant Biol, 2010, 12(1): 183-196. DOI:10.1111/j.1438-8677.2009.00208.x |
| [32] |
MCGILL B J, ENQUIST B J, WEIHER E, et al. Rebuilding community ecology from functional traits[J]. Trends Ecol Evol, 2006, 21(4): 178-185. DOI:10.1016/j.tree.2006.02.002 |
| [33] |
WRIGHT I J, REICH P B, WESTOBY M, et al. The worldwide leaf economics spectrum[J]. Nature, 2004, 428(6985): 821-827. DOI:10.1038/nature02403 |
| [34] |
DONOVAN L A, MAHERALI H, CARUSO C M, et al. The evolution of the worldwide leaf economics spectrum[J]. Trends Ecol Evol, 2011, 26(2): 88-95. DOI:10.1016/j.tree.2010.11.011 |
| [35] |
ARMANI M, GOODALE U M, CHARLES-DOMINIQUE T, et al. Structural defence is coupled with the leaf economic spectrum across saplings of spiny species[J]. Oikos, 2020, 129(5): 740-752. DOI:10.1111/oik.06960 |
| [36] |
Dataset of China Ecosystem Research Network: Dinghushan Forest Ecosystem Research Station (1998—2008)[M]. Beijing: China Agriculture Press, 2011.
|
| [37] |
YAN B G, LIU G C, FAN B, et al. Relationships between plantstoi- chiometry and biomass in an arid-hot valley, southwest China[J]. Chin J Plant Ecol, 2015, 39(8): 807-815. 干热河谷植物化学计量特征与生物量之间的关系[J]. 植物生态学报, 2015, 39(8): 807-815. DOI:10.17521/cjpe.2015.0077 |
| [38] |
DIAZ S, HODGSON J G, THOMPSON K, et al. The plant traits that drive ecosystems: Evidence from three continents[J]. J Veg Sci, 2004, 15(3): 295-304. DOI:10.1111/j.1654-1103.2004.tb02266.x |
| [39] |
ALONSO-FORN D, SANCHO-KNAPIK D, FERRIO J P, et al. Revi- siting the functional basis of sclerophylly within the leaf economics spectrum of oaks: Different roads to rome[J]. Curr For Rep, 2020, 6(4): 260-281. DOI:10.1007/s40725-020-00122-7 |
| [40] |
MASON C M, DONOVAN L A. Does investment in leaf defenses drive changes in leaf economic strategy? A focus on whole-plant ontogeny[J]. Oecologia, 2015, 177(4): 1053-1066. DOI:10.1007/s00442-014-3177-2 |
| [41] |
OSUNKOYA O O, DAUD S D, WIMMER F L. Longevity, lignin content and construction cost of the assimilatory organs of Nepenthes species[J]. Ann Bot, 2008, 102(5): 845-853. DOI:10.1093/aob/mcn162 |
| [42] |
LUSK C H, ONODA Y, KOOYMAN R, et al. Reconciling species- level vs plastic responses of evergreen leaf structure to light gradients: Shade leaves punch above their weight[J]. New Phytol, 2010, 186(2): 429-438. DOI:10.1111/j.1469-8137.2010.03202.x |
| [43] |
DAMOUR G, SIMONNEAU T, COCHARD H, et al. An overview of models of stomatal conductance at the leaf level[J]. Plant Cell Environ, 2010, 33(9): 1419-1438. DOI:10.1111/j.1365-3040.2010.02181.x |
| [44] |
POORTER L, BONGERS F. Leaf traits are good predictors of plant performance across 53 rain forest species[J]. Ecology, 2006, 87(7): 1733-1743. DOI:10.1890/0012-9658(2006)87[1733:Ltagpo]2.0.Co;2 |
| [45] |
OSTERTAG R, WARMAN L, CORDELL S, et al. Using plant func- tional traits to restore Hawaiian rainforest[J]. J Appl Ecol, 2015, 52(4): 805-809. DOI:10.1111/1365-2664.12413 |
| [46] |
CHAI Y F, YUE M, WANG M, et al. Plant functional traits suggest a change in novel ecological strategies for dominant species in the stages of forest succession[J]. Oecologia, 2016, 180(3): 771-783. DOI:10.1007/s00442-015-3483-3 |
| [47] |
DE VRIES F W T P, BRUNSTING A H M, VAN LAAR H H. Products, requirements and efficiency of biosynthesis a quantitative approach[J]. J Theor Biol, 1974, 45(2): 339-377. DOI:10.1016/0022-5193(74)90119-2 |
| [48] |
SHIPLEY B, LECHOWICZ M J, WRIGHT I, et al. Fundamental trade- offs generating the worldwide leaf economics spectrum[J]. Ecology, 2006, 87(3): 535-541. DOI:10.1890/05-1051 |
| [49] |
KITAJIMA K, POORTER L. Tissue-level leaf toughness, but not lamina thickness, predicts sapling leaf lifespan and shade tolerance of tropical tree species[J]. New Phytol, 2010, 186(3): 708-721. DOI:10.1111/j.1469-8137.2010.03212.x |
| [50] |
HOU H, LIU H, HE P C, et al. Different leaf construction strategies in evergreen and deciduous species of Magnoliaceae[J]. J Trop Subtrop Bot, 2019, 27(3): 272-278. 木兰科常绿与落叶物种叶片构建策略的差异[J]. 热带亚热带植物学报, 2019, 27(3): 272-278. DOI:10.11926/jtsb.3978 |
 2022, Vol. 30
2022, Vol. 30


